Cugell DW, Kamp DW: Azbest i opłucna: przegląd. Chest 2004, 125: 1103–1117. 10.1378/klatka piersiowa.125.3.1103
Artykuł
PubMed
Google Scholar
Poland CA, Duffin R, Kinloch I, Maynard A, Wallace WA, Seaton A, et al.: Nanorurki węglowe wprowadzone do jamy brzusznej myszy wykazują patogenność podobną do azbestu w badaniu pilotażowym. Nat Nanotechnol 2008, 3: 423–428. 10.1038/nnano.2008.111
Artykuł
CAS
PubMed
Google Scholar
Kane AB, Macdonald JL, Moalli PA: Ostre uszkodzenie i regeneracja komórek międzybłonka wytwarzanych przez włókna azbestu krokidolitu. American Review Of Respiratory Disease 1986, 133: A198.
Google Scholar
Moalli PA, Macdonald JL, Goodglick LA, Kane AB: Ostre uszkodzenie i regeneracja międzybłonia w odpowiedzi na włókna azbestu. American Journal Of Pathology 1987, 128: 426–445.
PubMed Central
CAS
PubMed
Google Scholar
Boutin C, Dumortier P, Rey F, Viallat JR, De Vuyst P: Czarne plamy koncentrują onkogenne włókna azbestowe w opłucnej ciemieniowej. Badanie torakoskopowe i minerakologiczne. Am J Respir Crit Care Med 1996, 153: 444–449.
Artykuł
CAS
PubMed
Google Scholar
Boutin C, Rey F, Gouvernet J, Viallat JR, Astoul P, Ledoray V: Torakoskopia w złośliwym międzybłoniaku opłucnej: prospektywne badanie 188 kolejnych pacjentów. Część 2: Rokowanie i inscenizacja. Rak 1993, 72: 394–404. 10.1002/1097-0142(19930715)72:2<394::AID-CNCR2820720214>3.0.CO;2-5
Artykuł
CAS
PubMed
Google Scholar
Viallat JR, Raybuad F, Passarel M, Boutin C: Migracja opłucnowa włókien chryzotylowych po wstrzyknięciu dotchawiczym u szczurów. Arch Environ Health 1986, 41: 282–286.
Artykuł
CAS
PubMed
Google Scholar
Kane AB: Epidemiologia i patologia chorób azbestozależnych. Recenzje In Mineralogy 1993, 28: 347–359.
CAS
Google Scholar
Donaldson K, Borm PJ, Castranova V, Gulumian M: Granice testowania stresu oksydacyjnego za pośrednictwem cząstek in vitro w przewidywaniu różnych patologii; Znaczenie dla badania nanocząstek. Część Fibre Toxicol 2009, 6: 13. 10.1186/1743-8977-6-13
Artykuł
PubMed Central
PubMed
Google Scholar
Yang H, Testa JR, Carbone M: Epidemiologia międzybłoniaka, karcynogeneza i patogeneza. Curr Treat Options Oncol 2008, 9: 147–157. 10.1007/s11864-008-0067-z
Artykuł
PubMed Central
PubMed
Google Scholar
Puhakka A, Ollikainen T, Soini Y, Kahlos K, Saily M, Koistinen P, et al.: Modulation of DNA single-nive breaks by intracellular glutathione in human lung cells exposed to asbestos fibers. Mutat Res 2002, 514: 7–17.
Artykuł
CAS
PubMed
Google Scholar
Donaldson K: Toksykologia inhalacyjna włókienek p-aramidowych. Critical Reviews In Toxicology 2009, w druku.
Google Scholar
Kreyling WG, Moller W, Semmler-Behnke M, Oberdorster G: Dozymetria cząstek: osadzanie się i klirens z dróg oddechowych i translokatonu do miejsc pozapłucnych. W toksykologii cząstek. Tom Rozdział 3. Pod redakcją: Donaldson K, Borm P. CRC Press, Boca Raton USA; 2007:47–74.
Google Scholar
Schlesinger RB, Ben-Jebria A, Dahl AR, Snipes MB, Ultman J: Dyspozycja wziewnych substancji toksycznych. W: Handbook of Human Toxicology. Pod redakcją: Massaro EJ. CRC Press Boca Raton; 1997:493–550.
Google Scholar
Walton WH: Rozdział 5. Pyły unoszące się w powietrzu. W włóknach mineralnych i zdrowiu. Pod redakcją: Liddell D, Miller K. Boca Raton, FL:CRC Press; 1991:55–77.
Google Scholar
Stanton MF: Niektóre etiologiczne rozważania dotyczące karcynogenezy włókien. W "Skutki biologiczne azbestu". Pod redakcją: Bogovski P, Gilson JC, Timbrell V, Wagner JC. WHO IARC Lyon; 1973:289–294.
Google Scholar
Davis JM, Addison J, Bolton RE, Donaldson K, Jones AD, Smith T: Chorobotwórczość długich i krótkich próbek włókien azbestu amozytycznego podawanego szczurom przez inhalację i wstrzyknięcie dootrzewnowe. Br J Exp Pathol 1986, 67: 415–430.
PubMed Central
CAS
PubMed
Google Scholar
Adamson IY, Bakowska J, Bowden DH: Proliferacja komórek śródbłonka po wkropleniu długich lub krótkich włókien azbestu do płuc myszy. Am J Pathol 1993, 142: 1209–1216.
PubMed Central
CAS
PubMed
Google Scholar
Adamson IY, Bakowska J, Bowden DH: Proliferacja komórek śródbłonka: niespecyficzna odpowiedź na uszkodzenie płuc związane ze zwłóknieniem. Am J Respir Cell Mol Biol 1994, 10: 253–258.
Artykuł
CAS
PubMed
Google Scholar
Goodglick LA, Kane AB: Cytotoksyczność długich i krótkich włókien azbestu krokidolitu invitro i invivo. Cancer Research 1990, 50: 5153–5163.
CAS
PubMed
Google Scholar
Donaldson K, Brown GM, Brown DM, Bolton RE, Davis JG: Potencjał zapalny długich i krótkich próbek azbestu amozytu. British Journal Of Industrial Medicine 1989, 46: 271–276.
PubMed Central
CAS
PubMed
Google Scholar
Donaldson K, Li XY, Dogra S, Miller BG, Brown GM: Stymulowane azbestem uwalnianie czynnika martwicy nowotworu z makrofagów pęcherzykowych zależy od długości włókna i opsonizacji. Journal Of Pathology 1992, 168: 243–248. 10.1002/ścieżka.1711680214
Artykuł
CAS
PubMed
Google Scholar
Hill IM, Beswick PH, Donaldson K: Różnicowe uwalnianie anionów ponadtlenkowych przez makrofagi traktowane azbestem o długich i krótkich włóknach jest konsekwencją zróżnicowanego powinowactwa do opsoniny. Medycyna Pracy i Środowiska 1995, 52: 92–96.
Artykuł
CAS
Google Scholar
Ye J, Shi X, Jones W, Rojanasakul Y, Cheng N, Schwegler-Berry D, et al.: Krytyczna rola długości włókna szklanego w produkcji TNF-alfa i aktywacji czynnika transkrypcyjnego w makrofagach. American Journal Of Physiology 1999, 276: L426-L434.
CAS
PubMed
Google Scholar
Hesterberg TW, Tsutsui T, Barrett JC: Transformacja nowotworowa zarodka chomika syryjskiego (She) przez azbest i włókno szklane - znaczenie wymiaru włókna. Proceedings Of The American Association Of Cancer Research 1983, 24: 96.
Google Scholar
Donaldson K, Golyasnya N: Cytogenetyczne i patogenne skutki azbestu długo- i krótkometrażowego. Journal Of Pathology 1995, 177: 303–307. 10.1002/ścieżka.1711770313
Artykuł
CAS
PubMed
Google Scholar
Jensen CG, Watson M: Hamowanie cytokinezy przez azbest i włókna syntetyczne. Cell Biol Int 1999, 23: 829–840. 10.1006/cbir.1999.0479
Artykuł
CAS
PubMed
Google Scholar
Muhle H, Bellmann B, Creutzenberg O: Toksykokinetyka guzków stałych w przewlekłych badaniach na szczurach z użyciem sadzy z silników wysokoprężnych, sadzy, tonera, dwutlenku tytanu i kwarcu. W toksycznym i rakotwórczym działaniu cząstek stałych w drogach oddechowych. Pod redakcją: Mohr U, Dungworth D, Oberdorster G. ILSI Press Washington DC; 1994:29–41.
Google Scholar
Searl A, Buchanan D, Cullen RT, Jones AD, Miller BG, Soutar CA: Biotrwałość i trwałość dziewięciu rodzajów włókien mineralnych w płucach szczurów w ciągu 12 miesięcy. Ann Occup Hyg 1999, 43: 143–153.
Artykuł
CAS
PubMed
Google Scholar
Hesterberg TW, Miiller WC, Musselman RP, Kamstrup O, Hamilton RD, Thevenaz P: Biotrwałość sztucznych włókien szklistych i azbestu krokidolitu w płucach szczura po inhalacji. Fundamental And Applied Toxicology 1996, 29: 267–279. 10.1006/faat.1996.0031
Artykuł
CAS
PubMed
Google Scholar
Donaldson K, Aitken R, Tran L, Stone V, Duffin R, Forrest G, et al.: Carbon nanotubes: a review of their properties in relation to pulmonary toxicology and workplace safety. Toxicol Sci 2006, 92: 5–22. 10.1093/toxsci/kfj130
Artykuł
CAS
PubMed
Google Scholar
Davis JM: Strukturalne różnice między międzybłoniakami opłucnej i otrzewnej wytwarzanymi u szczurów przez wstrzyknięcie azbestu krokidolitu. Ann Anat Pathol (Paryż) 1976, 21: 199–210.
CAS
Google Scholar
Abu-Hijleh MF, Habbal OA, Moqattash ST: Rola przepony w absorpcji limfatycznej z jamy otrzewnej. J Anat 1995, 186(Pt 3):453–467.
PubMed Central
PubMed
Google Scholar
Donaldson K, Addison J, Miller BG, Cullen RT, Davis JG: Zastosowanie krótkoterminowej odpowiedzi zapalnej w jamie otrzewnej myszy do oceny aktywności biologicznej wyługowanych włókien szklistych. Environmental Health Perspectives 1994, 102: 159–162. 10.2307/3432077
Artykuł
PubMed Central
CAS
PubMed
Google Scholar
Agostoni E, Zocchi L: Płyn opłucnowy i jego wymiany. Respir Physiol Neurobiol 2007, 159: 311–323. 10.1016/j.resp.2007.07.002
Artykuł
CAS
PubMed
Google Scholar
Baumann MH, Strange C, Sahn SA, Kinasewitz GT: Makrofagi opłucnej w różny sposób zmieniają produkcję glikozoaminoglikanów komórek międzybłonka opłucnej. Exp Lung Res 1996, 22: 101–111. 10.3109/01902149609074020
Artykuł
CAS
PubMed
Google Scholar
Lai-Fook SJ: Mechanika opłucnej i wymiana płynów. Physiol Rev 2004, 84: 385–410. 10.1152/physrev.00026.2003
Artykuł
CAS
PubMed
Google Scholar
Li YY, Li JC: Ultrastruktura i trójwymiarowe badanie aparatów szparkowych limfatycznych w opłucnej żebrowej królika. Microsc Res Tech 2003, 62: 240–246. 10.1002/jemt.10388
Artykuł
PubMed
Google Scholar
Liu J, Wong HL, Moselhy J, Bowen B, Wu XY, Johnston MR: Celowanie w cząstki koloidalne do węzłów chłonnych klatki piersiowej. Lung Cancer 2006, 51: 377–386. 10.1016/j.lungcan.2005.11.006
Artykuł
PubMed
Google Scholar
Shinohara H: Rozmieszczenie aparatów szmatycznych na opłucnej powierzchni jamy piersiowej i topografia powierzchni międzybłonka opłucnowego u chomika złotego. Anat Rec 1997, 249: 16–23. 10.1002/(SICI)1097-0185(199709)249:1<16::AID-AR3>3.0.CO;2-D
Artykuł
CAS
PubMed
Google Scholar
Mitchev K, Dumortier P, De Vuyst P: "Czarne plamy" i szkliste płytki opłucnej na opłucnej ciemieniowej 150 przypadków sekcji miejskiej. Am J Surg Pathol 2002, 26: 1198–1206. 10.1097/00000478-200209000-00010
Artykuł
PubMed
Google Scholar
Muller KM, Schmitz I, Konstantinidis K: Czarne plamy opłucnej ciemieniowej: morfologia i patogeneza formalna. Oddychanie 2002, 69: 261–267. 10.1159/000063630
Artykuł
PubMed
Google Scholar
Roberts GH: Patologia ciemieniowych blaszek opłucnej. J Clin Pathol 1971, 24: 348–353. 10.1136/jcp.24.4.348
Artykuł
PubMed Central
CAS
PubMed
Google Scholar
Churg A: Choroba nienowotworowa wywołana przez azbest. W patologii zawodowej choroby płuc. Tom Rozdział 9. Drugie wydanie. Pod redakcją: Churg A, Green FHY. Williams i Wilkins, Baltimore; 1998:277–338.
Google Scholar
Churg A, Green F: Patologia zawodowej choroby płuc. 2. edycja. Williams i Wilkins, Baltimore; 1999.
Google Scholar
Mutsaers SE, Prele CM, Brody AR, Idell S: Pathogenesis of pleural fibrosis. Respirology 2004, 9: 428–440. 10.1111/j.1440-1843.2004.00633.x
Article
PubMed
Google Scholar
Miserocchi G: Physiology and pathophysiology of pleural fluid turnover. Eur Respir J 1997, 10: 219–225. 10.1183/09031936.97.10010219
Article
CAS
PubMed
Google Scholar
Boutin C, Schlesser M, Frenay C, Astoul P: Złośliwy międzybłoniak opłucnej. Eur Respir J 1998, 12: 972–981. 10.1183/09031936.98.12040972
Artykuł
CAS
PubMed
Google Scholar
Churg A, Wiggs B, Depaoli L, Kampe B, Stevens B: Zawartość azbestu w płucach u pracowników chryzotylu z międzybłoniakiem. Am Rev Respir Dis 1984, 130: 1042–1045.
CAS
PubMed
Google Scholar
Dodson RF, Williams MG Jr, Corn CJ, Brollo A, Bianchi C: Zawartość azbestu w tkance płucnej, węzłach chłonnych i płytkach opłucnej od byłych stoczniowców. Am Rev Respir Dis 1990, 142: 843–847.
Artykuł
CAS
PubMed
Google Scholar
Kohyama N, Suzuki Y: Analiza włókien azbestowych w miąższu płuc, płytkach opłucnej i tkankach międzybłoniaka północnoamerykańskich pracowników izolacji. Ann N Y Acad Sci 1991, 643: 27–52. 10.1111/j.1749-6632.1991.tb24442.x
Artykuł
CAS
PubMed
Google Scholar
Bernstein DM, Rogers R, Smith P: Biotrwałość brazylijskiego azbestu chryzotylowego po inhalacji. Inhal Toxicol 2004, 16: 745–761. 10.1080/08958370490490176
Artykuł
CAS
PubMed
Google Scholar
Ryman-Rasmussen JP, Tewksbury EW, Moss OR, Cesta MF, Wong BA, Bonner JC: Wdychane wielościenne nanorurki węglowe nasilają zwłóknienie dróg oddechowych w astmie alergicznej u myszy. American Journal Of Respiratory Cell And Molecular Biology 2008. 2008–0276OC
Google Scholar
McElvenny DM, Darnton AJ, Price MJ, Hodgson JT: Śmiertelność międzybłoniaka w Wielkiej Brytanii w latach 1968-2001. Occup Med (Lond) 2005, 55: 79–87. 10.1093/occmed/kqi034
Artykuł
Google Scholar
Dodson RF, Atkinson MA: Pomiary obciążenia azbestem w tkankach. Ann N Y Acad Sci 2006, 1076: 281–291. 10.1196/annals.1371.015
Artykuł
PubMed
Google Scholar
Sebastien P, Janson X, Gaudichet A, Hirsch A, Bignon J: Retencja azbestu w tkankach ludzkiego układu oddechowego: pomiary porównawcze w miąższu płuc i opłucnej ciemieniowej. IARC Sci Publ; 1980:237–246.
Google Scholar
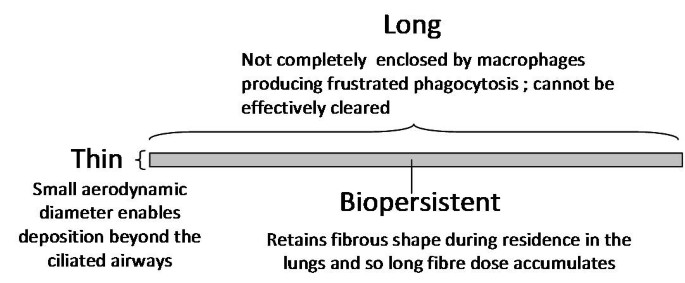
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)