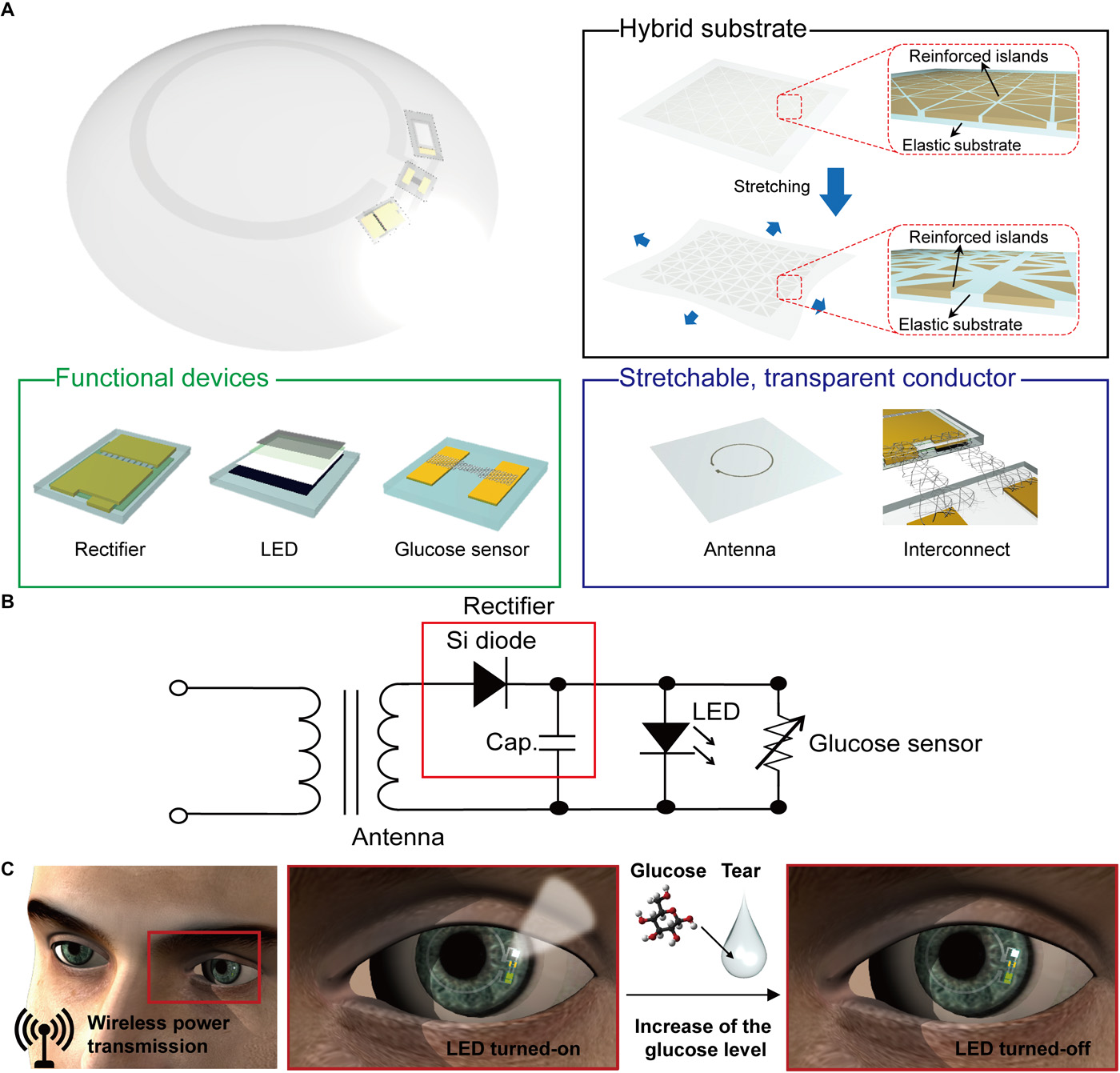
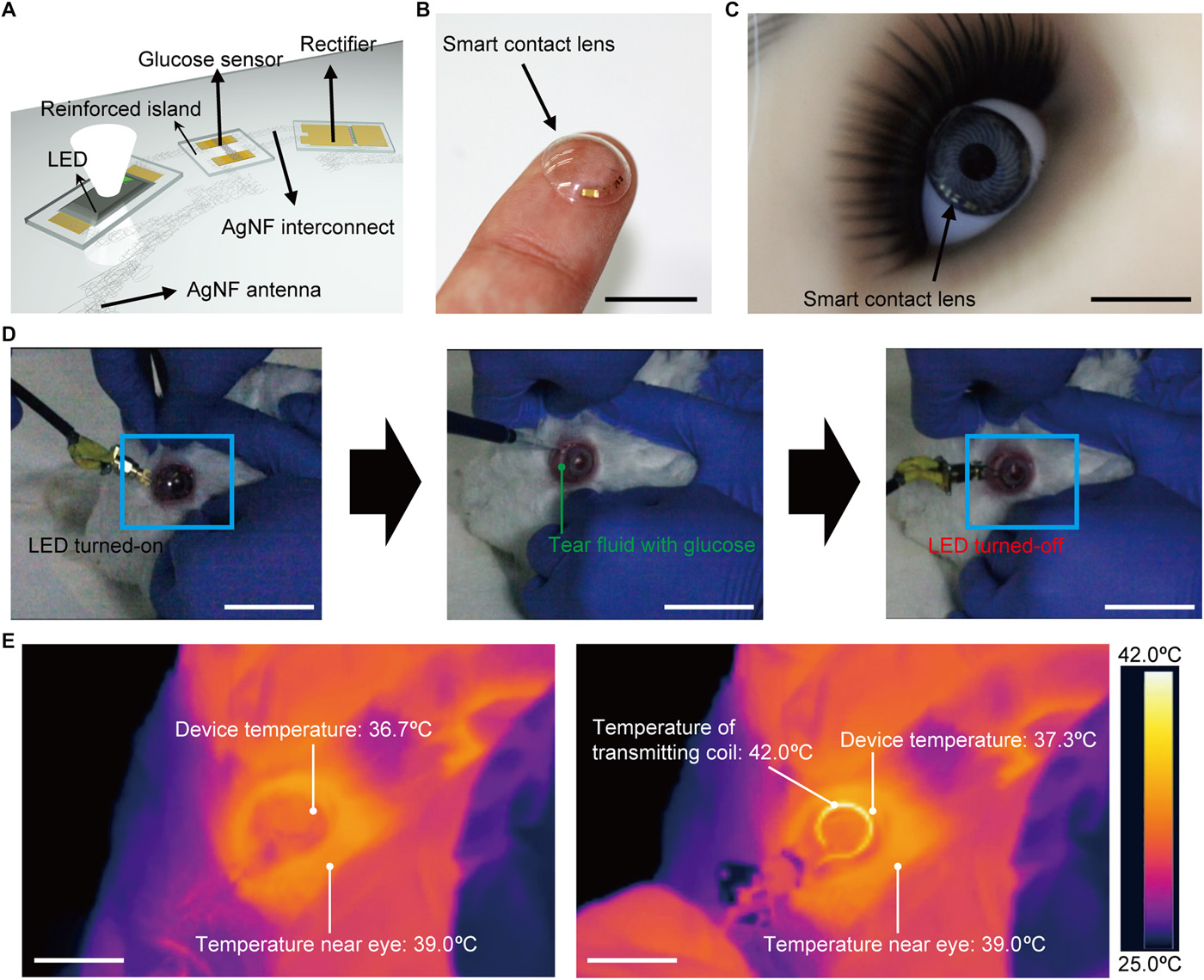
Ten czujnik glukozy został zintegrowany z wyświetlaczem bezprzewodowym (piksel LED, obwód prostowniczy i antena) przy użyciu hybrydowego podłoża jako w pełni funkcjonalnej inteligentnej soczewki kontaktowej. Po wytworzeniu wyświetlacza bezprzewodowego na podłożu hybrydowym, warstwa protektorowa Cu została wytrawiona w celu rozwarstwienia próbki. Następnie warstwa parylenu została częściowo wytrawiona w celu pasywacji całego regionu urządzenia, z wyjątkiem części kanałowej czujnika do wykrywania roztworu glukozy. Kanał grafenowy został przeniesiony na ten układ scalony. Następnie te zintegrowane elementy zostały osadzone w miękkiej soczewce kontaktowej przy użyciu procesu formowania (film S1). Podczas tego etapu formowania kanał grafenowy został otwarty i miejscowo odkryty przez materiał soczewki (elastomer silikonowy) w celu fizycznego kontaktu kanału z łzami. Ostatecznie GOD i CAT zostały unieruchomione na powierzchni grafenu, aby służyć jako czujnik glukozy.
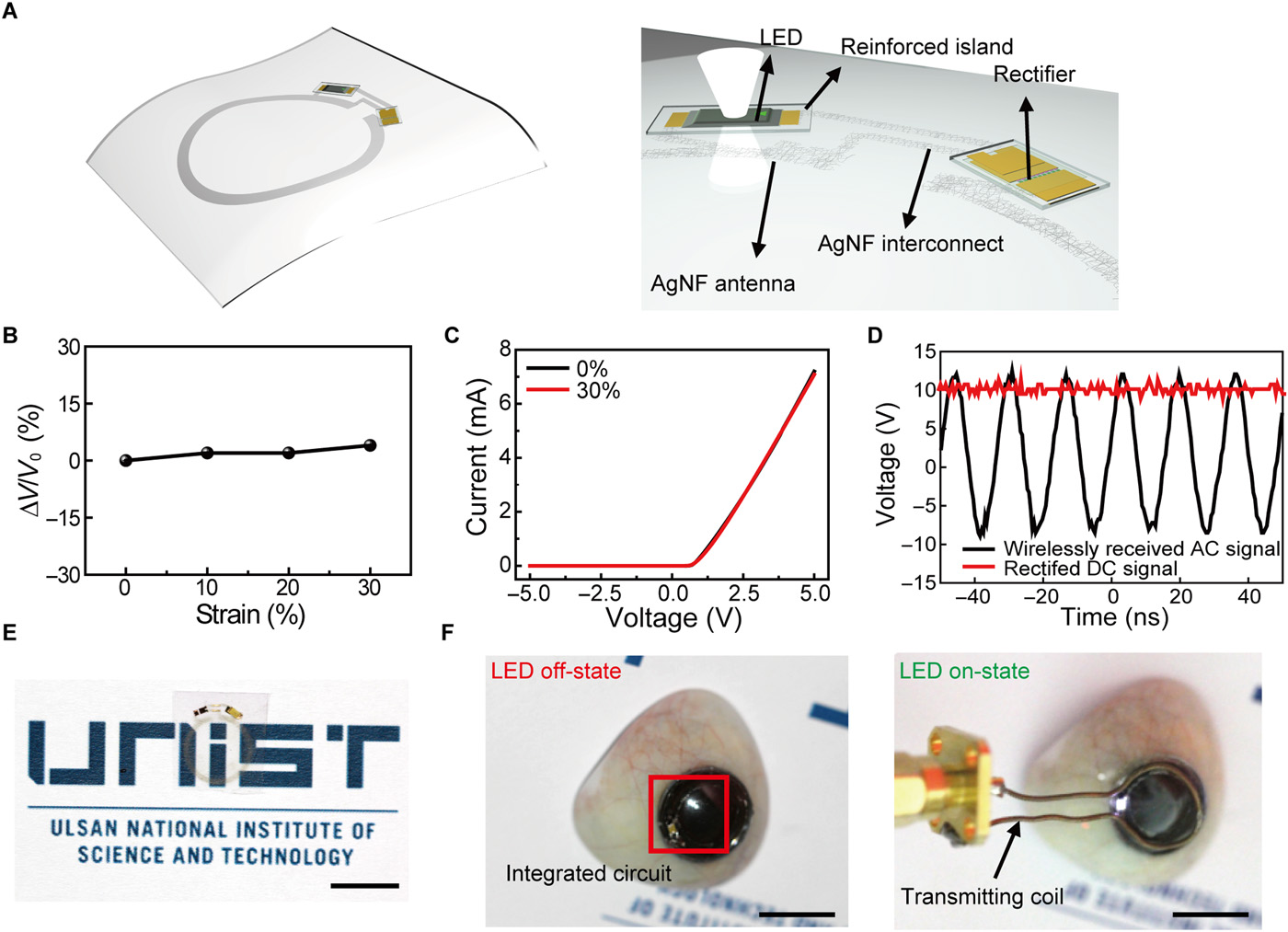
Rysunek 5 (A i B) przedstawia odpowiednio ilustrację schematyczną i zdjęcie w pełni zintegrowanej soczewki kontaktowej. Elektrody i urządzenia oparte na AgNF w powstałej inteligentnej soczewce kontaktowej są pasywowane przez warstwę parylenową, tak że ta warstwa pasywacyjna parylenu, jako bariera dyfuzyjna, zapobiega wyciekowi AgNF i jednocześnie zapewnia ochronę AgNF przed płynem łzowym (
41). Jak pokazano na
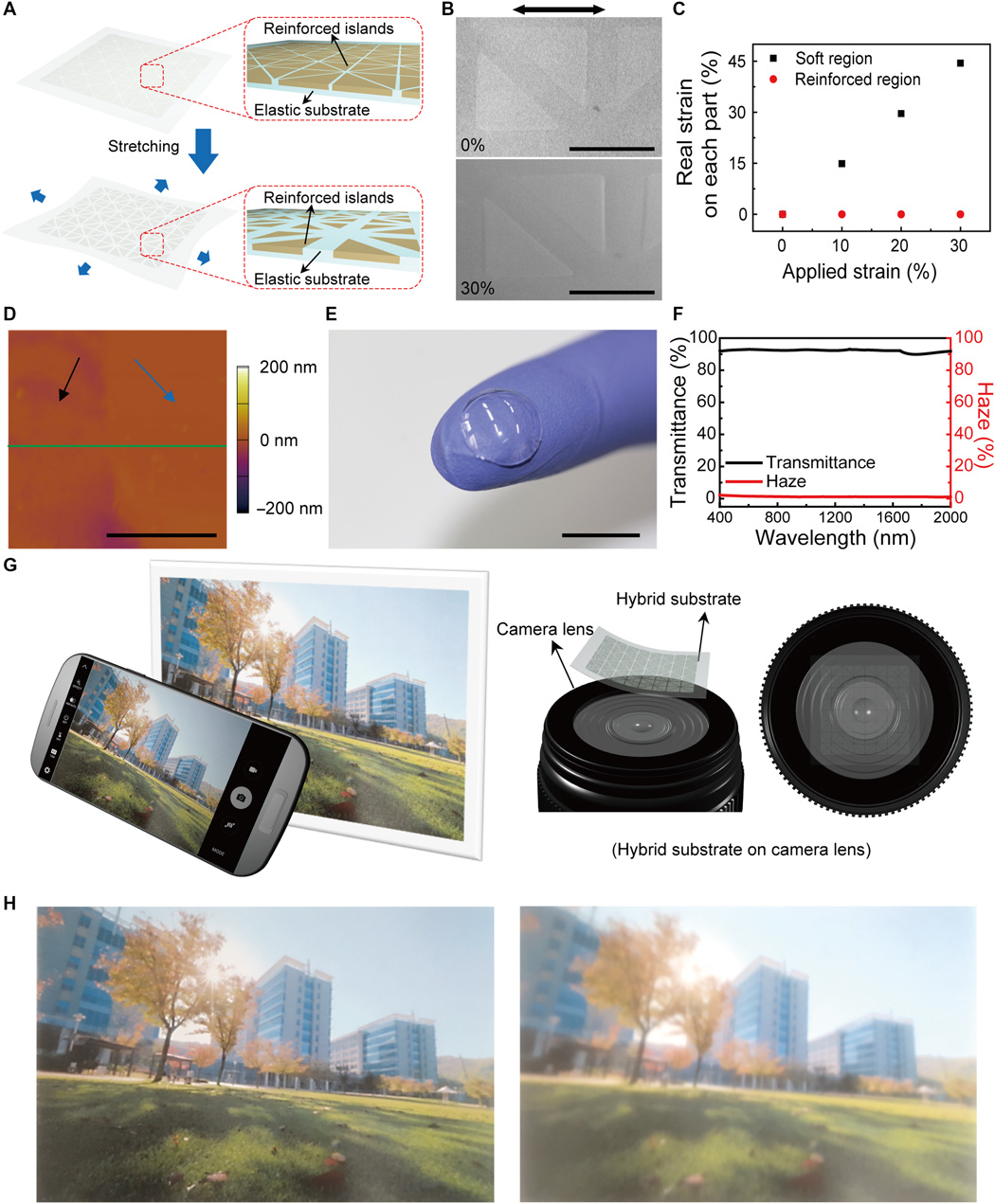
rys. 5C, powstała soczewka może zapobiegać zakłóceniom pola widzenia użytkownika, umieszczając nieprzezroczyste elementy (diody LED i wzory metalowe) poza ludzką źrenicą i dopasowując współczynniki załamania wzmocnionego materiału i elastomeru silikonowego z nieznacznym odchyleniem (Δ
n = 0,003). Długoterminowa stabilność tej inteligentnej soczewki została zbadana pod kątem powtarzalności podczas wielokrotnego użycia, przechowując w sztucznym roztworze łez przez okres do 48 godzin. Występuje znikoma degradacja odpowiedzi nawet po 48 godzinach, co sugeruje, że enzymy utrzymują swoją aktywność przez co najmniej 48 godzin (ryc. S13A). Ponadto obiektyw ten wykazywał prawie stałe napięcia wyjściowe przez prostownik antenowy nawet po 48 godzinach, ponieważ są one pasywowane przez podłoże hybrydowe i parylen, który może działać jako bariera dyfuzyjna (rys. S13B). Ponadto zbadano jego stabilność mechaniczną wobec cyklicznych odkształceń. Po 5000 cyklach rozciągania i zwalniania przy naprężeniu rozciągającym 30% inteligentna soczewka kontaktowa działała stabilnie z nieznaczną degradacją (rys. S13C). Ponieważ średni poziom glukozy łez u pacjentów z cukrzycą na czczo zwykle przekracza 0,9 mM, a stężenie dla osób na czczo bez cukrzycy wynosi poniżej 0,6 mM (
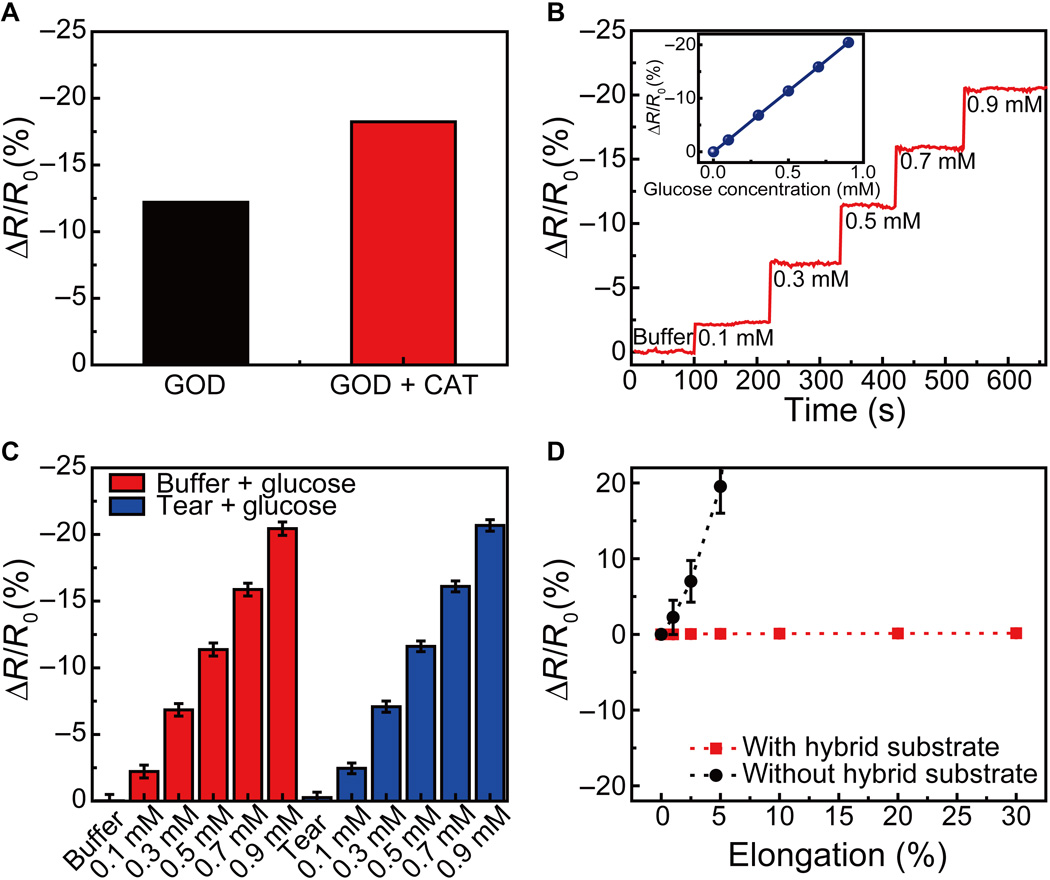
39), w naszym obwodzie wybrano stężenie glukozy 0,9 mM jako próg do zdiagnozowania cukrzycy ze wskazaniem włączenia / wyłączenia LED. Próg ten można dostroić po prostu zmieniając rezystancję czujnika. Wraz ze wzrostem stężenia glukozy w płynie łzowym zmniejsza się rezystancja czujnika. To zmniejszenie rezystancji czujnika zmniejsza rezystancję obwodu równoległego diody LED i czujnika (
rys. 1B). Jednak rezystancja innych elementów w tym systemie pozostaje niezmieniona. Powoduje to zmniejszenie polaryzacji przyłożonej do obwodu równoległego diody LED i czujnika w warunkach stale przyłożonego napięcia. Dlatego odchylenie zastosowane do piksela LED i luminancja diody LED zmniejszają się wraz ze wzrostem stężenia glukozy aż do progu (rys. S14). Gdy stężenie glukozy przekracza 0,9 mM, piksel ten wyłącza się, ponieważ odchylenie przyłożone do diody LED staje się niższe niż napięcie wyłączania.
Rysunek 5D pokazuje żywego królika noszącego te inteligentne soczewki kontaktowe do testu in vivo. Po założeniu tej miękkiej soczewki na oko królika byliśmy w stanie bezprzewodowo monitorować wzrost stężenia glukozy powyżej progu, obserwując działanie włączania / wyłączania diody LED. Przy stężeniu glukozy większym niż 0,9 mM dioda LED wyłączyła się, jak pokazano na prawym obrazku
rys. 5D i filmie S3. Królik nie wykazywał oznak nienormalnego zachowania, a ta inteligentna soczewka pozostała stabilna podczas powtarzających się mrugnięć oczami. Stabilny stan inteligentnych soczewek kontaktowych został potwierdzony przez operacje z wyższym transferem mocy (film S3). Wyższa moc indukuje wzrost prądu w diodzie LED, aby ją włączyć, chociaż rezystancja czujnika jest zmniejszona przez glukozę. W związku z tym piksel LED wyłączył się, ponieważ stężenie glukozy przekroczyło próg, a nie z powodu uszkodzenia obwodu. Konstrukcja jest taka, że dioda LED wyłącza się po wykryciu wysokiego poziomu glukozy, co jest sprzeczne z intuicją. Dlatego ulepszenie projektu systemu inteligentnych soczewek, który zapewnia intuicyjny status w celu wsparcia użyteczności, stanowi obiecujący obszar dla przyszłych prac (na przykład monitorowanie poziomu biomarkerów za pomocą smartfona). Ponadto wytwarzanie ciepła monitorowano za pomocą kamery termowizyjnej podczas bezprzewodowej pracy tego obiektywu (
rys. 5E i film S4). Chociaż królik nosił bezprzewodowo działający obwód soczewki, temperatura tego urządzenia soczewkowego była utrzymywana na poziomie ~ 37 ° C bez znaczącego wytwarzania ciepła. Chociaż bezprzewodowe przeniesienie mocy z cewki nadawczej do obiektywu zwiększyło temperaturę tej cewki nadawczej do ~42°C, czyli nieco więcej niż temperatura otoczenia, jej funkcja bezprzewodowa uniemożliwiła tej cewce dotknięcie oka lub powieki królika z przerwą ~5 mm. Ponadto, zgodnie z wynikami symulacji współczynnika absorpcji swoistej (SAR) dla osoby, maksymalna wartość SAR naszego inteligentnego systemu soczewek kontaktowych wynosiła 1,399 W/kg (rys. S15), która jest znacznie niższa niż wartość regulacyjna (10 W/kg) (
42).