- Journal List
- Adv Pharm Bull
- v.10(2); 2020 Jun
- PMC7191226

Nanostrukturalne nośniki lipidów: przełomowe podejście do przezskórnego dostarczania leków
Iti Chauhan
1Department of Pharmaceutics, I.T.S College of Pharmacy, Muradnagar, Ghaziabad- 201206, Uttar Pradesh, India.
Mohd Yasir
2Department of Pharmacy, College of Health Science, Arsi University, Asella, Oromia Region, Ethiopia.
Madhu Verma
1Department of Pharmaceutics, I.T.S College of Pharmacy, Muradnagar, Ghaziabad- 201206, Uttar Pradesh, India.
Alok Pratap Singh
1Department of Pharmaceutics, I.T.S College of Pharmacy, Muradnagar, Ghaziabad- 201206, Uttar Pradesh, India.
Abstrakt
Nanostrukturalne nośniki lipidów (NLC) to nowe preparaty farmaceutyczne, które składają się z fizjologicznych i biokompatybilnych lipidów, środków powierzchniowo czynnych i kosurfaktantów. Z biegiem czasu, jako nanonośnik lipidowy drugiej generacji, NLC pojawił się jako alternatywa dla nanocząstek pierwszej generacji. Ten artykuł przeglądowy podkreśla strukturę, skład, różne metodologie formułowania i charakterystykę NLC, które są warunkiem wstępnym w formułowaniu stabilnego systemu dostarczania leków. NLC mają ogromny potencjał na rynku farmaceutycznym i kosmetycznym ze względu na rozległe korzystne efekty, takie jak nawilżenie skóry, okluzja, zwiększona biodostępność i celowanie w skórę. Ten artykuł ma na celu wzbudzenie zainteresowania obecnym stanem techniki NLC poprzez omówienie ich obiecującej pomocy w miejscowym systemie dostarczania leków. Kluczowymi atrybutami NLC, które czynią je obiecującym systemem dostarczania leków, są łatwość przygotowania, biokompatybilność, wykonalność zwiększenia skali, nietoksyczność, ulepszone ładowanie leków i stabilność.
Wprowadzenie
Obecnie dziedzina nanotechnologii jest intensywnie wykorzystywana w technologii dostarczania leków do pasywnego i aktywnego ukierunkowania różnymi drogami podawania. Zastosowanie nanotechnologii w transdermalnym i miejscowym podawaniu leków ogłosiło nową domenę w dostarczaniu farmaceutyków przez skórę. Nanocząstki definiuje się jako koloidalne układy cząstek stałych o wymiarach od 10 do 1000 nm.1 Stałe nanocząstki lipidowe (SLN) zostały skonceptualizowane na początku 1990 roku przez profesora R.H. Müllera (Niemcy) i profesora M. Gasco (Włochy) jako nowy preparat posiadający kilka zalet, np. Zastosowanie biokompatybilnych lipidów, najmniejsze użycie rozpuszczalników organicznych podczas formulacji, wysoka stabilność in vivo i szerokie spektrum zastosowań.2 SLN to cząstki koloidalne przygotowane z lipidów stałych (stałych w temperaturze pokojowej i temperaturze ciała), środków powierzchniowo czynnych, składnika aktywnego i wody. Mimo to SLN doświadczają pewnych ograniczeń, takich jak słaba zdolność ładowania leku, nieprzewidywalna tendencja do żelowania, przejścia polimorficzne i wyciek leku podczas przechowywania.1-3
Nanostrukturalne nośniki lipidów (NLC) pojawiają się jako nanocząstki lipidowe drugiej generacji, aby przezwyciężyć niedociągnięcia pierwszej generacji, tj. SLN. Biodegradowalne i kompatybilne lipidy (stałe i ciekłe) oraz emulgatory są używane do otrzymywania NLC. Włączenie ciekłych lipidów (oleju) powoduje strukturalne niedoskonałości stałych lipidów, co prowadzi do mniej uporządkowanego układu krystalicznego, który zapobiega wyciekowi leku i zapewnia duże obciążenie lekami.2,4 W ciągu ostatnich kilku lat NLC zyskały uwagę naukowców jako alternatywa dla SLN, nanocząstek polimerowych, emulsji, mikrocząstek, liposomów itp.5 Te nanonośniki mają użyteczność w dostarczaniu leków hydrofilowych i lipofilowych. NLC stały się obiecującym systemem nośników do dostarczania farmaceutyków drogą doustną, pozajelitową, oczną, płucną, miejscową i przezskórną. Ostatnio NLC są również wykorzystywane w celowaniu w mózg, chemioterapii, terapii genowej, przemyśle spożywczym oraz dostarczaniu kosmeceutyków i nutraceutyków.5 Tabela nr 1 wspomina o zaletach i wadach NLC.
Tabela nr 1
| Zalety | Wady |
| Większa ładowność dla niektórych leków | Efekty cytotoksyczne związane z charakterem matrycy lipidowej i jej stężeniem |
| Mniej wody w dyspersji | Podrażniające i uczulające działanie surfaktantów |
| Zapobieganie lub minimalizowanie wydalania leku podczas przechowywania | Nadal należy wykorzystać zastosowanie i skuteczność w przypadku leków białkowych i peptydowych oraz systemów dostarczania genów |
| Kontrola i ukierunkowane uwalnianie leków | Stabilność lipidów |
| Wykonalność ładowania zarówno leków lipofilowych, jak i hydrofilowych | - |
| Stosowanie biodegradowalnych i biokompatybilnych lipidów | - |
| Unikaj rozpuszczalników organicznych | - |
| Tańsze (tańsze niż nośniki polimerowe/powierzchniowo czynne | - |
| Łatwiejsza kwalifikacja, walidacja i uzyskanie zatwierdzenia przez organy regulacyjne | - |
| Lepsza stabilność fizyczna | - |
| Łatwość przygotowania i skalowanie | - |
| Poprawa stosunku korzyści do ryzyka | - |
| Zwiększenie nawilżenia i elastyczności skóry | - |
| Niewielkie rozmiary zapewniają bliski kontakt z warstwą rogową | - |
| Zwiększona stabilność leków | - |
Rodzaje NLC
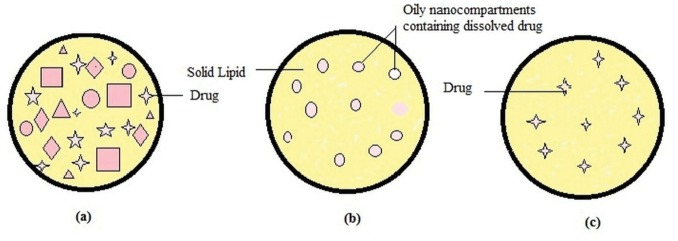
W zależności od umiejscowienia włączonych grup leków do NLC, następujące trzy rodzaje modeli morfologicznych (Ryc. 1) zaproponowano:
NLC typ I (model kryształu niedoskonałego)
Niedoskonały kryształ typu NLC składa się z wysoce nieuporządkowanej matrycy z wieloma pustkami i przestrzeniami, które mogą pomieścić więcej cząsteczek leków w amorficznych klastrach. Te niedoskonałości w porządku krystalicznym są nabywane przez zmieszanie stałych lipidów z odpowiednią ilością ciekłych lipidów (olejów). Ze względu na różną długość łańcucha kwasów tłuszczowych i mieszaninę mono-, di- i triacylogliceroli, matryca NLC nie jest w stanie utworzyć wysoce uporządkowanej struktury. Mieszanie przestrzennie różnych lipidów zwiększa ładowność leku, jednak ten model oferuje minimalną skuteczność uwięzienia.8,9
NLC typ II (typ wielokrotny)
Wiele typów NLC to rodzaj oleju / lipidu / wody. Leki lipofilowe są bardziej rozpuszczalne w płynnych lipidach niż stałe lipidy. Pomysł ten prowadzi do opracowania wielu typów NLC przy użyciu wysokiej zawartości płynnych lipidów. Ugrupowania olejowe, w niskich stężeniach, są skutecznie rozproszone w matrycy lipidowej. Dodatek oleju poza jego rozpuszczalnością indukuje separację faz, tworząc małe nano przedziały oleju otoczone stałą matrycą. Model typu II oferuje takie zalety, jak wysoka skuteczność pułapkowania leków, kontrolowane uwalnianie leków i zminimalizowany wyciek leku.9,10
NLC typ III (model amorficzny)
Amorficzny NLC jest formułowany przez staranne mieszanie lipidów w taki sposób, aby zminimalizować wyciek leku spowodowany procesem krystalizacji. Specyficzne lipidy, takie jak hydroksyl oktakosanyl, stearynian hydroksylowy, mirystynian izopropylu lub adypinian dibutylu tworzą stałe, ale niekrystaliczne cząstki. Matryca lipidowa istnieje w jednorodnym stanie amorficznym.8-10
Substancje pomocnicze stosowane w formułowaniu NLC
Ogólnie rzecz biorąc, NLC składają się z lipidów (stałych, jak i ciekłych), środków powierzchniowo czynnych, rozpuszczalników organicznych i innych czynników, takich jak jony przeciwdziałające i modyfikatory powierzchni. Tabela nr 2 zawiera niektóre substancje pomocnicze stosowane do formułowania NLC.
Tabela nr 2
| Składnik | Przykłady |
| Stały lipidowy | Wosk pszczeli, wosk Caranauba 2442, kwas stearynowy, palmitynian cetylu, Apifil®, Cutina CP, Dynasan 116, Dynasan®®118, Precifac ATO, Compritol®888 ATO, Elfacos® C 26, Imwitor 900,Precirol®® ATO 5, tristearyna, cholesterol,® kwas palmitynowy |
| Ciekłe lipidy (oleje) | Cetiol V, Miglyol® 812, Olej rycynowy, kwas oleinowy, olej Davana, olej palmowy, oliwa z oliwek, oleinian izodecylu, olej parafinowy, dkaprylokapadan glikolu propylenowego, kwas linolowy, kwas dekanowy, olej arganowy, olej kokosowy |
| Środki emulgujące | Pluronic F68 (poloxamer 188), Pluronic®® F127 (poloxamer 407), Tween 20, Tween 40, Tween 80, alkohol poliwinylowy, Solutol HS15, trehaloza, dezoksycholan sodu, glikocholan sodu, oleinian sodu, poliglicerol® metylo-glukozowy distearynian, Tego®Care 450, Tween™80, Maquat SC 18Maquat®® BTMC-85%, lecytyna jajeczna, lecytyna sojowa, fosfatydylocholiny, fosfatydyloetanoloaminy, Gelucire® 50/13, Miranol ultra 32 |
| Przeciwjony | Heksadecylowofosforan sodu, fosforan monodecylu, fosforan heksadecylowy mono, fosforan monooktylu, sól sodowa siarczanu dekstranu, hydrolizowany i polimeryzowany epoksydowany olej sojowy |
Lipidy
Podstawowym składnikiem nanostrukturalnych nośników lipidowych, które regulują zdolność ładowania leku, przedłużają działanie i stabilność formulacji, są lipidy. Do formułowania NLC zastosowano stałe lipidy, takie jak kwasy tłuszczowe, trójglicerydy, diglicerydy, monoglicerydy, steroidy i woski.12 Fizjologicznie akceptowalne, biodegradowalne, nietoksyczne i ogólnie uznane za bezpieczne (GRAS) lipidy są preferowane do otrzymywania nanocząstek lipidowych.10
Wybór odpowiednich lipidów jest niezbędny przed ich wykorzystaniem w przygotowaniu nośników nanocząsteczkowych. Rodzaj i struktura lipidów wpływa na różne cechy nanonośników. W praktyce zaproponowano rozpuszczalność lub wyraźny współczynnik podziału bioaktywnych w lipidach jako najlepsze kryteria wyboru odpowiedniego lipidu. Rozpuszczalność cząsteczek leku w lipidach ma charakter interpretacyjny, ponieważ wpływa na ładowanie leku i wydajność kapsułkowania.10 Stopień krystalizacji różnych zastosowanych lipidów wpływa również na uwięzienie i obciążenie leku, rozmiar i ładunek oraz skuteczność.12
Ze względu na wyższą lepkość fazy rozproszonej, ze względu na wyższe topnienie lipidów, wzrasta średnia wielkość cząstek nanodyspersji. Kształt kryształów lipidów, hydrofilowość lipidowa, zmienność składu to dodatkowe parametry związane z lipidami, które mogą wpływać na jakość NLC. Stwierdzono, że wzrost ilości lipidów o 5-10% prowadzi do większego rozmiaru cząstek.13
Surfaktanty
Rodzaj i stężenia surfaktantu wywierają wpływ na jakość i skuteczność NLC. Stwierdzono, że na toksyczność, stabilność fizyczną i krystaliczność NLC duży wpływ ma wybór środka powierzchniowo czynnego.14 Systemy środków powierzchniowo czynnych mają również wpływ na stopień rozpuszczania leków i przepuszczalność leków. Surfaktanty dobierane są na podstawie drogi podania, wartości równowagi hydrofilowo-lipofilowej (HLB), wpływu na wielkość cząstek oraz modyfikacji lipidów. Środki powierzchniowo czynne (emulgatory) są adsorbowane na granicy faz, gdzie zmniejszają napięcie między fazą lipidową i wodną ze względu na ich amfipatyczny charakter.5 Podczas formułowania NLC krystalizacja cząstek koloidu idzie w parze z krzepnięciem, ale powierzchnia cząstek znacznie wzrasta podczas krystalizacji, tak że cały system staje się niestabilny. W związku z tym środek powierzchniowo czynny jest niezbędny do poprawy jakości interfejsu nanocząstek w celu osiągnięcia stabilności.15 Modyfikacja składu układu powierzchniowo czynnego może regulować mieszalność składników chemicznych w NLC, a tym samym stabilność.14
Wymagany HLB (rHLB) odgrywa ważną rolę przy wyborze odpowiedniego rodzaju i ilości środka powierzchniowo czynnego do formulacji NLC.16 rHLB lipidów i matrycy lipidowej określa się w celu obliczenia ilości emulgatorów, które mają być dodane do formulacji. Wartość rHLB dla lipidów jest wartością HLB emulgatora, która jest niezbędna do właściwej emulgacji, tj. zmniejszenia napięcia międzyfazowego między fazą olejową a wodną. Pomaga to również w osiągnięciu stabilnego nanosystemu i małych cząstek NLC.17,18 Oznaczając rHLB, do formulacji można zastosować odpowiednią kombinację emulgatorów o najmniejszym stężeniu. rHLB dla lipidów (stałych i ciekłych) i matrycy lipidowej oblicza się doświadczalnie przez dyspergowanie w mieszaninach środka powierzchniowo czynnego o różnych wartościach HLB. Mieszaninę poddaje się homogenizacji wysokociśnieniowej i analizuje pod kątem najmniejszej wielkości cząstek.16,18,19
Inne składniki
Sole organiczne i polimery jonowe mogą być stosowane jako przeciwjony w formułowaniu nośników nanostrukturalnych w celu przezwyciężenia wyzwania związanego z kapsułkowaniem cząsteczek leków rozpuszczalnych w wodzie. Modyfikatory powierzchni to kolejna kategoria substancji pomocniczych stosowanych w formulacji NLC w celu zminimalizowania ich fagocytarnego wychwytu przez makrofagi w układzie siateczkowo-śródbłonkowym (RES). Cząsteczki lipidów są pokryte hydrofilowymi polimerami, takimi jak PEG, poloksaminy lub poloksamery, aby wydłużyć czas przebywania cząsteczek leku w krążeniu ogólnoustrojowym. Modyfikacja powierzchni może oferować inne korzyści, takie jak zwiększona stabilność fizyczna i biokompatybilność, celowanie w leki, zwiększony transport przez nabłonek.10,20
Metody przygotowania NLC
Technika homogenizacji wysokociśnieniowej
Technika ta jest wydajna i niezawodna w produkcji NLC na skalę komercyjną. Wysokie ciśnienie stosowane w technice homogenizacji pozwala uniknąć stosowania rozpuszczalników organicznych w preparatach i uczynić je przyjaznymi dla środowiska. Ponadto homogenizacja wysokociśnieniowa jest łatwa do skalowania i jest atrakcyjną techniką stosowaną w produkcji farmaceutyków i kosmetyków do stosowania miejscowego.21 Homogenizację na gorąco przeprowadza się w podwyższonej temperaturze, a homogenizację na zimno przeprowadza się poniżej temperatury pokojowej. Składnik aktywny jest rozpuszczany lub rozpraszany w stopionym lipidze przed homogenizacją wysokociśnieniową, w obu podejściach. Wysokie ciśnienie (100–2000 bar) przesuwa płyn w wąskiej szczelinie homogenizatora.
Homogenizacja na gorąco
W tym podejściu homogenizacja jest przeprowadzana w podwyższonej temperaturze. Stałe lipidy topią się w temperaturze powyżej 5-10°C powyżej ich temperatury topnienia. Dyspersję uzyskuje się przez dodanie ciekłego lipidu i leku, który ma być kapsułkowany. Mieszanina jest rozpraszana w wodnym roztworze środka powierzchniowo czynnego(-ych) podgrzanego do tej samej temperatury przez urządzenie mieszające z szybkim cięciem i prowadzi do powstania wstępnej emulsji. Preemulsja jest wprowadzana do homogenizatora wysokociśnieniowego w kontrolowanej temperaturze. Zasadniczo do homogenizacji wystarcza od 3 do 5 cykli przy ciśnieniu 500-1500 barów. Lipid rekrystalizuje i powoduje powstawanie nanocząstek, gdy nanoemulsja jest stopniowo schładzana. Zastosowanie wysokiej temperatury podczas procesu może prowadzić do degradacji składników wrażliwych na ciepło. Kolejnym problemem, który może się pojawić, jest zmniejszenie zdolności emulgujących surfaktantów na skutek wysokiej temperatury, ponieważ surfaktanty mają punkt zmętnienia niższy niż 85°C. Może to wywoływać niestabilność nanonośników.4,6,21-23
Homogenizacja na zimno
W tej technice stop lipidów zawierający substancję czynną jest szybko schładzany do zestalenia przy użyciu ciekłego azotu lub suchego lodu, a następnie mielony i mielony przed rozproszeniem w zimnej fazie środka powierzchniowo czynnego, a następnie homogenizowany w temperaturze pokojowej. Ciśnienie stosowane w procesie na zimno jest wyższe, tj. 5-10 cykli po 1500 bar. Takie podejście minimalizuje ekspozycję termiczną leku i dobrze nadaje się do leków termolabilnych. Poprawa skuteczności uwięzienia leków i równomierna dystrybucja leku w lipidach to inne zalety tej metody. Powoduje to jednak powstawanie nanocząstek o bardziej zmiennych rozmiarach.4,22-24
Metoda odparowywania emulgowania rozpuszczalnikowego
W tej metodzie lipidy (stały lipid + ciekły lipid) wraz z lekiem rozpuszcza się w niemieszającym się z wodą rozpuszczalniku organicznym (cykloheksan, chloroform).25 Otrzymaną mieszaninę rozprasza się do wodnego roztworu emulgatorów wytwarzając emulsję o/w. Odparowanie pod zmniejszonym ciśnieniem jest stosowane w celu usunięcia rozpuszczalnika z emulsji. Odparowanie prowadzi do dyspersji nanocząstek w fazie wodnej (poprzez wytrącanie lipidów w środowisku wodnym). Ta metoda pozwala uniknąć naprężeń termicznych, ale stosowanie rozpuszczalnika organicznego jest wadą. Wielkość cząstek może wynosić od 30-100 nm w zależności od stałego lipidu i środka powierzchniowo czynnego.6,24
Metoda dyfuzji emulgowania rozpuszczalnikowego
W tej technice rozpuszczalnik i woda są wzajemnie nasycone w celu utrzymania początkowej równowagi termodynamicznej.
Następnie lipidy i lek rozpuszcza się w rozpuszczalniku nasyconym wodą. Lek zawierający rozpuszczalnik i lipidy są emulgowane w nasyconym rozpuszczalnikiem wodnym roztworze emulgatora przez homogenizator, tworząc emulsję o/w. Nanocząstki lipidowe wytrącają się po rozcieńczeniu nadmiarem wody (stosunek: 1:5–1:10) w wyniku dyfuzji rozpuszczalnika organicznego z kropelek emulsji do fazy ciągłej. Rozpuszczalnik można usunąć przez ultrafiltrację lub liofilizację. Dyfuzja rozpuszczalników jest bardziej innowacyjna, a większość zastosowanego rozpuszczalnika wykazuje lepszy profil bezpieczeństwa w porównaniu z lotnymi rozpuszczalnikami.25
Metoda mikroemulsji
W tym podejściu stały lipid jest topiony, a następnie dodaje ciekły lipid i rozpuszcza lek w kolejnej mieszaninie. Oddzielnie mieszanina emulgatora, koemulgatora i wody jest podgrzewana w tej samej temperaturze. Zarówno faza lipidowa, jak i wodna są mieszane w odpowiednich proporcjach i delikatnie mieszane w celu wytworzenia termodynamicznie stabilnego oleju w gorącej mikroemulsji wodnej. Gorąca mikroemulsja jest szybko rozpraszana w nadmiarze schłodzonej wody (0-4°C) z energicznym mieszaniem. Rozcieńczenie powoduje rozpad mikroemulsji na nanoemulsję z najdrobniejszymi cząstkami. Stosunek gorącej mikroemulsji do zimnej wody zwykle mieści się w zakresie od 1:10 do 1:50. Gdy mikroemulsja jest rozcieńczana zimną wodą, wewnętrzne kropelki lipidów rekrystalizują się, tworząc nośniki o rozmiarach nano. Wielkość nanocząstek zależy od wielkości kropli mikroemulsji i różnicy temperatur między mikroemulsją a wodą lodową. Szybkie chłodzenie, a tym samym zestalanie, może zapobiec agregacji cząstek i prowadzić do produkcji mniejszych cząstek.26 Dyspersje NLC utworzone tą metodą zawierały dużą ilość cząstek w zakresie mikronów; Dlatego w tym stanie zoptymalizowano czas mieszania, procent lipidów i ilość leku w celu uzyskania odpowiedniej wielkości i wyższej skuteczności uwięzienia. Metoda nie wymaga specjalnego sprzętu ani energii do produkcji NLC; Dlatego łatwo jest komercyjnie zwiększyć skalę techniki.22,27,28
Technika podwójnej emulsji
Metoda ta jest stosowana głównie do produkcji nanocząstek lipidowych obciążonych lekami hydrofilowymi. Technika ta pokonuje problem eskapizmu rozpuszczalnej w wodzie części w fazie wodnej z fazy oleistej badanej metodą mikroemulsji.29 W tej metodzie lek jest najpierw rozpuszczany w rozpuszczalniku wodnym (wewnętrzna faza wodna), a następnie dyspergowany w fazie lipidowej (stopiony stały lipid + ciekły lipid + lipofilowy środek powierzchniowo czynny + lipofilowa aktywna część cząsteczkowa) w celu wytworzenia emulsji pierwotnej (w/o). Zarówno faza lipidowa, jak i wodna są utrzymywane w tej samej temperaturze. Stabilizator zapobiega utracie leku do fazy zewnętrznej podczas odparowywania rozpuszczalnika. Następnie emulsja pierwotna jest rozpraszana do dużej objętości wodnego roztworu środka powierzchniowo czynnego, a następnie sonikacja w celu utworzenia podwójnej emulsji (w / o / w). Nanocząsteczki lipidów są następnie oczyszczane przez ultrafiltrację lub odparowanie rozpuszczalnika.24,30
Technika wtrysku rozpuszczalnikowego
Jest to realna nowa technika wytwarzania nanocząstek lipidowych. W tej technice lipidy są rozpuszczane w rozpuszczalniku mieszającym się z wodą (np. aceton, metanol, etanol, alkohol izopropylowy) lub rozpuszczalnej w wodzie mieszaninie rozpuszczalników, a następnie szybko wstrzykiwane do wodnego roztworu środka powierzchniowo czynnego pod ciągłym mieszaniem. Powstałą dyspersję filtruje się w celu wyeliminowania nadmiaru lipidów.31 Technika opiera się na szybkiej dyfuzji rozpuszczalnika na granicy rozpuszczalnika-lipidu z fazą wodną.32 Wielkość cząstek nanonośników zależy od szybkości dyfuzji rozpuszczalnika organicznego przez granicę lipid-rozpuszczalnik. Ta metoda oferuje tę zaletę w postaci łatwej obsługi, wydajności, wszechstronności, braku użycia sprzętu technicznego (np. homogenizatora wysokociśnieniowego) i stosowania zatwierdzonych rozpuszczalników organicznych.31
Homogenizacja z wysokim ścinaniem i ultradźwięki
Jedną z metod wytwarzania NLC jest homogenizacja z wysokim ścinaniem lub ultradźwięki. Te techniki dyspersji wykorzystują urządzenia do przygotowania nanonośników. Stały i ciekły lipidy są topione i rozpraszane w wodnym roztworze środka powierzchniowo czynnego pod wpływem homogenizacji z wysokim cięciem lub ultradźwięków, co powoduje utworzenie nanodyspersji.33,34 Intensywne siły ścinające niezbędne do nano-emulgowania są generowane przez kawitację ultradźwiękową, która wytwarza gwałtownie i asymetrycznie implodujące pęcherzyki próżniowe i rozbija cząstki do skali nanometrowej.35
Ultradźwięki typu sondowego dają pożądane efekty, takie jak homogenizacja, dyspersja, deaglomeracja, mielenie i emulgowanie.36 Rodzaj i stężenie lipidów i surfaktantów, ich stosunek, czas sonikacji lub mieszania, prędkość to niektóre z parametrów, które należy zoptymalizować w celu uzyskania powtarzalnej metody uzyskiwania niewielkich rozmiarów nanonośników. Niska jakość dyspersji jest wadą homogenizacji z wysokim ścinaniem i ultradźwięków. Na jakość dyspersji nanocząstek lipidowych wytwarzanych przez te techniki często wpływa obecność mikrocząstek, co prowadzi do fizycznej niestabilności podczas przechowywania.37 Zanieczyszczenia metalami ze sprzętu to kolejny ważny problem związany z ultradźwiękami.35
Technika inwersji faz
Jest to nowatorskie, opłacalne i wolne od rozpuszczalników podejście do formułowania nanonośników lipidowych, które obejmuje inwersję faz z emulsji o / w / o. Składa się z dwóch kroków.
Krok 1 polega na zmieszaniu wszystkich składników (lipidów, środków powierzchniowo czynnych i wody) w zoptymalizowanych proporcjach. Mieszaninę miesza się, a temperaturę zwiększa się z szybkością 4°C, aby osiągnąć temperaturę pokojową do 85°C. Trzy cykle temperatury (85-60-85-60-85°C) są stosowane do systemu, aby osiągnąć strefę inwersji faz.
Krok 2 powoduje nieodwracalny wstrząs wprowadzony w celu przerwania systemu, z powodu rozcieńczenia zimną wodą (0oC). Ten szybki dodatek zimnej wody powoduje powstawanie nanokapsułek. Zastosowanie powolnego mieszania magnetycznego przez 5 minut pozwala uniknąć agregacji cząstek. Zaangażowanie niskoenergetyczne umożliwia tworzenie stabilnych przezroczystych dyspersji (mniejszych niż 25 nm), które mogą być wykorzystywane do enkapsulacji wielu związków bioaktywnych.38
Metoda mikrofluidyzacji
Technika polega na zastosowaniu nowej, opatentowanej technologii mieszania wykorzystującej urządzenie do płynu szybkotnącego znane jako mikrofluidyzator. W tym procesie ciecz jest przetłaczana z prędkością do 400 m/s przez mikrokanaliki do obszaru uderzenia przy wysokich ciśnieniach roboczych. Kawitacja i towarzyszące jej ścinanie i uderzenie są odpowiedzialne za skuteczną redukcję wielkości cząstek w "komorze interakcji". Technika może być stosowana zarówno na skalę laboratoryjną, jak i produkcyjną.39
Technika stycznika membranowego
Stycznik membranowy służy do identyfikacji systemów membranowych, które są wykorzystywane do "utrzymywania kontaktu" w dwóch fazach. Faza lipidowa, w temperaturze powyżej temperatury topnienia, jest umieszczana w naczyniu pod ciśnieniem. Dopuszcza się przenikanie przez ceramiczne pory membranowe pod przyłożonym ciśnieniem, tworząc małe kropelki. Faza wodna, pod ciągłym mieszaniem, przepływa stycznie wewnątrz modułu membrany i usuwa kropelki utworzone na wylotach porów. Chłodzenie preparatu do temperatury pokojowej prowadzi do powstawania cząstek lipidów. Temperatura fazy wodnej i lipidowej, faza wodna, prędkość przepływu stycznego i ciśnienie fazy lipidowej oraz wielkość porów błony to parametry procesu wpływające na wielkość nanonośników lipidowych. Korzyści z tego nowego procesu emulgowania membranowego to komercyjna skalowalność i kontrola wielkości cząstek poprzez dopasowanie zoptymalizowanych parametrów.40
Charakterystyka NLC
Do scharakteryzowania właściwości fizykochemicznych NLC wymagane są odpowiednie techniki w celu zapewnienia ich wydajności, jakości produktu i stabilności. Różne parametry oceny, takie jak morfologia cząstek, właściwości międzyfazowe, skuteczność pułapkowania leków, badania krystaliczności itp., Oświecają wykonalność NLC jako systemu dostarczania leków.
Pomiar wielkości cząstek
Wielkość cząstek NLC jest ogólnie określana przez spektroskopię korelacji fotonów (PCS) przy użyciu Zetasizera, który działa na teorii Mie. Spektroskopia korelacji fotonów (inaczej dynamiczne rozpraszanie światła lub quasi-elastyczne rozpraszanie światła) opiera się na pomiarze fluktuacji rozproszonego światła wynikających z ruchu Browna.41 Zapewnia średnią wielkość cząstek (średnia z) i polidyspersyjność układu jako miarę rozkładu wielkości cząstek. Charakteryzuje cząstki od kilku nanometrów do około 3 mikronów. Dyfraktometr laserowy (LD) może charakteryzować szeroki zakres od nanometrów do mikrometrów cząstek. Ocena ta opiera się na wzorze dyfrakcyjnym przedstawiającym kształt i rozmiar cząstek (wyjaśnionym przez teorię Fraunhofera).1 W progresji, połączenie dyfrakcji laserowej z technologią różnicowego rozpraszania intensywności polaryzacji skutkuje wielkością cząstek tak małych jak 10 nm.
Uzyskane dane interpretuje się poprzez obliczenie rozkładu objętości oznaczonego przez Dv(10), Dv(50), Dv(90). Parametr Dv(90) wskazuje punkt wielkości, do którego znajduje się 90% skumulowanej objętości materiału w danej próbce. Podobnie, wartość Dv(50) daje punkt wielkości, poniżej którego 50 % próbki ma podaną wielkość. W określaniu wielkości cząstek rozpiętość jest parametrem obrazującym wskaźnik polidyspersyjności (PI), tj. jak szeroki jest rozkład wielkości populacji nanocząstek. Jest miarą jednorodności cząstek, a jej wartość mieści się w przedziale od 0 do 1. Wysoka wartość zakresu wskazuje na szeroki rozkład rozmiarów i wysoką polidyspersyjność.42-44 Teoretycznie populacje monodyspersyjne wskazują na PI = 0. Dlatego pomiar PI jest niezbędny do potwierdzenia wąskiego rozkładu wielkości cząstek.45
Inną techniką klasyfikacji wielkości cząstek jest frakcjonowanie przepływu polowego (FFF) oparte na zależnym od wielkości profilu migracji i akumulacji cząstek po zastosowaniu prostopadłego pola zewnętrznego w przepływie laminarnym. Podział na frakcje o różnych rozmiarach można osiągnąć przez grawitację (sedymentacja FFF), termoforezę w gradientach temperatury (termiczny FFF), przez pola elektryczne (elektryczne FFF) lub przez pola hydrodynamiczne (FFF z przepływem krzyżowym).46 Inne zgłoszone techniki stosowane do określania wielkości cząstek to dynamiczna ultramikroskopia (charakteryzacja), spektroskopia ultradźwiękowa, analiza kriogenicznej transmisyjnej mikroskopii elektronowej (cryo-TEM), spektroskopia ruchliwości elektroakustycznej. Określenie wielkości cząstek ma ogromne znaczenie w preparatach nanostrukturalnych, ponieważ mały rozmiar cząstek przyczynia się do większego obszaru międzyfazowego, co może następnie zapewnić lepsze dzielenie i wchłanianie leku na powierzchni skóry.47-49
Potencjał Zeta
Potencjał zeta (ZP) jest kluczowym czynnikiem oceny stabilności nanodyspersji. Oznaczenie ZP opiera się na ruchliwości elektroforetycznej cząstek w środowisku wodnym. Potencjał Zeta charakteryzuje ładunek powierzchniowy i daje informacje o długoterminowej stabilności. Przy wyższym ZP agregacja cząstek jest mniej prawdopodobna z powodu odpychania elektrycznego, podczas gdy dyspersje o niższych wartościach mają tendencję do koagulacji lub flokulacji, co może prowadzić do mniejszej stabilności.50
Ogólnie rzecz biorąc, potencjał zeta dyspersji powinien być mniejszy niż -30 mV lub większy niż +30 mV dla stabilizacji elektrostatycznej NLC.51 Oszacowanie potencjału zeta można wykonać za pomocą laserowej elektroforezy dopplerowskiej przy użyciu Malvern ZetaSizer Nano ZS. Poprzez przyłożenie pola elektrycznego do próbki, cząstki o potencjale zeta będą migrować w kierunku elektrody o przeciwnym ładunku z prędkością względną do wielkości potencjału zeta. Prędkość jest mierzona przy użyciu techniki laserowej anemometrii dopplerowskiej, znanej również jako laserowa velocimetria dopplerowska.52,53 Przesunięcie częstotliwości padającej wiązki laserowej spowodowane przez te poruszające się cząstki jest mierzone jako ruchliwość cząstek, a ta jest przekształcana w potencjał zeta zgodnie z równaniem Henry'ego. Na potencjał zeta wpływają takie czynniki, jak przewodność elektryczna, pH i charakter odczynników.53
Morfologia NLC
Morfologię powierzchni NLC można zaobserwować za pomocą transmisyjnej i skaningowej mikroskopii elektronowej (TEM, SEM), mikroskopii sił atomowych (AFM) i PCS. Techniki te są wypróbowane i prawdziwe dla wymiarowej i strukturalnej charakterystyki NLC.13
Barwienie ujemne, zamarzanie-pękanie i witryfikacja przez zamrażanie zanurzeniowe są różnymi metodami przygotowania próbki do TEM, które mogą dostarczyć różnych informacji o cząstkach koloidalnych. Próbka jest umieszczana na siatce ze złotą lub miedzianą siatką o określonym rozmiarze oczek i barwiona roztworem soli metali ciężkich, który zapewnia wysoki kontrast w mikroskopie elektronowym. Po wyschnięciu próbka jest oglądana w mikroskopie elektronowym, gdzie nanocząstki wydają się jasne na ciemniejszym tle plamy.54 Odwodnienie podczas przygotowywania próbki może prowadzić do zmian strukturalnych, a tym samym pierwotna morfologia nanonośników może ulec zmianie. Kriotransmisyjna mikroskopia elektronowa (cryo-TEM) i krioelektronowa tomografia (cryo-ET) to solidne i niezbędne narzędzie do wizualizacji koloidalnego systemu dostarczania leków. Metodologia umożliwia badanie próbki w zeszklonym zamrożonym stanie uwodnionym, umożliwiając wizualizację nanocząstek zasadniczo takich, jakie istnieją w roztworze.55 Czasami zastosowanie środka powierzchniowo czynnego w obrazowaniu SEM prowadzi do powstawania artefaktów z powodu tworzenia gładkiej powłoki maskującej na powierzchni cząstek.56
AFM jest stosunkowo prostą i nieinwazyjną techniką, która może być wykorzystywana jako główne narzędzie obrazowania do pomiaru i manipulowania morfologią i wielkością nanocząstek lipidowych. AFM oferuje górną krawędź w charakteryzowaniu heterogenicznych materiałów i dostarczaniu wysokiej jakości danych.57 Próbki do AFM wymagają utrwalenia przez usunięcie wody, co może spowodować zmianę stanu emulgatora i zmiany polimorficzne w lipidach.46 Technika ta nie wykorzystuje wiązek ani promieniowania, jednak sonda skanująca z ostrymi końcówkami przymocowana do wolnego końca sprężyny, takiej jak wspornik. Ugięcie, oscylacja lub przesunięcie częstotliwości rezonansowej ruchu wspornika są wykorzystywane do ilościowego określenia interakcji między końcówką a powierzchnią próbki.11
Skuteczność uwięzienia
To wpływ na charakterystykę uwalniania decyduje o ilości leku załadowanego w NLC, co ma pierwszorzędne znaczenie. Skuteczność uwięzienia (Ee) określa stosunek między masą uwięzionego narkotyku a całkowitą masą leku dodanego do dyspersji. Ilość leku kapsułkowanego na jednostkę masy NLC określa się metodą ultrafiltracji-wirowania. Przygotowuje się znaną dyspersję NLC i przeprowadza wirowanie w probówce wirówki zamontowanej z ultrafiltrem. Po odpowiednim rozcieńczeniu ilość wolnego leku w supernatantu jest oznaczana za pomocą spektrofotometru.43
Skuteczność uwięzienia w NLC oblicza się za pomocą następującego równania.
gdzie Wa jest początkową masą użytego leku, a Ws jest ilością leku określoną w supernatantach po oddzieleniu fazy lipidowej i wodnej.58
Ładowność Lc wyraża stosunek między uwięzionym lekiem a całkowitą masą lipidów. Określa się ją w następujący sposób:
gdzie Wl jest wagą lipidów dodanych w preparacie.58
Ciekłe lipidy tworzą nieuporządkowaną matrycę krystaliczną, a co za tym idzie, więcej miejsca jest dostępne do ładowania dużej ilości leku, zwiększając w ten sposób skuteczność uwięzienia. Ee i Lc zależą od kilku parametrów, takich jak właściwości lipofilowe aktywnego składnika farmaceutycznego, badanie przesiewowe najbardziej odpowiedniego składu/stosunku lipidów lipidowych (lipidy stałe/ciekłe) i kombinacja środków powierzchniowo czynnych, a także zastosowana procedura produkcji.59
Krystaliczność i polimorfizm
Charakterystyka krystaliczności składników NLC jest ważna, ponieważ matryca lipidowa, jak również obciążony lek mogą ulegać polimorficznej zmianie przejściowej prowadzącej do możliwego niepożądanego wycieku leku podczas przechowywania.60 Status krystaliczności cząstki wpływa również na wydajność kapsułkowania i szybkość uwalniania.61 Wzrost stabilności termodynamicznej i gęstości upakowania lipidów, podczas gdy spadek szybkości włączania leku obserwuje się w następującej kolejności46: Przechłodzona modyfikacja > alfa > modyfikacja beta > beta
Aby zbadać krystaliczność i status polimorficzny, przeprowadza się eksperymenty z różnicową kalorymetrią skaningową (DSC) i dyfrakcją rentgenowską (XRD).
DSC podaje ciepło utracone lub uzyskane z powodu zmian fizycznych lub chemicznych w próbce w funkcji temperatury. Pomiary DSC ujawniają stan zachowania lipidów, topnienia i krystalizacji lipidów stałych w nanostrukturach.62,63 Analizę DSC przeprowadza się na czystych lekach, czystych lipidach i nanocząsteczkach. Charakterystyka DSC może oświetlić strukturę NLC poprzez mieszanie stałych lipidów z ciekłymi lipidami.64 Rozpad i stopienie sieci krystalicznej poprzez ogrzewanie lub chłodzenie próbki dostarczają wyłącznych informacji o polimorfizmie, porządkowaniu kryształów, mieszaninach eutektycznych, procesach przemiany szklanej i interakcjach lipidowych leków.64,65 Wskaźnik rekrystalizacji (RI) jest parametrem do przeprowadzenia badań porównawczych krystaliczności między opracowanymi formulacjami. Można go obliczyć z następującego wzoru:
gdzie ΔH NLC = entalpia topnienia 1 g zawiesiny NLC,
ΔH luzem = entalpia topnienia 1 g lipidów luzem,
ΔH podaje się w J/g, a stężenie podaje się jako procent fazy lipidowej.66
Gonullu i wsp. określili wskaźnik krystalizacji (CI%) w celu określenia stanu krystalicznego leku w preparatach.
gdzie Ms = entalpia topnienia (J g–1) nanocząstek lipidowych, Mp = entalpia topnienia (J g–1) czystego lipidu stałego, a Ύ oznacza stężenie lipidów stałych (%) w dyspersji nanocząstek.62
Wzrost ilości ciekłego lipidu obniża krystaliczność i zwiększa defekty wysoce uporządkowanej struktury NLC. Zasada wykonywania DSC opiera się na różnej entalpii i temperaturze topnienia dla różnych zmian lipidów. NLC o mniejszym rozmiarze, a zatem o większej powierzchni i wykorzystujących więcej środków powierzchniowo czynnych wykazały spadek entalpii i temperatury topnienia lipidów.10
Analiza XRD jest kolejną użyteczną techniką ujawniania polimorficznych zmian strukturalnych związków W XRD monochromatyczna wiązka promieniowania rentgenowskiego jest dyfrakcjonowana pod kątem zgodnie z rodzajem i rozmieszczeniem atomów oraz przestrzenią między płaszczyznami w kryształach.60 Lipidy mają zdolność agregacji na różne sposoby, dając początek różnym formom polimorficznym. Może to być w postaci miceli, fazy lamelarnej, układu rurowego lub fazy sześciennej. Szerokokątne i małokątowe techniki rozpraszania promieniowania rentgenowskiego (WAXS, SAXS) są wykorzystywane do badania układu warstw, struktury krystalicznej, zachowania fazowego i polimorficznego cząsteczek lipidów i leków. Daje również wyobrażenie o długości krótkiego i długiego odstępu sieci lipidowej46 i lokalizacja leku w nim.67
Pomiar napięcia powierzchniowego
Wzrost stężenia emulgatora obniża napięcie międzyfazowe układu w wyniku procesu emulgowania. Napięcie powierzchniowe nanocząstek lipidowych jest często mierzone metodą płytki Wilhelmy'ego. Pomiar kąta działania jest kolejną metodą wykrywania napięcia powierzchniowego układów nanocząsteczkowych.11
Przyrząd Kibron jest precyzyjnym, łatwym w użyciu przyrządem do balansu skrętnego do pomiaru napięcia powierzchniowego NLC. Wykorzystuje połączenie techniki maksymalnej siły ciągnącej i unikalnej ultraczułej mikrowagi z zastrzeżonym czujnikiem Kibron. Przyrząd jest na równi w technice wyznaczania napięcia powierzchniowego w porównaniu z platynowymi płytkami Wilhelmy'ego lub pierścieniem Du Noüya.68
Ocena dodatkowych struktur koloidalnych
W różnych przypadkach zaobserwowano, że innym strukturom koloidalnym, takim jak micele, mieszane micele, liposomy, przechłodzone stopy, towarzyszą nanocząsteczkom lipidowym. Ocena tych struktur koloidalnych jest dość trudnym zadaniem ze względu na ich podobieństwo wielkości, niską rozdzielczość PCS do multimodalnego rozkładu wielkości obrazu. Przygotowanie próbki może zmienić równowagę złożonego układu koloidalnego. Może również wymagać rozcieńczenia dyspersji wodą, co może prowadzić do usunięcia środka powierzchniowo czynnego z powierzchni nanocząstek. Z tego powodu techniki takie jak magnetyczny rezonans jądrowy (NMR) i elektronowy rezonans spinowy (ESR) są niezwykle przydatnymi narzędziami do jednoczesnego wykrywania struktur koloidalnych i bez przygotowywania próbek. Te nieniszczące metody są owocne w badaniu zjawisk dynamicznych i obecności nano przedziałów olejowych w koloidalnych dyspersjach lipidowych.69
Badanie rezonansu magnetycznego
Spektroskopia NMR (1HNMR) i ESR są wykorzystywane do badania struktury nanocząstek lipidowych i obciążonego leku.70 Spektroskopia służy do oceny mobilności i interakcji cząsteczek oleju z lipidami stałymi. Ta nieinwazyjna technika pozwala na proste i szybkie wykrycie dzięki szerokości sygnału. Czasy relaksacji protonów są związane z szerokością linii NMR. Ruchome cząsteczki oleju dają małe szerokości linii o dużych amplitudach, podczas gdy cząsteczki o ograniczonej mobilności dają słabe amplitudy i szerokie sygnały. Dlatego technika ta jest w stanie ocenić stopień unieruchomienia.46,71
Negatywne zabarwienie
Ujemne zabarwienie służy do zwiększenia nieprzezroczystości elektronów otaczającego pola. Technika ta wykorzystuje sole różnych metali ciężkich do określenia współobecności koloidalnych cząstek lipidów w dyspersji przez TEM. Badaną próbkę umieszczoną na siatce z metalowej siatki barwi się roztworami soli metali ciężkich, takich jak octan uranylu, molibdenian amonu, krzemikowolfram sodu lub fosfotungstat sodu, który zwiększa kontrast. Sekcje są całkowicie wysuszone przed próbą obrazowania mikroskopowego. Obecność szybko suszonych i barwionych artefaktów sprawia, że odróżnienie ich od rzeczywistych cząstek koloidalnych jest żmudne. Wygenerowane mikrofotografie optyczne mają niską rozdzielczość ze względu na plamę wielkości ziarna. Mikroskopia elektronowa barwiąca ujemnie może dawać trójwymiarowe projekcje, ale problem może pojawić się z powodu niewystarczających widoków z powodu przyłączenia próbki do ciągłego nośnika węglowego w preferowanej orientacji.10,72
Elektronowy rezonans spinowy (ESR)
Badanie ESR wymaga paramagnetycznych sond spinowych i nie wymaga przygotowania próbki. Widma dostarczają informacji o ruchliwości molekularnej i polaryzacji wewnątrz systemu dostarczania leków. Technika ta daje bezpośrednią i nieinwazyjną ocenę rozkładu sondy spinowej pomiędzy fazą wodną i lipidową.46 Widma ESR dają sygnał dla lipidów paramagnetycznych. To narzędzie pomaga zrozumieć charakterystyczne właściwości nano przedziałów w nośnikach lipidowych.71
Spektroskopia Ramana
Jest to doskonałe narzędzie do odpowiedzi na wiele pytań dotyczących właściwości strukturalnych lipidów. Technika ta nie wymaga żadnych wstępnych kroków i pozwala na wykrycie w obecności wody.63 Spektroskopia w podczerwieni z transformacją Fouriera i badania Ramana są prowadzone w celu wykrycia interakcji lek-lipid. Badanie spektroskopii Ramana wzbudziło drgania molekularne wytwarzane przez wiązkę lasera. Technika ta służy do mapowania zmian chemicznych i strukturalnych w cząsteczkach z ich przejścia między dwoma stanami wibracyjnymi. Spektroskopia Ramana jest użytecznym narzędziem do badania pakowania, konformacji i wszelkich zmian w układzie łańcucha lipidowego po załadowaniu olejów.70
Struktura bariery skórnej
Skóra, największy wielowarstwowy organ ciała, o powierzchni 1,7-2,0 m2, składa się z kilku warstw: warstwy rogowej (SC), żywotnego naskórka, skóry właściwej i dolnych warstw tkanki tłuszczowej. SC, warstwa powierzchowna, jest główną blokadą skóry. SC składa się z korneocytów objętych domenami lipidowymi, takimi jak długołańcuchowe ceramidy, wolne kwasy tłuszczowe, cholesterol, sterole i fosfoliipdy.41 Korneocyty są pokryte zrogowaciałą otoczką komórkową (nierozpuszczalną), która działa jako krytyczna bariera skórna utworzona przez kowalencyjne sieciowanie białek składowych, takich jak inwolucyna, lorykryna i małe białko bogate w prolinę.73 Korneocyty są umieszczane w miejscach blaszkowatych lipidów, które są zorientowane równolegle do powierzchni korneocytów. Ponieważ większość leków podawanych przez skórę musi niezawodnie przenikać wzdłuż krętej ścieżki w tych miejscach lipidowych, organizacja i skład składnika lipidowego jest postrzegany jako imperatywny dla przeszkody skórnej.74,75 Dlatego lipidy odgrywają istotną rolę w utrudnieniach skórnych, co sprawia, że ich wspólny przebieg działania w obszarach blaszkowatych, kluczowa procedura w rozwoju niedrożności skóry. Niskie pH skóry, obecność enzymów, nawilżenie skóry, stan chorobowy i gradient stężenia przezskórnego to kolejne czynniki konceptualizujące właściwości barierowe skóry. Na wchłanianie przezskórne środków stosowanych miejscowo wpływa również masa cząsteczkowa, współczynnik podziału, projekt formulacji, obecność wzmacniacza penetracji.76
Korzystna rola NLC w transdermalnym podawaniu leków
Transdermalny system podawania leków jest od wieków systemem o ustalonej pozycji, który pozwala osiągnąć różne cele terapeutyczne na różnych poziomach strukturalnych skóry (np. powierzchni, naskórek, skóra właściwa i podskórna). Jednak pojawiło się kilka problemów związanych z konwencjonalnymi preparatami do stosowania miejscowego, np. nieprzepuszczalność bariery skórnej, ograniczona skuteczność i wysoka częstotliwość stosowania. Obecny cel badacza jest dość związany z wykorzystaniem NLC do stosowania miejscowego i skórnego, zarówno w sektorze farmaceutycznym, jak i kosmetycznym. NLC składają się z biologicznie aktywnych i biodegradowalnych lipidów, które wykazują mniejszą toksyczność i oferują wiele korzystnych cech, takich jak przyczepność, okluzja, nawilżenie skóry, smarowanie, gładkość, zmiękczość, wzmocnienie penetracji skóry, zmodyfikowane uwalnianie, poprawa wyglądu preparatu, zapewniająca efekt wybielający i oferująca ochronę substancji aktywnych przed degradacją.2 Kluczowe zalety oferowane przez NLC, które sprawiają, że jego rola jest lepsza w transdermalnym dostarczaniu leków, są następujące:
Przenikanie skóry
Wiele literatury naukowej stwierdza się na temat zdolności NLC do kontrolowania szybkości przenikania leku do skóry, co ogranicza niepożądane aktywne wchłanianie do krążenia krwi.77
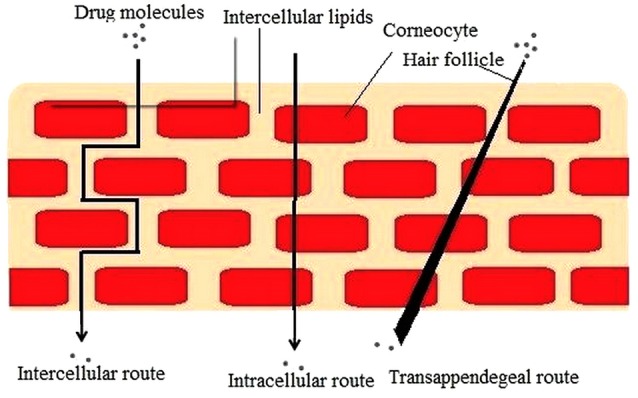
Mniejszy rozmiar NLC zapewnia bliski kontakt z SC i może zwiększyć penetrację skóry przez związek aktywny. Badacze osiągnęli konsensus co do dróg penetracji nanocząstek (Ryc. 2) przez skórę. Proponowane mechanizmy wzbogacania przenikania cząstek przez warstwę rogową naskórka przez dyfuzję leku są następujące:
- Nieskazitelne leki obciążyły pęcherzyki wchodzące w różne warstwy skóry.
- Pęcherzyki lipidowe działające jako wzmacniacze penetracji poprzez ich właściwości fluidyzujące i modyfikujące lipidy skóry.
- Indukcja nanostruktury, nośnika lipidowego i wymiany leków skórnych po zmieszaniu lipidów nośnikowych z komórkowymi lipidami skóry.
- Droga wyrostka robaczkowego, w tym mieszki włosowe (HF), pilosebaceous i pory gruczołów potowych.57
Przypisywane mieszkowi włosowemu mówi o inwazji naskórka rozszerzającego się głęboko w skórę właściwą, co skutkuje bardziej godnym uwagi prawdziwym regionem wchłaniania leku. Mieszek włosowy stał się najważniejszym szlakiem penetracji nanocząstek wśród dróg przydatkowych. Poza tym mieszki włosowe przemawiają do skutecznego magazynu miejscowo podawanych nanocząstek, które zwykle są rozciągane głęboko w tkance do 2000 μm. Zarówno wzmocnienie przenikania, jak i trwałe uwalnianie są osiągalne dzięki większej objętości przechowywania odlewów mieszków włosowych. Cząsteczki leku gromadzą się w odlewach pęcherzykowych, a następnie dyfuzja leku z nanonośników do skóry.78
Penetracja NLC przez skórę zależy od ich składu i ich właściwości fizykochemicznych, takich jak wielkość, agregacja, ładunek na powierzchni cząstek, hydrofobowość, rozpuszczalność cząstek w skórze, właściwości solubilizujące cząstek w kierunku lipidów skóry oraz to, czy cząstki posiadają zdolność tworzenia filmu.73
Transepidermalna utrata wody (TEWL)
TEWL to ilość wody, która pasywnie odparowuje przez skórę do środowiska zewnętrznego z powodu gradientu ciśnienia pary wodnej po obu stronach bariery skórnej i służy do scharakteryzowania funkcji bariery skórnej.79 Pomiary strat TEWL wskazują na uszkodzoną i osłabioną funkcję barierową warstwy rogowej naskórka. Wzrost TEWL oznacza przerwanie warstwy rogowej naskórka i wyczerpanie lipidów międzykomórkowych.41 Miejscowe stosowanie NLC wyczerpuje TEWL z powodu zwiększonej okluzji skóry prowadzącej do nawilżenia skóry. Zaobserwowano, że stosowanie NLC pomogło zmniejszyć utratę wilgoci ze skóry w porównaniu ze skórą nieleczoną. Zawdzięcza to ultradrobnym rozmiarom nanonośników lipidowych uruchamiających dużą powierzchnię i ulepszonym właściwościom adhezyjnym. Cząsteczki lipidów tworzą jednolity, zwarty film na skórze, hamując w ten sposób parowanie wody ze skóry.80 Mniejszy rozmiar cząstek, zmniejszone parowanie wody ze skóry.41
Stwierdzono, że obecność wysoce krystalicznego lipidu w formulacji skutecznie zmniejsza utratę wilgoci z warstwy rogowej naskórka.81 Obecność emolientów (lecytyna, glikol propylenowy) w preparacie NLC pomaga zastąpić zubożone naturalne lipidy obecne w przestrzeni między korneocytami w warstwie rogowej naskórka, aby zapobiec nadmiernemu TEWL.82
Niedrożność skóry
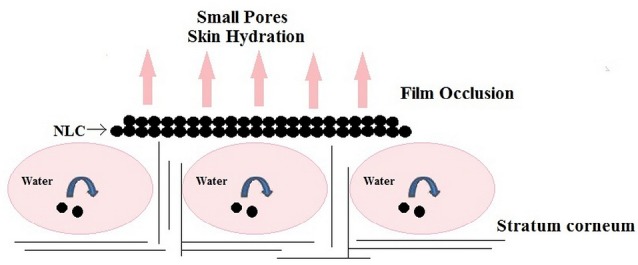
Ogólnie rzecz biorąc, nanonośniki lipidowe mają szczególne właściwości okluzyjne naskórka, które poprzez hamowanie parowania wody mogą zwiększyć bioaktywną penetrację do warstwy rogowej naskórka. Stwierdzono, że nanocząstki są 15 razy bardziej okluzyjne niż mikrocząstki. Müller i inni wspomnieli o NLC jako "niewidzialnej, zwiększającej penetrację folii z tworzywa sztucznego".83 Zakres funkcji okluzyjnej NLC zależy od następujących czynników:
- Rozmiar cząstek: Mały rozmiar cząstek nanonośników zmniejsza parowanie wody ze skóry. Współczynnik okluzji mikrocząstek lipidowych o średnicy >1 μm wynosił 10%, podczas gdy nanocząstki lipidowe o wielkości 200 nm wykazywały 50% okluzji.84 Wissing i in. pokazują również, że tworzenie się jednowarstwowej warstwy na skórze wymaga 4 mg produktu miejscowego z 4% nanocząstkami lipidowymi o wielkości około 200 nm.81 Ten film okluzyjny, jak pokazano w Ryc. 3, ponieważ jest hydrofobowy, zapobiega odwodnieniu skóry, opóźnia przenikanie filtrów UV do filtrów przeciwsłonecznych i inne efekty wybielające, właściwości smarowania/zmiękczania i uwalniania kontrolnego.37
- Krystaliczność i stężenie lipidów: Wysokie stężenie lipidów (50%-60%) obecnych w preparacie NLC działa jak czynnik okluzyjny i odpowiada za zatrzymywanie wilgoci w warstwie rogowej naskórka.41 Stwierdzono, że wysoką okluzyjność można osiągnąć przy niskotopliwych lipidach i cząstkach wysoce krystalicznych. Preparat zawierający cząstki o wielkości mniejszej niż 400 nm i co najmniej 35% lipidów o wysokiej krystaliczności okazał się najbardziej skuteczny. Wzrost zawartości oleju w formule NLC powoduje spadek współczynnika okluzyjnego.81 Przechłodzone stopione (niekrystaliczne nanocząstki) nie mają właściwości okluzyjnych.61 Zwiększony efekt nawilżenia skóry pojawił się ze względu na okluzyjną naturę NLC.84
Nawilżenie i elastyczność skóry
Zwykle ludzka skóra utrzymuje zawartość wody 10% -20% suchej masy tkanki. Zawartość lipidów powierzchniowych i stan nawilżenia odgrywają ważną rolę we właściwościach ciernych skóry.41 Odpowiednie nawilżenie skóry spowalnia oznaki starzenia i chroni przed uszkodzeniami środowiska. NLC wytwarzany z biokompatybilnych i fizjologicznych lipidów trzyma się mocno na skórze i wytwarza działanie okluzyjne, rozszerzając nawilżenie skóry. Nanocząstki lipidowe opóźniają również utratę wilgoci, a tym samym rozluźniają opakowanie korneocytów. Rozszerzona luka między korneocytami prowadzi z kolei do zwiększonej penetracji leków.85 NLC mogą rozszerzyć ten doskonały atrybut nawodnienia ze względu na jego ultradrobne rozmiary. Przypisywane drobnym rozmiarom nanocząsteczki lipidowe przylegają do warstwy lipidowej warstwy rogowej (oddziaływania hydrofobowe). Zaadsorbowany film regeneruje uszkodzoną skórę, a tym samym przywraca ochronny cienki film.86 Ze względu na mniejszy rozmiar cząstek wymiary kanałów kapilarnych porów nanometrowych będą znacznie mniejsze; W ten sposób zmniejszy się hydrodynamiczne parowanie wody.83,87
Loo i in. przedstawili wysokie stężenie lipidów w NLC, które skuteczniej zwiększają nawodnienie w wyniku warstwy okluzyjnej. Dzieje się tak z powodu przesuwania dodatkowych lipidów do przestrzeni międzykomórkowej skóry, które pomagają w zmniejszeniu TEWL.82 Obecność humektantów w formulacji ma dodatkowy wpływ na nawilżenie SC poprzez przyciąganie wilgoci ze skóry właściwej i powietrza. Tichota i inni opracowali hydrożel na bazie NLC oleju arganowego, wykazujący synergistyczny wpływ na nawilżenie skóry (okluzja NLC plus nawilżenie oleju arganowego).88
Nawilżenie skóry można zmierzyć za pomocą korneometru. Przyrząd działa na mechanizm pomiaru pojemności lub przewodności medium dielektrycznego. Wraz ze wzrostem poziomu nawodnienia warstwy rogowej zmienia się jej właściwość dielektryczna. Metoda jest prosta, szybka i prawie nie ulega resztekom skóry.82 Zaobserwowano, że nawilżenie skóry zostaje wzmocnione wraz ze zwiększonym stężeniem lipidów.41 Mikrorelief skóry służy do oceny skuteczności nawilżania skóry kosmetyków i można go ocenić, mierząc parametry szorstkości, łuszczenia się, wygładzania i marszczenia.88 Efekt nawilżający produktu prowadzi do zwiększenia nawilżenia skóry, co przyczynia się do wygładzenia zmarszczek i zwiększenia penetracji bioaktywnych do określonych warstw skóry.82 Wszelkie zmiany w poziomie nawilżenia skóry są mierzone w dowolnych jednostkach.
Stabilność bioaktywnych
Jedną z najważniejszych cech nanocząstek lipidowych jest zdolność do opóźniania chemicznej degradacji substancji czynnych przez szlaki fotochemiczne, hydrolityczne i oksydacyjne. Stabilność chemiczna cząsteczki leku zależy od stałej matrycy lipidowej nanocząstek lipidowych. Naukowcy zauważyli, że stabilność chemiczna NLC wytwarzanego z mniej krystaliczną stałą niedoskonałością lipidów i sieci uległa poprawie dzięki zwiększonemu rozmieszczeniu leków w matrycy lipidowej. Ciało stałe minimalizuje wymianę substancji czynnych z fazą wodną (prawo dyfuzji Einsteina).89 Ponadto należy dokonać przeglądu struktury i dobrej stabilności chemicznej samego lipidu. Dlatego wybór najbardziej odpowiedniego lipidu podczas badań preformulacyjnych jest dość ważny. W badaniach zauważono, że substancje czynne, które są włączone do niedoskonałości w mniej krystalicznej matrycy lipidowej NLC, zapewniają przedłużoną stabilność fizyczną.65 Tabela nr 3 wyświetla krótką literaturę na temat leków włączonych do NLC w celu zwiększenia stabilności.
Tabela nr 3
| Nazwa leku | Metoda przygotowania NLC | Stosowane substancje pomocnicze | Szczegóły | Ref. |
| Idebenon (IDB) | Zmodyfikowana homogenizacja z szybkim cięciem i metoda ultradźwiękowa | Palmitostearynian glicerolu, Średniołańcuchowe trójglicerydy kwasów tłuszczowych | 1. Średniołańcuchowe trójglicerydy kwasów tłuszczowych jako ciekłe lipidy, mają wyższą rozpuszczalność dla IDB niż stałe lipidy i są włączone do rdzenia stałego lipidu. Lek znajduje się prawdopodobnie w ciekłym lipidzie, który z kolei jest otoczony stałym lipidem. 2. Zapewnia to pewien stopień mobilności leku, który przyczynia się do stabilności, nawet gdy stały lipidy ulegają zmianom polimorficznym. Zmniejszenie wydalania IDB z nieuporządkowanych nanoprzedziałów w stałej matrycy pozwala uniknąć degradacji IDB. | 90 |
| Koenzym Q10 (CoQ10) | Technika homogenizacji wysokociśnieniowej na gorąco | O/020G, O/100G, monostearynian gliceryny, gliceryd, zakres 20 | 1. CoQ10 istniał jako forma amorficzna w formule opartej na NLC i wykazał znacznie zwiększoną fotostabilność w porównaniu z samym CoQ10. 2. CoQ10-NLC posiadał ładunek ujemny i wysoce stabilną dyspersję o średnicy nanoskali, gdy były rozproszone w wodzie. | 57 |
| Kwas alfa-liponowy (ALA) | Technika homogenizacji wysokociśnieniowej na gorąco | Monostearynian gliceryny, trioctan glicerolu | 1. Około 88,5% początkowego ALA w systemie NLC pozostało po 120 dniach w tych samych warunkach, podczas gdy zatrzymanie wolnego ALA wynosiło tylko 0,7% przy naturalnym napromieniowaniu światłem dziennym. 2. Enkapsulacja ALA wewnątrz nanokropli zapewniła lepszą ochronę przed fotostabilnością. | 91 |
| Palmitynian retinylu (RP) | Metoda ultradźwiękowa | Kwas stearynowy, palmitynian cetylu, olej kokosowy z pierwszego tłoczenia | 1, NLC uznano za lepszy preparat chroniący RP przed stresującymi warunkami światła, temperatury i degradacji hydrolitycznej. 2. Podczas przechowywania przez 28 d palmitynian retinylu w NLC uległ degradacji tylko o około 15% w porównaniu z mikroemulsją, gdzie 50% uległo degradacji leku. | 92 |
| Luteina | Homogenizacja wysokociśnieniowa. | Tripalmitynian glicerolu, wosk Carnauba Miglyol® 812 | 1. NLC poprawiło termostabilność luteiny i fotostabilność 10 razy bardziej niż forma wolna. 2. Zaobserwowano tylko 6% -8% degradacji po napromieniowaniu. 3. Wosk Carnauba (stały lipid) działa jak molekularny filtr przeciwsłoneczny, przyczyniając się w ten sposób do doskonałego efektu stabilizacji fotografii. | 93 |
| Palmitynian askorbylu (AP) | Technika homogenizacji wysokociśnieniowej | Imwitor® 900 (monostearynian glicerolu), Labrafil® M1944 (ester polietylenoglikol-6 oleju z pestek moreli), hydryna® (stearynian PEG-2), Apifil® (niejonowy hydrofilowy biały wosk pszczeli) | 1. Wybór surfaktantu był jednym z ważnych czynników zwiększających stabilność AP ustawionych na styku. 2. Surfaktanty adsorbują się na powierzchniach lub interfejsach systemu i modyfikują powierzchnię lub energię swobodną międzyfazową. 3. Stwierdzono również, że zwiększenie stężenia leku aż do nasycenia, rozpuszczalności w stopionym lipidze prowadzi do modelu "rdzenia wzbogacającego leki". 4. Wyższe obciążenie AP prowadzi do enkapsulacji leku w matrycy lipidowej w porównaniu do mniejszego obciążenia lekami. W tym przypadku cząsteczki AP mogą być chronione przed cząsteczkami tlenu. | 65 |
| Rezorcyna fenyloetylowa (PR) | Metoda homogenizacji wysokociśnieniowej na gorąco. | Monostearynian gliceryny, diglicerydy, BehenylAlcohol LL-oktylu i decylu glicerynian | 1. W ciągu 90 dni przechowywania 88,6 ± 2,8% PR pozostało niezmienione w PR-NLC w naturalnym świetle dziennym. 2. Włączenie PR do NLC może zapewnić większą stabilność chemiczną, szczególnie fotostabilność, podczas przechowywania w świetle naturalnym w porównaniu z wolnym PR. | 94 |
Długotrwały efekt
Na profil uwalniania z nanocząstek lipidowych istotny wpływ ma rodzaj lipidów (ciała stałego lub oleju) zastosowanych do sformułowania nośnika, stężenie środka powierzchniowo czynnego (lub surfaktantów), rozpuszczalność i stężenie substancji aktywnej w osnowie lipidowej oraz sposób formułowania NLC.77 NLC są wytwarzane przez kontrolowane mieszanie stałych lipidów z niekompatybilnymi przestrzennie ciekłymi lipidami, co prowadzi do specjalnych nanostruktur o ulepszonych właściwościach włączania i uwalniania leków.Tabela nr 4 przedstawić przegląd prac wykonanych w celu przedłużenia uwalniania leku za pomocą NLC.
Tabela nr 4
| Nazwa leku | Metoda przygotowania | Cel przedłużonego uwalniania | Szczegóły | Ref. |
| Acyklofenak | Metoda emulgowania stopu i krzepnięcia w niskiej temperaturze Metoda ultradźwiękowa lub metoda homogenizatora o dużej prędkości | Sformułowanie systemu dostarczania leków o kontrolowanym uwalnianiu przez dłuższy czas, aby spełnić cele leczenia zapalenia stawów, takie jak zmniejszenie bólu i stanu zapalnego | 1. Kwas oleinowy odegrał ważną rolę w uwalnianiu aceklofenaku z dyspersji NLC. 2. Ciekły lipidy znajdują się w zewnętrznej powłoce nanocząstek, co prowadzi do powłoki wzbogaconej lekiem, która jest związana z uwalnianiem wybuchu na początkowym etapie. 3. Brak znaczącego wpływu metody przygotowania na uwalnianie leku. | 42 |
| Amoitone B | Technologia odparowywania emulsji i krzepnięcia w niskiej temperaturze | Aby skonstruować skuteczny system dostarczania amoitonu B w celu uzyskania przedłużonego uwalniania, a tym samym przedłużyć czas krążenia leku w organizmie i poprawić biodostępność. | 1. Podczas kontaktu z roztworem uwalniania powierzchowny lek został szybko uwolniony, co doprowadziło do uwolnienia serii w początkowej fazie. 2. Wraz z degradacją i erozją matrycy lipidowej, lek włączony do rdzenia nanocząstek został uwolniony w sposób długotrwały. | 95 |
| Orydonin | Technika odparowywania emulsji i krzepnięcia w niskiej temperaturze | Przygotowanie NLC obciążonego orydoniną, w którym nanocząstki można łatwo uzyskać w łagodnych warunkach bez potrzeby stosowania specjalnego sprzętu, a także można osiągnąć trwałe uwalnianie leku. | 1. Podczas emulgowania początkowo większość leku była rozpraszana w kropelkach lipidów z powodu niskiej rozpuszczalności w wodzie. 2. Wraz ze wzrostem temperatury i istnieniem surfaktantu, który zwiększał rozpuszczalność leku w wodzie, lek migrował z fazy lipidowej do fazy wodnej. 3. Podczas chłodzenia wytworzonej nanoemulsji O/W nastąpiło ponowne rozdzielenie leku na fazę lipidową. 4. Po osiągnięciu temperatury rekrystalizacji lipidu, stały rdzeń lipidowy został szybko zestalony, tworząc stały rdzeń lipidowy, w którym losowo rozmieszczono ciekły lipid. | 96 |
Kierowanie na skórę
Ukierunkowane dostarczanie leków do warstwy naskórka może wykazywać ogromne korzyści w porównaniu z podawaniem ogólnoustrojowym w niezliczonych terapiach. Do leczenia dolegliwości skórnych, takich jak trądzik, infekcja grzybicza lub wypadanie włosów; Skuteczność leku miejscowego jest spekulowana na podstawie ich potencjału do osiągnięcia pożądanego miejsca działania (określone warstwy skóry) i pozostawania tam w terapeutycznym efektywnym stężeniu przez odpowiedni czas. Słabe efekty terapeutyczne i działania niepożądane wykazywane przez konwencjonalne miejscowe nośniki można pokonać, formułując NLC skóry.22 Strategia celowania w warstwę naskórka jest korzystna pod względem bezpieczeństwa, a także bogatej sieci komórek prezentujących antygen w naskórku, wywołujących wyższą odpowiedź immunologiczną.78
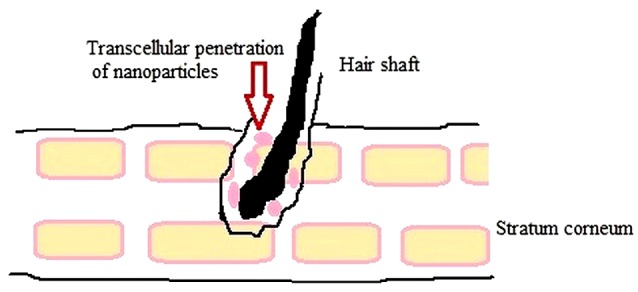
Naukowcy nie są jeszcze zgodni co do faktu, że właściwość cząstek spowoduje lepsze celowanie w skórę. Stwierdzono, że właściwości leku, takie jak wielkość nośnika cząstek stałych, ładunek powierzchniowy i skład materiału wpływają na przenikanie skóry i farmakodynamikę leków kapsułkowanych. Stopień wiązania leku z białkami osocza wpływa na celowanie naskórka i przenikanie cząstek w głąb HF, ze względu na sieć naczyń włosowatych wokół tej struktury, głównie w fazie wzrostu. Po akumulacji w HF nanocząsteczki mogą szybko i w sposób ciągły dyfundować do skóry właściwej lub regionu podskórnego, wzmacniając celowanie naskórka, a także lokalne dostarczanie leku.78
Zaobserwowano, że dostosowanie wielkości nośników cząstek stałych umożliwia penetrację wewnątrz- lub przezfolikową (Ryc. 4) i dostarczanie leków. Cząstki o różnych rozmiarach i strukturach gromadzą się w otworach mieszków włosowych i przenikają wzdłuż kanału pęcherzykowego, po nałożeniu na skórę. Systemy dostarczania leków oparte na cząsteczkach mogą być stosowane do celowania w określone regiony w przewodzie pęcherzykowym, ponieważ głębokość penetracji jest liczona na podstawie wielkości cząstek i typu mieszka włosowego. Ruch włosa może również przyczynić się do penetracji nanocząstek o wielkości 20 nm.97 Lipidy przypominające składem sebum mogą również przyspieszać penetrację pęcherzyków, ponieważ wysoki współczynnik podziału sebum/woda jest podstawową cechą transportu do HF. Można również założyć celowanie w naskórek z powodu rozpuszczania lub erozji cząstek lipidów w sebum. Manipulowanie ładunkiem powierzchniowym może być również stosowane jako podejście do celowania.78
Cząsteczki leku włączone do NLC w celu zwalczania skóry
Podofilotoksyna, azotan oksykonazolu, klobetazol, kurkumina, tretinoina, minoksydyl, finasteryd, difenypron, chlorowodorek terbinafiny.
Perspektywa regulacyjna
Jedną z istotnych podstaw szerokiej akceptacji i sukcesu komercyjnego NLC jest to, że przewoźnicy ci stanowią niewielkie przeszkody regulacyjne. Nanostrukturalne nośniki lipidowe wykorzystują lipidy i emulgatory o profilach fizjologicznych, nietoksycznych, biodegradowalnych i kompatybilnych. Wszystkie użyte składniki posiadają status GRAS uznany przez organy regulacyjne lub zostały już zaakceptowane do kapsułkowania związków farmaceutycznych lub spożywczych czynnych. W każdym razie konieczne jest stosowanie wszystkich składników w bezpiecznym i akceptowanym zakresie. Większość z nich jest otrzymywana lub składa się ze składników występujących naturalnie w organizmie człowieka, tj. kwasów tłuszczowych i glicerolu. Wiadomo, że są one dobrze tolerowane i zmniejszają cytotoksyczne lub niepożądane reakcje na leki.22,77,83
Status patentowy NLC
W ciągu ostatniej dekady nanostrukturalne nośniki lipidowe zostały wykorzystane do formułowania wielu środków transdermalnych i kosmetycznych. Na preparaty nanolipidowe przyznano różne patenty. Tabela nr 5 przedstawia krótki przegląd patentów na temat oryginalnego wynalazku w nanostrukturalnych nośnikach lipidowych.
Tabela nr 5
| Nazwa patentu | Numer patentu | Wynalazców | Data publikacji | Odniesienie |
| Nowy nośnik nanolipidowy do wstrzykiwań zawierający substancje z serii paklitakselu i sposób ich przygotowania | CN101366697A | Liu i wsp. | 18/2/2009 | 98 |
| Nanostrukturalne nośniki lipidowe zawierające ryluzol i preparaty farmaceutyczne zawierające wspomniane cząstki | EP20070764871 | Bondi i wsp. | 20/10/2010 | 99 |
| Zastosowanie nanostrukturalnego systemu podawania leków nośnikami lipidów | CN101129335A | Jian i wsp. | 22/9/2010 | 100 |
| Kompozytowy środek przeciwprzesiewający nanostrukturalny nośnik lipidowy i metoda jego przygotowania | CN102688152A | Qiang i wsp. | 26/9/2012 | 101 |
| Kapsułki z nanocząsteczkami lipidowymi | USA 2013/0017239 A1 | Petit i wsp. | 17/1/2013 | 102 |
| Bioniczny nanostrukturalny nośnik lipidowy lowastatyny i metoda jego przygotowania | CN102935077A | Jianping i wsp. | 20/2/2013 | 103 |
| Nanostrukturalny nośnik lipidowy koenzymu Q i metoda jego przygotowania | CN101658468A | Lato i wsp. | 6/3/2013 | 104 |
| Preparaty nanocząsteczkowe do dostarczania skóry | US8715736B2 | Sachdeva i wsp. | 06/05/2014 | 105 |
| Kompozycja do leczenia białaczki | WO2014123406A1 | Abdullah i wsp. | 14/8/2014 | 106 |
| Metoda wytwarzania preparatu nanolipidowego do pielęgnacji i/lub naprawy skóry oraz jego preparat nanolipidowy | WO2015105407A1 | Ujang i wsp. | 16/7/2015 | 107 |
| Nanocząsteczki lipidowe do gojenia się ran | EP2821077A1 | Lafuente i wsp. | 7/01/2015 | 108 |
| Przygotowanie metody nanostrukturalnych nośników lipidowych (NLC) i wykonanych produktów | CN102283809B | Ismail i wsp. | 14/12/2016 | 109 |
| Nanostrukturalny nośnik lipidowy zawierający α-tokoferol i metoda jego przygotowania | KR101777616B1 | Geun i wsp. | 13/9/2017 | 110 |
| Nanostrukturalne nośniki do kierowania i ukierunkowanego dostarczania substancji na żądanie | Zgłoszenie patentowe w USA 20170119891 | Lal i wsp. | 4/5/2017 | 111 |
Wnioski i perspektywy na przyszłość
NLC zapewnia duży wpływ na ogromne słupki, które są warunkiem wstępnym sformułowania stabilnego systemu dostarczania leków. Zastosowanie nanonośników w transdermalnym podawaniu leków ogłosiło nową domenę w dostarczaniu leków. NLC są chemicznie i fizycznie stabilnym systemem z ulepszonym włączaniem leków i zwiększoną biodostępnością. Rosnące zainteresowanie przemysłu systemem nośników lipidów znacznie rozszerza postępy w ostatnich latach. Obecnie na rynku dostępnych jest ponad 30 komercyjnych preparatów NLC zawierających składniki leków i kosmetyków. NLC jako inteligentniejsza generacja nanocząstek lipidowych jest obiecującym kandydatem do zapewnienia ukierunkowania skóry wraz z efektem okluzyjnym i przedłużonym uwalnianiem. Nanonośniki lipidowe szukają uwagi przemysłu ze względu na wykwalifikowaną i potwierdzoną skalę technologii, status GRAS substancji pomocniczych i łatwą produkcję na dużą skalę. Przyszłe formuły NLC mogą przynieść więcej dobrobytu systemowi nośników lipidów ze względu na jego wiele lepszych właściwości w porównaniu z systemami pierwszej generacji. Przyszłe obawy obejmują również ocenę toksyczności i zagrożeń dla zdrowia związanych z nanostrukturami. Więcej badań w badaniach przedklinicznych i klinicznych utoruje drogę do sukcesu strukturom nanolipidowym. Osiągnięcie w tej dziedzinie można sobie wyobrazić, jeśli przemysł farmaceutyczny podejmie badania akademickie, aby stylizować ten system nośników dla różnych środków terapeutycznych i kosmetycznych.