Ocena bezpieczeństwa materiałów na bazie grafenu: koncentracja na zdrowiu ludzkim i środowisku
- Bengt Fadeel*Bengt Fadeel*E-mail: [email protected]Nanosafety & Nanomedicine Laboratory, Institute of Environmental Medicine, Karolinska Institutet, 17777 Stockholm, SwedenMore by Bengt Fadeel,
- Cyrill BussyCyrill BussyNanomedicine Laboratory, Faculty of Biology, Medicine & Health, University of Manchester, Manchester M13 9PL, United KingdomMore by Cyrill Bussy,
- Sonia MerinoSonia MerinoFaculty of Chemical Science and Technology, University of Castilla-La Mancha, 13071 Ciudad Real, SpainMore by Sonia Merino,
- Ester VázquezEster VázquezFaculty of Chemical Science and Technology, University of Castilla-La Mancha, 13071 Ciudad Real, SpainMore by Ester Vázquez,
- Emmanuel Flahaut
- Florencja Mouchet
- Lauris Evariste
- Laury Gauthier
- Antti J. KoivistoAntti J. KoivistoNational Research Centre for the Working Environment, 2100 Copenhagen, DenmarkMore by Antti J. Koivisto,
- Ulla VogelUlla VogelNational Research Centre for the Working Environment, 2100 Copenhagen, DenmarkMore by Ulla Vogel,
- Cristina MartínCristina MartínUniversity of Strasbourg, CNRS, Immunology, Immunopathology and Therapeutic Chemistry, 67000 Strasbourg, FranceMore by Cristina Martín,
- Lucia G. DeloguLucia G. DeloguDepartment of Chemistry and Pharmacy University of Sassari, Sassari 7100, ItalyIstituto di Ricerca Pediatrica, Fondazione Città della Speranza, 35129 Padova, ItalyMore by Lucia G. Delogu,
- Tina Buerki-ThurnherrTina Buerki-ThurnherrSwiss Federal Laboratories for Materials Science and Technology (EMPA), 9014 St. Gallen, SwitzerlandMore by Tina Buerki-Thurnherr,
- Peter WickPeter WickSwiss Federal Laboratories for Materials Science and Technology (EMPA), 9014 St. Gallen, SwitzerlandMore by Peter Wick,
- Didier Beloin-Saint-PierreDidier Beloin-Saint-PierreSwiss Federal Laboratories for Materials Science and Technology (EMPA), 9014 St. Gallen, SwitzerlandMore by Didier Beloin-Saint-Pierre,
- Roland HischierRoland HischierSwiss Federal Laboratories for Materials Science and Technology (EMPA), 9014 St. Gallen, SzwajcariaWięcej od: Roland Hischier,
- Marco PelinMarco PelinDepartment of Life Sciences, University of Trieste, 34127 Trieste, ItalyMore by Marco Pelin,
- Fabio Candotto CarnielFabio Candotto CarnielDepartment of Life Sciences, University of Trieste, 34127 Trieste, ItalyMore by Fabio Candotto Carniel,
- Mauro TretiachMauro TretiachDepartment of Life Sciences, University of Trieste, 34127 Trieste, ItalyMore by Mauro Tretiach,
- Fabrizia CescaFabrizia CescaCenter for Synaptic Neuroscience and Technology, Istituto Italiano di Tecnologia, 16132 Genova, ItalyMore by Fabrizia Cesca,
- Fabio BenfenatiFabio BenfenatiCenter for Synaptic Neuroscience and Technology, Istituto Italiano di Tecnologia, 16132 Genova, ItalyMore by Fabio Benfenati,
- Denis ScainiDenis ScainiScuola Internazionale Superiore di Studi Avanzati (SISSA), 34136 Trieste, ItalyMore by Denis Scaini,
- Laura BalleriniLaura BalleriniScuola Internazionale Superiore di Studi Avanzati (SISSA), 34136 Trieste, ItalyMore by Laura Ballerini,
- Kostas KostarelosKostas KostarelosNanomedicine Laboratory, Faculty of Biology, Medicine & Health, University of Manchester, Manchester M13 9PL, United KingdomMore by Kostas Kostarelos,
- Maurizio Prato*Maurizio Prato*E-mail: [email protected]Department of Chemical and Pharmaceutical Sciences, University of Trieste, 34127 Trieste, ItalyCarbon Nanobiotechnology Laboratory, CIC BiomaGUNE, 20009 San Sebastian, SpainBasque Foundation for Science, Ikerbasque, 48013 Bilbao, SpainMore by Maurizio Pratoi
- Alberto Bianco*Alberto Bianco*E-mail: [email protected]University of Strasbourg, CNRS, Immunology, Immunopathology and Therapeutic Chemistry, 67000 Strasbourg, FranceMore by Alberto Bianco
Abstrakt
Grafen i jego pochodne są zwiastunami "cudownych" materiałów o różnorodnych zastosowaniach w różnych sektorach społeczeństwa, od elektroniki po magazynowanie energii i medycynę. Rosnące wykorzystanie materiałów na bazie grafenu (GBM) wymaga kompleksowej oceny potencjalnego wpływu tych materiałów na zdrowie ludzkie i środowisko. W tym miejscu omawiamy syntezę i charakterystykę GBM, a także ocenę zagrożeń dla ludzi i środowiska związanych z GBM przy użyciu systemów modelowych in vitro i in vivo w celu zrozumienia właściwości, które leżą u podstaw biologicznych skutków tych materiałów; nie wszystkie GBM są takie same i ważne jest, abyśmy rozplątali relacje struktura-aktywność dla tej klasy materiałów.
- nanomateriały węglowe narażenie na
- grafen narażenie
- na zagrożenie
- ocena cyklu życia
- bezpieczeństwo środowisko
- toksyczność
Synteza i charakterystyka materiałów na bazie grafenu
- Abstract
- Synthesis and Characterization of Graphene-Based Materials
- Biodistribution and Fate of Graphene-Based Materials
- Hazard Assessment of Graphene-Based Materials
- Environmental Hazard Assessment of Graphene-Based Materials
- Exposure and Life Cycle Analysis of Graphene-Based Materials
- Concluding Remarks
- Supporting Information
- Author Information
- Acknowledgments
- Vocabulary
- References
Ryc. 1
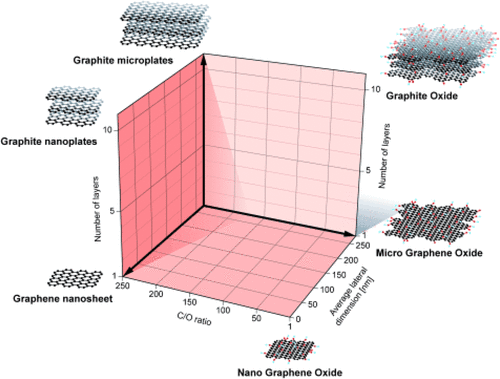
Ryc. 1. Ramy klasyfikacji materiałów na bazie grafenu. Przedruk za zgodą ref (22). Prawa autorskie 2014 Wiley-VCH Verlag GmbH & Co, KGaA, Weinheim.
Synteza materiałów na bazie grafenu
Grafen
Tlenek grafenu (GO)
Zredukowany tlenek grafenu (rGO)
Charakterystyka materiałów na bazie grafenu
| własność | technika |
|---|---|
| wymiary boczne | mikroskopia elektronowa (TEM, SEM) |
| mikroskopia sił atomowych (AFM) | |
| dynamiczne rozpraszanie światła (DLS) | |
| liczba warstw | mikroskopia elektronowa (TEM) |
| mikroskopia sił atomowych (AFM) | |
| Spektroskopia Ramana | |
| ładunek powierzchniowy | ζ-potencjał |
| Stosunek atomowy C/O | Spektroskopia fotoelektronów rentgenowskich (XPS) |
| analiza elementarna | |
| struktura chemiczna/funkcjonalizacja | Spektroskopia fotoelektronów rentgenowskich (XPS) |
| analiza elementarna | |
| Spektroskopia Ramana | |
| analiza termograwimetryczna (TGA) | |
| ζ-potencjał | |
| Spektroskopia w podczerwieni z transformacją Fouriera (FTIR) | |
| zanieczyszczenia metalami | Dyfrakcja elektronów rentgenowskich (XRD) |
| fluorescencja rentgenowska całkowitego odbicia (TXRF) | |
| Spektroskopia adsorpcji atomowej | |
| spektrometria masowa z plazmą sprzężoną indukcyjnie (ICP-MS) | |
| zawartość endotoksyn | oznaczenie limulusa libacytów amoebocytów (LAL) |
| test ekspresji TNF oparty na makrofagach (TET) |
Analizowanie roli właściwości materiału: biblioteki referencyjne
Biodystrybucja i losy materiałów na bazie grafenu
- Abstract
- Synthesis and Characterization of Graphene-Based Materials
- Biodistribution and Fate of Graphene-Based Materials
- Hazard Assessment of Graphene-Based Materials
- Environmental Hazard Assessment of Graphene-Based Materials
- Exposure and Life Cycle Analysis of Graphene-Based Materials
- Concluding Remarks
- Supporting Information
- Author Information
- Acknowledgments
- Vocabulary
- References
Wiele dróg narażenia na materiały na bazie grafenu
Łączenie nanobezpieczeństwa i medycyny: podawanie dożylne
Ryc. 2
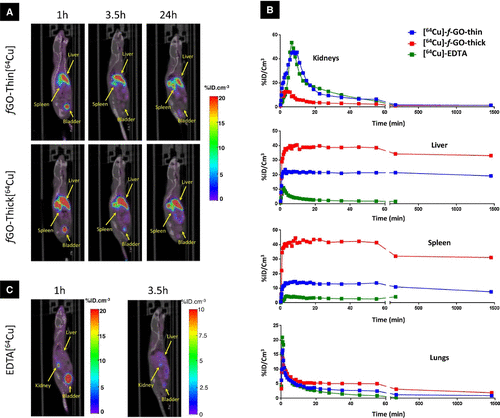
Ryc. 2. Biodystrybucja GO. Obrazowanie PET/CT i dystrybucja tkanek [64Cu]-f-GO-cienki, [64Cu]-f-GO-gruby, oraz [64Cu]-EDTA. (A) Obrazy PET/CT całego ciała myszy C57BL/6 wstrzykniętych dożylnie [64Cu]-f-GO-cienki (u góry) oraz [64Cu]-f-GO-gruby (na dole) w różnych punktach czasowych (1, 3.5, 24 h). (B) Krzywe czasowo-aktywne głównych narządów myszy C57BL/6, którym wstrzyknięto [64Cu]-f-GO-cienki, [64Cu]-f-GO-gruby i control [64Cu]-EDTA. (C) Obrazy PET/CT całego ciała myszy C57BL/6 wstrzykniętej dożylnie z próbką kontrolną [64Cu]-EDTA, wykazujący prawie całkowite wydalanie i brak akumulacji tkanek po 3 h. Przedruk za zgodą ref (40). Prawa autorskie 2016 Elsevier.
Ocena zagrożeń związanych z materiałami na bazie grafenu
- Abstract
- Synthesis and Characterization of Graphene-Based Materials
- Biodistribution and Fate of Graphene-Based Materials
- Hazard Assessment of Graphene-Based Materials
- Environmental Hazard Assessment of Graphene-Based Materials
- Exposure and Life Cycle Analysis of Graphene-Based Materials
- Concluding Remarks
- Supporting Information
- Author Information
- Acknowledgments
- Vocabulary
- References
Interakcje immunologiczne materiałów na bazie grafenu
Ryc. 3

Ryc. 3. Wychwyt makrofagów przez GO. Pierwotne ludzkie makrofagi pochodzące z monocytów łatwo spożywają GO bez ultrastrukturalnych objawów ostrej toksyczności. Makrofagi inkubowano przez 3 godziny z małym lub dużym GO lub bez niego (50 μg / ml). Obrazy TEM (pasek skali: 2 μm) pokazują (a) komórki kontrolne, (b) komórki narażone na GO-S oraz (c) komórki narażone na GO-L. Zinternalizowane GO można zobaczyć w panelach (b,c). Mikrofotografie o większym powiększeniu (pasek skali: 1 μm) pokazują (d) komórki kontrolne, (e) komórki wystawione na działanie GO-S i (f,g) komórki wystawione na działanie GO-L. Gwiazdka w panelu (e) oznacza arkusze GO, które są internalizowane. Gwiazdka w panelu (f) pokazuje dużą agregację GO wewnątrz komórki, podczas gdy obraz w panelu (g) pokazuje obecność arkuszy GO w błonie plazmatycznej komórki, a także GO zinternalizowanego w komórce. Dla porównania gwiazdka oznacza mitochondrium. Wreszcie, przy większym powiększeniu (pasek skali: 200 nm), mikrografie w panelach (h,i) pokazują odpowiednio zinternalizowane GO-S i GO-L. Przedruk za zgodą ref (39). Prawa autorskie 2018 Wiley-VCH Verlag GmbH & Co.
Ryc. 4
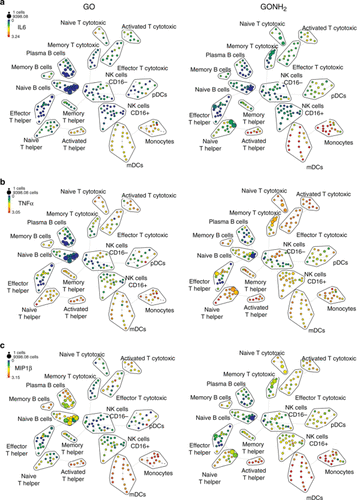
Ryc. 4. Analiza immunologicznego wpływu grafenu za pomocą cytometrii masowej pojedynczych komórek. SPADE (spanning tree, progression analysis of density-normalized events) algorytm grupowania analiza istotnie wydzielanych cytokin. Wykresy drzewa pokazują różne subpopulacje komórek odpornościowych, a rozmiar każdej gromady w drzewie wskazuje względną częstotliwość komórek, które mieszczą się w granicach wymiarowych granic węzłów. Kolor węzła jest skalowany do mediany intensywności ekspresji znacznika komórek w każdym węźle, wyrażonej jako procent maksymalnej wartości w zbiorze danych: (a) IL-6; b) TNF-α oraz c) MIP-1β dla GO (po lewej) i GO-NH2 (po prawej). Przedruk za zgodą ref (134). Prawa autorskie 2017 Nature Publishing Group.
Biodegradacja materiałów na bazie grafenu
Efekty skórne materiałów na bazie grafenu
Płucne działanie materiałów na bazie grafenu
Wpływ materiałów na bazie grafenu na układ sercowo-naczyniowy
Wpływ żołądkowo-jelitowy materiałów na bazie grafenu
Ryc. 5
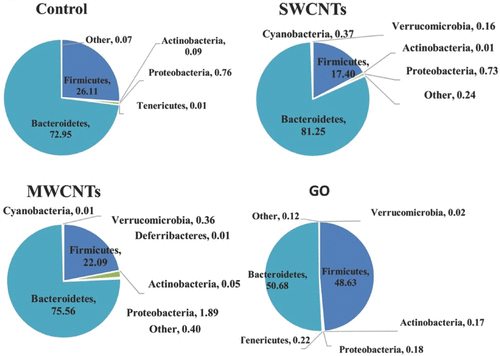
Ryc. 5. Nanomateriały na bazie węgla i mikrobiom jelitowy. Porównanie liczebności społeczności bakteryjnej na poziomie typu po ostrym doustnym podaniu SWCNT, MWCNT i GO myszom (2,5 mg / kg przez 7 dni). Wykresy kołowe pokazują względną obfitość mikroflory jelitowej w oparciu o sekwencjonowanie genu 16S rRNA. Przedruk za zgodą ref (197). Prawa autorskie 2018 Wiley-VCH Verlag GmbH & Co.
Wpływ materiałów na bazie grafenu na reprodukcję i rozwój
Wpływ materiałów na bazie grafenu na ośrodkowy układ nerwowy
Ryc. 6

Ryc. 6. Interakcje grafenu z neuronami. Pierwotne neurony korowe szczura były narażone na FLG (tutaj w skrócie GR) i płatki GO (1 i 10 μg / ml) przez 96 godzin lub 14 dni lub na równoważne objętości odpowiednich nośników. SEM wykorzystano do zbadania interakcji płatków z komórkami neuronalnymi. e–h) Znaleziono dużą liczbę płatków (białe groty strzał) w kontakcie z błoną komórkową; Jednak morfologia komórek i rozwój sieci pozostały w dużej mierze nienaruszone. (i–l) Wychwyt komórek FLG i GO oraz lokalizacja wewnątrzkomórkowa badano za pomocą TEM. Po godzinie 24 większość płatków znaleziono poza celami (nie pokazano). Jednak począwszy od 96 h, płatki były internalizowane do pęcherzyków wewnątrzkomórkowych (i,j; czarne groty strzał) lub wolne w cytoplazmie (l; czarne groty strzał). Przedruk z ref (218). Prawa autorskie 2016 Amerykańskie Towarzystwo Chemiczne.
Ryc. 7

Ryc. 7. Grafenowa modulacja komunikacji neuronalnej. (Górny rząd) Rekonstrukcje topografii AFM kontroli szkła, grafenu jednowarstwowego (SLG), grafenu wielowarstwowego (MLG) i pozłacanych powierzchni szklanych. AFM udokumentował chropowatość powierzchni materiałów, która wahała się od 0,23 ± 0,02 nm dla kontroli (n = 3), 1,5 ± 0,5 nm dla SLG (n = 3), 20 ± 10 nm dla MLG (n = 3) i 0,47 ± 0,1 nm dla Au (n = 3). Pasek podziałki, 5 μm. (Środkowy rząd) Reprezentatywne obrazy SEM przedstawiające morfologię neuronów hipokampa po 10 dniach in vitro, wspierane przez różne substraty. Substraty kultur nie zostały wstępnie poddane obróbce dodatkowymi cząsteczkami adhezyjnymi, które mogłyby maskować działanie grafenu. Pasek podziałki, 10 μm. (Dolny rząd) SLG wyzwala zmiany w wewnętrznej pobudliwości pojedynczej komórki. Reprezentatywne zapisy zaciskowe neuronów hipokampa w hodowli przez 10 dni. Neurony kontrolne i SLG wykazywały podobne potencjały błony spoczynkowej (-52 ± 10 mV w SLG; -50 ± 7 mV pod kontrolą). Przy utrzymywaniu na poziomie −60 mV mierzono spontaniczny potencjał czynnościowy, jak podsumowano na histogramach (po prawej). Zwróć uwagę na znacznie wyższą częstotliwość potencjału czynnościowego w SLG (2,60 ± 0,36 Hz w neuronach hodowanych na SLG, n = 21; 1,37 ± 0,26 Hz pod kontrolą, n = 19; P = 0,0054). *P < 0,05, **P < 0,01. Przedruk za zgodą ref (228). Prawa autorskie 2018 Nature Publishing Group.
Ocena zagrożeń dla środowiska materiałów na bazie grafenu
- Abstract
- Synthesis and Characterization of Graphene-Based Materials
- Biodistribution and Fate of Graphene-Based Materials
- Hazard Assessment of Graphene-Based Materials
- Environmental Hazard Assessment of Graphene-Based Materials
- Exposure and Life Cycle Analysis of Graphene-Based Materials
- Concluding Remarks
- Supporting Information
- Author Information
- Acknowledgments
- Vocabulary
- References
Wpływ materiałów na bazie grafenu na bakterie
Wpływ materiałów na bazie grafenu na fotoautotrofy
Wpływ materiałów na bazie grafenu na rośliny nasienne
Wpływ materiałów na bazie grafenu na bezkręgowce
Wpływ materiałów na bazie grafenu na kręgowce
Ryc. 8
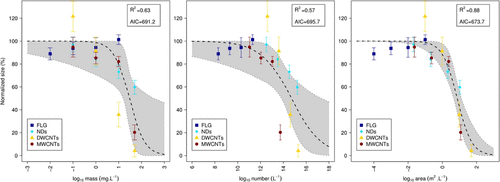
Ryc. 8. Wybór najlepszej dawki metrycznej. Zahamowanie wzrostu u larw Xenopus laevis po 12-dniowej ekspozycji na kilkuwarstwowy grafen, nanodiamenty i dwuścienne lub wielościenne nanorurki węglowe. Znormalizowany rozmiar (%) jest wykreślany w porównaniu z logarytmami o podstawie 10 trzech różnych wskaźników: stężenie masowe (mg · L–1), stężenie liczbowe (L–1) i stężenie powierzchni (m2· L–1). Czarne linie przerywane reprezentują przewidywania modelu regresji nieliniowej, a obszary cieniowane to 95% przedziały ufności (CI). 95% CI na średnich rozmiarach jest reprezentowanych jako pionowe słupki błędów. Przedruk z ref (298). Prawa autorskie 2016 Amerykańskie Towarzystwo Chemiczne.
Dalsze tematy badawcze w ekotoksykologii materiałów na bazie grafenu
Analiza narażenia i cyklu życia materiałów na bazie grafenu
- Abstract
- Synthesis and Characterization of Graphene-Based Materials
- Biodistribution and Fate of Graphene-Based Materials
- Hazard Assessment of Graphene-Based Materials
- Environmental Hazard Assessment of Graphene-Based Materials
- Exposure and Life Cycle Analysis of Graphene-Based Materials
- Concluding Remarks
- Supporting Information
- Author Information
- Acknowledgments
- Vocabulary
- References
Narażenie zawodowe na materiały na bazie grafenu
Metody analizy cyklu życia materiałów na bazie grafenu
Ryc. 9
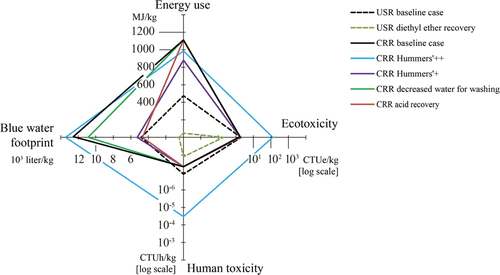
Ryc. 9. Analiza cyklu życia produkcji grafenu. Droga redukcji chemicznej (CRR) i droga ultradźwiękowa (USR) to dwie drogi złuszczania w fazie ciekłej o potencjale przemysłowym przy niskich kosztach. Na rysunku przedstawiono wyniki analizy wrażliwości. Przedruk z ref (218). Prawa autorskie 2016 Amerykańskie Towarzystwo Chemiczne.
Uwagi końcowe
- Abstract
- Synthesis and Characterization of Graphene-Based Materials
- Biodistribution and Fate of Graphene-Based Materials
- Hazard Assessment of Graphene-Based Materials
- Environmental Hazard Assessment of Graphene-Based Materials
- Exposure and Life Cycle Analysis of Graphene-Based Materials
- Concluding Remarks
- Supporting Information
- Author Information
- Acknowledgments
- Vocabulary
- References
Informacje uzupełniające
- Abstract
- Synthesis and Characterization of Graphene-Based Materials
- Biodistribution and Fate of Graphene-Based Materials
- Hazard Assessment of Graphene-Based Materials
- Environmental Hazard Assessment of Graphene-Based Materials
- Exposure and Life Cycle Analysis of Graphene-Based Materials
- Concluding Remarks
- Supporting Information
- Author Information
- Acknowledgments
- Vocabulary
- References
Informacje uzupełniające są dostępne bezpłatnie na stronie internetowej ACS Publications pod adresem DOI: 10.1021/acsnano.8b04758.
Pięć rycin i pięć tabel opisujących wykresy 3D w celu zilustrowania zakresu GBM, które zostały poddane badaniom toksykologicznym (PDF)
Regulamin
Większość elektronicznych plików informacji pomocniczych jest dostępna bez subskrypcji ACS Web Editions. Takie pliki mogą być pobierane przez artykuł do użytku badawczego (jeśli istnieje licencja na użytek publiczny powiązana z odpowiednim artykułem, licencja ta może zezwalać na inne zastosowania). Pozwolenie od ACS można uzyskać na inne wykorzystanie za pośrednictwem systemu uprawnień RightsLink: http://pubs.acs.org/page/copyright/permissions.html.
Podziękowania
- Abstract
- Synthesis and Characterization of Graphene-Based Materials
- Biodistribution and Fate of Graphene-Based Materials
- Hazard Assessment of Graphene-Based Materials
- Environmental Hazard Assessment of Graphene-Based Materials
- Exposure and Life Cycle Analysis of Graphene-Based Materials
- Concluding Remarks
- Supporting Information
- Author Information
- Acknowledgments
- Vocabulary
- References
Autorzy są wspierani przez Komisję Europejską w ramach projektu Graphene Flagship Project (umowa o grant nr 696656), projektu JTC 2015 FLAG-ERA (G-Immunomics) oraz projektu FP7-GLADIATOR (umowa o grant nr 604000). B.F. jest również częściowo wspierany przez krajowy program MISTRA Environmental Nanosafety Program (Szwecja). A.B. pragnie podziękować francuskiej Narodowej Agencji Badawczej (ANR-15-GRFL-0001-05) i Międzynarodowemu Centrum Badań Pionierskich w Chemii (icFRC) za finansowanie.
Słownictwo
- Abstract
- Synthesis and Characterization of Graphene-Based Materials
- Biodistribution and Fate of Graphene-Based Materials
- Hazard Assessment of Graphene-Based Materials
- Environmental Hazard Assessment of Graphene-Based Materials
- Exposure and Life Cycle Analysis of Graphene-Based Materials
- Concluding Remarks
- Supporting Information
- Author Information
- Acknowledgments
- Vocabulary
- References
| Materiały na bazie grafenu | rodzina materiałów na bazie węgla, w tym grafen, tlenek grafenu, zredukowany tlenek grafenu i grafenowe kropki kwantowe |
| Ocena cyklu życia | technika badania nakładów i wyników materiałów oraz związanego z nimi wpływu na środowisko, który można bezpośrednio przypisać produktowi w całym cyklu jego życia; |
| biologia systemów | podejście w badaniach biomedycznych w celu zrozumienia złożoności na poziomie organizmu, tkanki lub komórki, co prowadzi do głębszego zrozumienia złożonych sieci i procesów biologicznych |
| nanobezpieczeństwo | kwestie bezpieczeństwa związane z nanotechnologiami, obejmujące takie zagadnienia, jak charakterystyka nanomateriałów, wpływ nanomateriałów na zdrowie ludzkie i środowisko oraz narażenie i ocena ryzyka |
| biodegradacja | proces, w którym mikroorganizm przekształca lub zmienia strukturę materiału organicznego poprzez działania metaboliczne lub enzymatyczne |
| Biodystrybucja | określenie lokalizacji związków przemieszczających się w organizmie |
Odwołania
- Abstract
- Synthesis and Characterization of Graphene-Based Materials
- Biodistribution and Fate of Graphene-Based Materials
- Hazard Assessment of Graphene-Based Materials
- Environmental Hazard Assessment of Graphene-Based Materials
- Exposure and Life Cycle Analysis of Graphene-Based Materials
- Concluding Remarks
- Supporting Information
- Author Information
- Acknowledgments
- Vocabulary
- References
Ten artykuł odnosi się do 348 innych publikacji.
- 1Novoselov, K. S.; Fal'ko, V. I.; Colombo, L.; Gellert, P. R.; Schwab, M. G.; Kim, K. Mapa drogowa dla grafenu. Natura 2012, 490, 192–200, DOI: 10.1038/nature11458[Crossref], [PubMed], [CAS], Google Scholar1https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC38XhsVyrsrrO&md5=39fd29cc6d8a772bfa811f57bc142fd7A roadmap for grapheneNovoselov, K. S.; Fal'ko, V. I.; Colombo, L.; Gellert, P. R.; Schwab, M. G.; Kim, K.Nature (London, United Kingdom) (2012), 490 (7419), 192-200CODEN: NATUAS; ISSN:0028-0836. (Nature Publishing Group)A review. Recent years have witnessed many breakthroughs in research on graphene (the first 2D at. crystal) as well as a significant advance in the mass prodn. of this material. This one-atom-thick fabric of C uniquely combines extreme mech. strength, exceptionally high electronic and thermal conductivities, impermeability to gases, as well as many other supreme properties, all of which make it highly attractive for numerous applications. Here we review recent progress in graphene research and in the development of prodn. methods, and critically analyze the feasibility of various graphene applications.
- 2Ferrari, A. C.; Bonaccorso, F.; Fal'ko, V.; Novoselov, K. S.; Roche, S.; Bøggild, P.; Borini, S.; Koppens, F. H. L.; Palermo, V.; Pugno, N.; Garrido, J. A.; Sordan, R.; Bianco, A.; Ballerini, L.; Prato, M.; Lidorikis, E.; Kivioja, J.; Marinelli, C.; Ryhänen, T.; Morpurgo, A. Mapa drogowa nauki i technologii dla grafenu, powiązanych kryształów dwuwymiarowych i systemów hybrydowych. Nanoskala 2015, 7, 4598–4810, DOI: 10.1039/C4NR01600A[Crossref], [PubMed], [CAS], Google Scholar2https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2cXhsFyhu77K&md5=65926c599802eaf69f8e1b3160cc0189Science and technology roadmap for graphene, related two-dimensional crystals, and hybrid systemsFerrari, Andrea C.; Bonaccorso, Francesco; Fal'ko, Vladimir; Novoselov, Konstantin S.; Roche, Stephan; Boeggild, Peter; Borini, Stefano; Koppens, Frank H. L.; Palermo, Vincenzo; Pugno, Nicola; Garrido, Jose A.; Sordan, Roman; Bianco, Alberto; Ballerini, Laura; Prato, Maurizio; Lidorikis, Elefterios; Kivioja, Jani; Marinelli, Claudio; Ryhanen, Tapani; Morpurgo, Alberto; Coleman, Jonathan N.; Nicolosi, Valeria; Colombo, Luigi; Fert, Albert; Garcia-Hernandez, Mar; Bachtold, Adrian; Schneider, Gregory F.; Guinea, Francisco; Dekker, Cees; Barbone, Matteo; Sun, Zhipei; Galiotis, Costas; Grigorenko, Alexander N.; Konstantatos, Gerasimos; Kis, Andras; Katsnelson, Mikhail; Vandersypen, Lieven; Loiseau, Annick; Morandi, Vittorio; Neumaier, Daniel; Treossi, Emanuele; Pellegrini, Vittorio; Polini, Marco; Tredicucci, Alessandro; Williams, Gareth M.; Hee Hong, Byung; Ahn, Jong-Hyun; Min Kim, Jong; Zirath, Herbert; van Wees, Bart J.; van der Zant, Herre; Occhipinti, Luigi; Di Matteo, Andrea; Kinloch, Ian A.; Seyller, Thomas; Quesnel, Etienne; Feng, Xinliang; Teo, Ken; Rupesinghe, Nalin; Hakonen, Pertti; Neil, Simon R. T.; Tannock, Quentin; Lofwander, Tomas; Kinaret, JariNanoscale (2015), 7 (11), 4598-4810CODEN: NANOHL; ISSN:2040-3372. (Royal Society of Chemistry)A review. We present the science and technol. roadmap for graphene, related two-dimensional crystals, and hybrid systems, targeting an evolution in technol., that might lead to impacts and benefits reaching into most areas of society. This roadmap was developed within the framework of the European Graphene Flagship and outlines the main targets and research areas as best understood at the start of this ambitious project. We provide an overview of the key aspects of graphene and related materials (GRMs), ranging from fundamental research challenges to a variety of applications in a large no. of sectors, highlighting the steps necessary to take GRMs from a state of raw potential to a point where they might revolutionize multiple industries. We also define an extensive list of acronyms in an effort to standardize the nomenclature in this emerging field.
- 3Bianco, A.; Prato, M. Obawy dotyczące bezpieczeństwa grafenu i materiałów 2D: flagowa perspektywa. Mater 2D. 2015, 2, 030201, DOI: 10.1088/2053-1583/2/3/030201
- 4Park, M. V. D. Z.; Bleeker, E. A. J.; Marka, W.; Cassee, F. R.; van Elk, M.; Gosens, I.; de Jong, W. H.; Meesters, J. A. J.; Peijnenburg, W. J. G. M.; Quik, J. T. K.; Vandebriel, R. J.; Sips, A. J. A. M. Rozważania na temat bezpiecznych innowacji: przypadek grafenu. ACS Nano 2017, 11, 9574– 9593, DOI: 10.1021/acsnano.7b04120[ACS Full Text
 ], [CAS], Google Scholar4https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2sXhsFensLjF&md5=c4d3e30331adb4b3929e605877b64897Considerations for Safe Innovation: The Case of GraphenePark, Margriet V. D. Z.; Bleeker, Eric A. J.; Brand, Walter; Cassee, Flemming R.; van Elk, Merel; Gosens, Ilse; de Jong, Wim H.; Meesters, Johannes A. J.; Peijnenburg, Willie J. G. M.; Quik, Joris T. K.; Vandebriel, Rob J.; Sips, Adrienne J. A. M.ACS Nano (2017), 11 (10), 9574-9593CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)A review. The terms safe innovation and safe(r)-by-design are currently popular in the field of nanotechnol. These terms are used to describe approaches that advocate the consideration of safety aspects already at an early stage of the innovation process of (nano)materials and nanoenabled products. Here, we investigate the possibilities of considering safety aspects during various stages of the innovation process of graphene, outlining what information is already available for assessing potential hazard, exposure, and risks. In addn., we recommend further steps to be taken by various stakeholders to promote the safe prodn. and safe use of graphene.
], [CAS], Google Scholar4https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2sXhsFensLjF&md5=c4d3e30331adb4b3929e605877b64897Considerations for Safe Innovation: The Case of GraphenePark, Margriet V. D. Z.; Bleeker, Eric A. J.; Brand, Walter; Cassee, Flemming R.; van Elk, Merel; Gosens, Ilse; de Jong, Wim H.; Meesters, Johannes A. J.; Peijnenburg, Willie J. G. M.; Quik, Joris T. K.; Vandebriel, Rob J.; Sips, Adrienne J. A. M.ACS Nano (2017), 11 (10), 9574-9593CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)A review. The terms safe innovation and safe(r)-by-design are currently popular in the field of nanotechnol. These terms are used to describe approaches that advocate the consideration of safety aspects already at an early stage of the innovation process of (nano)materials and nanoenabled products. Here, we investigate the possibilities of considering safety aspects during various stages of the innovation process of graphene, outlining what information is already available for assessing potential hazard, exposure, and risks. In addn., we recommend further steps to be taken by various stakeholders to promote the safe prodn. and safe use of graphene. - 5Polska, C. A.; Duffin, R.; Kinloch, I.; Maynard, A.; Wallace, W. A. H.; Seaton, A.; Kamień, V.; Brown, S.; MacNee, W.; Donaldson, K. Nanorurki węglowe wprowadzone do jamy brzusznej myszy wykazują patogenność podobną do azbestu w badaniu pilotażowym. Nat. Nanotechnol. 2008, 3, 423–428, DOI: 10.1038/nnano.2008.111[Crossref], [PubMed], [CAS], Google Scholar5https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BD1cXotFehs7o%253D&md5=54ae8b1abbe311ade69bb8255891b407Carbon nanotubes introduced into the abdominal cavity of mice show asbestos-like pathogenicity in a pilot studyPoland, Craig A.; Duffin, Rodger; Kinloch, Ian; Maynard, Andrew; Wallace, William A. H.; Seaton, Anthony; Stone, Vicki; Brown, Simon; MacNee, William; Donaldson, KenNature Nanotechnology (2008), 3 (7), 423-428CODEN: NNAABX; ISSN:1748-3387. (Nature Publishing Group)Carbon nanotubes have distinctive characteristics, but their needle-like fiber shape has been compared to asbestos, raising concerns that widespread use of carbon nanotubes may lead to mesothelioma, cancer of the lining of the lungs caused by exposure to asbestos. Exposing the mesothelial lining of the body cavity of mice, as a surrogate for the mesothelial lining of the chest cavity, to long multiwalled carbon nanotubes results in asbestos-like, length-dependent, pathogenic behavior. This includes inflammation and the formation of lesions known as granulomas. This is of considerable importance, because research and business communities continue to invest heavily in carbon nanotubes for a wide range of products under the assumption that they are no more hazardous than graphite. The authors' results suggest the need for further research and great caution before introducing such products into the market if long-term harm is to be avoided. A pilot study in a small no. of mice shows that long multiwalled carbon nanotubes introduced into the abdominal cavity can cause asbestos-like pathogenic behavior. The results suggest the need for further research and caution before introducing nanotube products into the market.
- 6Kuempel, E. D.; Jaurand, M.-C.; Møller, P.; Morimoto, Y.; Kobayashi, N.; Pinkerton, K. E.; Sargent, L. M.; Vermeulen, R. C. H.; Fubini, B.; Kane, A. B. Ocena dowodów mechanistycznych i kluczowych luk w danych w ocenie potencjalnej rakotwórczości nanorurek węglowych i nanowłókien u ludzi. Krytyka. Rev. Toxicol. 2017, 47, 1–58, DOI: 10.1080/10408444.2016.1206061[Crossref], [PubMed], [CAS], Google Scholar6https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC28XhsVSlurnL&md5=ca1dc533df738b01b82cb52446fa317aEvaluating the mechanistic evidence and key data gaps in assessing the potential carcinogenicity of carbon nanotubes and nanofibers in humansKuempel, Eileen D.; Jaurand, Marie-Claude; Moeller, Peter; Morimoto, Yasuo; Kobayashi, Norihiro; Pinkerton, Kent E.; Sargent, Linda M.; Vermeulen, Roel C. H.; Fubini, Bice; Kane, Agnes B.Critical Reviews in Toxicology (2017), 47 (1), 1-58CODEN: CRTXB2; ISSN:1040-8444. (Taylor & Francis Ltd.)In an evaluation of carbon nanotubes (CNTs) for the IARC Monograph 111, the Mechanisms Subgroup was tasked with assessing the strength of evidence on the potential carcinogenicity of CNTs in humans. The mechanistic evidence was considered to be not strong enough to alter the evaluations based on the animal data. In this paper, we provide an extended, in-depth examn. of the in vivo and in vitro exptl. studies according to current hypotheses on the carcinogenicity of inhaled particles and fibers. We cite addnl. studies of CNTs that were not available at the time of the IARC meeting in Oct. 2014, and extend our evaluation to include carbon nanofibers (CNFs). Finally, we identify key data gaps and suggest research needs to reduce uncertainty. The focus of this review is on the cancer risk to workers exposed to airborne CNT or CNF during the prodn. and use of these materials. The findings of this review, in general, affirm those of the original evaluation on the inadequate or limited evidence of carcinogenicity for most types of CNTs and CNFs at this time, and possible carcinogenicity of one type of CNT (MWCNT-7). The key evidence gaps to be filled by research include: investigation of possible assocns. between in vitro and early-stage in vivo events that may be predictive of lung cancer or mesothelioma, and systematic anal. of dose-response relationships across materials, including evaluation of the influence of physico-chem. properties and exptl. factors on the observation of nonmalignant and malignant endpoints.
- 7Kostarelos, K.; Lacerda, L.; Pastorin, G.; Wu, W.; Więckowski, S.; Luangsivilay, J.; Godefroy, S.; Pantarotto, D.; Briand, J.-P.; Müller, S.; Prato, M.; Bianco, A. Komórkowy wychwyt funkcjonalizowanych nanorurek węglowych jest niezależny od grupy funkcjonalnej i typu komórki. Nat. Nanotechnol. 2007, 2, 108–113, DOI: 10.1038/nnano.2006.209[Crossref], [PubMed], [CAS], Google Scholar7https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BD2sXit1Wrtrs%253D&md5=030c99a00e958dd35bc1a8607c882a54Cellular uptake of functionalized carbon nanotubes is independent of functional group and cell typeKostarelos, Kostas; Lacerda, Lara; Pastorin, Giorgia; Wu, Wei; Wieckowski, Sebastien; Luangsivilay, Jacqueline; Godefroy, Sylvie; Pantarotto, Davide; Briand, Jean-Paul; Muller, Sylviane; Prato, Maurizio; Bianco, AlbertoNature Nanotechnology (2007), 2 (2), 108-113CODEN: NNAABX; ISSN:1748-3387. (Nature Publishing Group)The development of nanomaterials for biomedical and biotechnol. applications is an area of research that holds great promise and intense interest, and carbon-based nanostructures in particular, such as carbon nanotubes (CNTs), are attracting an increasing level of attention. One of the key advantages that CNTs offer is the possibility of effectively crossing biol. barriers, which would allow their use in the delivery of therapeutically active mols. The authors' labs. have been investigating the use of CNTs in biomedical applications, and in particular as nanovectors for therapeutic agent delivery. The interaction between cells and CNTs is a crit. issue that will det. any future biol. application of such structures. Various types of functionalized carbon nanotubes (f-CNTs) exhibit a capacity to be taken up by a wide range of cells and can intracellularly traffic through different cellular barriers.
- 8Schipper, M. L.; Nakayama-Ratchford, N.; Davis, C. R.; Kam, N. W. S.; Chu, P.; Liu, Z.; Słońce, X.; Dai, H.; Gambhir, S. S. Pilotażowe badanie toksykologiczne jednościennych nanorurek węglowych w małej próbce myszy. Nat. Nanotechnol. 2008, 3, 216–221, DOI: 10.1038/nnano.2008.68[Crossref], [PubMed], [CAS], Google Scholar8https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BD1cXkt1Slu7w%253D&md5=814b1f01559c4f5071a5b81c4e94c64aA pilot toxicology study of single-walled carbon nanotubes in a small sample of miceSchipper, Meike L.; Nakayama-Ratchford, Nozomi; Davis, Corrine R.; Kam, Nadine Wong Shi; Chu, Pauline; Liu, Zhuang; Sun, Xiaoming; Dai, Hongjie; Gambhir, Sanjiv S.Nature Nanotechnology (2008), 3 (4), 216-221CODEN: NNAABX; ISSN:1748-3387. (Nature Publishing Group)Single-walled carbon nanotubes are currently under evaluation in biomedical applications, including in vivo delivery of drugs, proteins, peptides, and nucleic acids (for gene transfer or gene silencing), in vivo tumor imaging, and tumor targeting of single-walled carbon nanotubes as an antineoplastic treatment. However, concerns about the potential toxicity of single-walled carbon nanotubes have been raised. Here the authors examine the acute and chronic toxicity of functionalized single-walled carbon nanotubes when injected into the bloodstream of mice. Survival, clin., and lab. parameters reveal no evidence of toxicity over 4 mo. Upon killing, careful necropsy and tissue histol. show age-related changes only. Histol. and Raman microscopic mapping demonstrate that functionalized single-walled carbon nanotubes persisted within liver and spleen macrophages for 4 mo without apparent toxicity. Although this is a preliminary study with a small group of animals, the results encourage further confirmation studies with larger groups of animals.
- 9Kagan, V. E.; Konduru, N. V.; Feng, W.; Allen, B. L.; Conroy, J.; Wołkow, J.; Własowa, I. I.; Belikova, N. A.; Yanamala, N.; Kapralov, A.; Tyurina, Y. Y.; Shi, J.; Kisin, E. R.; Murray, A. R.; Franks, J.; Stolz, D.; Gou, P.; Klein-Seetharaman, J.; Fadeel, B.; Gwiazda, A. Nanorurki węglowe rozkładane przez mieloperoksydazę neutrofilową wywołują mniej zapalenia płuc. Nat. Nanotechnol. 2010, 5, 354–359, DOI: 10.1038/nnano.2010.44[Crossref], [PubMed], [CAS], Google Scholar9https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3cXls12isb4%253D&md5=20b56ba9ecf823553930816138b3dffeCarbon nanotubes degraded by neutrophil myeloperoxidase induce less pulmonary inflammationKagan, Valerian E.; Konduru, Nagarjun V.; Feng, Weihong; Allen, Brett L.; Conroy, Jennifer; Volkov, Yuri; Vlasova, Irina I.; Belikova, Natalia A.; Yanamala, Naveena; Kapralov, Alexander; Tyurina, Yulia Y.; Shi, Jingwen; Kisin, Elena R.; Murray, Ashley R.; Franks, Jonathan; Stolz, Donna; Gou, Pingping; Klein-Seetharaman, Judith; Fadeel, Bengt; Star, Alexander; Shvedova, Anna A.Nature Nanotechnology (2010), 5 (5), 354-359CODEN: NNAABX; ISSN:1748-3387. (Nature Publishing Group)We have shown previously that single-walled carbon nanotubes can be catalytically biodegraded over several weeks by the plant-derived enzyme, horseradish peroxidase. However, whether peroxidase intermediates generated inside human cells or biofluids are involved in the biodegrdn. of carbon nanotubes has not been explored. Here, we show that hypochlorite and reactive radical intermediates of the human neutrophil enzyme myeloperoxidase catalyze the biodegrdn. of single-walled carbon nanotubes in vitro, in neutrophils and to a lesser degree in macrophages. Mol. modeling suggests that interactions of basic amino acids of the enzyme with the carboxyls on the carbon nanotubes position the nanotubes near the catalytic site. Importantly, the biodegraded nanotubes do not generate an inflammatory response when aspirated into the lungs of mice. Our findings suggest that the extent to which carbon nanotubes are biodegraded may be a major determinant of the scale and severity of the assocd. inflammatory responses in exposed individuals.
- 10Bhattacharya, K.; Mukherjee, S. P.; Gallud, A.; Burkert, S. C.; Bistarelli, S.; Bellucci, S.; Bottini, M.; Gwiazda, A.; Fadeel, B. Biologiczne interakcje nanomateriałów na bazie węgla: od koronacji do degradacji. Nanomedycyna 2016, 12, 333–351, DOI: 10.1016/j.nano.2015.11.011[Crossref], [PubMed], [CAS], Google Scholar10https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC28XlvVCqsA%253D%253D&md5=27801167ac52dbd5af33a2d2e1a34d4fBiological interactions of carbon-based nanomaterials: From coronation to degradationBhattacharya, Kunal; Mukherjee, Sourav P.; Gallud, Audrey; Burkert, Seth C.; Bistarelli, Silvia; Bellucci, Stefano; Bottini, Massimo; Star, Alexander; Fadeel, BengtNanomedicine (New York, NY, United States) (2016), 12 (2), 333-351CODEN: NANOBF; ISSN:1549-9634. (Elsevier)Carbon-based nanomaterials including carbon nanotubes, graphene oxide, fullerenes and nanodiamonds are potential candidates for various applications in medicine such as drug delivery and imaging. However, the successful translation of nanomaterials for biomedical applications is predicated on a detailed understanding of the biol. interactions of these materials. Indeed, the potential impact of the so-called bio-corona of proteins, lipids, and other biomols. on the fate of nanomaterials in the body should not be ignored. Enzymic degrdn. of carbon-based nanomaterials by immune-competent cells serves as a special case of bio-corona interactions with important implications for the medical use of such nanomaterials. In the present review, we highlight emerging biomedical applications of carbon-based nanomaterials. We also discuss recent studies on nanomaterial 'coronation' and how this impacts on biodistribution and targeting along with studies on the enzymic degrdn. of carbon-based nanomaterials, and the role of surface modification of nanomaterials for these biol. interactions.
- 11Szwedowa, A. A.; Kagan, V. E.; Fadeel, B. Bliskie spotkania małego rodzaju: niekorzystne skutki materiałów stworzonych przez człowieka łączących się z nanokosmosem systemów biologicznych. Annu. Rev. Pharmacol. Toxicol. 2010, 50, 63–88, DOI: 10.1146/annurev.pharmtox.010909.105819[Crossref], [PubMed], [CAS], Google Scholar11https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3cXisVeltbk%253D&md5=c4127a2971a72e3a98af19580c0ad62dClose encounters of the small kind: adverse effects of man-made materials interfacing with the nano-cosmos of biological systemsShvedova, Anna A.; Kagan, Valerian E.; Fadeel, BengtAnnual Review of Pharmacology and Toxicology (2010), 50 (), 63-88CODEN: ARPTDI; ISSN:0362-1642. (Annual Reviews Inc.)A review. Engineered nanomaterials have unique physico-chem. properties that make them promising for many technol. and biomedical applications, including tissue regeneration, drug and gene delivery, and in vivo monitoring of disease processes. However, with the burgeoning capabilities to manipulate structures at the nano-scale, intentional as well as unintentional human exposures to engineered nanomaterials are set to increase. Nanotoxicol. is an emerging discipline focused on understanding the properties of engineered nanomaterials and their interactions with biol. systems, and may be viewed as the study of the undesirable interference between man-made nanomaterials and cellular nanostructures or nanomachines. In this review, we discuss recognition of engineered nanomaterials by the immune system, our primary defense system against foreign invasion. Moreover, as oxidative stress is believed to be one of the major deleterious consequences of exposure to nanomaterials, we explore triggering of pro- and antioxidant pathways as well as biomarkers of oxidative stress. Finally, we highlight in vivo studies of the toxicol. outcomes of engineered nanomaterials, including carbon nanotubes, with an emphasis on inflammation and genotoxic responses.
- 12Donaldson, K.; Polska, C. A. Nanotoksyczność: kwestionowanie mitu toksyczności nanospecyficznej. Curr. Opin. Biotechnol. 2013, 24, 724–734, DOI: 10.1016/j.copbio.2013.05.003[Crossref], [PubMed], [CAS], Google Scholar12https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3sXptlGrsL0%253D&md5=dde1b497718e9aaebdc230bdcdf86598Nanotoxicity: challenging the myth of nano-specific toxicityDonaldson, Ken; Poland, Craig A.Current Opinion in Biotechnology (2013), 24 (4), 724-734CODEN: CUOBE3; ISSN:0958-1669. (Elsevier B.V.)A review. The anal. of nanoparticle (NP) hazard is currently a major research pre-occupation for particle toxicologists since there is a pressing requirement for a comprehensive understanding of nanoparticle hazard because of the wide spectrum of NP varying in compn., shape and size that require testing for risk assessment. The Biol. EDs (BEDs) of nanoparticles, the dose entity that drives toxicity include charge, soly., contaminants, shape and the ability to translocate from the site of deposition in the lungs. We point out here that all of these modes of toxicity are relevant and described for conventional pathogenic particles. There is no evidence that particles below 100 nm, the threshold definition of a NP, show any step-change in their hazard meaning that there is no evidence of novel 'nano-specific hazard'. Therefore conventional particle toxicol. data are useful and relevant to the detn. of the nanoparticle hazard. Emphasis away from 'nano-specific effects' and the availability of hazard data from conventional particles will focus limited resource towards a full understanding of the NP hazard. This will lead to improved ability to identify and test for their effects and measure their toxicokinetics and so contribute to their risk assessment.
- 13Bianco, A. Grafen: bezpieczny czy toksyczny? Dwie twarze medalu. Angew. Chem., Int. Ed. 2013, 52, 4986–4997, DOI: 10.1002/anie.201209099[Crossref], [CAS], Google Scholar13https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3sXlsl2jtrk%253D&md5=4f293b4b7482a9468c792ae44746e9eeGraphene: Safe or Toxic? The Two Faces of the MedalBianco, AlbertoAngewandte Chemie, International Edition (2013), 52 (19), 4986-4997CODEN: ACIEF5; ISSN:1433-7851. (Wiley-VCH Verlag GmbH & Co. KGaA)A review. Graphene is considered the future revolutionary material. For its development, it is of fundamental importance to evaluate the safety profile and the impact on health. Graphene is part of a bigger family which has been identified as the graphene family nanomaterials (GFNs). Clarifying the existence of multiple graphene forms allows better understanding the differences between the components and eventually correlating their biol. effects to the physicochem. characteristics of each structure. Some in vitro and in vivo studies clearly showed no particular risks, while others have indicated that GFNs might become health hazards. This Minireview critically discusses the recent studies on the toxicity of GFNs to provide some perspective on the possible risks to their future development in materials and biomedical sciences.
- 14Krug, H. F. Badania nad nanobezpieczeństwem – czy jesteśmy na dobrej drodze?. Angew. Chem., Int. Ed. 2014, 53, 12304– 12319, DOI: 10.1002/anie.201403367[Crossref], [CAS], Google Scholar14https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2cXhvVGksLzP&md5=47e39189d170a4b2ca2b0f34f36122caNanosafety Research-Are We on the Right Track?Krug, Harald F.Angewandte Chemie, International Edition (2014), 53 (46), 12304-12319CODEN: ACIEF5; ISSN:1433-7851. (Wiley-VCH Verlag GmbH & Co. KGaA)A review. The no. of studies that have been published on the topic of nanosafety speaks for itself. We have seen an almost exponential rise over the past 15 years or so in the no. of articles on nanotoxicol. Although only a couple of hundred papers had appeared on the topic of "Nanomaterials: environmental and health effects" before 2000, this no. has exploded to over 10 000 since 2001. Most of these studies, however, do not offer any kind of clear statement on the safety of nanomaterials. On the contrary, most of them are either self-contradictory or arrive at completely erroneous conclusions. Three years ago in this Journal we underscored the deficiencies in the way these studies were designed and pointed out the sources of error in the methods used. Now, on the basis of a comprehensive review of the literature and with the help of selected toxicol. end points, we attempt to indicate where the significant weaknesses of these studies lie and what we must improve in the future.
- 15Sanchez, V. C.; A. Jachak; Hurt, R. H.; Kane, A. B. Biologiczne interakcje nanomateriałów z rodziny grafenów: przegląd interdyscyplinarny. Chem. Res. Toxicol. 2012, 25, 15–34, DOI: 10.1021/tx200339h[ACS Full Text
 ], [CAS], Google Scholar15https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3MXhtlGjt73N&md5=331735edd40d5f955121e3d2def219adBiological Interactions of Graphene-Family Nanomaterials: An Interdisciplinary ReviewSanchez, Vanesa C.; Jachak, Ashish; Hurt, Robert H.; Kane, Agnes B.Chemical Research in Toxicology (2012), 25 (1), 15-34CODEN: CRTOEC; ISSN:0893-228X. (American Chemical Society)A review. Graphene is a single-atom thick, two-dimensional sheet of hexagonally arranged carbon atoms isolated from its three-dimensional parent material, graphite. Related materials include few-layer-graphene (FLG), ultrathin graphite, graphene oxide (GO), reduced graphene oxide (rGO), and graphene nanosheets (GNS). This review proposes a systematic nomenclature for this set of Graphene-Family Nanomaterials (GFNs) and discusses specific materials properties relevant for biomol. and cellular interactions. We discuss several unique modes of interaction between GFNs and nucleic acids, lipid bilayers, and conjugated small mol. drugs and dyes. Some GFNs are produced as dry powders using thermal exfoliation, and in these cases, inhalation is a likely route of human exposure. Some GFNs have aerodynamic sizes that can lead to inhalation and substantial deposition in the human respiratory tract, which may impair lung defense and clearance leading to the formation of granulomas and lung fibrosis. The limited literature on in vitro toxicity suggests that GFNs can be either benign or toxic to cells, and it is hypothesized that the biol. response will vary across the material family depending on layer no., lateral size, stiffness, hydrophobicity, surface functionalization, and dose. Generation of reactive oxygen species (ROS) in target cells is a potential mechanism for toxicity, although the extremely high hydrophobic surface area of some GFNs may also lead to significant interactions with membrane lipids leading to direct phys. toxicity or adsorption of biol. mols. leading to indirect toxicity. Limited in vivo studies demonstrate systemic biodistribution and biopersistence of GFNs following i.v. delivery. Similar to other smooth, continuous, biopersistent implants or foreign bodies, GFNs have the potential to induce foreign body tumors. Long-term adverse health impacts must be considered in the design of GFNs for drug delivery, tissue engineering, and fluorescence-based biomol. sensing. Future research is needed to explore fundamental biol. responses to GFNs including systematic assessment of the phys. and chem. material properties related to toxicity. Complete materials characterization and mechanistic toxicity studies are essential for safer design and manufg. of GFNs in order to optimize biol. applications with minimal risks for environmental health and safety.
], [CAS], Google Scholar15https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3MXhtlGjt73N&md5=331735edd40d5f955121e3d2def219adBiological Interactions of Graphene-Family Nanomaterials: An Interdisciplinary ReviewSanchez, Vanesa C.; Jachak, Ashish; Hurt, Robert H.; Kane, Agnes B.Chemical Research in Toxicology (2012), 25 (1), 15-34CODEN: CRTOEC; ISSN:0893-228X. (American Chemical Society)A review. Graphene is a single-atom thick, two-dimensional sheet of hexagonally arranged carbon atoms isolated from its three-dimensional parent material, graphite. Related materials include few-layer-graphene (FLG), ultrathin graphite, graphene oxide (GO), reduced graphene oxide (rGO), and graphene nanosheets (GNS). This review proposes a systematic nomenclature for this set of Graphene-Family Nanomaterials (GFNs) and discusses specific materials properties relevant for biomol. and cellular interactions. We discuss several unique modes of interaction between GFNs and nucleic acids, lipid bilayers, and conjugated small mol. drugs and dyes. Some GFNs are produced as dry powders using thermal exfoliation, and in these cases, inhalation is a likely route of human exposure. Some GFNs have aerodynamic sizes that can lead to inhalation and substantial deposition in the human respiratory tract, which may impair lung defense and clearance leading to the formation of granulomas and lung fibrosis. The limited literature on in vitro toxicity suggests that GFNs can be either benign or toxic to cells, and it is hypothesized that the biol. response will vary across the material family depending on layer no., lateral size, stiffness, hydrophobicity, surface functionalization, and dose. Generation of reactive oxygen species (ROS) in target cells is a potential mechanism for toxicity, although the extremely high hydrophobic surface area of some GFNs may also lead to significant interactions with membrane lipids leading to direct phys. toxicity or adsorption of biol. mols. leading to indirect toxicity. Limited in vivo studies demonstrate systemic biodistribution and biopersistence of GFNs following i.v. delivery. Similar to other smooth, continuous, biopersistent implants or foreign bodies, GFNs have the potential to induce foreign body tumors. Long-term adverse health impacts must be considered in the design of GFNs for drug delivery, tissue engineering, and fluorescence-based biomol. sensing. Future research is needed to explore fundamental biol. responses to GFNs including systematic assessment of the phys. and chem. material properties related to toxicity. Complete materials characterization and mechanistic toxicity studies are essential for safer design and manufg. of GFNs in order to optimize biol. applications with minimal risks for environmental health and safety. - 16Lalwani, G.; D'Agati, M.; Khan, A. M.; Sitharaman, B. Toksykologia nanomateriałów na bazie grafenu. Adv. Drug Delivery Rev. 2016, 105, 109-144, DOI: 10.1016/j.addr.2016.04.028[Crossref], [PubMed], [CAS], Google Scholar16https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC28XnsV2gsr0%253D&md5=9c78313ebe97a7f599147beeecf4ab50Toxicology of graphene-based nanomaterialsLalwani, Gaurav; D'Agati, Michael; Khan, Amit Mahmud; Sitharaman, BalajiAdvanced Drug Delivery Reviews (2016), 105 (Part_B), 109-144CODEN: ADDREP; ISSN:0169-409X. (Elsevier B.V.)Graphene based nanomaterials possess remarkable physiochem. properties suitable for diverse applications in electronics, telecommunications, energy and healthcare. The human and environmental exposure to graphene-based nanomaterials is increasing due to advancements in the synthesis, characterization and large-scale prodn. of graphene and the subsequent development of graphene based biomedical and consumer products. A large no. of in vitro and in vivo toxicol. studies have evaluated the interactions of graphene-based nanomaterials with various living systems such as microbes, mammalian cells, and animal models. A significant no. of studies have examd. the short- and long-term in vivo toxicity and biodistribution of graphene synthesized by variety of methods and starting materials. A key focus of these examns. is to properly assoc. the biol. responses with chem. and morphol. properties of graphene. Several studies also report the environmental and genotoxicity response of pristine and functionalized graphene. This review summarizes these in vitro and in vivo studies and critically examines the methodologies used to perform these evaluations. Our overarching goal is to provide a comprehensive overview of the complex interplay of biol. responses of graphene as a function of their physiochem. properties.
- 17Reina, G.; González-Domínguez, J. M.; Criado, A.; Vázquez, E.; Bianco, A.; Prato, M. Obietnice, fakty i wyzwania dla grafenu w zastosowaniach biomedycznych. Chem. Soc. Rev. 2017, 46, 4400–4416, DOI: 10.1039/C7CS00363C[Crossref], [PubMed], [CAS], Google Scholar17https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2sXhtFyqtbrP&md5=fac25dcc837c266c1740345500d8440aPromises, facts and challenges for graphene in biomedical applicationsReina, Giacomo; Gonzalez-Dominguez, Jose Miguel; Criado, Alejandro; Vazquez, Ester; Bianco, Alberto; Prato, MaurizioChemical Society Reviews (2017), 46 (15), 4400-4416CODEN: CSRVBR; ISSN:0306-0012. (Royal Society of Chemistry)The graphene family has captured the interest and the imagination of an increasing no. of scientists working in different fields, ranging from composites to flexible electronics. In the area of biomedical applications, graphene is esp. involved in drug delivery, biosensing and tissue engineering, with strong contributions to the whole nanomedicine area. Besides the interesting results obtained so far and the evident success, there are still many problems to solve, on the way to the manufg. of biomedical devices, including the lack of standardization in the prodn. of the graphene family members. Control of lateral size, aggregation state (single vs. few layers) and oxidn. state (unmodified graphene vs. oxidized graphenes) is essential for the translation of this material into clin. assays. In this Tutorial Review we critically describe the latest developments of the graphene family materials into the biomedical field. We analyze graphene-based devices starting from graphene synthetic strategies, functionalization and processibility protocols up to the final in vitro and in vivo applications. We also address the toxicol. impact and the limitations in translating graphene materials into advanced clin. tools. Finally, new trends and guidelines for future developments are presented.
- 18Ema, M.; Gamo, M.; Honda, K. Przegląd badań toksyczności nanomateriałów na bazie grafenu u zwierząt laboratoryjnych. Regulować. Toxicol. Pharmacol. 2017, 85, 7–24, DOI: 10.1016/j.yrtph.2017.01.011[Crossref], [PubMed], [CAS], Google Scholar18https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2sXisVCntL4%253D&md5=6e161b89ebfb01f37de1d3a3b13115f0A review of toxicity studies on graphene-based nanomaterials in laboratory animalsEma, Makoto; Gamo, Masashi; Honda, KazumasaRegulatory Toxicology and Pharmacology (2017), 85 (), 7-24CODEN: RTOPDW; ISSN:0273-2300. (Elsevier Inc.)We summarized the findings of toxicity studies on graphene-based nanomaterials (GNMs) in lab. mammals. The inhalation of graphene (GP) and graphene oxide (GO) induced only minimal pulmonary toxicity. Bolus airway exposure to GP and GO caused acute and subacute pulmonary inflammation. Large-sized GO (L-GO) was more toxic than small-sized GO (S-GO). Intratracheally administered GP passed through the air-blood barrier into the blood and i.v. GO distributed mainly in the lungs, liver, and spleen. S-GO and L-GO mainly accumulated in the liver and lungs, resp. Limited information showed the potential behavioral, reproductive, and developmental toxicity and genotoxicity of GNMs. There are indications that oxidative stress and inflammation may be involved in the toxicity of GNMs. The surface reactivity, size, and dispersion status of GNMs play an important role in the induction of toxicity and biodistribution of GNMs. Although this review paper provides initial information on the potential toxicity of GNMs, data are still very limited, esp. when taking into account the many different types of GNMs and their potential modifications. To fill the data gap, further studies should be performed using lab. mammals exposed using the route and dose anticipated for human exposure scenarios.
- 19Fojtů, M.; Teo, W. Z.; Pumera, M. Wpływ nanomateriałów 2D na środowisko i potencjalne zagrożenia dla zdrowia. Środowisko: Nano 2017, 4, 1617–1633, DOI: 10.1039/C7EN00401J[Crossref], [CAS], Google Scholar19https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2sXhtF2rsrfJ&md5=088d986da8cac0a27ace8b7061fe7868Environmental impact and potential health risks of 2D nanomaterialsFojtu, Michaela; Teo, Wei Zhe; Pumera, MartinEnvironmental Science: Nano (2017), 4 (8), 1617-1633CODEN: ESNNA4; ISSN:2051-8161. (Royal Society of Chemistry)The prospective intensive utilization of two-dimensional (2D) nanomaterials, such as graphene, transition metal dichalcogenides, and black phosphorus, increased the requirements for thorough comprehension of their potential impact on the environment and health. The unique properties of 2D materials originate from their parent material cryst. structure composed of vertically stacked layers. This enables the redn. of their thickness on the at. layer scale while simultaneously changing their physicochem. properties. Layered nanomaterials are revealing their promising employment in a wide range of applications, from the fabrication of products for everyday use to water purifn. and applications in biomedicine. The degrdn. of such materials, their biocompatibility, and their effect on living organisms have begun to attract increased attention since their auspicious application potential is still increasing. Here, we summarize recent knowledge regarding the environmental and health risks of graphene-based materials, transition metal dichalcogenides, and black phosphorus. We have summarized the current progress and findings concerning their biocompatibility, nanotoxicity, and biodistribution, bringing awareness to the complexity of these phenomena.
- 20Wołkow, J.; McIntyre, J.; Prina-Mello, A. Toksyczność grafenu jako obosieczny miecz ryzyka i możliwych do wykorzystania możliwości: krytyczna analiza najnowszych trendów i osiągnięć. Mater 2D. 2017, 4, 022001, DOI: 10.1088/2053-1583/aa5476
- 21Bianco, A.; Cheng, H.-M.; Enoki, T.; Gogotsi, Y.; Hurt, R. H.; Koratkar, N.; Kyotani, T.; Monthioux, M.; Park, C. R.; Tascon, J. M. D.; Zhang, J. Wszystko w rodzinie grafenów – zalecanej nomenklaturze dla dwuwymiarowych materiałów węglowych. Węgiel 2013, 65, 1–6, DOI: 10.1016/j.carbon.2013.08.038[Crossref], [CAS], Google Scholar21https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3sXhsVCitrbK&md5=8db9e63da674e82738226d2483d9050cAll in the graphene family - A recommended nomenclature for two-dimensional carbon materialsBianco, Alberto; Cheng, Hui-Ming; Enoki, Toshiaki; Gogotsi, Yury; Hurt, Robert H.; Koratkar, Nikhil; Kyotani, Takashi; Monthioux, Marc; Park, Chong Rae; Tascon, Juan M. D.; Zhang, JinCarbon (2013), 65 (), 1-6CODEN: CRBNAH; ISSN:0008-6223. (Elsevier Ltd.)Interest in two-dimensional, sheet-like or flake-like carbon forms has expanded beyond monolayer graphene to include related materials with significant variations in layer no., lateral dimension, rotational faulting, and chem. modification. Describing this family of "graphene materials" has been causing confusion in the Carbon journal and in the scientific literature as a whole. The international editorial team for Carbon believes that the time has come for a discussion on a rational naming system for two-dimensional carbon forms. We propose here a first nomenclature for two-dimensional carbons that could guide authors toward a more precise description of their subject materials, and could allow the field to move forward with a higher degree of common understanding.
- 22Wick, P.; Louw-Gaume, A. E.; Kucki, M.; Krug, H. F.; Kostarelos, K.; Fadeel, B.; Dawson, K. a.; A. Salvati; Vázquez, E.; Ballerini, L.; Tretiach, M.; Benfenati, F.; Flahaut, E.; Gauthier, L.; Prato, M.; Bianco, A. Ramy klasyfikacji materiałów na bazie grafenu. Angew. Chem., Int. Ed. 2014, 53, 7714– 7718, DOI: 10.1002/anie.201403335[Crossref], [CAS], Google Scholar22https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2cXpsVKit74%253D&md5=bbb7a59c7a6e533514839c0de3549247Classification Framework for Graphene-Based MaterialsWick, Peter; Louw-Gaume, Anna E.; Kucki, Melanie; Krug, Harald F.; Kostarelos, Kostas; Fadeel, Bengt; Dawson, Kenneth A.; Salvati, Anna; Vazquez, Ester; Ballerini, Laura; Tretiach, Mauro; Benfenati, Fabio; Flahaut, Emmanuel; Gauthier, Laury; Prato, Maurizio; Bianco, AlbertoAngewandte Chemie, International Edition (2014), 53 (30), 7714-7718CODEN: ACIEF5; ISSN:1433-7851. (Wiley-VCH Verlag GmbH & Co. KGaA)Graphene is the enabling material of the 21st century and there are high expectations for its potential applications. A clear and consistent system describing the various derivs. of graphene promotes a precise vocabulary for the family of graphene-based materials. This will be a prerequisite, for example, to understand structure-activity relationships in the context of human health and safety and to avoid generalizations about the capabilities and limitations of graphene- based materials. Within the European Union's GRAPHENE Flagship project, three phys.-chem. descriptors specific for graphene were defined to assist in the classification of graphene-based materials.
- 23Bottari, G.; Herranz, M. Á.; Wibmer, L.; Volland, M.; Rodríguez-Pérez, L.; Guldi, D. M.; Hirsch, A.; Martín, N.; D'Souza, F.; Torres, T. Funkcjonalizacja chemiczna i charakterystyka materiałów na bazie grafenu. Chem. Soc. Rev. 2017, 46, 4464-4500, DOI: 10.1039/C7CS00229G[Crossref], [PubMed], [CAS], Google Scholar23https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2sXhtFKhtrvE&md5=1f0cfbf285c40a39a16efc02bf3409d2Chemical functionalization and characterization of graphene-based materialsBottari, Giovanni; Herranz, Ma Angeles; Wibmer, Leonie; Volland, Michel; Rodriguez-Perez, Laura; Guldi, Dirk M.; Hirsch, Andreas; Martin, Nazario; D'Souza, Francis; Torres, TomasChemical Society Reviews (2017), 46 (15), 4464-4500CODEN: CSRVBR; ISSN:0306-0012. (Royal Society of Chemistry)Graphene-based materials (GBMs), with graphene, their most known member, at the head, constitute a large family of materials which has aroused the interest of scientists working in different research fields such as chem., physics, or materials science, to mention a few, arguably as no other material before. In this review, we offer a general overview on the most relevant synthetic approaches for the covalent and non-covalent functionalization and characterization of GBMs. Moreover, some representative examples of the incorporation into GBMs of electroactive units such as porphyrins, phthalocyanines, or ferrocene, among others, affording electron donor-acceptor (D-A) hybrids are presented. For the latter systems, the photophys. characterization of their ground- and excited-state features has also been included, paying particular attention to elucidate the fundamental dynamics of the energy transfer and charge sepn. processes of these hybrids. For some of the presented architectures, their application in solar energy conversion schemes and energy prodn. has been also discussed.
- 24Dong, L.; Yang, J.; Chhowalla, M.; Loh, K. P. Synteza i redukcja dużych arkuszy tlenku grafenu. Chem. Soc. Rev. 2017, 46, 7306– 7316, DOI: 10.1039/C7CS00485K[Crossref], [PubMed], [CAS], Google Scholar24https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2sXhs12lsLbF&md5=15bc5ee0cd2e8994b57887a82b889cc7Synthesis and reduction of large sized graphene oxide sheetsDong, Lei; Yang, Jieun; Chhowalla, Manish; Loh, Kian PingChemical Society Reviews (2017), 46 (23), 7306-7316CODEN: CSRVBR; ISSN:0306-0012. (Royal Society of Chemistry)Graphene oxide (GO) can be considered as one of the most visible outcomes of graphene research in terms of large scale prodn. and commercialization prospects. Although GO can be easily prepd. by oxidn.-exfoliation of graphite in agitated solns., the size of these sheets is generally limited due to fragmentation along fault lines during chem. oxidn. and exfoliation in agitated solns. In this account, we discuss recent strategies which have been developed for the prepn. of large sized graphene oxide (LGO) sheets with lateral sizes >10 μm, using chem. expanded graphite as the starting material. LGO has a much lower d. of defects than GO prepd. using the conventional Hummers' method and can be readily transformed into graphene by chem. redn. In addn., the unique advantages of using LGO sheets as a performance enhancer are discussed. Finally, this review also discusses recent advances in the chem. and electrochem. redn. of graphene oxide.
- 25Yin, P. T.; Szach, S.; Chhowalla, M.; Lee, K.-B. Projektowanie, synteza i charakterystyka materiałów hybrydowych grafen-nanocząstka do biozastosowań. Chem. Rev. 2015, 115, 2483-2531, DOI: 10.1021/cr500537t[ACS Full Text
 ], [CAS], Google Scholar25https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2MXjtVSjs7s%253D&md5=043909061e1bb64f0c5d595077cb25f5Design, Synthesis, and Characterization of Graphene-Nanoparticle Hybrid Materials for BioapplicationsYin, Perry T.; Shah, Shreyas; Chhowalla, Manish; Lee, Ki-BumChemical Reviews (Washington, DC, United States) (2015), 115 (7), 2483-2531CODEN: CHREAY; ISSN:0009-2665. (American Chemical Society)A review.
], [CAS], Google Scholar25https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2MXjtVSjs7s%253D&md5=043909061e1bb64f0c5d595077cb25f5Design, Synthesis, and Characterization of Graphene-Nanoparticle Hybrid Materials for BioapplicationsYin, Perry T.; Shah, Shreyas; Chhowalla, Manish; Lee, Ki-BumChemical Reviews (Washington, DC, United States) (2015), 115 (7), 2483-2531CODEN: CHREAY; ISSN:0009-2665. (American Chemical Society)A review. - 26Mukherjee, S. P.; Lozano, N.; Kucki, M.; Del Rio-Castillo, A. E.; Newman, L.; Vázquez, E.; Kostarelos, K.; Wick, P.; Fadeel, B. Wykrywanie zanieczyszczenia endotoksynami materiałów na bazie grafenu za pomocą testu ekspresji TNF-α i wytycznych dotyczących produkcji tlenku grafenu wolnego od endotoksyn. PLoS One 2016, 11, e0166816, DOI: 10.1371/journal.pone.0166816[Crossref], [PubMed], [CAS], Google Scholar26https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2sXktVOltLc%253D&md5=1dd701d9306b1e3034f83e6741d5bbc4Detection of endotoxin contamination of graphene based materials using the TNF-α expression test and guidelines for endotoxin- free graphene oxide productionMukherjee, Sourav P.; Lozano, Neus; Kucki, Melanie; Del Rio-Castillo, Antonio E.; Newman, Leon; Vazquez, Ester; Kostarelos, Kostas; Wick, Peter; Fadeel, BengtPLoS One (2016), 11 (11), e0166816/1-e0166816/17CODEN: POLNCL; ISSN:1932-6203. (Public Library of Science)Nanomaterials may be contaminated with bacterial endotoxin during prodn. and handling, which may confound toxicol. testing of these materials, not least when assessing for immunotoxicity. In the present study, we evaluated the conventional Limulus amebocyte lysate (LAL) assay for endotoxin detection in graphene based material (GBM) samples, including graphene oxide (GO) and few-layered graphene (FLG). Our results showed that some GO samples interfered with various formats of the LAL assay. To overcome this problem, we developed a TNF-α expression test (TET) using primary human monocyte-derived macrophages incubated in the presence or absence of the endotoxin inhibitor, polymyxin B sulfate, and found that this assay, performed with non-cytotoxic doses of the GBM samples, enabled unequivocal detection of endotoxin with a sensitivity that is comparable to the LAL assay. FLG also triggered TNF-α prodn. in the presence of the LPS inhibitor, pointing to an intrinsic pro-inflammatory effect. Finally, we present guidelines for the prepn. of endotoxin-free GO, validated by using the TET.
- 27M. Cai; Thorpe, D.; Adamson, D. H.; Schniepp, H. C. Metody złuszczania grafitu. J. Mater. Chem. 2012, 22, 24992– 25002, DOI: 10.1039/c2jm34517j[Crossref], [CAS], Google Scholar27https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC38Xhs12ls7rK&md5=574d6181655b8628d94387327410a170Methods of graphite exfoliationCai, Minzhen; Thorpe, Daniel; Adamson, Douglas H.; Schniepp, Hannes C.Journal of Materials Chemistry (2012), 22 (48), 24992-25002CODEN: JMACEP; ISSN:0959-9428. (Royal Society of Chemistry)A review. For applications of two-dimensional graphene, com. viable sources are necessary. Exfoliation from bulk, stacked graphite is the most economical way to achieve large quantities of single layer graphene. A no. of methods have been developed to achieve exfoliation of graphite, each with advantages and disadvantages. In this review, we describe current exfoliation methods and techniques used to produce single layer materials from graphite precursors.
- 28Hernández-Sánchez, D.; M. Scardamaglia; Saucedo-Anaya, S.; Bittencourt, C.; Quintana, M. Złuszczanie grafitu i tlenku grafitu w wodzie chlorem e 6. RSC Adv. 2016, 6, 66634– 66640, DOI: 10.1039/C6RA13501C[Crossref], [CAS], Google Scholar28https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC28XhtFantLjF&md5=9bddd68531a305b6c96e4544e1db4415Exfoliation of graphite and graphite oxide in water by chlorin e6Hernandez-Sanchez, Dania; Scardamaglia, Mattia; Saucedo-Anaya, Sonia; Bittencourt, Carla; Quintana, MildredRSC Advances (2016), 6 (71), 66634-66640CODEN: RSCACL; ISSN:2046-2069. (Royal Society of Chemistry)Few layer graphene (FLG) and graphene oxide (GO) are considered important materials for the development of future technol. applications. Diverse strategies are followed for their synthesis and prodn. resulting in graphene materials with different processability, electronic, optical, mech., and chem. properties. In particular, many efforts are directed at the integration of FLG or GO with water dispersable functional mols. Recent advances in ultrasonication techniques have led to the control over the synthesis of carbon nanostructures using a versatile synthetic tool. Herein, we demonstrate the facile prepn. of two different types of chlorin e6 (Ce6) nanohybrids in biocompatible media: few-layer graphene (FLG-Ce6) and graphene oxide (GO-Ce6) in deionized water (DW) and phosphate buffered saline (PBS). The exfoliation is energetically driven by acoustic cavitation while mol. interactions are responsible for the stabilization of FLG and GO in water by Ce6. The nanohybrid materials might find applications in energy and biomedicine fields since the main photophys. features of Ce6, such as its efficient use of energy in the near IR region, its light harvesting properties, and its capacity for energy and electron transferring processes, are well preserved.
- 29Salunke, B. K.; Kim, B. S. Łatwa synteza grafenu metodą biologiczną. RSC Adv. 2016, 6, 17158–17162, DOI: 10.1039/C5RA25977K[Crossref], [CAS], Google Scholar29https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC28XitFeisro%253D&md5=e6e215c59b5424b18a071302cc9f0800Facile synthesis of graphene using a biological methodSalunke, Bipinchandra K.; Kim, Beom SooRSC Advances (2016), 6 (21), 17158-17162CODEN: RSCACL; ISSN:2046-2069. (Royal Society of Chemistry)A new, facile, low cost, environmentally safe process is demonstrated for the prodn. of few layer graphene by liq. phase exfoliation of graphite using exts. of medicinal plants in water. Plant exts. possibly function as bio-surfactants by creating a barrier in the aggregation by adsorbing on to the exposed surfaces of the graphite, weakening the attraction between the layers created by the van der Waals forces and allowing the graphite to slowly exfoliate in the form of undamaged flakes.
- 30Pattammattel, A.; Pande, P.; Kuttappan, D.; Apulia, M.; Basu, A. K.; Amalaradjou, M. A.; Kumar, C. V. Kontrolowanie interfejsu grafen-bio: dyspersje w surowicach zwierzęcych w celu zwiększenia stabilności i zmniejszenia toksyczności. Langmuir 2017, 33, 14184– 14194, DOI: 10.1021/acs.langmuir.7b02854[ACS Full Text
 ], [CAS], Google Scholar30https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2sXhvVWltrrP&md5=593a8c1624784bbdcff9d9bcc030e3a9Controlling the Graphene-Bio Interface: Dispersions in Animal Sera for Enhanced Stability and Reduced ToxicityPattammattel, Ajith; Pande, Paritosh; Kuttappan, Deepa; Puglia, Megan; Basu, Ashis K.; Amalaradjou, Mary Anne; Kumar, Challa V.Langmuir (2017), 33 (49), 14184-14194CODEN: LANGD5; ISSN:0743-7463. (American Chemical Society)Liq. phase exfoliation of graphite in six different animal sera and evaluation of its toxicity are reported here. Previously, we reported the exfoliation of graphene using proteins, and here we extend this approach to complex animal fluids. A kitchen blender with a high-turbulence flow gave high quality and max. exfoliation efficiency in all sera tested, when compared to the values found with shear and ultrasonication methods. Raman spectra and electron microscopy confirmed the formation of three- or four-layer, submicrometer size graphene, independent of the serum used. Graphene prepd. in serum was directly transferred to cell culture media without post-treatments. Contrary to many reports, a nanotoxicity study of this graphene fully dispersed to human embryonic kidney cells, human lung cancer cells, and nematodes (Caenorhabditis elegans) showed no acute toxicity for up to 7 days at various doses (50-500 μg/mL), but prolonged exposure at higher doses (300-500 μg/mL, 10-15 days) showed cytotoxicity to cells (∼95% death) and reproductive toxicity to C. elegans (5-10% redn. in brood size). The origin of toxicity was found to be due to the highly fragmented smaller graphene sheets (<200 nm), while the larger sheets were nontoxic (50-300 μg/mL dose). In contrast, graphene produced with sodium cholate as the mediator has been found to be cytotoxic to these cells at these dosages. We demonstrated the toxicity of liq. phase exfoliated graphene is attributed to highly fragmented fractions or nonbiocompatible exfoliating agents. Thus, low-toxicity graphene/serum suspensions are produced by a facile method in biol. media, and this approach may accelerate the much-anticipated development of graphene for biol. applications.
], [CAS], Google Scholar30https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2sXhvVWltrrP&md5=593a8c1624784bbdcff9d9bcc030e3a9Controlling the Graphene-Bio Interface: Dispersions in Animal Sera for Enhanced Stability and Reduced ToxicityPattammattel, Ajith; Pande, Paritosh; Kuttappan, Deepa; Puglia, Megan; Basu, Ashis K.; Amalaradjou, Mary Anne; Kumar, Challa V.Langmuir (2017), 33 (49), 14184-14194CODEN: LANGD5; ISSN:0743-7463. (American Chemical Society)Liq. phase exfoliation of graphite in six different animal sera and evaluation of its toxicity are reported here. Previously, we reported the exfoliation of graphene using proteins, and here we extend this approach to complex animal fluids. A kitchen blender with a high-turbulence flow gave high quality and max. exfoliation efficiency in all sera tested, when compared to the values found with shear and ultrasonication methods. Raman spectra and electron microscopy confirmed the formation of three- or four-layer, submicrometer size graphene, independent of the serum used. Graphene prepd. in serum was directly transferred to cell culture media without post-treatments. Contrary to many reports, a nanotoxicity study of this graphene fully dispersed to human embryonic kidney cells, human lung cancer cells, and nematodes (Caenorhabditis elegans) showed no acute toxicity for up to 7 days at various doses (50-500 μg/mL), but prolonged exposure at higher doses (300-500 μg/mL, 10-15 days) showed cytotoxicity to cells (∼95% death) and reproductive toxicity to C. elegans (5-10% redn. in brood size). The origin of toxicity was found to be due to the highly fragmented smaller graphene sheets (<200 nm), while the larger sheets were nontoxic (50-300 μg/mL dose). In contrast, graphene produced with sodium cholate as the mediator has been found to be cytotoxic to these cells at these dosages. We demonstrated the toxicity of liq. phase exfoliated graphene is attributed to highly fragmented fractions or nonbiocompatible exfoliating agents. Thus, low-toxicity graphene/serum suspensions are produced by a facile method in biol. media, and this approach may accelerate the much-anticipated development of graphene for biol. applications. - 31Liu, X.; Liu, J.; Zhan, D.; Yan, J.; Wang, J.; Chao, D.; Lai, L.; Chen, M.; J. Yin; Shen, Z. Wielokrotne złuszczanie mikrofalowe grafitu ekspandowalnego do przygotowania wielowarstwowego grafenu na dużą skalę i wysokiej jakości. RSC Adv. 2013, 3, 11601– 11606, DOI: 10.1039/c3RA22673E[Crossref], [CAS], Google Scholar31https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3sXhtVarurbJ&md5=5c933e6ce3e1935d62c9ba6cfaf56d2fRepeated microwave-assisted exfoliation of expandable graphite for the preparation of large scale and high quality multi-layer grapheneLiu, Xiaoxu; Liu, Jilei; Zhan, Da; Yan, Jiaxu; Wang, Jin; Chao, Dongliang; Lai, Linfei; Chen, Minghua; Yin, Jinghua; Shen, ZexiangRSC Advances (2013), 3 (29), 11601-11606CODEN: RSCACL; ISSN:2046-2069. (Royal Society of Chemistry)The increasing demand for graphene's industrial application requires a new route for its mass prodn. with high quality. Here, we report a facile, green, highly efficient and cost effective method for prepg. a large amt. of high quality graphene flakes, which is by the repeated microwave assisted exfoliation of expandable graphite (EG). The successful exfoliation of graphite is realized through the intercalation and decompn. of eco-friendly chems. with the assistance of a microwave source. The chem. morphol. and electrocatalytic performance analyses reveal that the graphene flakes are of high quality with little degrdn.
- 32León, V.; González-Domínguez, J. M.; Fierro, J. L. G.; Prato, M.; Vázquez, E. Produkcja i stabilność mechanochemicznie złuszczonego grafenu w wodzie i pożywkach hodowlanych. Nanoskala 2016, 8, 14548–14555, DOI: 10.1039/C6NR03246J
- 33González-Domínguez, J. M.; León, V.; Lucío, M. I.; Prato, M.; Vázquez, E. Produkcja gotowego do użycia grafenu kilkuwarstwowego w zawiesinach wodnych. Nat. Protoc. 2018, 13, 495–506, DOI: 10.1038/nprot.2017.142[Crossref], [PubMed], [CAS], Google Scholar33https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC1cXisl2kurc%253D&md5=e61c3385dd08691bbb536312046671b2Production of ready-to-use few-layer graphene in aqueous suspensionsGonzalez-Dominguez, Jose M.; Leon, Veronica; Lucio, Maria Isabel; Prato, Maurizio; Vazquez, EsterNature Protocols (2018), 13 (3), 495-506CODEN: NPARDW; ISSN:1750-2799. (Nature Research)A review. Graphene has promising phys. and chem. properties such as high strength and flexibility, coupled with high elec. and thermal conductivities. It is therefore being incorporated into polymer-based composites for use in electronics and photonics applications. A main constraint related to the graphene development is that, being of a strongly hydrophobic nature, almost all dispersions (usually required for its handling and processing toward the desired application) are prepd. in poisonous org. solvents such as N-Me pyrrolidone or N,N-DMF. Here, we describe how to prep. exfoliated graphite using a ball mill. The graphene produced is three to four layers thick and ~ 500 nm in diam. on av., as measured by electron microscopy and Raman spectroscopy; can be stored in the form of light solid; and is easily dispersed in aq. media. Our methodol. consists of four main steps: (i) the mechanochem. intercalation of org. mols. (melamine) into graphite, followed by suspension in water; (ii) the washing of suspended graphene to eliminate most of the melamine; (iii) the isolation of stable graphene sheets; and (iv) freeze-drying to obtain graphene powder. This process takes 6-7 or 9-10 d for aq. suspensions and dry powders, resp. The product has well-defined properties and can be used for many science and technol. applications, including toxicol. impact assessment and the prodn. of innovative medical devices.
- 34Amiri, A.; Zubir, M. N. M.; Dimiev, A. M.; Teng, K. H.; Shanbedi, M.; Kazi, S. N.; Rozali, S. B. Łatwa, przyjazna dla środowiska, opłacalna i skalowalna produkcja kilkuwarstwowego grafenu. Chem. inż. J. 2017, 326, 1105–1115, DOI: 10.1016/j.cej.2017.06.046[Crossref], [CAS], Google Scholar34https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2sXhtVerurbN&md5=fe3292a79cf23b3c2741949d87a97251Facile, environmentally friendly, cost effective and scalable production of few-layered grapheneAmiri, Ahmad; Zubir, Mohd. Nashrul Mohd.; Dimiev, Ayrat M.; Teng, K. H.; Shanbedi, Mehdi; Kazi, S. N.; Bin Rozali, ShaifulazuarChemical Engineering Journal (Amsterdam, Netherlands) (2017), 326 (), 1105-1115CODEN: CMEJAJ; ISSN:1385-8947. (Elsevier B.V.)Commercialization of graphene is still one the biggest challenges in the carbon field despite the development of several methods for its prodn. The lack of simple, cost-effective and scalable methods for mass-prodn. of graphene hampers its promotion to the market. Here, we propose a new method for large-scale prodn. of mono- and few-layered graphene via liq. phase exfoliation with the use of wet ball milling in the presence of org. solvents at extremely low temps. The wet ball milling combined with the temp. modulated high surface energy solvents affords exfoliation of bulk graphite into graphenes in a fast, scalable, cost effective and environmentally friendly process. The thorough statistical anal. of as-prepd. graphene flakes demonstrates that more than 61% of the flakes comprise less than 5 layers, while ∼14% of the flakes were monolayer graphene. Combined with the ∼30% yield of few-layer graphene out of the graphite precursor, this method demonstrates incredible efficiency in just 45 min. In the presence of methanol, our method results in formation of predominantly bi-layer graphene, which is more difficult to obtain in scalable fashion, than mono-layer graphene. The high quality of as-obtained graphenes is fully confirmed by Raman spectroscopy, TEM, SAED, AFM and XPS.
- 35Ali-Boucetta, H.; Bitounis, D.; Raveendran-Nair, R.; Sługa, A.; Van den Bossche, J.; Kostarelos, K. Oczyszczone dyspersje tlenku grafenu nie wykazują cytotoksyczności in vitro i patogeniczności in vivo. Adv. Healthcare Mater. 2013, 2, 433–441, DOI: 10.1002/adhm.201200248[Crossref], [PubMed], [CAS], Google Scholar35https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3sXjsVKgs7s%253D&md5=3e6408260ebe6fc5dc657565da84213fPurified Graphene Oxide Dispersions Lack In Vitro Cytotoxicity and In Vivo PathogenicityAli-Boucetta, Hanene; Bitounis, Dimitrios; Raveendran-Nair, Rahul; Servant, Ania; Van den Bossche, Jeroen; Kostarelos, KostasAdvanced Healthcare Materials (2013), 2 (3), 433-441CODEN: AHMDBJ; ISSN:2192-2640. (Wiley-VCH Verlag GmbH & Co. KGaA)Prompted by the excitement from the description of single layer graphene, increased attention for potential applications in the biomedical field was recently placed on graphene oxide (GO). Detn. of the opportunities and limitations that GO offers in biomedicine are particularly prone to inaccuracies due to wide variability in the prepn. methodologies of GO material in different labs., that results in significant variation in the purity of the material and the yield of the oxidn. reactions, primarily the Hummers method used. Herein, the fabrication of highly pure, colloidally stable, and evenly dispersed GO in physiol.-relevant aq. buffers in comparison to conventional GO is investigated. The purified GO material is thoroughly characterized by a battery of techniques, and is shown to consist of single layer GO sheets of lateral dimensions below 500 nm. The cytotoxic impact of the GO in vitro and its inflammation profile in vivo is investigated. The purified GO prepd. and characterized here does not induce significant cytotoxic responses in vitro, or inflammation and granuloma formation in vivo following i.p. injection. This is one of the initial steps towards detn. of the safety risks assocd. with GO material that may be interacting with living tissue.
- 36Jasim, D. A.; Lozano, N.; Kostarelos, K. Synteza kilkuwarstwowych, wysokiej czystości arkuszy tlenku grafenu z różnych źródeł grafitu dla biologii. Mater 2D. 2016, 3, 014006, DOI: 10.1088/2053-1583/3/1/014006[Crossref], [CAS], Google Scholar36https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2sXls1elsb4%253D&md5=4a6e49132ce830f1ec262f79a05a0f2cSynthesis of few-layered, high-purity graphene oxide sheets from different graphite sources for biologyJasim, Dhifaf A.; Lozano, Neus; Kostarelos, Kostas2D Materials (2016), 3 (1), 014006/1-014006/17CODEN: DMATB7; ISSN:2053-1583. (IOP Publishing Ltd.)This work aimed to interrogate the role that the starting graphitic material played on the physicochem. properties of graphene oxide (GO) sheets and their impact on mammalian cell viability following exposure to those flakes. Three different GO thin sheets were synthesized from three starting graphite material: flakes (GO-f), ground (GO-g) and powder (GO-p) using a modified Hummers' method. The synthetic yield of this methodol. was found to differ according to type of starting material, with GO-p resulting in most efficient yields. Structural and morphol. comparison of the three GO sheet types were carried out using transmission electron microscopy and at. force microscopy. Optical properties were measured using UV/visible and fluorescence spectroscopy. Surface characteristics and chem. were detd. using a battery of techniques. Exposure to human cells was studied using the human A549 lung epithelial cultures. Our results revealed that all three GO samples were composed of few-layer sheets with similar physicochem. and surface characteristics. However, significant differences were obsd. in terms of their lateral dimensions with GO-p, prepd. from graphite powder, being the largest among the GOs. No cytotoxicity was detected for any of the GO samples following exposure onto A549 cells up to 48 h. In conclusion, the form and type of the starting graphite material is shown to be an important factor that can det. the synthetic yield and the structural characteristics of the resulting GO sheets.
- 37Coleman, B. R.; Rycerz, T.; Gies, V.; Jakubek, Z. J.; Zou, S. Manipulacja i kwantyfikacja wielkości płatka tlenku grafenu: fotoluminescencja i cytotoksyczność. ACS Appl. Mater. Interfejsy 2017, 9, 28911– 28921, DOI: 10.1021/acsami.7b08585[ACS Full Text
 ], [CAS], Google Scholar37https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2sXht1Oht7fE&md5=27c39812226b072bee39604d18d5f046Manipulation and Quantification of Graphene Oxide Flake Size: Photoluminescence and CytotoxicityColeman, Brian R.; Knight, Timothy; Gies, Valerie; Jakubek, Zygmunt J.; Zou, ShanACS Applied Materials & Interfaces (2017), 9 (34), 28911-28921CODEN: AAMICK; ISSN:1944-8244. (American Chemical Society)Single-layered graphene oxide (GO) has exhibited great promise in the areas of sensing, membrane filtration, supercapacitors, bioimaging, and therapeutic carriers because of its biocompatibility, large surface area, and electrochem., photoluminescent, and optical properties. To elucidate how the phys. dimensions of GO affect its intrinsic properties, the authors employed sonication to produce >130 different sizes of GO in aq. dispersion and implemented new approaches to characterize various GO properties as a function of the av. flake size. New protocols were developed to det. and compare the flake size of GO dispersions sonicated with energies up to 20 MJ/g by using dynamic light scattering and at. force microscopy (AFM). The relation between the av. flake size and sonication energy per unit mass of GO was obsd. to follow a power law. AFM height measurements showed that the sonication of GO yielded monolayered flakes. Luminescence of GO was characterized as a function of the sonication energy (or the av. flake size which is the monotonic function of the sonication energy), excitation wavelength, and pH of the dispersion. The strong dependence of the luminescence intensity on pH control and the variation of the luminescence intensity with different flake sizes were obsd. An intense luminescence signal, likely related to the sepn. of the oxidative debris from the GO framework, was found at the highest sonication energies (E ⪆ 15 MJ/g) or under extremely alk. conditions (pH ⪆ 11). The cytotoxicity of GO was studied with various flake sizes. Size- and concn.-dependent cytotoxicity was obsd. for cell lines NIH 3T3 and A549. The NIH 3T3 cell line also demonstrated time-dependent cytotoxicity.
], [CAS], Google Scholar37https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2sXht1Oht7fE&md5=27c39812226b072bee39604d18d5f046Manipulation and Quantification of Graphene Oxide Flake Size: Photoluminescence and CytotoxicityColeman, Brian R.; Knight, Timothy; Gies, Valerie; Jakubek, Zygmunt J.; Zou, ShanACS Applied Materials & Interfaces (2017), 9 (34), 28911-28921CODEN: AAMICK; ISSN:1944-8244. (American Chemical Society)Single-layered graphene oxide (GO) has exhibited great promise in the areas of sensing, membrane filtration, supercapacitors, bioimaging, and therapeutic carriers because of its biocompatibility, large surface area, and electrochem., photoluminescent, and optical properties. To elucidate how the phys. dimensions of GO affect its intrinsic properties, the authors employed sonication to produce >130 different sizes of GO in aq. dispersion and implemented new approaches to characterize various GO properties as a function of the av. flake size. New protocols were developed to det. and compare the flake size of GO dispersions sonicated with energies up to 20 MJ/g by using dynamic light scattering and at. force microscopy (AFM). The relation between the av. flake size and sonication energy per unit mass of GO was obsd. to follow a power law. AFM height measurements showed that the sonication of GO yielded monolayered flakes. Luminescence of GO was characterized as a function of the sonication energy (or the av. flake size which is the monotonic function of the sonication energy), excitation wavelength, and pH of the dispersion. The strong dependence of the luminescence intensity on pH control and the variation of the luminescence intensity with different flake sizes were obsd. An intense luminescence signal, likely related to the sepn. of the oxidative debris from the GO framework, was found at the highest sonication energies (E ⪆ 15 MJ/g) or under extremely alk. conditions (pH ⪆ 11). The cytotoxicity of GO was studied with various flake sizes. Size- and concn.-dependent cytotoxicity was obsd. for cell lines NIH 3T3 and A549. The NIH 3T3 cell line also demonstrated time-dependent cytotoxicity. - 38Orecchioni, M.; Jasim, D. A.; Pescatori, M.; Manetti, R.; Fozza, C.; F. Sgarrella; Bedognetti, D.; Bianco, A.; Kostarelos, K.; Delogu, L. G. Molekularny i genomiczny wpływ dużych i małych arkuszy tlenku grafenu o dużym i małym wymiarze bocznym na ludzkie komórki odpornościowe od zdrowych dawców. Adv. Healthcare Mater. 2016, 5, 276–287, DOI: 10.1002/adhm.201500606[Crossref], [PubMed], [CAS], Google Scholar38https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2MXitVCqs77N&md5=37832613234885afb65fdc90cbcc7100Molecular and Genomic Impact of Large and Small Lateral Dimension Graphene Oxide Sheets on Human Immune Cells from Healthy DonorsOrecchioni, Marco; Jasim, Dhifaf A.; Pescatori, Mario; Manetti, Roberto; Fozza, Claudio; Sgarrella, Francesco; Bedognetti, Davide; Bianco, Alberto; Kostarelos, Kostas; Delogu, Lucia GemmaAdvanced Healthcare Materials (2016), 5 (2), 276-287CODEN: AHMDBJ; ISSN:2192-2640. (Wiley-VCH Verlag GmbH & Co. KGaA)Graphene oxide (GO) is attracting great interest in biomedical sciences. The impact of GO on immune cells is one fundamental area of study that is often overlooked, but crit. in terms of clin. translation. This work investigates the effects of two types of thoroughly characterized GO sheets, different in their lateral dimension, on human peripheral immune cells provided from healthy donors using a wide range of assays. After evaluation of cell viability, the gene expression was analyzed, following GO exposure on 84 genes related to innate and adaptive immune responses. Exposure to GO small sheets was found to have a more significant impact on immune cells compared to GO large sheets, reflected in the upregulation of crit. genes implicated in immune responses and the release of cytokines IL1β and TNFα. These findings were further confirmed by whole-genome microarray anal. of the impact of small GO sheets on T cells and monocytes. Activation in both cell types was underlined by the overexpression of genes such as CXCL10 and receptor CXCR3. Significant energy-dependent pathway modulation was identified. These findings can potentially pave the foundations for further design of graphene that can be used for immune modulation applications, for example in cancer immunotherapy.
- 39Mukherjee, S. P.; Kostarelos, K.; Fadeel, B. Profilowanie cytokin pierwotnych ludzkich makrofagów narażonych na wolny od endotoksyn tlenek grafenu: niezależna od wielkości aktywacja inflamasomu NLRP3. Adv. Healthcare Mater. 2018, 7, 1700815, DOI: 10.1002/adhm.201700815
- 40Jasim, D. A.; Boutin, H.; Fairclough, M.; Ménard-Moyon, C.; Prenant, C.; Bianco, A.; Kostarelos, K. Grubość funkcjonalizowanych arkuszy tlenku grafenu odgrywa kluczową rolę w gromadzeniu się tkanek i wydalaniu z moczem: pilotażowe badanie PET / CT. Appl. Mater. Dzisiaj 2016, 4, 24–30, DOI: 10.1016/j.apmt.2016.04.003
- 41Jasim, D. A.; Murphy, S.; Newman, L.; Mironov, A.; Prestat, E.; McCaffrey, J.; Ménard-Moyon, C.; Rodrigues, A. F.; Bianco, A.; Haigh, S.; Lennon, R.; Kostarelos, K. Wpływ rozległej filtracji kłębuszkowej cienkich arkuszy tlenku grafenu na fizjologię nerek. ACS Nano 2016, 10, 10753– 10767, DOI: 10.1021/acsnano.6b03358[ACS Full Text
 ], [CAS], Google Scholar41https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC28XhvFGgsr%252FO&md5=4a367d90400726d1685a155534147362The Effects of Extensive Glomerular Filtration of Thin Graphene Oxide Sheets on Kidney PhysiologyJasim, Dhifaf A.; Murphy, Stephanie; Newman, Leon; Mironov, Aleksandr; Prestat, Eric; McCaffrey, James; Menard-Moyon, Cecilia; Rodrigues, Artur Filipe; Bianco, Alberto; Haigh, Sarah; Lennon, Rachel; Kostarelos, KostasACS Nano (2016), 10 (12), 10753-10767CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)Understanding how two-dimensional (2D) nanomaterials interact with the biol. milieu is fundamental for their development towards biomedical applications. When thin, individualized GO sheets were administered i.v. in mice, extensive urinary excretion was obsd., to indicate rapid transit across the glomerular filtration barrier (GFB). A detailed anal. of kidney function, histopathol. and ultrastructure was performed, along with the in vitro responses of two highly specialized GFB cells (glomerular endothelial cells and podocytes) following exposure to GO. The authors investigated whether these cells preserved their unique barrier function at doses 100 times greater than the dose expected to reach the GFB in vivo. Both serum and urine analyses revealed that there was no impairment of kidney function up to one month after injection of GO at escalating doses. Histol. examn. suggested no damage to the glomerular and tubular regions of the kidneys. Ultrastructural anal. by TEM showed absence of damage, with no change in the size of podocyte slits, endothelial cell fenestra, or the glomerular basement membrane. The endothelial and podocyte cell cultures regained their full barrier function after >48 h of GO exposure and cellular uptake was significant in both cell types after 24 h. This study provided previously unreported understanding of the interaction between thin GO sheets with different components of the GFB in vitro and in vivo to highlight that the glomerular excretion of significant amts. of GO did not induce any signs of acute nephrotoxicity or glomerular barrier dysfunction.
], [CAS], Google Scholar41https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC28XhvFGgsr%252FO&md5=4a367d90400726d1685a155534147362The Effects of Extensive Glomerular Filtration of Thin Graphene Oxide Sheets on Kidney PhysiologyJasim, Dhifaf A.; Murphy, Stephanie; Newman, Leon; Mironov, Aleksandr; Prestat, Eric; McCaffrey, James; Menard-Moyon, Cecilia; Rodrigues, Artur Filipe; Bianco, Alberto; Haigh, Sarah; Lennon, Rachel; Kostarelos, KostasACS Nano (2016), 10 (12), 10753-10767CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)Understanding how two-dimensional (2D) nanomaterials interact with the biol. milieu is fundamental for their development towards biomedical applications. When thin, individualized GO sheets were administered i.v. in mice, extensive urinary excretion was obsd., to indicate rapid transit across the glomerular filtration barrier (GFB). A detailed anal. of kidney function, histopathol. and ultrastructure was performed, along with the in vitro responses of two highly specialized GFB cells (glomerular endothelial cells and podocytes) following exposure to GO. The authors investigated whether these cells preserved their unique barrier function at doses 100 times greater than the dose expected to reach the GFB in vivo. Both serum and urine analyses revealed that there was no impairment of kidney function up to one month after injection of GO at escalating doses. Histol. examn. suggested no damage to the glomerular and tubular regions of the kidneys. Ultrastructural anal. by TEM showed absence of damage, with no change in the size of podocyte slits, endothelial cell fenestra, or the glomerular basement membrane. The endothelial and podocyte cell cultures regained their full barrier function after >48 h of GO exposure and cellular uptake was significant in both cell types after 24 h. This study provided previously unreported understanding of the interaction between thin GO sheets with different components of the GFB in vitro and in vivo to highlight that the glomerular excretion of significant amts. of GO did not induce any signs of acute nephrotoxicity or glomerular barrier dysfunction. - 42Rodrigues, A. F.; Newman, L.; Lozano, N.; Mukherjee, S. P.; Fadeel, B.; Bussy, C.; Kostarelos, K. Plan syntezy i charakterystyki cienkiego tlenku grafenu o kontrolowanych wymiarach bocznych dla biomedycyny. Mater 2D. 2018, 5, 035020, DOI: 10.1088/2053-1583/aac05c[Crossref], [CAS], Google Scholar42https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC1MXlt1SjsLw%253D&md5=ffd7895f0a265119f3ae8d8b21f2978dA blueprint for the synthesis and characterisation of thin graphene oxide with controlled lateral dimensions for biomedicineRodrigues, Artur Filipe; Newman, Leon; Lozano, Neus; Mukherjee, Sourav P.; Fadeel, Bengt; Bussy, Cyrill; Kostarelos, Kostas2D Materials (2018), 5 (3), 035020/1-035020/19CODEN: DMATB7; ISSN:2053-1583. (IOP Publishing Ltd.)Graphene-based materials (GBMs) have ignited a revolution in material science and technol., with electronic, optical and mech. properties that are of relevant interest for a wide range of applications. To support the development of these enabling technologies, a global research effort has been invested to assess their hazard and biocompatibility. The aim of the present work was to produce a blueprint for the synthesis and characterization of non-pyrogenic graphene oxide (GO) flakes with three different controlled lateral dimensions, which could be further used for either hazard assessment or biomedical proof-of-concept studies. A battery of techniques used to characterize the physicochem. properties of the GO samples included at. force microscopy, transmission electron microscopy, Fourier-transformed infra-red spectroscopy, XPS and Raman spectroscopy. The combination of these different techniques confirmed that only the lateral dimension varied among the GO materials produced, without significant change in any other of their fundamental physicochem. properties, such as the thickness or surface chem. The proposed systematic approach in GO batch prodn. for biol. will hopefully contribute to a better understanding of the material properties that govern their interactions with biol. systems and offer a blueprint towards standardisation of biol. relevant 2D materials.
- 43De Silva, K. K. H.; Huang, H.-H.; Joshi, R. K.; Yoshimura, M. Chemiczna redukcja tlenku grafenu za pomocą zielonych reduktorów. Węgiel 2017, 119, 190–199, DOI: 10.1016/j.carbon.2017.04.025[Crossref], [CAS], Google Scholar43https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2sXmsVeitro%253D&md5=0befcbbeeacb817a7bab60bb245a9983Chemical reduction of graphene oxide using green reductantsDe Silva, K. K. H.; Huang, H.-H.; Joshi, R. K.; Yoshimura, M.Carbon (2017), 119 (), 190-199CODEN: CRBNAH; ISSN:0008-6223. (Elsevier Ltd.)Graphene has exceptional phys., chem., mech., thermal and optical properties which offer huge potential for applications in various sectors. Chem. oxidn. of graphite to graphene oxide followed by the redn. process is the commonly used method for mass scale prodn. of graphene or reduced graphene oxide (RGO). Among the large no. of chem. reducing agents used to prep. RGO or graphene, the most efficient reductant is hydrazine. It is toxic in nature and harmful to the environment, thus it is in high demand to use green reductants for RGO synthesis. We understand that due to high demand of graphene/graphene oxide/reduced graphene oxide recently and which is expected to be more in future, green synthesis methods are extremely important. In this article, we have studied the synthesis methods, characterization and the possible mechanism for green redn., esp. by ascorbic acid. This article could possibly motivate the researcher worldwide to innovate new green methods for mass scale prodn. of graphene based materials.
- 44Fernández-Merino, M. J.; Guardia, L.; Paredes, J. I.; Villar-Rodil, S.; Solís-Fernández, P.; Martínez-Alonso, A.; Tascón, J. M. D. Witamina C jest idealnym substytutem hydrazyny w redukcji zawiesin tlenku grafenu. J. Phys. Chem. C 2010, 114, 6426–6432, DOI: 10.1021/jp100603h[ACS Full Text
 ], [CAS], Google Scholar44https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3cXislyru78%253D&md5=0ef03b756a33ff86a953803c1ab6f6abVitamin C Is an Ideal Substitute for Hydrazine in the Reduction of Graphene Oxide SuspensionsFernandez-Merino, M. J.; Guardia, L.; Paredes, J. I.; Villar-Rodil, S.; Solis-Fernandez, P.; Martinez-Alonso, A.; Tascon, J. M. D.Journal of Physical Chemistry C (2010), 114 (14), 6426-6432CODEN: JPCCCK; ISSN:1932-7447. (American Chemical Society)The prepn. of soln.-processable graphene from graphite oxide typically involves a hydrazine redn. step, but the use of such a reagent in the large-scale implementation of this approach is not desirable due to its high toxicity. Here, we compare the deoxygenation efficiency of graphene oxide suspensions by different reductants (sodium borohydride, pyrogallol, and vitamin C, in addn. to hydrazine), as well as by heating the suspensions under alk. conditions. In almost all cases, the degree of redn. attainable and the subsequent restoration of relevant properties (e.g., elec. cond.) lag significantly behind those achieved with hydrazine. Only vitamin C is found to yield highly reduced suspensions in a way comparable to those provided by hydrazine. Stable suspensions of vitamin C-reduced graphene oxide can be prepd. not only in water but also in common org. solvents, such as N,N-dimethylformamide (DMF) or N-methyl-2-pyrrolidone (NMP). These results open the perspective of replacing hydrazine in the redn. of graphene oxide suspensions by an innocuous and safe reductant of similar efficacy, thus facilitating the use of graphene-based materials for large-scale applications.
], [CAS], Google Scholar44https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3cXislyru78%253D&md5=0ef03b756a33ff86a953803c1ab6f6abVitamin C Is an Ideal Substitute for Hydrazine in the Reduction of Graphene Oxide SuspensionsFernandez-Merino, M. J.; Guardia, L.; Paredes, J. I.; Villar-Rodil, S.; Solis-Fernandez, P.; Martinez-Alonso, A.; Tascon, J. M. D.Journal of Physical Chemistry C (2010), 114 (14), 6426-6432CODEN: JPCCCK; ISSN:1932-7447. (American Chemical Society)The prepn. of soln.-processable graphene from graphite oxide typically involves a hydrazine redn. step, but the use of such a reagent in the large-scale implementation of this approach is not desirable due to its high toxicity. Here, we compare the deoxygenation efficiency of graphene oxide suspensions by different reductants (sodium borohydride, pyrogallol, and vitamin C, in addn. to hydrazine), as well as by heating the suspensions under alk. conditions. In almost all cases, the degree of redn. attainable and the subsequent restoration of relevant properties (e.g., elec. cond.) lag significantly behind those achieved with hydrazine. Only vitamin C is found to yield highly reduced suspensions in a way comparable to those provided by hydrazine. Stable suspensions of vitamin C-reduced graphene oxide can be prepd. not only in water but also in common org. solvents, such as N,N-dimethylformamide (DMF) or N-methyl-2-pyrrolidone (NMP). These results open the perspective of replacing hydrazine in the redn. of graphene oxide suspensions by an innocuous and safe reductant of similar efficacy, thus facilitating the use of graphene-based materials for large-scale applications. - 45Zhu, C.; Guo, S.; Fang, Y.; Dong, S. Cukier redukujący: nowe cząsteczki funkcjonalne do zielonej syntezy nanoarkuszy grafenu. ACS Nano 2010, 4, 2429– 2437, DOI: 10.1021/nn1002387[ACS Full Text
 ], [CAS], Google Scholar45https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3cXktVyhsLc%253D&md5=987145bec0dcae1681985d0b88bfc77aReducing sugar: new functional molecules for the green synthesis of graphene nanosheetsZhu, Chengzhou; Guo, Shaojun; Fang, Youxing; Dong, ShaojunACS Nano (2010), 4 (4), 2429-2437CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)In this paper, we developed a green and facile approach to the synthesis of chem. converted graphene nanosheets (GNS) based on reducing sugars, such as glucose, fructose and sucrose using exfoliated graphite oxide (GO) as precursor. The obtained GNS is characterized with at. force microscopy, UV-visible absorption spectroscopy, transmission electron microscopy, XPS, and so on. The merit of this method is that both the reducing agents themselves and the oxidized products are environmentally friendly. It should be noted that, besides the mild redn. capability to GO, the oxidized products of reducing sugars could also play an important role as a capping reagent in stabilizing as-prepd. GNS simultaneously, which exhibited good stability in water. This approach can open up the new possibility for prepg. GNS in large-scale prodn. alternatively. Moreover, it is found that GNS-based materials could be of great value for applications in various fields, such as good electrocatalytic activity toward catecholamines (dopamine, epinephrine, and norepinephrine).
], [CAS], Google Scholar45https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3cXktVyhsLc%253D&md5=987145bec0dcae1681985d0b88bfc77aReducing sugar: new functional molecules for the green synthesis of graphene nanosheetsZhu, Chengzhou; Guo, Shaojun; Fang, Youxing; Dong, ShaojunACS Nano (2010), 4 (4), 2429-2437CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)In this paper, we developed a green and facile approach to the synthesis of chem. converted graphene nanosheets (GNS) based on reducing sugars, such as glucose, fructose and sucrose using exfoliated graphite oxide (GO) as precursor. The obtained GNS is characterized with at. force microscopy, UV-visible absorption spectroscopy, transmission electron microscopy, XPS, and so on. The merit of this method is that both the reducing agents themselves and the oxidized products are environmentally friendly. It should be noted that, besides the mild redn. capability to GO, the oxidized products of reducing sugars could also play an important role as a capping reagent in stabilizing as-prepd. GNS simultaneously, which exhibited good stability in water. This approach can open up the new possibility for prepg. GNS in large-scale prodn. alternatively. Moreover, it is found that GNS-based materials could be of great value for applications in various fields, such as good electrocatalytic activity toward catecholamines (dopamine, epinephrine, and norepinephrine). - 46Haghighi, B.; Tabrizi, M. A. Zielona synteza nanoarkuszy zredukowanego tlenku grafenu przy użyciu wody różanej oraz badanie ich właściwości i zastosowań. RSC Adv. 2013, 3, 13365–13371, DOI: 10.1039/c3RA40856F[Crossref], [CAS], Google Scholar46https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3sXhtFeqtr7J&md5=bf4618e21465fed2afab624ad246c943Green-synthesis of reduced graphene oxide nanosheets using rose water and a survey on their characteristics and applicationsHaghighi, Behzad; Tabrizi, Mahmoud AmouzadehRSC Advances (2013), 3 (32), 13365-13371CODEN: RSCACL; ISSN:2046-2069. (Royal Society of Chemistry)Rose water as a green reducing and stabilizing agent is introduced and used for the chem. redn. of exfoliated graphite oxide (GO) and the synthesis of reduced graphene oxide nanosheets (RGONs). The prepd. materials are characterized with UV-visible absorption spectroscopy, Fourier transform IR spectroscopy, Raman spectroscopy, at. force microscopy (AFM), SEM, transmission electron microscopy and X-ray diffraction (XRD). The results of XRD anal. show that the oxygen contg. functional groups of exfoliated GO have been removed remarkably after its redn. by rose water. AFM and Raman spectroscopy results indicate that the exfoliated GO has been reduced to monolayer RGONs. Electrochem. impedance spectroscopy measurements show that the rate of electron transfer of the redox probe on prepd. RGONs is much higher than that obsd. on exfoliated GO, indicating the capability of the proposed method for the prodn. of RGONs. Moreover, excellent electrocatalytic activity towards catechol, NAD and immobilized glucose oxidase is obsd. on a glassy carbon electrode modified with RGONs, indicating the applicability of the prepd. RGONs for the fabrication of sensors and biosensors.
- 47Akhavan, O.; Ghaderi, E. Bakterie Escherichia coli redukują tlenek grafenu do bakteriobójczego grafenu w sposób samoograniczający. Węgiel 2012, 50, 1853–1860, DOI: 10.1016/j.carbon.2011.12.035[Crossref], [CAS], Google Scholar47https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC38XhvFOjtbo%253D&md5=29ab29625c1dc9194813f9448af9e6d0Escherichia coli bacteria reduce graphene oxide to bactericidal graphene in a self-limiting mannerAkhavan, O.; Ghaderi, E.Carbon (2012), 50 (5), 1853-1860CODEN: CRBNAH; ISSN:0008-6223. (Elsevier Ltd.)Interactions of chem. exfoliated graphene oxide (GO) nanosheets and Escherichia coli bacteria living in mixed-acid fermn. with an anaerobic condition were investigated for different exposure times. XPS showed that as the exposure time increased (from 0 to 48 h), the oxygen-contg. functional groups of the GO decreased by ∼60%, indicating a relative chem. redn. of the sheets by interaction with the bacteria. Raman spectroscopy and current-voltage measurement confirmed the redn. of the GO exposed to the bacteria. The redn. was believed to be due to the metabolic activity of the surviving bacteria through their glycolysis process. It was found that the GO sheets could act as biocompatible sites for adsorption and proliferation of the bacteria on their surfaces, while the bacterially-reduced GO (BRGO) sheets showed an inhibition for proliferation of the bacteria on their surfaces. It was shown that the slight antibacterial property of the BRGO sheets and the detaching of the already proliferated bacteria from the surface of these sheets contributed to the growth inhibition of the bacteria on the surface of the reduced sheets.
- 48Aunkor, M. T. H.; Mahbubul, I. M.; Saidur, R.; Metselaar, H. S. C. zielona redukcja tlenku grafenu. RSC Adv. 2016, 6, 27807– 27828, DOI: 10.1039/C6RA03189G[Crossref], [CAS], Google Scholar48https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC28XjslKiu7s%253D&md5=de3412fe2b548182d51f4c7d6c4293d6The green reduction of graphene oxideAunkor, M. T. H.; Mahbubul, I. M.; Saidur, R.; Metselaar, H. S. C.RSC Advances (2016), 6 (33), 27807-27828CODEN: RSCACL; ISSN:2046-2069. (Royal Society of Chemistry)Graphene is an ultra-thin material, which has received broad interest in many areas of science and technol. because of its unique phys., chem., mech. and thermal properties. Synthesis of high quality graphene in an inexpensive and eco-friendly manner is a big challenge. Among various methods, chem. synthesis is considered the best because it is easy, scalable, facile, and inexpensive. Different kinds of chem. reducers have been used to produce graphene sheets. However, some chems. are toxic, corrosive, and hazardous. For this reason, researchers have been using different environmentally friendly substances (termed green reducers) to produce functional graphene sheets. This paper presents an overview and discussion of the green redn. of graphene oxide (GO) to graphene. It also reviews the characterization of GO and its oxide redn. through the anal. of different spectroscopic and microscopic techniques such as Raman spectroscopy, Fourier transform IR spectroscopy, XPS, X-ray diffraction, transmission electron microscopy, SEM, and at. force microscopy.
- 49Sołtani, T.; Kyu Lee, B. Łagodna droga ultradźwiękowa do zredukowanego tlenku grafenu z nieskazitelnego grafitu. J. Interfejs koloidowy Sci. 2017, 486, 337–343, DOI: 10.1016/j.jcis.2016.09.075[Crossref], [PubMed], [CAS], Google Scholar49https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC28Xhs1CnsLbM&md5=30dd28755a4aee8b1ff8c57fb770fc72A benign ultrasonic route to reduced graphene oxide from pristine graphiteSoltani, Tayyebeh; Lee, Byeong-KyuJournal of Colloid and Interface Science (2017), 486 (), 337-343CODEN: JCISA5; ISSN:0021-9797. (Elsevier B.V.)In this study, we report the synthesis of high purity reduced graphene oxide (rGO) from pristine graphite via a fast and cost-effective one-step ultrasonic redn. method. Ultrasonic treatment was employed to avoid the harsh reaction conditions, including high temp. and use of highly toxic hydrazine, required for the conventional rGO prepn. method. The high temp. produced during the ultrasound irradn. at low temp. and short reaction time enabled the redn. of graphene oxide (GO) into rGO without the use of toxic chems. The oxygen functional groups on GO were successfully reduced by the sonochem. redn. The rGO prepd. using the ultrasonic method exhibited a curled morphol., a very thin wrinkled paper-like structure, sheet folding, minimal layers (∼4 layers), and a layer spacing of ∼1 nm. The sonochem. approach for the synthesis of rGO showed fast, high productivity, much improved safety, less energy, and time consuming characteristics as compared to other methods. More importantly, highly explosive and poisonous hydrazine is not required in this sonochem. technique, opposed to that required in conventional rGO synthesis, making it useful for many industrial applications of rGO.
- 50Wang, Z.; Xu, D.; Huang, Y.; Wu, Z.; Wang, L.; Zhang, X. Łatwa, łagodna i szybka redukcja rozkładu termicznego tlenku grafenu w powietrzu i jego zastosowanie w wysokowydajnych bateriach litowych. Chem. Commun. 2012, 48, 976–978, DOI: 10.1039/C2CC16239C[Crossref], [PubMed], [CAS], Google Scholar50https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC38XhvVKhtw%253D%253D&md5=fbc59de646682a634d404e4c75d5070eFacile, mild and fast thermal-decomposition reduction of graphene oxide in air and its application in high-performance lithium batteriesWang, Zhong-li; Xu, Dan; Huang, Yun; Wu, Zhong; Wang, Li-min; Zhang, Xin-boChemical Communications (Cambridge, United Kingdom) (2012), 48 (7), 976-978CODEN: CHCOFS; ISSN:1359-7345. (Royal Society of Chemistry)The authors proposed a facile, mild and effective thermal-decompn. strategy to prep. high-quality graphene at a low temp. of 300° in only 5 min under an ambient atm. Applying the advantage of this strategy that provides an oxidizing atm., pure V2O5/graphene composite is successfully synthesized and exerts excellent Li storage properties.
- 51Yang, D.; Velamakanni, A.; Bozoklu, G.; Park, S.; Stoller, M.; Piner, R. D.; Stankovich, S.; Jung, I.; Field, D. A.; Komora, C. A.; Ruoff, R. S. Analiza chemiczna warstw tlenku grafenu po obróbce cieplnej i chemicznej za pomocą fotoelektronów rentgenowskich i spektroskopii mikro-Ramana. Węgiel 2009, 47, 145–152, DOI: 10.1016/j.carbon.2008.09.045[Crossref], [CAS], Google Scholar51https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BD1cXhsVChsbbI&md5=99e301a34edd05e2c0c0a1849e8b3721Chemical analysis of graphene oxide films after heat and chemical treatments by X-ray photoelectron and Micro-Raman spectroscopyYang, Dongxing; Velamakanni, Aruna; Bozoklu, Guelay; Park, Sungjin; Stoller, Meryl; Piner, Richard D.; Stankovich, Sasha; Jung, Inhwa; Field, Daniel A.; Ventrice, Carl A. Jr.; Ruoff, Rodney S.Carbon (2009), 47 (1), 145-152CODEN: CRBNAH; ISSN:0008-6223. (Elsevier Ltd.)Several nanometer-thick graphene oxide films deposited on silicon nitride-on silicon substrates were exposed to nine different heat treatments (three in Argon, three in Argon and Hydrogen, and three in ultra-high vacuum), and also a film was held at 70 °C while being exposed to a vapor from hydrazine monohydrate. The films were characterized with at. force microscopy to obtain local thickness and variation in thickness over extended regions. XPS was used to measure significant redn. of the oxygen content of the films; heating in ultra-high vacuum was particularly effective. The overtone region of the Raman spectrum was used, for the first time, to provide a "fingerprint" of changing oxygen content.
- 52Mori, F.; Kubouchi, M.; Arao, Y. Wpływ struktur grafitowych na produktywność i jakość grafenu kilkuwarstwowego w złuszczaniu w fazie ciekłej. J. Mater. Sci. 2018, 53, 12807– 12815, DOI: 10.1007/s10853-018-2538-3[Crossref], [CAS], Google Scholar52https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC1cXhtFSmtrfK&md5=e3689e87a96872d6f4300dcc584200cfEffect of graphite structures on the productivity and quality of few-layer graphene in liquid-phase exfoliationMori, Fumiya; Kubouchi, Masatoshi; Arao, YoshihikoJournal of Materials Science (2018), 53 (18), 12807-12815CODEN: JMTSAS; ISSN:0022-2461. (Springer)Liq.-phase exfoliation (LPE) is a promising technique for commercializing graphene prodn. because of its simplicity and cost-effectiveness. However, the low yield of graphene in lab.-scale prodn., less than 10 g/h, necessitates modifications to the process for it to be feasible for com. applications. Natural graphite has various size distribution, crystallite sizes, and interlayer space, making the choice of initial graphite very important. Five types of natural graphite with different structures were prepd. for the expt. The structural parameters of graphite such as crystallite size and d-spacing were precisely detd. based on a std. procedure of X-ray diffraction measurements for carbon materials. The effects of graphite flake size and crystallite size on the productivity and quality of few-layer graphene (FLG) were investigated. The results showed that small graphite was easier to fragment and exfoliate. FLG productivity improvement up to 1500% was attained when graphite with smaller flakes was used instead of graphite with large flakes. The crystallite size of graphite was manipulated by plenary ball milling, and the effect of crystallite on FLG productivity in LPE process was also discussed.
- 53Ding, J.-H.; Zhao, H.-R.; Yu, H.-B. Oparte na wodzie zielone podejście do produkcji na dużą skalę wodnych kompatybilnych nanopłytek grafenu. Sci. Rep. 2018, 8, 5567, DOI: 10.1038/s41598-018-23859-5[Crossref], [PubMed], [CAS], Google Scholar53https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A280%3ADC%252BC1MnoslGitQ%253D%253D&md5=50c7a7701d314b612af7f0cf9158fb43A water-based green approach to large-scale production of aqueous compatible graphene nanoplateletsDing Ji-Heng; Zhao Hong-Ran; Yu Hai-BinScientific reports (2018), 8 (1), 5567 ISSN:.The unique properties of graphene are highly desired for printing electronics, coatings, energy storage, separation membranes, biomedicine, and composites. However, the high efficiency exfoliation of graphene into single- or few-layered nanoplates remains a grand challenge and becomes the bottleneck in essential studies and applications of graphene. Here, we report a scalable and green method to exfoliate graphene nanoplatelets (GNPs) from nature graphite in pure water without using any chemicals or surfactants. The essence of this strategy lies in the facile liquid exfoliation route with the assistance of vapor pretreatment for the preparation of edge hydroxylated graphene. The produced graphene consisted primarily of fewer than ten atomic layers. Such the water soluble graphene can be stored in the form of dispersion (~0.55 g L(-1)) or filter cake for more than 6 months without the risk of re-stacking. This method paves the way for the environmentally friendly and cost-effective production of graphene-based materials.
- 54Reddy, V.; Satish Babu, K. K. C.; Torati, S. R.; Eom, Y. J.; Trung, T. Q.; Lee, N.-E.; Kim, C. Skalowalna produkcja dyspergowalnego w wodzie zredukowanego tlenku grafenu i jego integracja w tranzystorze polowym. J. Ind. Eng. Chem. 2018, 63, 19–26, DOI: 10.1016/j.jiec.2018.01.033[Crossref], [CAS], Google Scholar54https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC1cXis12rurg%253D&md5=9a50ae49ad434fe70eed32bf366e5877Scalable production of water-dispersible reduced graphene oxide and its integration in a field effect transistorReddy, Venu; Satish Babu, K. K. C.; Torati, Sri Ramulu; Eom, Yun Ji; Trung, Tran Quang; Lee, Nae-Eung; Kim, Cheol-GiJournal of Industrial and Engineering Chemistry (Amsterdam, Netherlands) (2018), 63 (), 19-26CODEN: JIECFI; ISSN:1226-086X. (Elsevier B.V.)The development of environmentally benign, low-processing and low-cost approaches to the large-scale prepn. of advanced nanomaterials based on the use of biol. materials is currently attracting great interest. Here, we report the discovery that aq. honey solns. reduce graphene oxide in a low-cost and an eco-friendly manner, yielding highly water dispersive functionalized reduced graphene sheets. The roles of honey in the redn. of graphene oxide of as-prepd. graphene are demonstrated. The possible mechanism for the de-epoxidn. of graphene oxide is elucidated. The fabricated a honey-reduced graphene oxide-based field-effect transistor exhibited ambipolar transfer characteristics, thereby demonstrating that the developed material may therefore have applications in electronic devices and sensors.
- 55Balasubramanyan, S.; Sasidharan, S.; Poovathinthodiyil, R.; Ramakrishnan, R. M.; Narayanan, B. N. Mechaniczne złuszczanie grafitu za pośrednictwem sacharozy: zielona metoda produkcji grafenu na dużą skalę i jego zastosowanie w katalitycznej redukcji 4-nitrofenolu. Nowy J. Chem. 2017, 41, 11969– 11978, DOI: 10.1039/C7NJ01900A[Crossref], [CAS], Google Scholar55https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2sXhsVGktbrE&md5=da8694efbb17023786c260f70c049b26Sucrose-mediated mechanical exfoliation of graphite: a green method for the large scale production of graphene and its application in catalytic reduction of 4-nitrophenolBalasubramanyan, Sowmya; Sasidharan, Sreenikesh; Poovathinthodiyil, Raveendran; Ramakrishnan, Resmi M.; Narayanan, Binitha N.New Journal of Chemistry (2017), 41 (20), 11969-11978CODEN: NJCHE5; ISSN:1144-0546. (Royal Society of Chemistry)We report an incredibly simple and green method for the large scale prodn. of graphene by the ball-milling of graphite with sucrose as an auxiliary milling agent, plausibly assisted by the interaction of the sucrose mols. with the graphitic surface layers by virtue of non-conventional CH/π or OH/π interactions. Upon calcination, the graphene-sucrose mixt. directly yields mono- and few-layer graphene nanosheets. The graphene thus produced forms stable suspensions in various org. solvents, enabling its further processing and fabrication. It is also demonstrated that the graphene produced can be used successfully for heterogeneous catalytic redn. of 4-nitrophenol.
- 56González, V. J.; Rodríguez, A. M.; León, V.; J. Frontiñán-Rubio; Fierro, J. L. G.; Durán-Prado, M.; Muñoz-García, A. B.; Pavone, M.; Vázquez, E. Słodki grafen: złuszczanie grafitu i otrzymywanie kokryształów glukozy-grafenu poprzez zabiegi mechanochemiczne. Zielona chemia. 2018, 20, 3581–3592, DOI: 10.1039/C8GC01162A[Crossref], [CAS], Google Scholar56https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC1cXht1ersLjO&md5=14fe258165f902d27a77116fa1785564Sweet graphene: exfoliation of graphite and preparation of glucose-graphene cocrystals through mechanochemical treatmentsGonzalez, Viviana Jehova; Rodriguez, Antonio M.; Leon, Veronica; Frontinan-Rubio, Javier; Fierro, Jose Luis G.; Duran-Prado, Mario; Munoz-Garcia, Ana B.; Pavone, Michele; Vazquez, EsterGreen Chemistry (2018), 20 (15), 3581-3592CODEN: GRCHFJ; ISSN:1463-9262. (Royal Society of Chemistry)Mechanochem. treatment with carbohydrates leads to the successful exfoliation of graphite and this can be considered as a green approach to the prepn. of graphene. Glucose, fructose, and saccharose were used and the former showed the best exfoliation behavior to generate graphene materials with a relatively low no. of defects, as evidenced by Raman spectroscopy. The addn. of small amts. of water to the ball milling treatment led to the formation of glucose-graphene co-crystals, which exhibited superior properties in terms of colloidal stability and minimization of cell toxicity.
- 57Zhang, X.; Wang, L.; Lu, Q.; Kaplan, D. L. Masowa produkcja biokompatybilnego grafenu z wykorzystaniem nanowłókien jedwabiu. ACS Appl. Mater. Interfejsy 2018, 10, 22924– 22931, DOI: 10.1021/acsami.8b04777[ACS Full Text
 ], [CAS], Google Scholar57https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC1cXhtFKhtrjN&md5=5e48af036ecad2ecda31f1e76f98fb05Mass Production of Biocompatible Graphene Using Silk NanofibersZhang, Xiaoyi; Wang, Ling; Lu, Qiang; Kaplan, David L.ACS Applied Materials & Interfaces (2018), 10 (27), 22924-22931CODEN: AAMICK; ISSN:1944-8244. (American Chemical Society)Mass prodn. of high-quality graphene dispersions under mild conditions impacts the utility of the material for biomedical applications. Various proteins have been used to prep. graphene dispersions, rare sources, and expensive prices for these proteins restrict their large-scale utility for the prodn. of graphene. Here, inexpensive silk proteins as an abundant resource in nature were used for graphene exfoliation. The silk proteins were assembled into hydrophobic nanofibers with neg. charge, and then optimized for the prodn. of graphene. Significantly higher concns. (>8 mg mL-1) and yields (>30%) of graphene dispersions under ambient aq. conditions were achieved compared with previous protein-assisted exfoliation systems. The exfoliated graphene exhibited excellent stability in water and fetal bovine serum soln., cytocompatibility, and cond., suggesting a promising future in biomedical and bioengineering applications.
], [CAS], Google Scholar57https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC1cXhtFKhtrjN&md5=5e48af036ecad2ecda31f1e76f98fb05Mass Production of Biocompatible Graphene Using Silk NanofibersZhang, Xiaoyi; Wang, Ling; Lu, Qiang; Kaplan, David L.ACS Applied Materials & Interfaces (2018), 10 (27), 22924-22931CODEN: AAMICK; ISSN:1944-8244. (American Chemical Society)Mass prodn. of high-quality graphene dispersions under mild conditions impacts the utility of the material for biomedical applications. Various proteins have been used to prep. graphene dispersions, rare sources, and expensive prices for these proteins restrict their large-scale utility for the prodn. of graphene. Here, inexpensive silk proteins as an abundant resource in nature were used for graphene exfoliation. The silk proteins were assembled into hydrophobic nanofibers with neg. charge, and then optimized for the prodn. of graphene. Significantly higher concns. (>8 mg mL-1) and yields (>30%) of graphene dispersions under ambient aq. conditions were achieved compared with previous protein-assisted exfoliation systems. The exfoliated graphene exhibited excellent stability in water and fetal bovine serum soln., cytocompatibility, and cond., suggesting a promising future in biomedical and bioengineering applications. - 58Kim, H.-R.; Lee, S.-H.; Lee, K.-H. Skalowalna produkcja dużych jednowarstwowych grafenów metodą złuszczania mikrofalowego "w wodzie dejonizowanej. Węgiel 2018, 134, 431–438, DOI: 10.1016/j.carbon.2018.04.014[Crossref], [CAS], Google Scholar58https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC1cXnvVSmt78%253D&md5=5acab8f3fa6578f873ad46f20d3e8664Scalable production of large single-layered graphenes by microwave exfoliation 'in deionized water'Kim, Hye-Rim; Lee, Sung-Hyun; Lee, Kun-HongCarbon (2018), 134 (), 431-438CODEN: CRBNAH; ISSN:0008-6223. (Elsevier Ltd.)Single-layered graphenes with large sizes were produced by inserting solvent mols. between the graphene layers in graphite intercalation compds. (GICs) followed by direct microwave exfoliation 'in a solvent' to prevent re-aggregation. During the microwave exfoliation of GICs in deionized (DI) water, single-layered graphenes were produced, and their lateral sizes ranged from several micrometers to several tens of micrometers. The entire process time was less than 2 h, and toxic compds. were not used. In the case of microwave exfoliation in acetone or ethanol, graphenes with a thickness of 3-6 nm were mainly produced rather than single-layered graphenes. In addn., when the produced graphenes were directly dispersed in DI water, the dispersed state was maintained for 2 days. This method is very advantageous for industrial scale-up.
- 59Jerzy, G.; Sisupal, S. B.; Tomy, T.; Kumaran, A.; Vadivelu, P.; Suvekbala, V.; Sivaram, S.; Ragupathy, L. Łatwe, przyjazne dla środowiska i skalowalne podejście do produkcji nieskazitelnego kilku warstw grafenu odpowiedniego do przygotowania biokompatybilnych nanokompozytów polimerowych. Sci. Rep. 2018, 8, 11228, DOI: 10.1038/s41598-018-28560-1[Crossref], [PubMed], [CAS], Google Scholar59https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A280%3ADC%252BB3c7hvFOhsw%253D%253D&md5=68ae0e7e0a13e0a0f64f20614a96802bFacile, environmentally benign and scalable approach to produce pristine few layers graphene suitable for preparing biocompatible polymer nanocompositesGeorge Gejo; Sisupal Suja Bhargavan; Tomy Teenu; Kumaran Alaganandam; Suvekbala Vemparthan; Ragupathy Lakshminarayanan; Vadivelu Prabha; Sivaram SwaminathanScientific reports (2018), 8 (1), 11228 ISSN:.The success of developing graphene based biomaterials depends on its ease of synthesis, use of environmentally benign methods and low toxicity of the chemicals involved as well as biocompatibility of the final products/devices. We report, herein, a simple, scalable and safe method to produce defect free few layers graphene using naturally available phenolics i.e. curcumin/tetrahydrocurcumin/quercetin, as solid-phase exfoliating agents with a productivity of ∼45 g/batch (D/G ≤ 0.54 and D/D' ≤ 1.23). The production method can also be employed in liquid-phase using a ball mill (20 g/batch, D/G ≤ 0.23 and D/D' ≤ 1.12) and a sand grinder (10 g/batch, D/G ≤ 0.11 and D/D∼ ≤ 0.78). The combined effect of π-π interaction and charge transfer (from curcumin to graphene) is postulated to be the driving force for efficient exfoliation of graphite. The yielded graphene was mixed with the natural rubber (NR) latex to produce thin film nanocomposites, which show superior tensile strength with low modulus and no loss of % elongation at break. In-vitro and in-vivo investigations demonstrate that the prepared nanocomposite is biocompatible. This approach could be useful for the production of materials suitable in products (gloves/condoms/catheters), which come in contact with body parts/body fluids.
- 60González-Domínguez, J. M.; León, V.; Lucío, M. I.; Prato, M.; Vázquez, E. Produkcja gotowego do użycia grafenu kilkuwarstwowego w zawiesinach wodnych. Nat. Protoc. 2018, 13, 495–506, DOI: 10.1038/nprot.2017.142[Crossref], [PubMed], [CAS], Google Scholar60https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC1cXisl2kurc%253D&md5=e61c3385dd08691bbb536312046671b2Production of ready-to-use few-layer graphene in aqueous suspensionsGonzalez-Dominguez, Jose M.; Leon, Veronica; Lucio, Maria Isabel; Prato, Maurizio; Vazquez, EsterNature Protocols (2018), 13 (3), 495-506CODEN: NPARDW; ISSN:1750-2799. (Nature Research)A review. Graphene has promising phys. and chem. properties such as high strength and flexibility, coupled with high elec. and thermal conductivities. It is therefore being incorporated into polymer-based composites for use in electronics and photonics applications. A main constraint related to the graphene development is that, being of a strongly hydrophobic nature, almost all dispersions (usually required for its handling and processing toward the desired application) are prepd. in poisonous org. solvents such as N-Me pyrrolidone or N,N-DMF. Here, we describe how to prep. exfoliated graphite using a ball mill. The graphene produced is three to four layers thick and ~ 500 nm in diam. on av., as measured by electron microscopy and Raman spectroscopy; can be stored in the form of light solid; and is easily dispersed in aq. media. Our methodol. consists of four main steps: (i) the mechanochem. intercalation of org. mols. (melamine) into graphite, followed by suspension in water; (ii) the washing of suspended graphene to eliminate most of the melamine; (iii) the isolation of stable graphene sheets; and (iv) freeze-drying to obtain graphene powder. This process takes 6-7 or 9-10 d for aq. suspensions and dry powders, resp. The product has well-defined properties and can be used for many science and technol. applications, including toxicol. impact assessment and the prodn. of innovative medical devices.
- 61Yang, S.; Lohe, M. R.; Müllen, K.; Feng, X. Grafen nowej generacji z podejść elektrochemicznych: produkcja i zastosowania. Adv. Mater. 2016, 28, 6213–6221, DOI: 10.1002/adma.201505326[Crossref], [PubMed], [CAS], Google Scholar61https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC28XhvVSitbk%253D&md5=bcc93390e8971a15c363364ddbf89006New-Generation Graphene from Electrochemical Approaches: Production and ApplicationsYang, Sheng; Lohe, Martin R.; Muellen, Klaus; Feng, XinliangAdvanced Materials (Weinheim, Germany) (2016), 28 (29), 6213-6221CODEN: ADVMEW; ISSN:0935-9648. (Wiley-VCH Verlag GmbH & Co. KGaA)A review. Extensive research suggests a bright future for the graphene market. However, for a long time there was a huge gap between lab.-scale research and com. application due to the challenging task of reproducible bulk prodn. of high-quality graphene at low cost. Electrochem. exfoliation of graphite has emerged as a promising wet chem. method with advantages such as upscalability, soln. processability and eco-friendliness. Recent progress in the electrochem. exfoliation of graphite and prospects for the application of exfoliated graphene, mainly in the fields of composites, electronics, energy storage and conversion are discussed.
- 62Gao, X.; Lowry, G. V. Postęp w kierunku standaryzacji i zwalidowanych charakterystyk do pomiaru właściwości fizykochemicznych wytwarzanych nanomateriałów istotnych dla zagrożeń dla zdrowia i bezpieczeństwa nano. NanoImpact 2018, 9, 14–30, DOI: 10.1016/j.impact.2017.09.002
- 63Bourdo, S. E.; Al Faouri, R.; Sleezer, R.; Nima, Z. A.; Lafont, A.; Chhetri, B. P.; Benamara, M.; Marcin, B.; Salamo, G. J.; Biris, A. S. Charakterystyka fizykochemiczna nieskazitelnego i funkcjonalizowanego grafenu. J. Appl. Toxicol. 2017, 37, 1288–1296, DOI: 10.1002/jat.3493[Crossref], [PubMed], [CAS], Google Scholar63https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2sXhtFSmu7%252FM&md5=b92964e5275459e9b5189c85a79a910bPhysicochemical characteristics of pristine and functionalized grapheneBourdo, Shawn E.; Al Faouri, Radwan; Sleezer, Robert; Nima, Zeid A.; Lafont, Andersen; Chhetri, Bijay P.; Benamara, Mourad; Martin, Betty; Salamo, Gregory J.; Biris, Alexandru S.Journal of Applied Toxicology (2017), 37 (11), 1288-1296CODEN: JJATDK; ISSN:0260-437X. (John Wiley & Sons Ltd.)Graphene-based nanomaterials have received significant attention in the last decade due to their interesting properties. Its elec. and thermal cond. and strength make graphene well suited for a variety of applications, particularly for use as a composite material in plastics. Furthermore, much work is taking place to utilize graphene as a biomaterial for uses such as drug delivery and tissue regeneration scaffolds. Owing to the rapid progress of graphene and its potential in many marketplaces, the potential toxicity of these materials has garnered attention. Graphene, while simple in its purest form, can have many different chem. and phys. properties. In this paper, we describe our toxicity evaluation of pristine graphene and a functionalized graphene sample that has been oxidized for enhanced hydrophilicity, which was synthesized from the pristine sample. The samples were characterized by XPS, Raman spectroscopy, IR spectroscopy, thermogravimetric anal., zeta-potential, at. force microscopy and electron microscopy. We discuss the disagreement between the size of imaged samples analyzed by at. force microscopy and by transmission electron microscopy. Furthermore, the samples each exhibit quite different surface chem. and structure, which directly affects their interaction with aq. environments and is important to consider when evaluating the toxicity of materials both in vitro and in vivo.
- 64Li, Y.; Fujita, M.; Boraschi, D. Zanieczyszczenie endotoksynami nanomateriałów prowadzi do błędnej interpretacji wyników dotyczących bezpieczeństwa immunologicznego. Front. Immunol. 2017, 8, 472, DOI: 10.3389/fimmu.2017.00472[Crossref], [PubMed], [CAS], Google Scholar64https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC1cXhvFemsL7N&md5=fe86b38a30c32264e67f7a34c0dd9a32Endotoxin contamination in nanomaterials leads to the misinterpretation of immunosafety resultsLi, Yang; Fujita, Mayumi; Boraschi, DianaFrontiers in Immunology (2017), 8 (), 00472/1-00472/7CODEN: FIRMCW; ISSN:1664-3224. (Frontiers Media S.A.)Given the presence of engineered nanomaterials in consumers' products and their application in nanomedicine, nanosafety assessment is becoming increasingly import-ant. In particular, immunosafety aspects are being actively investigated. In nanomaterial immunosafety testing strategies, it is important to consider that nanomaterials and nanoparticles are very easy to become contaminated with endotoxin, which is a wide-spread contaminant coming from the Gram-neg. bacterial cell membrane. Because of the potent inflammatory activity of endotoxin, contaminated nanomaterials can show inflammatory/toxic effects due to endotoxin, which may mask or misidentify the real bio-logical effects (or lack thereof) of nanomaterials. Therefore, before running immunosafety assays, either in vitro or in vivo, the presence of endotoxin in nanomaterials must be evaluated. This calls for using appropriate assays with proper controls, because many nanomaterials interfere at various levels with the com. available endotoxin detec-tion methods. This also underlines the need to develop robust and bespoke strategies for endotoxin evaluation in nanomaterials.
- 65Pumera, M.; Ambrosi, A.; Chng, E. L. K. Zanieczyszczenia w grafenach i nanorurkach węglowych oraz ich wpływ na właściwości redoks. Chem. Sci. 2012, 3, 3347–3355, DOI: 10.1039/c2sc21374e[Crossref], [CAS], Google Scholar65https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC38XhsF2rtrvI&md5=5ecd5ddd14bc435d50644e29e11751acImpurities in graphenes and carbon nanotubes and their influence on the redox propertiesPumera, Martin; Ambrosi, Adriano; Chng, Elaine Lay KhimChemical Science (2012), 3 (12), 3347-3355CODEN: CSHCCN; ISSN:2041-6520. (Royal Society of Chemistry)A review. Carbon nanomaterials, such as carbon nanotubes and graphene-related materials are currently being heavily researched and widely proposed for numerous applications. It is often underestimated that these carbon nanomaterials are of complex nature, consisting of different components and often contg. impurities. These impurities can dramatically influence, or even dominate various properties of carbon nanotubes and graphenes. Herein, we will show that impurities in such carbon nanomaterials are capable of exhibiting a striking effect on their redox properties. The impurities being discussed include metallic, nanographitic and amorphous carbon-based impurities commonly found in carbon nanotube samples; and metallic, nanographitic, and carbonaceous debris-based impurities in graphenes. We emphasize that the effects brought about by these impurities on the properties of the carbon nanomaterials can, in many cases be rather significant. As such, one needs to be cautious by clearly accounting for these effects obsd. for the nanomaterials before assigning any properties to the material itself.
- 66Liao, K.-H.; Lin, Y.-S.; Macosko, C. W.; Haynes, C. L. Cytotoksyczność tlenku grafenu i grafenu w ludzkich erytrocytach i fibroblastach skóry. ACS Appl. Mater. Interfejsy 2011, 3, 2607–2615, DOI: 10.1021/am200428v[ACS Full Text
 ], [CAS], Google Scholar66https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3MXotlGhsL8%253D&md5=c85d96f60388c108e3d665be8a304c60Cytotoxicity of Graphene Oxide and Graphene in Human Erythrocytes and Skin FibroblastsLiao, Ken-Hsuan; Lin, Yu-Shen; Macosko, Christopher W.; Haynes, Christy L.ACS Applied Materials & Interfaces (2011), 3 (7), 2607-2615CODEN: AAMICK; ISSN:1944-8244. (American Chemical Society)Two-dimensional carbon-based nanomaterials, including graphene oxide and graphene, are potential candidates for biomedical applications such as sensors, cell labeling, bacterial inhibition, and drug delivery. Herein, the authors explore the biocompatibility of graphene-related materials with controlled phys. and chem. properties. The size and extent of exfoliation of graphene oxide sheets was varied by sonication intensity and time. Graphene sheets were obtained from graphene oxide by a simple (hydrazine-free) hydrothermal route. The particle size, morphol., exfoliation extent, oxygen content, and surface charge of graphene oxide and graphene were characterized by wide-angle powder X-ray diffraction, at. force microscopy, XPS, dynamic light scattering, and zeta-potential. One method of toxicity assessment was based on measurement of the efflux of Hb from suspended red blood cells. At the smallest size, graphene oxide showed the greatest hemolytic activity, whereas aggregated graphene sheets exhibited the lowest hemolytic activity. Coating graphene oxide with chitosan nearly eliminated hemolytic activity. Together, these results demonstrate that particle size, particulate state, and oxygen content/surface charge of graphene have a strong impact on biol./toxicol. responses to red blood cells. In addn., the cytotoxicity of graphene oxide and graphene sheets was investigated by measuring mitochondrial activity in adherent human skin fibroblasts using two assays. The methylthiazolyldiphenyl-tetrazolium bromide (MTT) assay, a typical nanotoxicity assay, fails to predict the toxicity of graphene oxide and graphene toxicity because of the spontaneous redn. of MTT by graphene and graphene oxide, resulting in a false pos. signal. However, appropriate alternate assessments, using the water-sol. tetrazolium salt (WST-8), trypan blue exclusion, and reactive oxygen species assay reveal that the compacted graphene sheets are more damaging to mammalian fibroblasts than the less densely packed graphene oxide. Clearly, the toxicity of graphene and graphene oxide depends on the exposure environment (i.e., whether or not aggregation occurs) and mode of interaction with cells (i.e., suspension vs. adherent cell types).
], [CAS], Google Scholar66https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3MXotlGhsL8%253D&md5=c85d96f60388c108e3d665be8a304c60Cytotoxicity of Graphene Oxide and Graphene in Human Erythrocytes and Skin FibroblastsLiao, Ken-Hsuan; Lin, Yu-Shen; Macosko, Christopher W.; Haynes, Christy L.ACS Applied Materials & Interfaces (2011), 3 (7), 2607-2615CODEN: AAMICK; ISSN:1944-8244. (American Chemical Society)Two-dimensional carbon-based nanomaterials, including graphene oxide and graphene, are potential candidates for biomedical applications such as sensors, cell labeling, bacterial inhibition, and drug delivery. Herein, the authors explore the biocompatibility of graphene-related materials with controlled phys. and chem. properties. The size and extent of exfoliation of graphene oxide sheets was varied by sonication intensity and time. Graphene sheets were obtained from graphene oxide by a simple (hydrazine-free) hydrothermal route. The particle size, morphol., exfoliation extent, oxygen content, and surface charge of graphene oxide and graphene were characterized by wide-angle powder X-ray diffraction, at. force microscopy, XPS, dynamic light scattering, and zeta-potential. One method of toxicity assessment was based on measurement of the efflux of Hb from suspended red blood cells. At the smallest size, graphene oxide showed the greatest hemolytic activity, whereas aggregated graphene sheets exhibited the lowest hemolytic activity. Coating graphene oxide with chitosan nearly eliminated hemolytic activity. Together, these results demonstrate that particle size, particulate state, and oxygen content/surface charge of graphene have a strong impact on biol./toxicol. responses to red blood cells. In addn., the cytotoxicity of graphene oxide and graphene sheets was investigated by measuring mitochondrial activity in adherent human skin fibroblasts using two assays. The methylthiazolyldiphenyl-tetrazolium bromide (MTT) assay, a typical nanotoxicity assay, fails to predict the toxicity of graphene oxide and graphene toxicity because of the spontaneous redn. of MTT by graphene and graphene oxide, resulting in a false pos. signal. However, appropriate alternate assessments, using the water-sol. tetrazolium salt (WST-8), trypan blue exclusion, and reactive oxygen species assay reveal that the compacted graphene sheets are more damaging to mammalian fibroblasts than the less densely packed graphene oxide. Clearly, the toxicity of graphene and graphene oxide depends on the exposure environment (i.e., whether or not aggregation occurs) and mode of interaction with cells (i.e., suspension vs. adherent cell types). - 67Yang, K.; Wan, J.; Zhang, S.; Zhang, Y.; Lee, S.-T.; Liu, Z. Farmakokinetyka in vivo, długoterminowa biodystrybucja i toksykologia pegylowanego grafenu u myszy. ACS Nano 2011, 5, 516–522, DOI: 10.1021/nn1024303[ACS Full Text
 ], [CAS], Google Scholar67https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3cXhsFKqu7%252FL&md5=5b9b425a918f0092a66b9e7d804753eeIn Vivo Pharmacokinetics, Long-Term Biodistribution, and Toxicology of PEGylated Graphene in MiceYang, Kai; Wan, Jian-Mei; Zhang, Shuai; Zhang, You-Jiu; Lee, Shuit-Tong; Liu, ZhuangACS Nano (2011), 5 (1), 516-522CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)Graphene has emerged as interesting nanomaterials with promising applications in a range of fields including biomedicine. In this work, for the first time we study the long-term in vivo biodistribution of 125I-labeled nanographene sheets (NGS) functionalized with polyethylene glycol (PEG) and systematically examine the potential toxicity of graphene over time. Our results show that PEGylated NGS mainly accumulate in the reticuloendothelial system (RES) including liver and spleen after i.v. administration and can be gradually cleared, likely by both renal and fecal excretion. PEGylated NGS do not cause appreciable toxicity at our tested dose (20 mg/kg) to the treated mice in a period of 3 mo as evidenced by blood biochem., hematol. anal., and histol. examns. Our work greatly encourages further studies of graphene for biomedical applications.
], [CAS], Google Scholar67https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3cXhsFKqu7%252FL&md5=5b9b425a918f0092a66b9e7d804753eeIn Vivo Pharmacokinetics, Long-Term Biodistribution, and Toxicology of PEGylated Graphene in MiceYang, Kai; Wan, Jian-Mei; Zhang, Shuai; Zhang, You-Jiu; Lee, Shuit-Tong; Liu, ZhuangACS Nano (2011), 5 (1), 516-522CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)Graphene has emerged as interesting nanomaterials with promising applications in a range of fields including biomedicine. In this work, for the first time we study the long-term in vivo biodistribution of 125I-labeled nanographene sheets (NGS) functionalized with polyethylene glycol (PEG) and systematically examine the potential toxicity of graphene over time. Our results show that PEGylated NGS mainly accumulate in the reticuloendothelial system (RES) including liver and spleen after i.v. administration and can be gradually cleared, likely by both renal and fecal excretion. PEGylated NGS do not cause appreciable toxicity at our tested dose (20 mg/kg) to the treated mice in a period of 3 mo as evidenced by blood biochem., hematol. anal., and histol. examns. Our work greatly encourages further studies of graphene for biomedical applications. - 68Duch, M. C.; Budinger, G. R. S.; Liang, Y. T.; Soberanes, S.; Urich, D.; Chiarella, S. E.; Campochiaro, L. A.; Gonzalez, A.; Chandel, N. S.; Hersam, M. C.; Mutlu, G. M. Minimalizacja utleniania i stabilna dyspersja w nanoskali poprawia biokompatybilność grafenu w płucach. Nano Lett. 2011, 11, 5201–5207, DOI: 10.1021/nl202515a[ACS Full Text
 ], [CAS], Google Scholar68https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A280%3ADC%252BC38%252Fmt1ersw%253D%253D&md5=2901611a7f1af578ef7f0160bd2ee63dMinimizing oxidation and stable nanoscale dispersion improves the biocompatibility of graphene in the lungDuch Matthew C; Budinger G R Scott; Liang Yu Teng; Soberanes Saul; Urich Daniela; Chiarella Sergio E; Campochiaro Laura A; Gonzalez Angel; Chandel Navdeep S; Hersam Mark C; Mutlu Gokhan MNano letters (2011), 11 (12), 5201-7 ISSN:.To facilitate the proposed use of graphene and its derivative graphene oxide (GO) in widespread applications, we explored strategies that improve the biocompatibility of graphene nanomaterials in the lung. In particular, solutions of aggregated graphene, Pluronic dispersed graphene, and GO were administered directly into the lungs of mice. The introduction of GO resulted in severe and persistent lung injury. Furthermore, in cells GO increased the rate of mitochondrial respiration and the generation of reactive oxygen species, activating inflammatory and apoptotic pathways. In contrast, this toxicity was significantly reduced in the case of pristine graphene after liquid phase exfoliation and was further minimized when the unoxidized graphene was well-dispersed with the block copolymer Pluronic. Our results demonstrate that the covalent oxidation of graphene is a major contributor to its pulmonary toxicity and suggest that dispersion of pristine graphene in Pluronic provides a pathway for the safe handling and potential biomedical application of two-dimensional carbon nanomaterials.
], [CAS], Google Scholar68https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A280%3ADC%252BC38%252Fmt1ersw%253D%253D&md5=2901611a7f1af578ef7f0160bd2ee63dMinimizing oxidation and stable nanoscale dispersion improves the biocompatibility of graphene in the lungDuch Matthew C; Budinger G R Scott; Liang Yu Teng; Soberanes Saul; Urich Daniela; Chiarella Sergio E; Campochiaro Laura A; Gonzalez Angel; Chandel Navdeep S; Hersam Mark C; Mutlu Gokhan MNano letters (2011), 11 (12), 5201-7 ISSN:.To facilitate the proposed use of graphene and its derivative graphene oxide (GO) in widespread applications, we explored strategies that improve the biocompatibility of graphene nanomaterials in the lung. In particular, solutions of aggregated graphene, Pluronic dispersed graphene, and GO were administered directly into the lungs of mice. The introduction of GO resulted in severe and persistent lung injury. Furthermore, in cells GO increased the rate of mitochondrial respiration and the generation of reactive oxygen species, activating inflammatory and apoptotic pathways. In contrast, this toxicity was significantly reduced in the case of pristine graphene after liquid phase exfoliation and was further minimized when the unoxidized graphene was well-dispersed with the block copolymer Pluronic. Our results demonstrate that the covalent oxidation of graphene is a major contributor to its pulmonary toxicity and suggest that dispersion of pristine graphene in Pluronic provides a pathway for the safe handling and potential biomedical application of two-dimensional carbon nanomaterials. - 69Pinto, A. M.; Moreira, J. A.; Magalhães, F. D.; Gonçalves, I. C. Adsorpcja powierzchniowa polimeru jako strategia poprawy biokompatybilności nanopłytek grafenu. Koloidy Surf., B 2016, 146, 818–824, DOI: 10.1016/j.colsurfb.2016.07.031[Crossref], [PubMed], [CAS], Google Scholar69https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC28Xht1ClurfO&md5=9d76975141ae4b55444923801248cdacPolymer surface adsorption as a strategy to improve the biocompatibility of graphene nanoplateletsPinto, Artur M.; Moreira, J. Agostinho; Magalhaes, Fernao D.; Goncalves, Ines C.Colloids and Surfaces, B: Biointerfaces (2016), 146 (), 818-824CODEN: CSBBEQ; ISSN:0927-7765. (Elsevier B.V.)The biointeractions of graphene-based materials depend on their physico-chem. properties. These properties can be manipulated by polymer adsorption. Graphene nanoplatelets (GNP-C) were modified with PVA, HEC, PEG, PVP, chondroitin, glucosamine, and hyaluronic acid. These materials were characterized by SEM, DLS, XPS, Raman spectroscopy, and TGA. Surface adsorption was confirmed for all polymers. Biocompatibility evaluation showed that all of these materials induced low hemolysis (<1.7%) at concns. up to 500 μg mL-1. GNP-C-PVA and GNP-C-HEC presented the lowest haemolysis percentages and were therefore more thoroughly studied. The morphol. of HFF-1 cells was investigated by microscopy (optical, fluorescence, TEM) in order to evaluate interactions with GNP materials. Small GNP-C nanoplatelets were obsd. to enter cells independently of the surface treatment. For pristine GNP-C at a concn. of 50 μg mL-1, ROS prodn. increased 4.4-fold. This effect is lower for GNP-C-PVA (3.3-fold) and higher for GNP-C-HEC (5.1-fold). Resazurin assays showed that GNP-C caused toxicity in HFF-1 cells at concns. above 20 μg mL-1 at 24 h, which decreased at 48 and 72 h. PVA surface adsorption rendered GNP-C non-toxic at concns. up to 50 μg mL-1. LIVE/DEAD assays showed that at 20 and 50 μg mL-1 cell death is significantly lower for GNP-C-PVA compared to pristine GNP-C. Modification of nanoplatelets with HEC resulted in no benefit in terms of biocompatibility, whereas PVA considerably improved the biocompatibility.
- 70Meng, H.; Xia, T.; Jerzy, S.; Nel, A. E. Predykcyjny paradygmat toksykologiczny oceny bezpieczeństwa nanomateriałów. ACS Nano 2009, 3, 1620– 1627, DOI: 10.1021/nn9005973[ACS Full Text
 ], [CAS], Google Scholar70https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BD1MXovVOjsrw%253D&md5=69dfff2a92731684b22b146e706ef284A Predictive Toxicological Paradigm for the Safety Assessment of NanomaterialsMeng, Huan; Xia, Tian; George, Saji; Nel, Andre E.ACS Nano (2009), 3 (7), 1620-1627CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)A review. The rate of expansion of nanomaterials calls for the consideration of appropriate toxicol. paradigms in the safety assessment of nanomaterials. We advocate a predictive toxicol. paradigm for the assessment of nanomaterial hazards. The predictive toxicol. approach is defined as establishing and using mechanisms and pathways of injury at a cellular and mol. level to prioritize screening for adverse biol. effects and health outcomes in vivo. Specifically as it relates to nanomaterials, a predictive approach has to consider the physicochem. properties of the material that leads to mol. or cellular injury and also has to be valid in terms of disease pathogenesis in whole organisms.
], [CAS], Google Scholar70https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BD1MXovVOjsrw%253D&md5=69dfff2a92731684b22b146e706ef284A Predictive Toxicological Paradigm for the Safety Assessment of NanomaterialsMeng, Huan; Xia, Tian; George, Saji; Nel, Andre E.ACS Nano (2009), 3 (7), 1620-1627CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)A review. The rate of expansion of nanomaterials calls for the consideration of appropriate toxicol. paradigms in the safety assessment of nanomaterials. We advocate a predictive toxicol. paradigm for the assessment of nanomaterial hazards. The predictive toxicol. approach is defined as establishing and using mechanisms and pathways of injury at a cellular and mol. level to prioritize screening for adverse biol. effects and health outcomes in vivo. Specifically as it relates to nanomaterials, a predictive approach has to consider the physicochem. properties of the material that leads to mol. or cellular injury and also has to be valid in terms of disease pathogenesis in whole organisms. - 71Pokhrel, S.; Nel, A. E.; Mädler, L. Specjalnie zaprojektowane biblioteki nanomateriałów do badania toksyczności tlenków metali. Acc. Chem. Res. 2013, 46 (3), 632–641, DOI: 10.1021/ar300032q[ACS Full Text
 ], [CAS], Google Scholar71https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC38XhslKhsb3L&md5=0f6e46b17d211dd5ec58ff7f4dbec346Custom-Designed Nanomaterial Libraries for Testing Metal Oxide ToxicityPokhrel, Suman; Nel, Andre E.; Maedler, LutzAccounts of Chemical Research (2013), 46 (3), 632-641CODEN: ACHRE4; ISSN:0001-4842. (American Chemical Society)Advances in aerosol technol. over the past 10 years have enabled the generation and design of ultrafine nanoscale materials for many applications. A key new method is flame spray pyrolysis (FSP), which produces particles by pyrolyzing a precursor soln. in the gas phase. FSP is a highly versatile technique for fast, single-step, scalable synthesis of nanoscale materials. New innovations in particle synthesis using FSP technol., including variations in precursor chem., have enabled flexible, dry synthesis of loosely agglomerated, highly cryst. ultrafine powders (porosity ≥90%) of binary, ternary, and mixed-binary-and-ternary oxides. FSP can fulfill much of the increasing demand, esp. in biol. applications, for particles with specific material compn., high purity, and high crystallinity. In this Account, the authors describe a strategy for creating nanoparticle libraries (pure or Fedoped ZnO or TiO2) utilizing FSP and using these libraries to test hypotheses related to the particles' toxicity. The authors' innovation lies in the overall integration of the knowledge the authors have developed in the last 5 years in synthesizing nanomaterials to address specific hypotheses, demonstrating the electronic properties that cause the material toxicity, understanding the reaction mechanisms causing the toxicity, and extg. from in vitro testing and in vivo testing in terrestrial and marine organisms the essential properties of safe nanomaterials. On the basis of this acquired knowledge, the authors further describe how the dissolved metal ion from these materials (Zn2+ in this Account) can effectively bind with different cell constituents, causing toxicity. The authors use Fe-S protein clusters as an example of the complex chem. reactions taking place after free metal ions migrate into the cells. As a second example, TiO2 is an active material in the UV range that exhibits photocatalytic behavior. The induction of electron-hole (e-/H+) pairs followed by free radical prodn. is a key mechanism for biol. injury. The authors show that decreasing the bandgap energy increases the phototoxicity in the presence of near-visible light. The authors present in detail the mechanism of electron transfer in biotic and abiotic systems during light exposure. Through this example FSP is a versatile technique for efficiently designing a homologous library, meaning a library based on a parent oxide doped with different amts. of dopant, and investigating the properties of the resulting compds. Finally, the authors describe the future outlook and state-of-the-art of an innovative two-flame system. A double-flame reactor enables independent control over each flame, the nozzle distances and the flame angles for efficient mixing of the particle streams. In addn., it allows for different flame compns., flame sizes, and multicomponent mixing (a grain-grain heterojunction) during the reaction process.
], [CAS], Google Scholar71https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC38XhslKhsb3L&md5=0f6e46b17d211dd5ec58ff7f4dbec346Custom-Designed Nanomaterial Libraries for Testing Metal Oxide ToxicityPokhrel, Suman; Nel, Andre E.; Maedler, LutzAccounts of Chemical Research (2013), 46 (3), 632-641CODEN: ACHRE4; ISSN:0001-4842. (American Chemical Society)Advances in aerosol technol. over the past 10 years have enabled the generation and design of ultrafine nanoscale materials for many applications. A key new method is flame spray pyrolysis (FSP), which produces particles by pyrolyzing a precursor soln. in the gas phase. FSP is a highly versatile technique for fast, single-step, scalable synthesis of nanoscale materials. New innovations in particle synthesis using FSP technol., including variations in precursor chem., have enabled flexible, dry synthesis of loosely agglomerated, highly cryst. ultrafine powders (porosity ≥90%) of binary, ternary, and mixed-binary-and-ternary oxides. FSP can fulfill much of the increasing demand, esp. in biol. applications, for particles with specific material compn., high purity, and high crystallinity. In this Account, the authors describe a strategy for creating nanoparticle libraries (pure or Fedoped ZnO or TiO2) utilizing FSP and using these libraries to test hypotheses related to the particles' toxicity. The authors' innovation lies in the overall integration of the knowledge the authors have developed in the last 5 years in synthesizing nanomaterials to address specific hypotheses, demonstrating the electronic properties that cause the material toxicity, understanding the reaction mechanisms causing the toxicity, and extg. from in vitro testing and in vivo testing in terrestrial and marine organisms the essential properties of safe nanomaterials. On the basis of this acquired knowledge, the authors further describe how the dissolved metal ion from these materials (Zn2+ in this Account) can effectively bind with different cell constituents, causing toxicity. The authors use Fe-S protein clusters as an example of the complex chem. reactions taking place after free metal ions migrate into the cells. As a second example, TiO2 is an active material in the UV range that exhibits photocatalytic behavior. The induction of electron-hole (e-/H+) pairs followed by free radical prodn. is a key mechanism for biol. injury. The authors show that decreasing the bandgap energy increases the phototoxicity in the presence of near-visible light. The authors present in detail the mechanism of electron transfer in biotic and abiotic systems during light exposure. Through this example FSP is a versatile technique for efficiently designing a homologous library, meaning a library based on a parent oxide doped with different amts. of dopant, and investigating the properties of the resulting compds. Finally, the authors describe the future outlook and state-of-the-art of an innovative two-flame system. A double-flame reactor enables independent control over each flame, the nozzle distances and the flame angles for efficient mixing of the particle streams. In addn., it allows for different flame compns., flame sizes, and multicomponent mixing (a grain-grain heterojunction) during the reaction process. - 72Walkey, C. D.; Olsen, J. B.; Pieśń, F.; Liu, R.; Guo, H.; Olsen, D. W. H.; Cohen, Y.; Emili, A.; Chan, W. C. W. Odciski palców korony białkowej przewidują interakcję komórkową nanocząstek złota i srebra. ACS Nano 2014, 8, 2439– 2455, DOI: 10.1021/nn406018q[ACS Full Text
 ], [CAS], Google Scholar72https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2cXisVWitLk%253D&md5=6d25fd4ea571d7e9344bd853adf8dbeaProtein Corona Fingerprinting Predicts the Cellular Interaction of Gold and Silver NanoparticlesWalkey, Carl D.; Olsen, Jonathan B.; Song, Fayi; Liu, Rong; Guo, Hongbo; Olsen, D. Wesley H.; Cohen, Yoram; Emili, Andrew; Chan, Warren C. W.ACS Nano (2014), 8 (3), 2439-2455CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)Using quant. models to predict the biol. interactions of nanoparticles will accelerate the translation of nanotechnol. Here, we characterized the serum protein corona 'fingerprint' formed around a library of 105 surface-modified gold nanoparticles. Applying a bioinformatics-inspired approach, we developed a multivariate model that uses the protein corona fingerprint to predict cell assocn. 50% more accurately than a model that uses parameters describing nanoparticle size, aggregation state, and surface charge. Our model implicates a set of hyaluronan-binding proteins as mediators of nanoparticle-cell interactions. This study establishes a framework for developing a comprehensive database of protein corona fingerprints and biol. responses for multiple nanoparticle types. Such a database can be used to develop quant. relationships that predict the biol. responses to nanoparticles and will aid in uncovering the fundamental mechanisms of nano-bio interactions.
], [CAS], Google Scholar72https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2cXisVWitLk%253D&md5=6d25fd4ea571d7e9344bd853adf8dbeaProtein Corona Fingerprinting Predicts the Cellular Interaction of Gold and Silver NanoparticlesWalkey, Carl D.; Olsen, Jonathan B.; Song, Fayi; Liu, Rong; Guo, Hongbo; Olsen, D. Wesley H.; Cohen, Yoram; Emili, Andrew; Chan, Warren C. W.ACS Nano (2014), 8 (3), 2439-2455CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)Using quant. models to predict the biol. interactions of nanoparticles will accelerate the translation of nanotechnol. Here, we characterized the serum protein corona 'fingerprint' formed around a library of 105 surface-modified gold nanoparticles. Applying a bioinformatics-inspired approach, we developed a multivariate model that uses the protein corona fingerprint to predict cell assocn. 50% more accurately than a model that uses parameters describing nanoparticle size, aggregation state, and surface charge. Our model implicates a set of hyaluronan-binding proteins as mediators of nanoparticle-cell interactions. This study establishes a framework for developing a comprehensive database of protein corona fingerprints and biol. responses for multiple nanoparticle types. Such a database can be used to develop quant. relationships that predict the biol. responses to nanoparticles and will aid in uncovering the fundamental mechanisms of nano-bio interactions. - 73Zhou, H.; Mu, Q.; Gao, N.; Liu, A.; Xing, Y.; Gao, S.; Zhang, Q.; Qu, G.; Chen, Y.; Liu, G.; Zhang, B.; Yan, B. A Nano-Combinatorial Library Strategy for the Discovery of Nanotubes with reduced protein-binding, cytotoxicity, and immune response. Nano Lett. 2008, 8, 859–865, DOI: 10.1021/nl0730155[ACS Full Text
 ], [CAS], Google Scholar73https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BD1cXitleis7s%253D&md5=1a831465872c69ebd489a5841567a502A Nano-Combinatorial Library Strategy for the Discovery of Nanotubes with Reduced Protein-Binding, Cytotoxicity, and Immune ResponseZhou, Hongyu; Mu, Qingxin; Gao, Ningning; Liu, Aifeng; Xing, Yuehan; Gao, Sulian; Zhang, Qiu; Qu, Guangbo; Chen, Yuyan; Liu, Gang; Zhang, Bin; Yan, BingNano Letters (2008), 8 (3), 859-865CODEN: NALEFD; ISSN:1530-6984. (American Chemical Society)The authors have discovered functionalized multiwalled carbon nanotubes with reduced protein-binding, cytotoxicity, and immune response and the assocd. structure-activity relationships using in silico surface mol. diversity design, combinatorial library synthesis, and multiple biol. screenings. The authors' results demonstrated the general utility of the nanocombinatorial library approach in nanomedicine and nanotoxicity research.
], [CAS], Google Scholar73https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BD1cXitleis7s%253D&md5=1a831465872c69ebd489a5841567a502A Nano-Combinatorial Library Strategy for the Discovery of Nanotubes with Reduced Protein-Binding, Cytotoxicity, and Immune ResponseZhou, Hongyu; Mu, Qingxin; Gao, Ningning; Liu, Aifeng; Xing, Yuehan; Gao, Sulian; Zhang, Qiu; Qu, Guangbo; Chen, Yuyan; Liu, Gang; Zhang, Bin; Yan, BingNano Letters (2008), 8 (3), 859-865CODEN: NALEFD; ISSN:1530-6984. (American Chemical Society)The authors have discovered functionalized multiwalled carbon nanotubes with reduced protein-binding, cytotoxicity, and immune response and the assocd. structure-activity relationships using in silico surface mol. diversity design, combinatorial library synthesis, and multiple biol. screenings. The authors' results demonstrated the general utility of the nanocombinatorial library approach in nanomedicine and nanotoxicity research. - 74Li, Y.; Wang, J.; Zhao, F.; Bai, B.; Nie, G.; Nel, A. E.; Zhao, Y. Biblioteki nanomateriałów i organizmy modelowe do szybkiej analizy nanobezpieczeństwa o wysokiej zawartości. Natl. Sci. Rev. 2018, 5, 365–388, DOI: 10.1093/nsr/nwx120
- 75Docter, D.; Westmeier, D.; M. Markiewicz; Stolte, S.; Knauer, S. K.; Stauber, R. H. Korona biocząsteczki nanocząsteczkowej: wyciągnięte wnioski – wyzwanie przyjęte?. Chem. Soc. Rev. 2015, 44, 6094-6121, DOI: 10.1039/C5CS00217F[Crossref], [PubMed], [CAS], Google Scholar75https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2MXhtVSgsLvN&md5=3d9164867a4a20b6f9cf3c3a0dc287b8The nanoparticle biomolecule corona: lessons learned - challenge accepted?Docter, D.; Westmeier, D.; Markiewicz, M.; Stolte, S.; Knauer, S. K.; Stauber, R. H.Chemical Society Reviews (2015), 44 (17), 6094-6121CODEN: CSRVBR; ISSN:0306-0012. (Royal Society of Chemistry)Besides the wide use of engineered nanomaterials (NMs) in tech. products, their applications are not only increasing in biotechnol. and biomedicine, but also in the environmental field. While the physico-chem. properties and behavior of NMs can be characterized accurately under idealized conditions, this is no longer the case in complex physiol. or natural environments. Herein, proteins and other biomols. rapidly bind to NMs, forming a protein/biomol. corona that critically affects the NMs' (patho)biol. and tech. identities. As the corona impacts the in vitro and/or in vivo NM applications in humans and ecosystems, a mechanistic understanding of its relevance and of the biophys. forces regulating corona formation is mandatory. Based on recent insights, we here critically review and present an updated concept of corona formation and evolution. We comment on how corona signatures may be linked to effects at the nano-bio interface in physiol. and environmental systems. In order to comprehensively analyze corona profiles and to mechanistically understand the coronas' biol./ecol. impact, we present a tiered multidisciplinary approach. To stimulate progress in this field, we introduce the potential impact of the corona for NM-microbiome-(human)host interactions and the novel concept of 'nanologicals', i.e., the nanomaterial-specific targeting of mol. machines. We conclude by discussing the relevant challenges that still need to be resolved in this field.
- 76Bussy, C.; Kostarelos, K. Pożywki hodowlane krytycznie wpływają na działanie tlenku grafenu na błony plazmatyczne. Chem. 2017, 2, 322–323, DOI: 10.1016/j.chempr.2017.01.015
- 77Chen, R.; Riviere, J. E. Biologiczny wskaźnik adsorpcji powierzchniowej nanomateriałów: modelowanie interakcji powierzchniowych nanomateriałów z biomolekułami. Adv. Exp. Med. Biol. 2017, 947, 207–253, DOI: 10.1007/978-3-319-47754-1_8[Crossref], [PubMed], [CAS], Google Scholar77https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC1cXhtVOhsL%252FK&md5=8873de2885127bfde51f89af2178c2c4Biological surface adsorption index of nanomaterials: modelling surface interactions of nanomaterials with biomoleculesChen, Ran; Riviere, Jim E.Advances in Experimental Medicine and Biology (2017), 947 (Modelling the Toxicity of Nanoparticles), 207-253CODEN: AEMBAP; ISSN:2214-8019. (Springer)A review. Quant. anal. of the interactions between nanomaterials and their surrounding environment is crucial for safety evaluation in the application of nanotechnol. as well as its development and standardization. In this chapter, we demonstrate the importance of the adsorption of surrounding mols. onto the surface of nanomaterials by forming biocorona and thus impact the bio-identity and fate of those materials. We illustrate the key factors including various phys. forces in detg. the interaction happening at bio-nano interfaces. We further discuss the math. endeavors in explaining and predicting the adsorption phenomena, and propose a new statistics-based surface adsorption model, the Biol. Surface Adsorption Index (BSAI), to quant. analyze the interaction profile of surface adsorption of a large group of small org. mols. onto nanomaterials with varying surface physicochem. properties, first employing five descriptors representing the surface energy profile of the nanomaterials, then further incorporating traditional semi-empirical adsorption models to address concn. effects of solutes. These Advancements in surface adsorption modeling showed a promising development in the application of quant. predictive models in biol. applications, nanomedicine, and environmental safety assessment of nanomaterials.
- 78Graham, U. M.; Jacobs, G.; Yokel, R. A.; Davis, B. H.; Dozier, A. K.; Brzoza, M. E.; Tseng, M. T.; Oberdörster, G.; Starszy, A.; DeLouise, L. Od dawki do odpowiedzi: przetwarzanie nanocząstek in vivo i potencjalna toksyczność. Adv. Exp. Med. Biol. 2017, 947, 71–100, DOI: 10.1007/978-3-319-47754-1_4
- 79Zhang, D.; Zhang, Z.; Liu, Y.; Chu, M.; Yang, C.; Li, W.; Shao, Y.; Yue, Y.; Xu, R. Krótko- i długoterminowy wpływ podawanych doustnie nanoarkuszy tlenku grafenu o obniżonej dawce na zachowania myszy. Biomateriały 2015, 68, 100–113, DOI: 10.1016/j.biomaterials.2015.07.060[Crossref], [PubMed], [CAS], Google Scholar79https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2MXht1OgsLvP&md5=57e7bd3d4ece2d88765fea35ec291779The short- and long-term effects of orally administered high-dose reduced graphene oxide nanosheets on mouse behaviorsZhang, Ding; Zhang, Zheyu; Liu, Yayun; Chu, Maoquan; Yang, Chengyu; Li, Wenhao; Shao, Yuxiang; Yue, Yan; Xu, RujiaoBiomaterials (2015), 68 (), 100-113CODEN: BIMADU; ISSN:0142-9612. (Elsevier Ltd.)Reduced graphene oxide (rGO), a carbon-based nanomaterial, has enormous potential in biomedical research, including in vivo cancer therapeutics. Concerns over the toxicity remain outstanding and must be investigated before clin. application. The effect of rGO exposure on animal behaviors, such as learning and memory abilities, has not been clarified. Herein, we explored the short- and long-term effects of orally administered rGO on mouse behaviors, including general locomotor activity level, balance and neuromuscular coordination, exploratory and anxiety behaviors, and learning and memory abilities using open-field, rotarod, and Morris water maze tests. Compared with mice administered buffer-dispersed mouse chow or buffer alone, mice receiving a high dose of small or large rGO nanosheets showed little change in exploratory, anxiety-like, or learning and memory behaviors, although general locomotor activity, balance, and neuromuscular coordination were initially affected, which the mechanisms (e.g. the influence of rGO exposure on the activity of superoxide dismutase in mouse serum) were discussed. The results presented in this work look to provide a deep understanding of the in vivo toxicity of rGO to animals, esp. its effect on learning and memory and other behaviors.
- 80Yang, K.; Gong, H.; Shi, X.; Wan, J.; Zhang, Y.; Liu, Z. Biodystrybucja in vivo i toksykologia funkcjonalizowanego tlenku nanografenu u myszy po podaniu doustnym i dootrzewnowym. Biomateriały 2013, 34, 2787–2795, DOI: 10.1016/j.biomaterials.2013.01.001[Crossref], [PubMed], [CAS], Google Scholar80https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3sXhtFahsbo%253D&md5=ee7c44c58878fbbf97db7e99e7101c02In vivo biodistribution and toxicology of functionalized nano-graphene oxide in mice after oral and intraperitoneal administrationYang, Kai; Gong, Hua; Shi, Xiaoze; Wan, Jianmei; Zhang, Youjiu; Liu, ZhuangBiomaterials (2013), 34 (11), 2787-2795CODEN: BIMADU; ISSN:0142-9612. (Elsevier Ltd.)Graphene oxide (GO) and its functionalized derivs. have attracted great attention in biomedicine in recent years. A no. of groups including ours have studied the in vivo behaviors of functionalized nano-graphene after i.v. injection or inhalation, and uncovered the surface coating & size dependent biodistribution and toxicol. profiles for this type of nanomaterials. However, the fate of GO derivs. in animals after oral feeding and i.p. injection, which are two other major drug administration routes, remain unclear. Therefore, in this work, we sought to systematically investigate in vivo biodistribution and potential toxicity of as-made GO and a no. of polyethylene glycol (PEG) functionalized GO derivs. with different sizes and surface coatings, after oral and i.p. administration at high doses. It is found that 125I labeled PEGylated GO derivs. show no obvious tissue uptake via oral administration, indicating the rather limited intestinal adsorption of those nanomaterials. In contrast, high accumulation of PEGylated GO derivs., but not as-made GO, in the reticuloendothelial (RES) system including liver and spleen is obsd. after i.p. injection. Further investigations based on histol. examn. of organ slices and hematol. anal. discover that although GO and PEGylated GO derivs. would retain in the mouse body over a long period of time after i.p. injection, their toxicity to the treated animals is insignificant. Our work is an important fundamental study that offers a deeper understanding of in vivo behaviors and toxicol. of functionalized nano-graphene in animals, depending on their different administration routes.
- 81Kucki, M.; Diener, L.; Bohmer, N.; Hirsch, C.; Krug, H. F.; Palermo, V.; , P. Wychwyt wolnego od oznakowania tlenku grafenu przez komórki Caco-2 zależy od stanu różnicowania komórek. J. Nanobiotechnol. 2017, 15, 46, DOI: 10.1186/s12951-017-0280-7[Crossref], [PubMed], [CAS], Google Scholar81https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC1cXitVOru7jF&md5=8e2b097965d22dc299189ff1a127c22fUptake of label-free graphene oxide by Caco-2 cells is dependent on the cell diferentiation statusKucki, Melanie; Diener, Liliane; Bohmer, Nils; Hirsch, Cordula; Krug, Harald F.; Palermo, Vincenzo; Wick, PeterJournal of Nanobiotechnology (2017), 15 (), 46/1-46/18CODEN: JNOAAO; ISSN:1477-3155. (BioMed Central Ltd.)Background: Understanding the interaction of graphene-related materials (GRM) with human cells is a key to the assessment of their potential risks for human health. There is a knowledge gap regarding the potential uptake of GRM by human intestinal cells after unintended ingestion. Therefore the aim of our study was to investigate the interaction of label-free graphene oxide (GO) with the intestinal cell line Caco-2 in vitro and to shed light on the influence of the cell phenotype given by the differentiation status on cellular uptake behavior. Results: Internalisation of two label-free GOs with different lateral size and thickness by undifferentiated and differentiated Caco-2 cells was analyzed by SEM and transmission electron microscopy. Semiquantification of cells assocd. with GRM was performed by flow cytometry. Undifferentiated Caco-2 cells showed significant amts. of cell-assocd. GRM, whereas differentiated Caco-2 cells exhibited low adhesion of GO sheets. Transmission electron microscopy anal. revealed internalisation of both applied GO (small and large) by undifferentiated Caco-2 cells. Even large GO sheets with lateral dimensions up to 10 ´i.m., were found internalised by undifferentiated cells, presumably by macropinocytosis. In contrast, no GO uptake could be found for differentiated Caco-2 cells exhibiting an enterocyte-like morphol. with apical brush border. Conclusions: Our results show that the internalisation of GO is highly dependent on the cell differentiation status of human intestinal cells. During differentiation Caco-2 cells undergo intense phenotypic changes which lead to a dramatic decrease in GRM internalisation. The results support the hypothesis that the cell surface topog. of differentiated Caco-2 cells given by the brush border leads to low adhesion of GO sheets and sterical hindrance for material uptake. In addn., the mech. properties of GRM, esp. flexibility of the sheets, seem to be an important factor for internalisation of large GO sheets by epithelial cells. Our results highlight the importance of the choice of the in vitro model to enable better in vitro-in vivo translation.
- 82Li, B.; Yang, J.; Huang, Q.; Zhang, Y.; Peng, C.; Zhang, Y.; On, Y.; Shi, J.; Li, W.; Hu, J.; Wentylator, C. Biodystrybucja i toksyczność płucna dotchawczo wkrapianego tlenku grafenu u myszy. NPG Azja Mater. 2013, 5, E44– E44, DOI: 10.1038/am.2013.7[Crossref], [CAS], Google Scholar82https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3sXhtVyrsb%252FP&md5=24168dadf3cf1482ef58502f49c789c2Biodistribution and pulmonary toxicity of intratracheally instilled graphene oxide in miceLi, Bo; Yang, Jianzhong; Huang, Qing; Zhang, Yi; Peng, Cheng; Zhang, Yujie; He, Yao; Shi, Jiye; Li, Wenxin; Hu, Jun; Fan, ChunhaiNPG Asia Materials (2013), 5 (April), e44CODEN: NAMPCE; ISSN:1884-4057. (Nature Publishing Group)Graphene and its derivs. (for example, nanoscale graphene oxide (NGO)) have emerged as extremely attractive nanomaterials for a wide range of applications, including diagnostics and therapeutics. In this work, we present a systematic study on the in vivo distribution and pulmonary toxicity of NGO for up to 3 mo after exposure. Radioisotope tracing and morphol. observation demonstrated that intratracheally instilled NGO was mainly retained in the lung. NGO could result in acute lung injury (ALI) and chronic pulmonary fibrosis. Such NGO-induced ALI was related to oxidative stress and could effectively be relieved with dexamethasone treatment. In addn., we found that the biodistribution of 125I-NGO varied greatly from that of 125I ions, hence it is possible that nanoparticulates could deliver radioactive isotopes deep into the lung, which might settle in numerous hot spots' that could result in mutations and cancers, raising environmental concerns about the large-scale prodn. of graphene oxide.
- 83Mao, L.; Hu, M.; Pan, B.; Xie, Y.; Petersen, E. J. Biodystrybucja i toksyczność znakowanego radioaktywnie kilkuwarstwowego grafenu u myszy po wkropleniu dotchawicy. Część. Toksyczny błonnik. 2015, 13, 7, DOI: 10.1186/s12989-016-0120-1
- 84Czarny, B.; Georgin, D.; Berthon, F.; Plastow, G.; M. Pinault; Patriarcha, G.; Thuleau, A.; L'Hermite, M. M.; Taran, F.; Nurkowanie, V. Translokacja nanorurek węglowych do odległych narządów po ekspozycji płucnej: spostrzeżenia in situ 14 C-Radioznakowanie i radioobrazowanie tkanek. ACS Nano 2014, 8, 5715– 5724, DOI: 10.1021/nn500475U
- 85Sydlik, S. A.; Jhunjhunwala, S.; Webber, M. J.; Anderson, D. G.; Langer, R. Zgodność in vivo tlenku grafenu z różnymi stopniami utlenienia. ACS Nano 2015, 9, 3866– 3874, DOI: 10.1021/acsnano.5b01290[ACS Full Text
 ], [CAS], Google Scholar85https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2MXmtF2nsrg%253D&md5=66ccf832b46e17cb958425211b79e48cIn Vivo Compatibility of Graphene Oxide with Differing Oxidation StatesSydlik, Stefanie A.; Jhunjhunwala, Siddharth; Webber, Matthew J.; Anderson, Daniel G.; Langer, RobertACS Nano (2015), 9 (4), 3866-3874CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)Graphene oxide (GO) is suggested to have great potential as a component of biomedical devices. Although this nanomaterial has been demonstrated to be cytocompatible in vitro, its compatibility in vivo in tissue sites relevant for biomedical device application is yet to be fully understood. Here, we evaluate the compatibility of GO with two different oxidn. levels following implantation in s.c. and i.p. tissue sites, which are of broad relevance for application to medical devices. We demonstrate GO to be moderately compatible in vivo in both tissue sites, with the inflammatory reaction in response to implantation consistent with a typical foreign body reaction. A redn. in the degree of GO oxidn. results in faster immune cell infiltration, uptake, and clearance following both s.c. and peritoneal implantation. Future work toward surface modification or coating strategies could be useful to reduce the inflammatory response and improve compatibility of GO as a component of medical devices.
], [CAS], Google Scholar85https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2MXmtF2nsrg%253D&md5=66ccf832b46e17cb958425211b79e48cIn Vivo Compatibility of Graphene Oxide with Differing Oxidation StatesSydlik, Stefanie A.; Jhunjhunwala, Siddharth; Webber, Matthew J.; Anderson, Daniel G.; Langer, RobertACS Nano (2015), 9 (4), 3866-3874CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)Graphene oxide (GO) is suggested to have great potential as a component of biomedical devices. Although this nanomaterial has been demonstrated to be cytocompatible in vitro, its compatibility in vivo in tissue sites relevant for biomedical device application is yet to be fully understood. Here, we evaluate the compatibility of GO with two different oxidn. levels following implantation in s.c. and i.p. tissue sites, which are of broad relevance for application to medical devices. We demonstrate GO to be moderately compatible in vivo in both tissue sites, with the inflammatory reaction in response to implantation consistent with a typical foreign body reaction. A redn. in the degree of GO oxidn. results in faster immune cell infiltration, uptake, and clearance following both s.c. and peritoneal implantation. Future work toward surface modification or coating strategies could be useful to reduce the inflammatory response and improve compatibility of GO as a component of medical devices. - 86Kurantowicz, N.; Strojny, B.; Sawosz, E.; Jaworski, S.; Kutwin, M.; M. Grodzik; mg. Wierzbicki; Lipińska, L.; Mitura, K.; Chwalibog, A. Biodystrybucja wysokiej dawki nanocząstek diamentu, grafitu i tlenku grafenu po wielokrotnych wstrzyknięciach dootrzewnowych u szczurów. Nanoskala Res. Lett. 2015, 10, 398, DOI: 10.1186/s11671-015-1107-9[Crossref], [PubMed], [CAS], Google Scholar86https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A280%3ADC%252BC28zitlOnuw%253D%253D&md5=88b3d9a5d16b91e9bb2c2a7c353743d0Biodistribution of a High Dose of Diamond, Graphite, and Graphene Oxide Nanoparticles After Multiple Intraperitoneal Injections in RatsKurantowicz Natalia; Strojny Barbara; Sawosz Ewa; Jaworski Slawomir; Kutwin Marta; Grodzik Marta; Wierzbicki Mateusz; Lipinska Ludwika; Mitura Katarzyna; Chwalibog AndreNanoscale research letters (2015), 10 (1), 398 ISSN:1931-7573.Carbon nanoparticles have recently drawn intense attention in biomedical applications. Hence, there is a need for further in vivo investigations of their biocompatibility and biodistribution via various exposure routes. We hypothesized that intraperitoneally injected diamond, graphite, and graphene oxide nanoparticles may have different biodistribution and exert different effects on the intact organism. Forty Wistar rats were divided into four groups: the control and treated with nanoparticles by intraperitoneal injection (4 mg of nanoparticles/kg body weight) eight times during the 4-week period. Blood was collected for evaluation of blood morphology and biochemistry parameters. Photographs of the general appearance of each rat's interior were taken immediately after sacrifice. The organs were excised and their macroscopic structure was visualized using a stereomicroscope. The nanoparticles were retained in the body, mostly as agglomerates. The largest agglomerates (up to 10 mm in diameter) were seen in the proximity of the injection place in the stomach serous membrane, between the connective tissues of the abdominal skin, muscles, and peritoneum. Numerous smaller, spherical-shaped aggregates (diameter around 2 mm) were lodged among the mesentery. Moreover, in the connective and lipid tissue in the proximity of the liver and spleen serosa, small aggregates of graphite and graphene oxide nanoparticles were observed. However, all tested nanoparticles did not affect health and growth of rats. The nanoparticles had no toxic effects on blood parameters and growth of rats, suggesting their potential applicability as remedies or in drug delivery systems.
- 87Syama, S.; Paweł, W.; Sabareeswaran, A.; Mohanan, P. V. Spektroskopia Ramana do wykrywania dystrybucji narządów i klirensu pegylowanego zredukowanego tlenku grafenu i konsekwencji biologicznych. Biomateriały 2017, 131, 121–130, DOI: 10.1016/j.biomaterials.2017.03.043[Crossref], [PubMed], [CAS], Google Scholar87https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2sXls1Wgtbg%253D&md5=110ca6a79f472cf6396180c1d29f9309Raman spectroscopy for the detection of organ distribution and clearance of PEGylated reduced graphene oxide and biological consequencesSyama, Santhakumar; Paul, Willi; Sabareeswaran, Arumugam; Mohanan, Parayanthala ValappilBiomaterials (2017), 131 (), 121-130CODEN: BIMADU; ISSN:0142-9612. (Elsevier Ltd.)Graphene, a 2D carbon material has found vast application in biomedical field because of its exciting physico-chem. properties. The large planar sheet like structure helps graphene to act as an effective carrier of drug or biomols. in enormous amt. However, limited data available on the biocompatibility of graphene upon interaction with the biol. system prompts us to evaluate their toxicity in animal model. In this study organ distribution, clearance and toxicity of PEGylated reduced nanographene (PrGO) on Swiss Albino mice was investigated after i.p. and i.v. administration. Biodistribution and blood clearance was monitored using confocal Raman mapping and indicated that PrGO was distributed on major organs such as brain, liver, kidney, spleen and bone marrow. Presence of PrGO in brain tissue suggests that it has the potential to cross blood brain barrier. Small amt. of injected PrGO was found to excrete via urine. Repeated administration of PrGO induced acute liver injury, congestion in kidney and increased splenocytes proliferation in days following exposure. Hence the result of the study recommended that PrGO should undergo intensive safety assessment before clin. application or validated to be safe for medical use.
- 88Blanco, E.; Shen, H.; Ferrari, M. Zasady projektowania nanocząstek w celu pokonywania biologicznych barier w dostarczaniu leków. Nat. Biotechnol. 2015, 33, 941–951, DOI: 10.1038/nbt.3330[Crossref], [PubMed], [CAS], Google Scholar88https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2MXhsVymt73I&md5=d693b4429d7ad4cc8b3898f7a0fb6235Principles of nanoparticle design for overcoming biological barriers to drug deliveryBlanco, Elvin; Shen, Haifa; Ferrari, MauroNature Biotechnology (2015), 33 (9), 941-951CODEN: NABIF9; ISSN:1087-0156. (Nature Publishing Group)Biol. barriers to drug transport prevent successful accumulation of nanotherapeutics specifically at diseased sites, limiting efficacious responses in disease processes ranging from cancer to inflammation. Although substantial research efforts have aimed to incorporate multiple functionalities and moieties within the overall nanoparticle design, many of these strategies fail to adequately address these barriers. Obstacles, such as nonspecific distribution and inadequate accumulation of therapeutics, remain formidable challenges to drug developers. A reimagining of conventional nanoparticles is needed to successfully negotiate these impediments to drug delivery. Site-specific delivery of therapeutics will remain a distant reality unless nanocarrier design takes into account the majority, if not all, of the biol. barriers that a particle encounters upon i.v. administration. By successively addressing each of these barriers, innovative design features can be rationally incorporated that will create a new generation of nanotherapeutics, realizing a paradigmatic shift in nanoparticle-based drug delivery.
- 89Qu, G.; Wang, X.; Liu, Q.; Liu, R.; Yin, N.; Ma, J.; Chen, L.; On, J.; Liu, S.; Jiang, G. Właściwości biologiczne ex vivo i in vivo tlenku grafenu oraz wpływ środka powierzchniowo czynnego na biokompatybilność tlenku grafenu. J. Environ. Sci. 2013, 25, 873–881, DOI: 10.1016/S1001-0742(12)60252-6[Crossref], [CAS], Google Scholar89https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3sXhs1ShtbvN&md5=95cd74b73324e4b4dcf4755321c98eaaThe ex vivo and in vivo biological performances of graphene oxide and the impact of surfactant on graphene oxide's biocompatibilityQu, Guangbo; Wang, Xiaoyan; Liu, Qian; Liu, Rui; Yin, Nuoya; Ma, Juan; Chen, Liqun; He, Jiuyang; Liu, Sijin; Jiang, GuibinJournal of Environmental Sciences (Beijing, China) (2013), 25 (5), 873-881CODEN: JENSEE; ISSN:1001-0742. (Science Press)Graphene oxide (GO) displays promising properties for biomedical applications including drug delivery and cancer therapeutics. However, GO exposure also raises safety concerns such as potential side effects on health. Here, the biol. effects of GO suspended in phosphate buffered saline (PBS) with or without 1% nonionic surfactant Tween 80 were investigated. Based on the ex vivo expts., Tween 80 significantly affected the interaction between GO and peripheral blood from mice. GO suspension in PBS tended to provoke the aggregation of dild. blood cells, which could be prevented by the addn. of Tween 80. After i.v. administration, GO suspension with or without 1% Tween 80 was quickly eliminated by the mononuclear phagocyte system. Nevertheless, GO suspension without Tween 80 showed greater accumulation in lungs than that contg. 1% Tween 80. In contrast, less GO was found in livers for GO suspension compared to Tween 80 assisted GO suspension. Organs including hearts, livers, lungs, spleens, kidneys, brains, and testes did not reveal histol. alterations. The indexes of peripheral blood showed no change upon GO exposure. Our results together demonstrated that Tween 80 could greatly alter GO'S biol. performance and det. the pattern of its biodistribution in mice.
- 90Wen, K.-P.; Chen, Y.-C.; Chuang, C.-H.; Chang, H.-Y.; Lee, C.-Y.; Tai, N.-H. Akumulacja i toksyczność dożylnie wstrzykniętego funkcjonalizowanego tlenku grafenu u myszy. J. Appl. Toxicol. 2015, 35, 1211–1218, DOI: 10.1002/jat.3187[Crossref], [PubMed], [CAS], Google Scholar90https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2MXhtVent7bM&md5=3571ba97d3767ef165bffb20f68c8169Accumulation and toxicity of intravenously-injected functionalized graphene oxide in miceWen, Kai-Ping; Chen, Ying-Chieh; Chuang, Chia-Hui; Chang, Hwan-You; Lee, Chi-Young; Tai, Nyan-HwaJournal of Applied Toxicology (2015), 35 (10), 1211-1218CODEN: JJATDK; ISSN:0260-437X. (John Wiley & Sons Ltd.)Graphene and its functionalized derivs. have recently emerged as interesting nanomaterials with promising applications in biomedicine. In this study, the long-term in vivo biodistribution of i.v. injected nanographene oxide (NGO) functionalized with poly sodium 4-styrenesulfonate (PSS) was systematically examd. and the potential toxicity over 6 mo of NGO-PSS nanoparticles was investigated. Our results showed that the nanoparticles mainly accumulate in the lung, liver and spleen, where they persist for at least 6 mo. These nanoparticles result in acute liver injury and chronic inflammation of the lung, liver and spleen, as evidenced by blood biochem. results and histol. examns.
- 91Girish, C. M.; Sasidharan, A.; Gowd, G. S.; Nair, S.; Koyakutty, M. Konfokalne badanie obrazowania Ramana pokazujące biodegradację grafenu in vivo za pośrednictwem makrofagów. Adv. Healthcare Mater. 2013, 2, 1489–1500, DOI: 10.1002/adhm.201200489[Crossref], [PubMed], [CAS], Google Scholar91https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3sXhslarsLnP&md5=02148db2759142ca2f697b6a933c2d73Confocal Raman Imaging Study Showing Macrophage Mediated Biodegradation of Graphene In VivoGirish, Chundayil Madathil; Sasidharan, Abhilash; Gowd, G. Siddaramana; Nair, Shantikumar; Koyakutty, ManzoorAdvanced Healthcare Materials (2013), 2 (11), 1489-1500CODEN: AHMDBJ; ISSN:2192-2640. (Wiley-VCH Verlag GmbH & Co. KGaA)This study is focused on the crucial issue of biodegradability of graphene under in vivo conditions. Characteristic Raman signatures of graphene are used to three dimensionally (3D) image its localization in lung, liver, kidney and spleen of mouse and identified gradual development of structural disorder, happening over a period of 3 mo, as indicated by the formation of defect-related D'band, line broadening of D and G bands, increase in ID/IG ratio and overall intensity redn. Prior to injection, the carboxyl functionalized graphene of lateral size ∼200 nm is well dispersed in aq. medium, but 24 h post injection, larger aggregates of size up to 10 μm are detected in various organs. Using Raman cluster imaging method, temporal development of disorder is detected from day 8 onwards, which begins from the edges and grows inwards over a period of 3 mo. The biodegrdn. is found prominent in graphene phagocytosed by tissue-bound macrophages and the gene expression studies of pro-inflammatory cytokines indicated the possibility of phagocytic immune response. In addn., in vitro studies conducted on macrophage cell lines also show development of structural disorder in the engulfed graphene, reiterating the role of macrophages in biodegrdn. This is the first report providing clear evidence of in vivo biodegrdn. of graphene and these results may radically change the perspective on potential biomedical applications of graphene.
- 92Li, B.; Zhang, X.; Yang, J.; Zhang, Y.; Li, W.; Wentylator, C.; Huang, Q. Wpływ powłoki glikolu polietylenowego na biodystrybucję i toksyczność nanotlenku grafenu u myszy po wstrzyknięciu dożylnym. Int. J. Nanomed. 2014, 9, 4697–4707, DOI: 10.2147/IJN. S66591[Crossref], [PubMed], [CAS], Google Scholar92https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2cXitFOiurbO&md5=76596057fd5233b9202930785f305df9Influence of polyethylene glycol coating on biodistribution and toxicity of nanoscale graphene oxide in mice after intravenous injectionLi, Bo; Zhang, Xiao-Yong; Yang, Jian-Zhong; Zhang, Yu-Jie; Li, Wen-Xin; Fan, Chun-Hai; Huang, QingInternational Journal of Nanomedicine (2014), 9 (), 4697-4707, 11 pp.CODEN: IJNNHQ; ISSN:1178-2013. (Dove Medical Press Ltd.)In this study, we assessed the in vivo behavior and toxicol. of nanoscale graphene oxide (NGO) in mice after i.v. injection. The influence of a polyethylene glycol (PEG) coating on the distribution and toxicity of the NGO was also investigated. The results show that NGO is mainly retained in the liver, lung, and spleen. Retention in the lung is partially due to NGO aggregation. The PEG coating reduces the retention of NGO in the liver, lung, and spleen and promotes the clearance of NGO from these organs, but NGO and NGO-PEG are still present after 3 mo. The PEG coating effectively reduces the early wt. loss caused by NGO and alleviates NGO-induced acute tissue injuries, which can include damage to the liver, lung, and kidney, and chronic hepatic and lung fibrosis.
- 93Sasidharan, A.; Swaroop, S.; Koduri, C. K.; Girish, C. M.; Chandran, P.; Panchakarla, L. S.; Somasundaram, V. H.; Gowd, G. S.; Nair, S.; Koyakutty, M. Porównawcza toksyczność in vivo, biodystrybucja narządów i odpowiedź immunologiczna nieskazitelnych, karboksylowanych i pegylowanych kilkuwarstwowych arkuszy grafenu u szwajcarskich myszy albinosów: badanie trzymiesięczne. Węgiel 2015, 95, 511–524, DOI: 10.1016/j.carbon.2015.08.074[Crossref], [CAS], Google Scholar93https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2MXhsVCrur7E&md5=eee2edf1ced60eeeb6b50b8486677d45Comparative in vivo toxicity, organ biodistribution and immune response of pristine, carboxylated and PEGylated few-layer graphene sheets in Swiss albino mice: A three month studySasidharan, Abhilash; Swaroop, Siddharth; Koduri, Chaitanya K.; Girish, Chundayil Madathil; Chandran, Parwathy; Panchakarla, L. S.; Somasundaram, Vijay H.; Gowd, Genekehal S.; Nair, Shantikumar; Koyakutty, ManzoorCarbon (2015), 95 (), 511-524CODEN: CRBNAH; ISSN:0008-6223. (Elsevier Ltd.)The authors present a comprehensive 3 mo report on the acute and chronic toxicity of i.v. administered (20 mg kg-1) few-layer graphene (FLG) and, its carboxylated (FLG-COOH) and PEGylated (FLG-PEG) derivs. in Swiss albino mice. Whole-animal in vivo tracking studies revealed that irresp. of surface modifications, graphene predominantly accumulated in lungs over a period of 24 h. Histol. assessment and ex vivo confocal Raman spectral mapping revealed highest uptake and retention in lung tissue, followed by spleen, liver and kidney, with no accumulation in brain, heart or testis. FLG and FLG-COOH accumulated within organs induced significant cellular and structural damages to lungs, liver, spleen, and kidney, ranging from mild congestion to necrosis, fibrosis and glomerular filtration dysfunction, without appreciable clearance. Serum biochem. anal. revealed that both FLG and FLG-COOH induced elevated levels of hepatic and renal injury markers. Quant. RT-PCR studies conducted on 23 crit. inflammation and immune response markers showed major alterations in gene expression profile by FLG, FLG-COOH and FLG-PEG treated animals. FLG-PEG in spite of its persistence within liver and spleen tissue for 3 mo, did not induce any noticeable toxicity or organ damage, and displayed significant changes in Raman spectra, indicative of their biodegrdn. potential.
- 94Liu, J.-H.; Yang, S.-T.; Wang, H.; Chang, Y.; A. Cao; Liu, Y. Wpływ wielkości i dawki na biodystrybucję tlenku grafenu u myszy. Nanomedycyna 2012, 7, 1801–1812, DOI: 10.2217/nnm.12.60
- 95Jasim, D. A.; Ménard-Moyon, C.; Bégin, D.; Bianco, A.; Kostarelos, K. Dystrybucja tkankowa i wydalanie z moczem podawanych dożylnie funkcjonalizowanych arkuszy tlenku grafenu. Chem. Sci. 2015, 6, 3952–3964, DOI: 10.1039/C5SC00114E[Crossref], [PubMed], [CAS], Google Scholar95https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2MXmsVCgtr4%253D&md5=b9d7b7b9bceea89fee6ef461083bf8f4Tissue distribution and urinary excretion of intravenously administered chemically functionalized graphene oxide sheetsJasim, Dhifaf A.; Menard-Moyon, Cecilia; Begin, Dominique; Bianco, Alberto; Kostarelos, KostasChemical Science (2015), 6 (7), 3952-3964CODEN: CSHCCN; ISSN:2041-6520. (Royal Society of Chemistry)The design of graphene-based materials for biomedical purposes is of great interest. Graphene oxide (GO) sheets represent the most widespread type of graphene materials in biol. investigations. In this work, thin GO sheets were synthesized and further chem. functionalized with DOTA (1,4,7,10-tetraazacyclododecane-1,4,7,10-tetraacetic acid), a stable radiometal chelating agent, by an epoxide opening reaction. We report the tissue distribution of the functionalized GO sheets labeled with radioactive indium (111In) after i.v. administration in mice. Whole body single photon emission computed tomog. (SPECT/CT) imaging, gamma counting studies, Raman microscopy and histol. investigations indicated extensive urinary excretion and predominantly spleen accumulation. Intact GO sheets were detected in the urine of injected mice by Raman spectroscopy, high resoln. transmission electron microscopy (HR-TEM) and electron diffraction. These results offer a previously unavailable pharmacol. understanding on how chem. functionalized GO sheets transport in the blood stream and interact with physiol. barriers that will det. their body excretion and tissue accumulation.
- 96Oberdörster, G.; Oberdörster, E.; Oberdörster, J. Nanotoksykologia: nowa dyscyplina ewoluująca z badań ultradrobnych cząstek. Environ. Perspektywa zdrowia. 2005, 113, 823–839, DOI: 10.1289/ehp.7339[Crossref], [PubMed], [CAS], Google Scholar96https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BD2MXntVyls7Y%253D&md5=a2fbd85436eb30794567d91103088042Nanotoxicology: an emerging discipline evolving from studies of ultrafine particlesOberdorster, Gunter; Oberdorster, Eva; Oberdorster, JanEnvironmental Health Perspectives (2005), 113 (7), 823-839CODEN: EVHPAZ; ISSN:0091-6765. (U. S. Department of Health and Human Services, Public Health Services)A review. Although humans have been exposed to airborne nanosized particles (NSPs; <100 nm) throughout their evolutionary stages, such exposure has increased dramatically over the last century due to anthropogenic sources. The rapidly developing field of nanotechnol. is likely to become yet another source through inhalation, ingestion, skin uptake, and injection of engineered nanomaterials. Information about safety and potential hazards is urgently needed. Results of older biokinetic studies with NSPs and newer epidemiol. and toxicol. studies with airborne ultrafine particles can be viewed as the basis for the expanding field of nanotoxicol., which can be defined as safety evaluation of engineered nanostructures and nanodevices. Collectively, some emerging concepts of nanotoxicol. can be identified from the results of these studies. When inhaled, specific sizes of NSPs are efficiently deposited by diffusional mechanisms in all regions of the respiratory tract. The small size facilitates uptake into cells and transcytosis across epithelial and endothelial cells into the blood and lymph circulation to reach potentially sensitive target sites such as bone marrow, lymph nodes, spleen, and heart. Access to the central nervous system and ganglia via translocation along axons and dendrites of neurons has also been obsd. NSPs penetrating the skin distribute via uptake into lymphatic channels. Endocytosis and biokinetics are largely dependent on NSP surface chem. (coating) and in vivo surface modifications. The greater surface area per mass compared with larger-sized particles of the same chem. renders NSPs more active biol. This activity includes a potential for inflammatory and pro-oxidant, but also antioxidant, activity, which can explain early findings showing mixed results in terms of toxicity of NSPs to environmentally relevant species. Evidence of mitochondrial distribution and oxidative stress response after NSP endocytosis points to a need for basic research on their interactions with subcellular structures. Addnl. considerations for assessing the safety of engineered NSPs include careful selections of appropriate and relevant doses/concns., the likelihood of increased effects in a compromised organism, and also the benefits of possible desirable effects. An interdisciplinary team approach (e.g., toxicol., materials science, medicine, mol. biol., and bioinformatics, to name a few) is mandatory for nanotoxicol. research to arrive at an appropriate risk assessment.
- 97Kamień, V.; Miller, M. R.; Clift, M. J. D.; Starszy, A.; Mills, N. L.; Møller, P.; Schins, R. P. F.; Vogel, U.; Kreyling, W. G.; Alstrup • Jensen, K.; Kuhlbusch, T. A. J.; Schwarze, P. E.; Hoet, P.; Pietroiusti, A.; De Vizcaya-Ruiz, A.; Baeza-Squiban, A.; Teixeira, J. P.; Tran, C. L.; Cassee, F. R. Nanomateriały a ultradrobne cząstki otoczenia: możliwość wymiany wiedzy toksykologicznej. Environ. Perspektywa zdrowia. 2017, 125, 106002, DOI: 10.1289/EHP424[Crossref], [PubMed], [CAS], Google Scholar97https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC1MXlsFGnsLY%253D&md5=0098ead3159f7ce97b5a8aa64a7b083eNanomaterials versus ambient ultrafine particles: an opportunity to exchange toxicology knowledgeStone, Vicki; Miller, Mark R.; Clift, Martin J. D.; Elder, Alison; Mills, Nicholas L.; ller, Peter M.; Schins, Roel P. F.; Vogel, Ulla; Kreyling, Wolfgang G.; Jensen, Keld Alstrup; Kuhlbusch, Thomas A. J.; Schwarze, Per E.; Hoet, Peter; Pietroiusti, Antonio; De Vizcaya-Ruiz, Andrea; Baeza-Squiban, Armelle; Teixeira, Joao Paulo; Tran, C. Lang; Cassee, Flemming R.Environmental Health Perspectives (2017), 125 (10), 106002/1-106002/17CODEN: EVHPAZ; ISSN:1552-9924. (U. S. Department of Health and Human Services, National Institutes of Health)BACKGROUND: A rich body of literature exists that has demonstrated adverse human health effects following exposure to ambient air particulate matter (PM), and there is strong support for an important role of ultrafine (nanosized) particles. At present, relatively few human health or epidemiol. data exist for engineered nanomaterials (NMs) despite clear parallels in their physicochem. properties and biol. actions in in vitro models. OBJECTIVES: NMs are available with a range of physicochem. characteristics, which allows a more systematic toxicol. anal. Therefore, the study of ultrafine particles (UFP, <100 nm in diam.) provides an opportunity to identify plausible health effects for NMs, and the study of NMs provides an opportunity to facilitate the understanding of the mechanism of toxicity of UFP. METHODS: A workshop of experts systematically analyzed the available information and identified 19 key lessons that can facilitate knowledge exchange between these discipline areas. DISCUSSION: Key lessons range from the availability of specific techniques and std. protocols for physicochem. characterization and toxicol. assessment to understanding and defining dose and the mol. mechanisms of toxicity. This review identifies a no. of key areas in which addnl. research prioritization would facilitate both research fields simultaneously. CONCLUSION: There is now an opportunity to apply knowledge from NM toxicol. and use it to better inform PM health risk research and vice versa.
- 98Schreiver, I.; Hesja, B.; Seim, C.; Castillo-Michel, H.; Villanova, J.; P. Laux; Dreiack, N.; Penning, R.; Tucoulou, R.; Cotte, M.; Luch, A. Mapowanie ν-XRF oparte na synchrotronach i mikroskopia μ-FTIR umożliwiają przyjrzenie się losowi i efektom pigmentów tatuażu w ludzkiej skórze. Sci. Rep. 2017, 7, 11395, DOI: 10.1038/s41598-017-11721-z[Crossref], [PubMed], [CAS], Google Scholar98https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A280%3ADC%252BC1cbnsFeisw%253D%253D&md5=dda48f7ae006494a5e5d13ea439f6cddSynchrotron-based ν-XRF mapping and μ-FTIR microscopy enable to look into the fate and effects of tattoo pigments in human skinSchreiver Ines; Laux Peter; Dreiack Nadine; Luch Andreas; Hesse Bernhard; Castillo-Michel Hiram; Villanova Julie; Tucoulou Remi; Cotte Marine; Seim Christian; Seim Christian; Penning RandolfScientific reports (2017), 7 (1), 11395 ISSN:.The increasing prevalence of tattoos provoked safety concerns with respect to particle distribution and effects inside the human body. We used skin and lymphatic tissues from human corpses to address local biokinetics by means of synchrotron X-ray fluorescence (XRF) techniques at both the micro (μ) and nano (ν) scale. Additional advanced mass spectrometry-based methodology enabled to demonstrate simultaneous transport of organic pigments, heavy metals and titanium dioxide from skin to regional lymph nodes. Among these compounds, organic pigments displayed the broadest size range with smallest species preferentially reaching the lymph nodes. Using synchrotron μ-FTIR analysis we were also able to detect ultrastructural changes of the tissue adjacent to tattoo particles through altered amide I α-helix to β-sheet protein ratios and elevated lipid contents. Altogether we report strong evidence for both migration and long-term deposition of toxic elements and tattoo pigments as well as for conformational alterations of biomolecules that likely contribute to cutaneous inflammation and other adversities upon tattooing.
- 99Fadeel, B.; Pietroiusti, A.; Shvedova, A. A. niekorzystny wpływ wytworzonych nanomateriałów: narażenie, toksykologia i wpływ na zdrowie ludzkie; 2nd ed. Elsevier, Amsterdam, Holandia, 2017.Google ScholarThere is no corresponding record for this reference.
- 100Bhattacharya, K.; Andón, F. T.; El-Sayed, R.; Fadeel, B. Mechanizmy toksyczności wywołanej nanorurkami węglowymi: koncentracja na zapaleniu płuc. Adv. Drug Delivery Rev. 2013, 65, 2087-2097, DOI: 10.1016/j.addr.2013.05.012
- 101Orecchioni, M.; Ménard-Moyon, C.; Delogu, L. G.; Bianco, A. Grafen i układ odpornościowy: wyzwania i potencjalność. Adv. Drug Delivery Rev. 2016, 105, 163-175, DOI: 10.1016/j.addr.2016.05.014[Crossref], [PubMed], [CAS], Google Scholar101https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC28Xoslags7o%253D&md5=1757715ed14fb416a77d77c3373842e2Graphene and the immune system: Challenges and potentialityOrecchioni, Marco; Menard-Moyon, Cecilia; Delogu, Lucia Gemma; Bianco, AlbertoAdvanced Drug Delivery Reviews (2016), 105 (Part_B), 163-175CODEN: ADDREP; ISSN:0169-409X. (Elsevier B.V.)In the growing area of nanomedicine, graphene-based materials (GBMs) are some of the most recent explored nanomaterials. For the majority of GBM applications in nanomedicine, the immune system plays a fundamental role. It is necessary to well understand the complexity of the interactions between GBMs, the immune cells, and the immune components and how they could be of advantage for novel effective diagnostic and therapeutic approaches. In this review, we aimed at painting the current picture of GBMs in the background of the immune system. The picture we have drawn looks like a cubist image, a sort of Picasso-like portrait looking at the topic from all perspectives: the challenges (due to the potential toxicity) and the potentiality like the conjugation of GBMs to biomols. to develop advanced nanomedicine tools. In this context, we have described and discussed i) the impact of graphene on immune cells, ii) graphene as immunobiosensor, and iii) antibodies conjugated to graphene for tumor targeting.Thanks to the huge advances on graphene research, it seems realistic to hypothesize in the near future that some graphene immunoconjugates, endowed of defined immune properties, can go through preclin. test and be successfully used in nanomedicine.
- 102J. Russier; Treossi, E.; Scarsi, A.; Perrozzi, F.; Dumortier, H.; Ottaviano, L.; M. Meneghetti; Palermo, V.; Bianco, A. Emonstrowanie efektu maski tlenku grafenu: badanie porównawcze na pierwotnych ludzkich i mysich komórkach fagocytarnych. Nanoskala 2013, 5, 11234– 11247, DOI: 10.1039/c3NR03543C
- 103Yue, H.; Wei, W.; Yue, Z.; Wang, B.; Luo, N.; Gao, Y.; Ma, D.; Ma, G.; Nie, Z. Rola bocznego wymiaru tlenku grafenu w regulacji odpowiedzi komórkowych. Biomateriały 2012, 33, 4013–4021, DOI: 10.1016/j.biomaterials.2012.02.021[Crossref], [PubMed], [CAS], Google Scholar103https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC38XjtFyqtb0%253D&md5=c5e55ec5710597ed3468624407684a47The role of the lateral dimension of graphene oxide in the regulation of cellular responsesYue, Hua; Wei, Wei; Yue, Zhanguo; Wang, Bin; Luo, Nana; Gao, Yongjun; Ma, Ding; Ma, Guanghui; Su, ZhiguoBiomaterials (2012), 33 (16), 4013-4021CODEN: BIMADU; ISSN:0142-9612. (Elsevier Ltd.)The nanomaterial graphene oxide (GO) has attracted explosive interests in various areas. However, its performance in biol. environments is still largely unknown, particularly with regard to cellular response to GO. Here we sepd. the GO sheets in different size and systematically investigated size effect of the GO in response to different types of cells. In terms of abilities to internalize GO, enormous discrepancies were obsd. in the six cell types, with only two phagocytes were found to be capable of internalizing GO. The 2 μm and 350 nm GO greatly differed in lateral dimensions, but equally contributed to the uptake amt. in macrophages. Similar amts. of antibody opsonization and active Fcγ receptor-mediated phagocytosis were demonstrated the cause of this behavior. In comparison with the nanosized GO, the GO in micro-size showed divergent intracellular locations and induced much stronger inflammation responses. Present study provided insight into selective internalization, size-independent uptake, and several other biol. behaviors undergone by GO. These findings might help build necessary knowledge for potential incorporation of the unique two-dimensional nanomaterial as a biomedical tool, and for avoiding potential hazards.
- 104Ma, J.; Liu, R.; Wang, X.; Liu, Q.; Chen, Y.; Valle, R. P.; Zuo, Y. Y.; Xia, T.; Liu, S. Kluczowa rola wielkości bocznej tlenku grafenu w aktywacji makrofagów i stymulowaniu odpowiedzi prozapalnych w komórkach i zwierzętach. ACS Nano 2015, 9, 10498– 10515, DOI: 10.1021/acsnano.5b04751[ACS Full Text
 ], [CAS], Google Scholar104https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2MXhsFagtLvJ&md5=4b7ebfeefff79a9352bc0d9d7e0753d1Crucial Role of Lateral Size for Graphene Oxide in Activating Macrophages and Stimulating Pro-inflammatory Responses in Cells and AnimalsMa, Juan; Liu, Rui; Wang, Xiang; Liu, Qian; Chen, Yunan; Valle, Russell P.; Zuo, Yi Y.; Xia, Tian; Liu, SijinACS Nano (2015), 9 (10), 10498-10515CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)Graphene oxide (GO) is increasingly used in biomedical applications because it possesses not only the unique properties of graphene including large surface area and flexibility but also hydrophilicity and dispersibility in aq. solns. However, there are conflicting results on its biocompatibility and biosafety partially due to large variations in physicochem. properties of GO, and the role of these properties including lateral size in the biol. or toxicol. effects of GO is still unclear. In this study, the authors focused on the role of lateral size by prepg. a panel of GO samples with differential lateral sizes using the same starting material. The authors found that, in comparison to its smaller counterpart, larger GO showed a stronger adsorption onto the plasma membrane with less phagocytosis, which elicited more robust interaction with toll-like receptors and more potent activation of NF-κB pathways. By contrast, smaller GO sheets were more likely taken up by cells. As a result, larger GO promoted greater M1 polarization, assocd. with enhanced prodn. of inflammatory cytokines and recruitment of immune cells. The in vitro results correlated well with local and systemic inflammatory responses after GO administration into the abdominal cavity, lung, or bloodstream through the tail vein. Together, this study delineated the size-dependent M1 induction of macrophages and pro-inflammatory responses of GO in vitro and in vivo. The data also unearthed the detailed mechanism underlying these effects: a size-dependent interaction between GO and the plasma membrane.
], [CAS], Google Scholar104https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2MXhsFagtLvJ&md5=4b7ebfeefff79a9352bc0d9d7e0753d1Crucial Role of Lateral Size for Graphene Oxide in Activating Macrophages and Stimulating Pro-inflammatory Responses in Cells and AnimalsMa, Juan; Liu, Rui; Wang, Xiang; Liu, Qian; Chen, Yunan; Valle, Russell P.; Zuo, Yi Y.; Xia, Tian; Liu, SijinACS Nano (2015), 9 (10), 10498-10515CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)Graphene oxide (GO) is increasingly used in biomedical applications because it possesses not only the unique properties of graphene including large surface area and flexibility but also hydrophilicity and dispersibility in aq. solns. However, there are conflicting results on its biocompatibility and biosafety partially due to large variations in physicochem. properties of GO, and the role of these properties including lateral size in the biol. or toxicol. effects of GO is still unclear. In this study, the authors focused on the role of lateral size by prepg. a panel of GO samples with differential lateral sizes using the same starting material. The authors found that, in comparison to its smaller counterpart, larger GO showed a stronger adsorption onto the plasma membrane with less phagocytosis, which elicited more robust interaction with toll-like receptors and more potent activation of NF-κB pathways. By contrast, smaller GO sheets were more likely taken up by cells. As a result, larger GO promoted greater M1 polarization, assocd. with enhanced prodn. of inflammatory cytokines and recruitment of immune cells. The in vitro results correlated well with local and systemic inflammatory responses after GO administration into the abdominal cavity, lung, or bloodstream through the tail vein. Together, this study delineated the size-dependent M1 induction of macrophages and pro-inflammatory responses of GO in vitro and in vivo. The data also unearthed the detailed mechanism underlying these effects: a size-dependent interaction between GO and the plasma membrane. - 105Palomäki, J.; Välimäki, E.; Sund, J.; Vippola, M.; Clausen, P. A.; Jensen, K. A.; Savolainen, K.; Matikainen, S.; Alenius, H. Długie, podobne do igieł nanorurki węglowe i azbest aktywują inflamasom NLRP3 poprzez podobny mechanizm. ACS Nano 2011, 5, 6861– 6870, DOI: 10.1021/nn200595c[ACS Full Text
 ], [CAS], Google Scholar105https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3MXpslWrs7k%253D&md5=9b5835cbbc35658df3bf4e6a7b37c176Long, Needle-like Carbon Nanotubes and Asbestos Activate the NLRP3 Inflammasome through a Similar MechanismPalomaki, Jaana; Valimaki, Elina; Sund, Jukka; Vippola, Minnamari; Clausen, Per Axel; Jensen, Keld Alstrup; Savolainen, Kai; Matikainen, Sampsa; Alenius, HarriACS Nano (2011), 5 (9), 6861-6870CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)Carbon nanomaterials (CNM) are targets of great interest because they have multiple applications in industry but also because of the fear of possible harmful health effects of certain types of CNM. The high aspect ratio of carbon nanotubes (CNT), a feature they share with asbestos, is likely the key factor for reported toxicity of certain CNT. However, the mechanism to explain this toxicity is unclear. Here the authors investigated whether different CNM induce a pro-inflammatory response in human primary macrophages. Carbon black, short CNT, long, tangled CNT, long, needle-like CNT, and crocidolite asbestos were used to compare the effect of size and shape on the potency of the materials to induce secretion of interleukin (IL) 1-family cytokines. The authors' results demonstrated that long, needle-like CNT and asbestos activated secretion of IL-1β from LPS-primed macrophages but only long, needle-like CNT induced IL-1α secretion. SiRNA expts. demonstrated that the NLRP3 inflammasome was essential for long, needle-like CNT and asbestos-induced IL-1β secretion. Moreover, it was noted that CNT-induced NLRP3 inflammasome activation depended on reactive oxygen species (ROS) prodn., cathepsin B activity, P2X7 receptor, and Src and Syk tyrosine kinases. These results provide new information about the mechanisms by which long, needle-like materials may cause their harmful health effects. Furthermore, the techniques used here may be of use in future risk assessments of nanomaterials.
], [CAS], Google Scholar105https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3MXpslWrs7k%253D&md5=9b5835cbbc35658df3bf4e6a7b37c176Long, Needle-like Carbon Nanotubes and Asbestos Activate the NLRP3 Inflammasome through a Similar MechanismPalomaki, Jaana; Valimaki, Elina; Sund, Jukka; Vippola, Minnamari; Clausen, Per Axel; Jensen, Keld Alstrup; Savolainen, Kai; Matikainen, Sampsa; Alenius, HarriACS Nano (2011), 5 (9), 6861-6870CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)Carbon nanomaterials (CNM) are targets of great interest because they have multiple applications in industry but also because of the fear of possible harmful health effects of certain types of CNM. The high aspect ratio of carbon nanotubes (CNT), a feature they share with asbestos, is likely the key factor for reported toxicity of certain CNT. However, the mechanism to explain this toxicity is unclear. Here the authors investigated whether different CNM induce a pro-inflammatory response in human primary macrophages. Carbon black, short CNT, long, tangled CNT, long, needle-like CNT, and crocidolite asbestos were used to compare the effect of size and shape on the potency of the materials to induce secretion of interleukin (IL) 1-family cytokines. The authors' results demonstrated that long, needle-like CNT and asbestos activated secretion of IL-1β from LPS-primed macrophages but only long, needle-like CNT induced IL-1α secretion. SiRNA expts. demonstrated that the NLRP3 inflammasome was essential for long, needle-like CNT and asbestos-induced IL-1β secretion. Moreover, it was noted that CNT-induced NLRP3 inflammasome activation depended on reactive oxygen species (ROS) prodn., cathepsin B activity, P2X7 receptor, and Src and Syk tyrosine kinases. These results provide new information about the mechanisms by which long, needle-like materials may cause their harmful health effects. Furthermore, the techniques used here may be of use in future risk assessments of nanomaterials. - 106Wang, X.; Duch, M. C.; Mansukhani, N.; Ji, Z.; Liao, Y.-P.; Wang, M.; Zhang, H.; Słońce, B.; Chang, C. H.; Li, R.; Lin, S.; Meng, H.; Xia, T.; Hersam, M. C.; Nel, A. E. Zastosowanie profibrogennego podejścia do predykcyjnego toksykologicznego podejścia opartego na mechanizmie fibrogennym do wielopoziomowych badań i analizy decyzyjnej nanomateriałów węglowych. ACS Nano 2015, 9, 3032– 3043, DOI: 10.1021/nn507243w[ACS Full Text
 ], [CAS], Google Scholar106https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2MXitVers70%253D&md5=78c49c31d11bebfd86429a189471b242Use of a Pro-Fibrogenic Mechanism-Based Predictive Toxicological Approach for Tiered Testing and Decision Analysis of Carbonaceous NanomaterialsWang, Xiang; Duch, Matthew C.; Mansukhani, Nikhita; Ji, Zhaoxia; Liao, Yu-Pei; Wang, Meiying; Zhang, Haiyuan; Sun, Bingbing; Chang, Chong Hyun; Li, Ruibin; Lin, Sijie; Meng, Huan; Xia, Tian; Hersam, Mark C.; Nel, Andre E.ACS Nano (2015), 9 (3), 3032-3043CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)Engineered carbonaceous nanomaterials (ECNs), including single-wall carbon nanotubes (SWCNTs), multiwall carbon nanotubes (MWCNTs), graphene, and graphene oxide (GO), are potentially hazardous to the lung. With incremental experience in the use of predictive toxicol. approaches, seeking to relate ECN physicochem. properties to adverse outcome pathways (AOPs), it is logical to explore the existence of a common AOP that allows comparative anal. of broad ECN categories. The authors established an ECN library comprising three different types of SWCNTs, graphene, and graphene oxide (two sizes) for comparative anal. according to a cell-based AOP that also plays a role in the pathogenesis of pulmonary fibrosis. SWCNTs synthesized by Hipco, arc discharge and Co-Mo catalyst (CoMoCAT) methods were obtained in their as-prepd. (AP) state, following which they were further purified (PD) or coated with Pluronic F108 (PF108) or bovine serum albumin (BSA) to improve dispersal and colloidal stability. GO was prepd. as two sizes, GO-small (S) and GO-large (L), while the graphene samples were coated with BSA and PF108 to enable dispersion in aq. soln. In vitro screening showed that AP- and PD-SWCNTs, irresp. of the method of synthesis, as well as graphene (BSA) and GO (S and L) could trigger interleukin-1β (IL-1β) and transforming growth factor-β1 (TGF-β1) prodn. in myeloid (THP-1) and epithelial (BEAS-2B) cell lines, resp. Oropharyngeal aspiration in mice confirmed that AP-Hipco tubes, graphene (BSA-dispersed), GO-S and GO-L could induce IL-1β and TGF-β1 prodn. in the lung in parallel with lung fibrosis. Notably, GO-L was the most pro-fibrogenic material based on rapid kinetics of pulmonary injury. In contrast, PF108-dispersed SWCNTs and -graphene failed to exert fibrogenic effects. Collectively, these data indicate that the dispersal state and surface reactivity of ECNs play key roles in triggering a pro-fibrogenic AOP, which could prove helpful for hazard ranking and a proposed tiered testing approach for large ECN categories.
], [CAS], Google Scholar106https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2MXitVers70%253D&md5=78c49c31d11bebfd86429a189471b242Use of a Pro-Fibrogenic Mechanism-Based Predictive Toxicological Approach for Tiered Testing and Decision Analysis of Carbonaceous NanomaterialsWang, Xiang; Duch, Matthew C.; Mansukhani, Nikhita; Ji, Zhaoxia; Liao, Yu-Pei; Wang, Meiying; Zhang, Haiyuan; Sun, Bingbing; Chang, Chong Hyun; Li, Ruibin; Lin, Sijie; Meng, Huan; Xia, Tian; Hersam, Mark C.; Nel, Andre E.ACS Nano (2015), 9 (3), 3032-3043CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)Engineered carbonaceous nanomaterials (ECNs), including single-wall carbon nanotubes (SWCNTs), multiwall carbon nanotubes (MWCNTs), graphene, and graphene oxide (GO), are potentially hazardous to the lung. With incremental experience in the use of predictive toxicol. approaches, seeking to relate ECN physicochem. properties to adverse outcome pathways (AOPs), it is logical to explore the existence of a common AOP that allows comparative anal. of broad ECN categories. The authors established an ECN library comprising three different types of SWCNTs, graphene, and graphene oxide (two sizes) for comparative anal. according to a cell-based AOP that also plays a role in the pathogenesis of pulmonary fibrosis. SWCNTs synthesized by Hipco, arc discharge and Co-Mo catalyst (CoMoCAT) methods were obtained in their as-prepd. (AP) state, following which they were further purified (PD) or coated with Pluronic F108 (PF108) or bovine serum albumin (BSA) to improve dispersal and colloidal stability. GO was prepd. as two sizes, GO-small (S) and GO-large (L), while the graphene samples were coated with BSA and PF108 to enable dispersion in aq. soln. In vitro screening showed that AP- and PD-SWCNTs, irresp. of the method of synthesis, as well as graphene (BSA) and GO (S and L) could trigger interleukin-1β (IL-1β) and transforming growth factor-β1 (TGF-β1) prodn. in myeloid (THP-1) and epithelial (BEAS-2B) cell lines, resp. Oropharyngeal aspiration in mice confirmed that AP-Hipco tubes, graphene (BSA-dispersed), GO-S and GO-L could induce IL-1β and TGF-β1 prodn. in the lung in parallel with lung fibrosis. Notably, GO-L was the most pro-fibrogenic material based on rapid kinetics of pulmonary injury. In contrast, PF108-dispersed SWCNTs and -graphene failed to exert fibrogenic effects. Collectively, these data indicate that the dispersal state and surface reactivity of ECNs play key roles in triggering a pro-fibrogenic AOP, which could prove helpful for hazard ranking and a proposed tiered testing approach for large ECN categories. - 107Słońce, B.; Wang, X.; Ji, Z.; Wang, M.; Liao, Y.-P.; Chang, C. H.; Li, R.; Zhang, H.; Nel, A. E.; Xia, T. Zależna od oksydazy NADPH aktywacja inflamasomu NLRP3 i jej ważna rola w zwłóknieniu płuc przez wielościenne nanorurki węglowe. Małe 2015, 11, 2087–2097, DOI: 10.1002/smll.201402859[Crossref], [PubMed], [CAS], Google Scholar107https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2MXosFCjsg%253D%253D&md5=2d83cac43ece9da7c980d87d7c07d803NADPH oxidase-dependent NLRP3 inflammasome activation and its important role in lung fibrosis by multiwalled carbon nanotubesSun, Bingbing; Wang, Xiang; Ji, Zhaoxia; Wang, Meiying; Liao, Yu-Pei; Chang, Chong Hyun; Li, Ruibin; Zhang, Haiyuan; Nel, Andre E.; Xia, TianSmall (2015), 11 (17), 2087-2097CODEN: SMALBC; ISSN:1613-6810. (Wiley-VCH Verlag GmbH & Co. KGaA)The purpose of this paper is to elucidate the key role of NADPH oxidase in NLRP3 inflammasome activation and generation of pulmonary fibrosis by multi-walled carbon nanotubes (MWCNTs). Although it is known that oxidative stress plays a role in pulmonary fibrosis by single-walled CNTs, the role of specific sources of reactive oxygen species, including NADPH oxidase, in inflammasome activation remains to be clarified. In this study, three long aspect ratio (LAR) materials (MWCNTs, single-walled carbon nanotubes, and silver nanowires) are used to compare with spherical carbon black and silver nanoparticles for their ability to trigger oxygen burst activity and NLRP3 assembly. All LAR materials but not spherical nanoparticles induce robust NADPH oxidase activation and respiratory burst activity in THP-1 cells, which are blunted in p22phox-deficient cells. The NADPH oxidase is directly involved in lysosomal damage by LAR materials, as demonstrated by decreased cathepsin B release and IL-1β prodn. in p22phox-deficient cells. Reduced respiratory burst activity and inflammasome activation are also obsd. in bone marrow-derived macrophages from p47phox-deficient mice. Moreover, p47phox-deficient mice have reduced IL-1β prodn. and lung collagen deposition in response to MWCNTs. Lung fibrosis is also suppressed by N-acetyl-cysteine in wild-type animals exposed to MWCNTs.
- 108Yang, M.; Flavin, K.; Kopf, I.; Radics, G.; Hearnden, C. H. A.; McManus, G. J.; Moran, B.; Villalta-Cerdas, A.; Echegoyen, L. A.; Giordani, S.; Lavelle, E. C. Funkcjonalizacja nanocząstek węgla moduluje rekrutację komórek zapalnych i aktywację inflamasomu NLRP3. Małe 2013, 9, 4194– 4206, DOI: 10.1002/smll.201300481[Crossref], [PubMed], [CAS], Google Scholar108https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3sXhtVOisrrN&md5=0d02d1a9a6ae3ed1ee2562899a6bc14bFunctionalization of Carbon Nanoparticles Modulates Inflammatory Cell Recruitment and NLRP3 Inflammasome ActivationYang, Marie; Flavin, Kevin; Kopf, Ilona; Radics, Gabor; Hearnden, Claire H. A.; McManus, Gavin J.; Moran, Barry; Villalta-Cerdas, Adrian; Echegoyen, Luis A.; Giordani, Silvia; Lavelle, Ed C.Small (2013), 9 (24), 4194-4206CODEN: SMALBC; ISSN:1613-6810. (Wiley-VCH Verlag GmbH & Co. KGaA)The inflammatory effects of carbon nanoparticles (NPs) are highly disputed. Here it is demonstrated that endotoxin-free prepns. of raw carbon nanotubes (CNTs) are very limited in their capacity to promote inflammatory responses in vitro, as well as in vivo. Upon purifn. and selective oxidn. of raw CNTs, a higher dispersibility is achieved in physiol. solns., but this process also enhances their inflammatory activity. In synergy with toll-like receptor (TLR) ligands, CNTs promote NLRP3 inflammasome activation and it is shown for the first time that this property extends to spherical carbon nano-onions (CNOs) of 6 nm in size. In contrast, the benzoic acid functionalization of purified CNTs and CNOs leads to significantly attenuated inflammatory properties. This is evidenced by a reduced secretion of the inflammatory cytokine IL-1β, and a pronounced decrease in the recruitment of neutrophils and monocytes following injection into mice. Collectively, these results reveal that the inflammatory properties of carbon NPs are highly dependent on their physicochem. characteristics and crucially, that chem. surface functionalization allows significant moderation of these properties.
- 109Andón, F. T.; Mukherjee, S. P.; Gessner, I.; Wortmann, L.; Xiao, L.; Hultenby, K.; Szwedowa, A. A.; Mathur, S.; Fadeel, B. Puste kule węglowe wywołują zależne od inflammasomów wydzielanie IL-1β w makrofagach. Węgiel 2017, 113, 243–251, DOI: 10.1016/j.carbon.2016.11.049[Crossref], [CAS], Google Scholar109https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC28XitFeiurvO&md5=d0dde4e9cf5c110ef44c9e74f9888feaHollow carbon spheres trigger inflammasome-dependent IL-1β secretion in macrophagesAndon, Fernando T.; Mukherjee, Sourav P.; Gessner, Isabel; Wortmann, Laura; Xiao, Lisong; Hultenby, Kjell; Shvedova, Anna A.; Mathur, Sanjay; Fadeel, BengtCarbon (2017), 113 (), 243-251CODEN: CRBNAH; ISSN:0008-6223. (Elsevier Ltd.)It is disputed whether inflammasome activation leading to secretion of pro-inflammatory interleukin (IL)-1β in macrophages transpires independently of cell death or whether the two processes are linked. Here, the authors synthesized hollow carbon spheres (HCS) and investigated their effects on primary human monocyte-derived macrophages (HMDM); short (500 nm) non-functionalized single-walled carbon nanotubes (SWCNT) were included for comparison. HCS (250 nm) were readily taken up by HMDM and induced ROS prodn., but did not trigger a loss of cell viability. However, a dose- and time-dependent release of IL-1β was detected in lipopolysaccharide (LPS)-primed macrophages upon exposure to HCS, while SWCNT-induced secretion of IL-1β was less pronounced. HCS-triggered IL-1β secretion was cathepsin B- and caspase-1-dependent, and was accompanied by a redn. in intracellular K+. Furthermore, cytokine secretion was reduced following treatment with the antioxidant, N-acetylcysteine, and cytochalasin D, an inhibitor of actin polymn. HCS also triggered IL-1β release in LPS-primed THP.1 cells, but not in THP.1 cells with silencing of ASC, NLRP3, or caspase-1 expression, providing evidence that IL-1β was elicited through NLRP3 inflammasome activation. These studies shed light on the effects of HCS on primary macrophages, and show that spherical carbon-based nanoparticles are potent inflammasome activators.
- 110De Gregorio, E.; Tritto, E.; Rappuoli, R. Alum Adjuvanticity: Rozwikłanie stuletniej tajemnicy. Eur. J. Immunol. 2008, 38, 2068–2071, DOI: 10.1002/eji.200838648[Crossref], [PubMed], [CAS], Google Scholar110https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BD1cXhtVCltrrL&md5=44aeba5749c4efa6e7bb53ce2102bd96Alum adjuvanticity: unraveling a century old mysteryDe Gregorio, Ennio; Tritto, Elaine; Rappuoli, RinoEuropean Journal of Immunology (2008), 38 (8), 2068-2071CODEN: EJIMAF; ISSN:0014-2980. (Wiley-VCH Verlag GmbH & Co. KGaA)The development of vaccine adjuvants for human use has been one of the slowest processes in the history of medicine. For almost one century, aluminum hydroxide (alum) has been the only vaccine adjuvant approved worldwide. Only in the past decade have two oil-in-water emulsions and one TLR agonist been approved by the European authorities as new vaccine adjuvants. Despite the fact that alum has been injected into billions of people, its mechanism of action is not fully understood. Recently, several reports have greatly increased our knowledge of the mol. and cellular events triggered by alum; however, the contribution of each of these processes to alum adjuvanticity is still unclear. A study published in this issue of the European Journal of Immunol. (vol.38, 2008), together with two recent publications, have demonstrated that the NOD-like receptor, pyrin domain contg. 3(Nlrp3)-inflammasome is the mol. target of alum immunostimulatory activity in vitro. Surprisingly, these three studies reported conflicting results on the requirement of the Nlrp3 inflammasome complex for alum adjuvant effects in vivo. This commentary attempts to resolve some of these discrepancies.
- 111Mukherjee, S. P.; Bottini, M.; Fadeel, B. Grafen i układ odpornościowy: romans wielu wymiarów. Front. Immunol. 2017, 8, 673, DOI: 10.3389/fimmu.2017.00673[Crossref], [PubMed], [CAS], Google Scholar111https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC1cXitVWntrvE&md5=48341e765fbdbeb7988a7252e35048b4Graphene and the immune system: a romance of many dimensionsMukherjee, Sourav P.; Bottini, Massimo; Fadeel, BengtFrontiers in Immunology (2017), 8 (), 673/1-673/11CODEN: FIRMCW; ISSN:1664-3224. (Frontiers Media S.A.)A review. Graphene-based materials (GBMs) are emerging as attractive materials for biomedical applications. Understanding how these materials are perceived by and interact with the immune system is of fundamental importance. Phagocytosis is a major mechanism deployed by the immune system to remove pathogens, particles, and cellular debris. Here, we discuss recent studies on the interactions of GBMs with different phagocytic cells, including macrophages, neutrophils, and dendritic cells. The importance of assessing GBMs for endotoxin contamination is discussed as this may skew results. We also explore the role of the bio-corona for interactions of GBMs with immune cells. Finally, we highlight recent evidence for direct plasma membrane interactions of GBMs.
- 112Li, R.; Guiney, L. M.; Chang, C. H.; Mansukhani, N. D.; Ji, Z.; Wang, X.; Liao, Y.-P.; Jiang, W.; Słońce, B.; Hersam, M. C.; Nel, A. E.; Xia, T. Utlenianie powierzchniowe tlenku grafenu determinuje uszkodzenie błony, peroksydację lipidów i cytotoksyczność w makrofagach w modelu toksyczności płucnej. ACS Nano 2018, 12, 1390– 1402, DOI: 10.1021/acsnano.7b07737[ACS Full Text
 ], [CAS], Google Scholar112https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC1cXnvVCktw%253D%253D&md5=250124aed2894ca31da55bcaa2d3ce57Surface Oxidation of Graphene Oxide Determines Membrane Damage, Lipid Peroxidation, and Cytotoxicity in Macrophages in a Pulmonary Toxicity ModelLi, Ruibin; Guiney, Linda M.; Chang, Chong Hyun; Mansukhani, Nikhita D.; Ji, Zhaoxia; Wang, Xiang; Liao, Yu-Pei; Jiang, Wen; Sun, Bingbing; Hersam, Mark C.; Nel, Andre E.; Xia, TianACS Nano (2018), 12 (2), 1390-1402CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)While two-dimensional graphene oxide (GO) is used increasingly in biomedical applications, there is uncertainty on how specific physicochem. properties relate to biocompatibility in mammalian systems. Although properties such as lateral size and the colloidal properties of the nanosheets are important, the specific material properties that we address here is the oxidn. state and reactive surface groups on the planar surface. In this study, we used a GO library, comprising pristine, reduced (rGO), and hydrated GO (hGO), in which quant. assessment of the hydroxyl, carboxyl, epoxy, and carbon radical contents was used to study the impact on epithelial cells and macrophages, as well as in the murine lung. Strikingly, we obsd. that hGO, which exhibits the highest carbon radical d., was responsible for the generation of cell death in THP-1 and BEAS-2B cells as a consequence of lipid peroxidn. of the surface membrane, membrane lysis, and cell death. In contrast, pristine GO had lesser effects, while rGO showed extensive cellular uptake with minimal effects on viability. In order to see how these in vitro effects relate to adverse outcomes in the lung, mice were exposed to GOs by oropharyngeal aspiration. Animal sacrifice after 40 h demonstrated that hGO was more prone than other materials to generate acute lung inflammation, accompanied by the highest lipid peroxidn. in alveolar macrophages, cytokine prodn. (LIX, MCP-1), and LDH release in bronchoalveolar lavage fluid. Pristine GO showed less toxicity, whereas rGO had minimal effects. We demonstrate that the surface oxidn. state and carbon radical content play major roles in the induction of toxicity by GO in mammalian cells and the lung.
], [CAS], Google Scholar112https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC1cXnvVCktw%253D%253D&md5=250124aed2894ca31da55bcaa2d3ce57Surface Oxidation of Graphene Oxide Determines Membrane Damage, Lipid Peroxidation, and Cytotoxicity in Macrophages in a Pulmonary Toxicity ModelLi, Ruibin; Guiney, Linda M.; Chang, Chong Hyun; Mansukhani, Nikhita D.; Ji, Zhaoxia; Wang, Xiang; Liao, Yu-Pei; Jiang, Wen; Sun, Bingbing; Hersam, Mark C.; Nel, Andre E.; Xia, TianACS Nano (2018), 12 (2), 1390-1402CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)While two-dimensional graphene oxide (GO) is used increasingly in biomedical applications, there is uncertainty on how specific physicochem. properties relate to biocompatibility in mammalian systems. Although properties such as lateral size and the colloidal properties of the nanosheets are important, the specific material properties that we address here is the oxidn. state and reactive surface groups on the planar surface. In this study, we used a GO library, comprising pristine, reduced (rGO), and hydrated GO (hGO), in which quant. assessment of the hydroxyl, carboxyl, epoxy, and carbon radical contents was used to study the impact on epithelial cells and macrophages, as well as in the murine lung. Strikingly, we obsd. that hGO, which exhibits the highest carbon radical d., was responsible for the generation of cell death in THP-1 and BEAS-2B cells as a consequence of lipid peroxidn. of the surface membrane, membrane lysis, and cell death. In contrast, pristine GO had lesser effects, while rGO showed extensive cellular uptake with minimal effects on viability. In order to see how these in vitro effects relate to adverse outcomes in the lung, mice were exposed to GOs by oropharyngeal aspiration. Animal sacrifice after 40 h demonstrated that hGO was more prone than other materials to generate acute lung inflammation, accompanied by the highest lipid peroxidn. in alveolar macrophages, cytokine prodn. (LIX, MCP-1), and LDH release in bronchoalveolar lavage fluid. Pristine GO showed less toxicity, whereas rGO had minimal effects. We demonstrate that the surface oxidn. state and carbon radical content play major roles in the induction of toxicity by GO in mammalian cells and the lung. - 113Chen, G.-Y.; Yang, H.-J.; Lu, C.-H.; Chao, Y.-C.; Hwang, S.-M.; Chen, C.-L.; Lo, K.-W.; Sung, L.-Y.; Luo, W.-Y.; Tuan, H.-Y.; Hu, Y. C. Jednoczesna indukcja autofagii i szlaków sygnałowych receptora tollopodobnego przez tlenek grafenu. Biomateriały 2012, 33, 6559–6569, DOI: 10.1016/j.biomaterials.2012.05.064[Crossref], [PubMed], [CAS], Google Scholar113https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC38Xos1ehtLc%253D&md5=3ca05540c6257a8c8e2486c1b1665331Simultaneous induction of autophagy and toll-like receptor signaling pathways by graphene oxideChen, Guan-Yu; Yang, Hong-Jie; Lu, Chia-Hsin; Chao, Yu-Chan; Hwang, Shiaw-Min; Chen, Chiu-Ling; Lo, Kai-Wei; Sung, Li-Yu; Luo, Wen-Yi; Tuan, Hsing-Yu; Hu, Yu-ChenBiomaterials (2012), 33 (27), 6559-6569CODEN: BIMADU; ISSN:0142-9612. (Elsevier Ltd.)Graphene oxide (GO) nanosheets have sparked growing interests in biol. and medical applications. This study examd. how macrophage, the primary immune cell type engaging microbes, responded to GO treatment. We uncovered that incubation of macrophage cell RAW264.7 with GO elicited autophagy in a concn.-dependent manner, as evidenced by the appearance of autophagic vacuoles and activation of autophagic marker proteins. Such GO-induced autophagy was obsd. in various cell lines and in macrophage treated with GO of different sizes. Strikingly, GO treatment of macrophage provoked the toll-like receptor (TLR) signaling cascades and triggered ensuing cytokine responses. Mol. anal. identified that TLR4 and TLR9 and their downstream signaling mediators MyD88, TRAF6 and NF-κB played pivotal roles in the GO-induced inflammatory responses. By silencing individual genes in the signaling pathway, we further unveiled that the GO-induced autophagy was modulated by TLR4, TLR9 and was dependent on downstream adaptor proteins MyD88, TRIF and TRAF6. Altogether, we demonstrated that GO treatment of cells simultaneously triggers autophagy and TLR4/TLR9-regulated inflammatory responses, and the autophagy was at least partly regulated by the TLRs pathway. This study thus suggests a mechanism by which cells respond to nanomaterials and underscores the importance of future safety evaluation of nanomaterials.
- 114Qu, G.; Liu, S.; Zhang, S.; Wang, L.; Wang, X.; Słońce, B.; Yin, N.; Gao, X.; Xia, T.; Chen, J.-J.; Jiang, G.-B. Tlenek grafenu indukuje martwicę zależną od receptora tollopodobnego 4 (TLR4) w makrofagach. ACS Nano 2013, 7, 5732– 5745, DOI: 10.1021/nn402330b[ACS Full Text
 ], [CAS], Google Scholar114https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3sXovFWktrk%253D&md5=c001d526308f33e5ae4054a91fdefad1Graphene Oxide Induces Toll-like Receptor 4 (TLR4)-Dependent Necrosis in MacrophagesQu, Guangbo; Liu, Sijin; Zhang, Shuping; Wang, Lei; Wang, Xiaoyan; Sun, Bingbing; Yin, Nuoya; Gao, Xiang; Xia, Tian; Chen, Jane-Jane; Jiang, Gui-BinACS Nano (2013), 7 (7), 5732-5745CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)Graphene and graphene-based nanomaterials display novel and beneficial chem., elec., mech., and optical characteristics, which endow these nanomaterials with promising applications in a wide spectrum of areas such as electronics and biomedicine. However, its toxicity on health remains unknown and is of great concern. In the present study, the authors demonstrated that graphene oxide (GO) induced necrotic cell death to macrophages. This toxicity is mediated by activation of toll-like receptor 4 (TLR4) signaling and subsequently in part via autocrine TNF-α prodn. Inhibition of TLR4 signaling with a selective inhibitor prevented cell death nearly completely. Furthermore, TLR4-deficient bone marrow-derived macrophages were resistant to GO-triggered necrosis. Similarly, GO did not induce necrosis of HEK293T/TLR4-null cells. Macrophagic cell death upon GO treatment was partially attributed to RIP1-RIP3 complex-mediated programmed necrosis downstream of TNF-α induction. Addnl., upon uptake into macrophages, GO accumulated primarily in cytoplasm causing dramatic morphol. alterations and a significant redn. of the macrophagic ability in phagocytosis. However, macrophagic uptake of GO may not be required for induction of necrosis. GO exposure also caused a large increase of intracellular reactive oxygen species (ROS), which contributed to the cause of cell death. The combined data reveal that interaction of GO with TLR4 is the predominant mol. mechanism underlying GO-induced macrophagic necrosis; also, cytoskeletal damage and oxidative stress contribute to decreased viability and function of macrophages upon GO treatment.
], [CAS], Google Scholar114https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3sXovFWktrk%253D&md5=c001d526308f33e5ae4054a91fdefad1Graphene Oxide Induces Toll-like Receptor 4 (TLR4)-Dependent Necrosis in MacrophagesQu, Guangbo; Liu, Sijin; Zhang, Shuping; Wang, Lei; Wang, Xiaoyan; Sun, Bingbing; Yin, Nuoya; Gao, Xiang; Xia, Tian; Chen, Jane-Jane; Jiang, Gui-BinACS Nano (2013), 7 (7), 5732-5745CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)Graphene and graphene-based nanomaterials display novel and beneficial chem., elec., mech., and optical characteristics, which endow these nanomaterials with promising applications in a wide spectrum of areas such as electronics and biomedicine. However, its toxicity on health remains unknown and is of great concern. In the present study, the authors demonstrated that graphene oxide (GO) induced necrotic cell death to macrophages. This toxicity is mediated by activation of toll-like receptor 4 (TLR4) signaling and subsequently in part via autocrine TNF-α prodn. Inhibition of TLR4 signaling with a selective inhibitor prevented cell death nearly completely. Furthermore, TLR4-deficient bone marrow-derived macrophages were resistant to GO-triggered necrosis. Similarly, GO did not induce necrosis of HEK293T/TLR4-null cells. Macrophagic cell death upon GO treatment was partially attributed to RIP1-RIP3 complex-mediated programmed necrosis downstream of TNF-α induction. Addnl., upon uptake into macrophages, GO accumulated primarily in cytoplasm causing dramatic morphol. alterations and a significant redn. of the macrophagic ability in phagocytosis. However, macrophagic uptake of GO may not be required for induction of necrosis. GO exposure also caused a large increase of intracellular reactive oxygen species (ROS), which contributed to the cause of cell death. The combined data reveal that interaction of GO with TLR4 is the predominant mol. mechanism underlying GO-induced macrophagic necrosis; also, cytoskeletal damage and oxidative stress contribute to decreased viability and function of macrophages upon GO treatment. - 115Mukherjee, S. P.; Bondarenko, O.; Kohonen, P.; Andón, F. T.; Brzicová, T.; Gessner, I.; Mathur, S.; Bottini, M.; Calligari, P.; Stella, L.; Kisin, E.; Szwedowa, A.; Autio, R.; Salminen-Mankonen, H.; Lahesmaa, R.; Fadeel, B. Wykrywanie makrofagów jednościennych nanorurek węglowych za pośrednictwem receptorów toll-podobnych. Sci. Rep. 2018, 8, 1115, DOI: 10.1038/s41598-018-19521-9[Crossref], [PubMed], [CAS], Google Scholar115https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A280%3ADC%252BC1MvitFKlug%253D%253D&md5=6acae7a5af7ea6a7e54fec7fd6c6eaf6Macrophage sensing of single-walled carbon nanotubes via Toll-like receptorsMukherjee Sourav P; Bondarenko Olesja; Kohonen Pekka; Andon Fernando T; Brzicova Tana; Fadeel Bengt; Bondarenko Olesja; Andon Fernando T; Brzicova Tana; Gessner Isabel; Mathur Sanjay; Bottini Massimo; Bottini Massimo; Calligari Paolo; Stella Lorenzo; Kisin Elena; Shvedova Anna; Shvedova Anna; Autio Reija; Salminen-Mankonen Heli; Lahesmaa RiittaScientific reports (2018), 8 (1), 1115 ISSN:.Carbon-based nanomaterials including carbon nanotubes (CNTs) have been shown to trigger inflammation. However, how these materials are 'sensed' by immune cells is not known. Here we compared the effects of two carbon-based nanomaterials, single-walled CNTs (SWCNTs) and graphene oxide (GO), on primary human monocyte-derived macrophages. Genome-wide transcriptomics assessment was performed at sub-cytotoxic doses. Pathway analysis of the microarray data revealed pronounced effects on chemokine-encoding genes in macrophages exposed to SWCNTs, but not in response to GO, and these results were validated by multiplex array-based cytokine and chemokine profiling. Conditioned medium from SWCNT-exposed cells acted as a chemoattractant for dendritic cells. Chemokine secretion was reduced upon inhibition of NF-κB, as predicted by upstream regulator analysis of the transcriptomics data, and Toll-like receptors (TLRs) and their adaptor molecule, MyD88 were shown to be important for CCL5 secretion. Moreover, a specific role for TLR2/4 was confirmed by using reporter cell lines. Computational studies to elucidate how SWCNTs may interact with TLR4 in the absence of a protein corona suggested that binding is guided mainly by hydrophobic interactions. Taken together, these results imply that CNTs may be 'sensed' as pathogens by immune cells.
- 116Barth, N. D.; Marwick, J. A.; Vendrell, M.; Rossi, A. G.; Dransfield, I. "Fagocytarna synapsa" i klirens komórek apoptotycznych. Front. Immunol. 2017, 8, 1708, DOI: 10.3389/fimmu.2017.01708[Crossref], [PubMed], [CAS], Google Scholar116https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC1cXitFOgs77L&md5=c768bfb6be93df0a3fdd22cb9ca548fcThe "phagocytic synapse" and clearance of apoptotic cellsBarth, Nicole D.; Marwick, John A.; Vendrell, Marc; Rossi, Adriano G.; Dransfield, IanFrontiers in Immunology (2017), 8 (), 1708/1-1708/9CODEN: FIRMCW; ISSN:1664-3224. (Frontiers Media S.A.)Apoptosis and subsequent phagocytic clearance of apoptotic cells is important for embryonic development, maintenance of tissues that require regular cellular renewal and innate immunity. The timely removal of apoptotic cells prevents progression to secondary necrosis and release of cellular contents, preventing cellular stress and inflammation. In addn., altered phagocyte behavior following apoptotic cell contact and phagocytosis engages an anti-inflammatory phenotype, which impacts upon development and progression of inflammatory and immune responses. Defective apoptotic cell clearance underlies the development of various inflammatory and autoimmune diseases. There is considerable functional redundancy in the receptors that mediate apoptotic cell clearance, highlighting the importance of this process in diverse physiol. processes. A single phagocyte may utilize multiple receptor pathways for the efficient capture of apoptotic cells by phagocytes (tethering) and the subsequent initiation of signaling events necessary for internalization. In this review, we will consider the surface alterations and mol. opsonization events assocd. with apoptosis that may represent a tunable signal that confers distinct intracellular signaling events and hence specific phagocyte responses in a context-dependent manner. Efficient mol. communication between phagocytes and apoptotic targets may require cooperative receptor utilization and the establishment of efferocytic synapse, which acts to stabilize adhesive interactions and facilitate the organization of signaling platforms that are necessary for controlling phagocyte responses.
- 117Sosale, N. G.; Spinler, K. R.; Alvey, C.; Discher, D. E. Wchłanianie makrofagów przez komórkę lub nanocząstkę jest regulowane przez nieuniknioną opsonizację, specyficzny dla gatunku "marker jaźni" CD47 i docelowe właściwości fizyczne. Curr. Opin. Immunol. 2015, 35, 107–112, DOI: 10.1016/j.coi.2015.06.013[Crossref], [PubMed], [CAS], Google Scholar117https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2MXhtFWnt7vM&md5=c080aea9ac5c3d2ef515b1eb003811c4Macrophage engulfment of a cell or nanoparticle is regulated by unavoidable opsonization, a species-specific 'Marker of Self' CD47, and target physical propertiesSosale, Nisha G.; Spinler, Kyle R.; Alvey, Cory; Discher, Dennis E.Current Opinion in Immunology (2015), 35 (), 107-112CODEN: COPIEL; ISSN:0952-7915. (Elsevier Ltd.)Professional phagocytes of the mononuclear phagocyte system (MPS), esp. ubiquitous macrophages, are commonly thought to engulf or not a target based strictly on 'eat me' mols. such as Antibodies. The target might be a viable 'self' cell or a drug-delivering nanoparticle, or it might be a cancer cell or a microbe. 'Marker of Self' CD47 signals into a macrophage to inhibit the acto-myosin cytoskeleton that makes engulfment efficient. In adhesion of any cell, the same machinery is generally activated by rigidity of target surfaces, and recent results confirm phagocytosis is likewise driven by the rigidity typical of microbes and many synthetics. Basic insights are already being applied in order to make macrophages eat cancer or to delay nanoparticle clearance for better drug delivery and imaging.
- 118Hu, W.; Peng, C.; Lv, M.; Li, X.; Zhang, Y.; Chen, N.; Wentylator, C.; Huang, Q. Białkowe łagodzenie cytotoksyczności tlenku grafenu za pośrednictwem korony. ACS Nano 2011, 5, 3693– 3700, DOI: 10.1021/nn200021j[ACS Full Text
 ], [CAS], Google Scholar118https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3MXkvFGjtro%253D&md5=e91ed9e3981f6b0ca57ac3447ee76d25Protein Corona-Mediated Mitigation of Cytotoxicity of Graphene OxideHu, Wenbing; Peng, Cheng; Lv, Min; Li, Xiaoming; Zhang, Yujie; Chen, Nan; Fan, Chunhai; Huang, QingACS Nano (2011), 5 (5), 3693-3700CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)Graphene is a single layer of sp2-bonded C that has unique and highly attractive electronic, mech., and thermal properties. Consequently, the potential impact of graphene and its derivs. (e.g., graphene oxide, GO) on human and environmental health has raised considerable concerns. In this study, we have carried out a systematic investigation on cellular effects of GO nanosheets and identified the effect of fetal bovine serum (FBS), an often-employed component in cell culture medium, on the cytotoxicity of GO. At low concns. of FBS (1%), human cells were sensitive to the presence of GO and showed concn.-dependent cytotoxicity. Interestingly, the cytotoxicity of GO was greatly mitigated at 10% FBS, the concn. usually employed in cell medium. Our studies have demonstrated that the cytotoxicity of GO nanosheets arises from direct interactions between the cell membrane and GO nanosheets that result in phys. damage to the cell membrane. This effect is largely attenuated when GO is incubated with FBS due to the extremely high protein adsorption ability of GO. The observation of this FBS-mitigated GO cytotoxicity effect may provide an alternative and convenient route to engineer nanomaterials for safe biomedical and environmental applications.
], [CAS], Google Scholar118https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3MXkvFGjtro%253D&md5=e91ed9e3981f6b0ca57ac3447ee76d25Protein Corona-Mediated Mitigation of Cytotoxicity of Graphene OxideHu, Wenbing; Peng, Cheng; Lv, Min; Li, Xiaoming; Zhang, Yujie; Chen, Nan; Fan, Chunhai; Huang, QingACS Nano (2011), 5 (5), 3693-3700CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)Graphene is a single layer of sp2-bonded C that has unique and highly attractive electronic, mech., and thermal properties. Consequently, the potential impact of graphene and its derivs. (e.g., graphene oxide, GO) on human and environmental health has raised considerable concerns. In this study, we have carried out a systematic investigation on cellular effects of GO nanosheets and identified the effect of fetal bovine serum (FBS), an often-employed component in cell culture medium, on the cytotoxicity of GO. At low concns. of FBS (1%), human cells were sensitive to the presence of GO and showed concn.-dependent cytotoxicity. Interestingly, the cytotoxicity of GO was greatly mitigated at 10% FBS, the concn. usually employed in cell medium. Our studies have demonstrated that the cytotoxicity of GO nanosheets arises from direct interactions between the cell membrane and GO nanosheets that result in phys. damage to the cell membrane. This effect is largely attenuated when GO is incubated with FBS due to the extremely high protein adsorption ability of GO. The observation of this FBS-mitigated GO cytotoxicity effect may provide an alternative and convenient route to engineer nanomaterials for safe biomedical and environmental applications. - 119Chong, Y.; Ge, C.; Yang, Z.; Garate, J. A.; Gu, Z.; Weber, J. K.; Liu, J.; Zhou, R. Zmniejszona cytotoksyczność nanoarkuszy grafenu za pośrednictwem powłoki białkowo-krwi. ACS Nano 2015, 9, 5713– 5724, DOI: 10.1021/nn5066606[ACS Full Text
 ], [CAS], Google Scholar119https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2MXpsFOntrY%253D&md5=3cb76dac50ba63b0bcba2f8c49da01cbReduced Cytotoxicity of Graphene Nanosheets Mediated by Blood-Protein CoatingChong, Yu; Ge, Cuicui; Yang, Zaixing; Garate, Jose Antonio; Gu, Zonglin; Weber, Jeffrey K.; Liu, Jiajia; Zhou, RuhongACS Nano (2015), 9 (6), 5713-5724CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)The advent and pending wide use of nanoscale materials urges a biosafety assessment and safe design of nanomaterials that demonstrate applicability to human medicine. In biol. microenvironment, biomols. will bind onto nanoparticles forming corona and endow nanoparticles new biol. identity. Since blood-circulatory system will most likely be the first interaction organ exposed to these nanomaterials, a deep understanding of the basic interaction mechanisms between serum proteins and foreign nanoparticles may help to better clarify the potential risks of nanomaterials and provide guidance on safe design of nanomaterials. In this study, the adsorption of four high-abundance blood proteins onto the carbon-based nanomaterial graphene oxide (GO) and reduced GO (rGO) were investigated via exptl. (AFM, florescence spectroscopy, SPR) and simulation-based (mol. dynamics) approaches. Among the proteins in question, we observe competitive binding to the GO surface that features a m´elange of distinct packing modes. Our MD simulations reveal that the protein adsorption is mainly enthalpically driven through strong π-π stacking interactions between GO and arom. protein residues, in addn. to hydrophobic interactions. Overall, these results were in line with previous findings related to adsorption of serum proteins onto single-walled carbon nanotubes (SWCNTs), but GO exhibits a dramatic enhancement of adsorption capacity compared to this one-dimensional carbon form. Encouragingly, protein-coated GO resulted in a markedly less cytotoxicity than pristine and protein-coated SWCNTs, suggesting a useful role for this planar nanomaterial in biomedical applications.
], [CAS], Google Scholar119https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2MXpsFOntrY%253D&md5=3cb76dac50ba63b0bcba2f8c49da01cbReduced Cytotoxicity of Graphene Nanosheets Mediated by Blood-Protein CoatingChong, Yu; Ge, Cuicui; Yang, Zaixing; Garate, Jose Antonio; Gu, Zonglin; Weber, Jeffrey K.; Liu, Jiajia; Zhou, RuhongACS Nano (2015), 9 (6), 5713-5724CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)The advent and pending wide use of nanoscale materials urges a biosafety assessment and safe design of nanomaterials that demonstrate applicability to human medicine. In biol. microenvironment, biomols. will bind onto nanoparticles forming corona and endow nanoparticles new biol. identity. Since blood-circulatory system will most likely be the first interaction organ exposed to these nanomaterials, a deep understanding of the basic interaction mechanisms between serum proteins and foreign nanoparticles may help to better clarify the potential risks of nanomaterials and provide guidance on safe design of nanomaterials. In this study, the adsorption of four high-abundance blood proteins onto the carbon-based nanomaterial graphene oxide (GO) and reduced GO (rGO) were investigated via exptl. (AFM, florescence spectroscopy, SPR) and simulation-based (mol. dynamics) approaches. Among the proteins in question, we observe competitive binding to the GO surface that features a m´elange of distinct packing modes. Our MD simulations reveal that the protein adsorption is mainly enthalpically driven through strong π-π stacking interactions between GO and arom. protein residues, in addn. to hydrophobic interactions. Overall, these results were in line with previous findings related to adsorption of serum proteins onto single-walled carbon nanotubes (SWCNTs), but GO exhibits a dramatic enhancement of adsorption capacity compared to this one-dimensional carbon form. Encouragingly, protein-coated GO resulted in a markedly less cytotoxicity than pristine and protein-coated SWCNTs, suggesting a useful role for this planar nanomaterial in biomedical applications. - 120Xu, M.; Zhu, J.; Wang, F.; Xiong, Y.; Wu, Y.; Wang, Q.; Weng, J.; Zhang, Z.; Chen, W.; Liu, S. Ulepszona biokompatybilność in vitro i in vivo tlenku grafenu poprzez modyfikację powierzchni: funkcjonalizacja poli(kwasu akrylowego) jest lepsza od pegylacji. ACS Nano 2016, 10, 3267– 3281, DOI: 10.1021/acsnano.6b00539[ACS Full Text
 ], [CAS], Google Scholar120https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC28XitFeqsLg%253D&md5=11b9041f461cbac026bff16cbddcc5ccImproved In Vitro and In Vivo Biocompatibility of Graphene Oxide through Surface Modification: Poly(Acrylic Acid)-Functionalization is Superior to PEGylationXu, Ming; Zhu, Jianqiang; Wang, Fanfan; Xiong, Yunjing; Wu, Yakun; Wang, Qiuquan; Weng, Jian; Zhang, Zhihong; Chen, Wei; Liu, SijinACS Nano (2016), 10 (3), 3267-3281CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)The unique physicochem. properties of two-dimensional (2D) graphene oxide (GO) could greatly benefit the biomedical field; however, recent research demonstrated that GO could induce in vitro and in vivo toxicity. We detd. the mechanism of GO induced toxicity, and our in vitro expts. revealed that pristine GO could impair cell membrane integrity and functions including regulation of membrane- and cytoskeleton-assocd. genes, membrane permeability, fluidity and ion channels. Furthermore, GO induced platelet depletion, pro-inflammatory response and pathol. changes of lung and liver in mice. To improve the biocompatibility of pristine GO, we prepd. a series of GO derivs. including aminated GO (GO-NH2), poly(acrylamide)-functionalized GO (GO-PAM), poly(acrylic acid)-functionalized GO (GO-PAA) and poly(ethylene glycol)-functionalized GO (GO-PEG), and compared their toxicity with pristine GO in vitro and in vivo. Among these GO derivs., GO-PEG and GO-PAA induced less toxicity than pristine GO, and GO-PAA was the most biocompatible one in vitro and in vivo. The differences in biocompatibility were due to the differential compns. of protein corona, esp. IgG, formed on their surfaces that det. their cell membrane interaction and cellular uptake, the extent of platelet depletion in blood, thrombus formation under short-term exposure and the pro-inflammatory effects under long-term exposure. Overall, our combined data delineated the key mol. mechanisms underlying the in vivo and in vitro biol. behaviors and toxicity of pristine GO, and identified a safer GO deriv. that could be used for future applications.
], [CAS], Google Scholar120https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC28XitFeqsLg%253D&md5=11b9041f461cbac026bff16cbddcc5ccImproved In Vitro and In Vivo Biocompatibility of Graphene Oxide through Surface Modification: Poly(Acrylic Acid)-Functionalization is Superior to PEGylationXu, Ming; Zhu, Jianqiang; Wang, Fanfan; Xiong, Yunjing; Wu, Yakun; Wang, Qiuquan; Weng, Jian; Zhang, Zhihong; Chen, Wei; Liu, SijinACS Nano (2016), 10 (3), 3267-3281CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)The unique physicochem. properties of two-dimensional (2D) graphene oxide (GO) could greatly benefit the biomedical field; however, recent research demonstrated that GO could induce in vitro and in vivo toxicity. We detd. the mechanism of GO induced toxicity, and our in vitro expts. revealed that pristine GO could impair cell membrane integrity and functions including regulation of membrane- and cytoskeleton-assocd. genes, membrane permeability, fluidity and ion channels. Furthermore, GO induced platelet depletion, pro-inflammatory response and pathol. changes of lung and liver in mice. To improve the biocompatibility of pristine GO, we prepd. a series of GO derivs. including aminated GO (GO-NH2), poly(acrylamide)-functionalized GO (GO-PAM), poly(acrylic acid)-functionalized GO (GO-PAA) and poly(ethylene glycol)-functionalized GO (GO-PEG), and compared their toxicity with pristine GO in vitro and in vivo. Among these GO derivs., GO-PEG and GO-PAA induced less toxicity than pristine GO, and GO-PAA was the most biocompatible one in vitro and in vivo. The differences in biocompatibility were due to the differential compns. of protein corona, esp. IgG, formed on their surfaces that det. their cell membrane interaction and cellular uptake, the extent of platelet depletion in blood, thrombus formation under short-term exposure and the pro-inflammatory effects under long-term exposure. Overall, our combined data delineated the key mol. mechanisms underlying the in vivo and in vitro biol. behaviors and toxicity of pristine GO, and identified a safer GO deriv. that could be used for future applications. - 121Belling, J. N.; Jackman, J. A.; Yorulmaz • Avsar, S.; Park, J. H.; Wang, Y.; Potroz, M. G.; Ferhan, A. R.; Weiss, P. S.; Cho, N.-J. Ukryte właściwości immunologiczne tlenku grafenu możliwe dzięki powierzchniowo wiązanemu czynnikowi dopełniacza H. ACS Nano 2016, 10, 10161– 10172, DOI: 10.1021/acsnano.6b05409[ACS Full Text
 ], [CAS], Google Scholar121https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC28XhslGhtbnE&md5=969b214b6704b9863f3174eab4d1ddd1Stealth Immune Properties of Graphene Oxide Enabled by Surface-Bound Complement Factor HBelling, Jason N.; Jackman, Joshua A.; Yorulmaz Avsar, Saziye; Park, Jae Hyeon; Wang, Yan; Potroz, Michael G.; Ferhan, Abdul Rahim; Weiss, Paul S.; Cho, Nam-JoonACS Nano (2016), 10 (11), 10161-10172CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)With mounting evidence that nanomaterials can trigger adverse innate immune responses such as complement activation, there is increasing attention to the development of strategies that mask the complement-activating properties of nanomaterials. The current gold std. to reduce complement activation of nanomaterials is the covalent attachment of polymer coatings on nanomaterial surfaces, even though this strategy provides only moderate protection against complement activation. Akin to protein coronas that form on nanomaterial surfaces in physiol. fluids, noncovalent strategies based on protein adsorption would offer a simplified, biomimetic approach to mitigate complement activation. Herein, we demonstrate that precoating graphene-based nanomaterials with purified, natural proteins enables regulatory control of nanomaterial-triggered complement activation. When the graphene-based nanomaterials were coated with complement factor H, nearly complete protection (>90% redn.) against complement activation (a "stealth effect") was achieved. By contrast, coating the nanomaterials with a passivating layer of bovine or human serum albumins achieved moderate protection (∼40% redn.), whereas IgG amplified complement activation by several-fold. Taken together, our results demonstrate that surface-bound factor H, as well as serum albumins, can prevent graphene oxide-triggered complement activation, thereby offering a facile approach to inhibit complement activation completely down to naturally occurring levels.
], [CAS], Google Scholar121https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC28XhslGhtbnE&md5=969b214b6704b9863f3174eab4d1ddd1Stealth Immune Properties of Graphene Oxide Enabled by Surface-Bound Complement Factor HBelling, Jason N.; Jackman, Joshua A.; Yorulmaz Avsar, Saziye; Park, Jae Hyeon; Wang, Yan; Potroz, Michael G.; Ferhan, Abdul Rahim; Weiss, Paul S.; Cho, Nam-JoonACS Nano (2016), 10 (11), 10161-10172CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)With mounting evidence that nanomaterials can trigger adverse innate immune responses such as complement activation, there is increasing attention to the development of strategies that mask the complement-activating properties of nanomaterials. The current gold std. to reduce complement activation of nanomaterials is the covalent attachment of polymer coatings on nanomaterial surfaces, even though this strategy provides only moderate protection against complement activation. Akin to protein coronas that form on nanomaterial surfaces in physiol. fluids, noncovalent strategies based on protein adsorption would offer a simplified, biomimetic approach to mitigate complement activation. Herein, we demonstrate that precoating graphene-based nanomaterials with purified, natural proteins enables regulatory control of nanomaterial-triggered complement activation. When the graphene-based nanomaterials were coated with complement factor H, nearly complete protection (>90% redn.) against complement activation (a "stealth effect") was achieved. By contrast, coating the nanomaterials with a passivating layer of bovine or human serum albumins achieved moderate protection (∼40% redn.), whereas IgG amplified complement activation by several-fold. Taken together, our results demonstrate that surface-bound factor H, as well as serum albumins, can prevent graphene oxide-triggered complement activation, thereby offering a facile approach to inhibit complement activation completely down to naturally occurring levels. - 122Matesanz, M.-C.; Vila, M.; Feito, M.-J.; Linares, J.; Gonçalves, G.; M. Vallet-Regi; Marques, P.-A. A. P.; Portolés, M.-T. Wpływ nanoarkuszy tlenku grafenu zlokalizowanych na włóknach F-aktyny na zmiany cyklu komórkowego. Biomateriały 2013, 34, 1562–1569, DOI: 10.1016/j.biomaterials.2012.11.001[Crossref], [PubMed], [CAS], Google Scholar122https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC38XhslWrsLfI&md5=fa540857176e69072203a4dd7f9c01c5The effects of graphene oxide nanosheets localized on F-actin filaments on cell-cycle alterationsMatesanz, Maria-Concepcion; Vila, Mercedes; Feito, Maria-Jose; Linares, Javier; Goncalves, Gil; Vallet-Regi, Maria; Marques, Paula-Alexandrina A. P.; Portoles, Maria-TeresaBiomaterials (2013), 34 (5), 1562-1569CODEN: BIMADU; ISSN:0142-9612. (Elsevier Ltd.)Graphene oxide (GO) is considered to be a promising nanomaterial for biomedical applications due to its small two-dimensional shape besides its elec. and mech. properties. However, only a few data concerning the cell responses to this material have been described and the GO biocompatibility has not been yet fully assessed. In the present study, graphene oxide nanosheets (GOs) decorated with 1-arm (1-GOs) and 6-arm (6-GOs) poly(ethylene glycol-amine) (PEG) have been incubated with cultured Saos-2 osteoblasts, MC3T3-E1 preosteoblasts and RAW-264.7 macrophages to analyze several key cell markers for in vitro biocompatibility evaluation. The results demonstrate that, after internalization, GO nanosheets are localized on F-actin filaments inducing cell-cycle alterations, apoptosis and oxidative stress in these cell types. The obsd. GOs effects must be considered in further studies focused on photothermal cancer therapy as a synergistic factor.
- 123Feito, M. J.; Vila, M.; Matesanz, M. C.; Linares, J.; Gonçalves, G.; Marques, P. A. A. P.; M. Vallet-Regí; Rojo, J. M.; Portolés, M. T. Ocena in vitro nanoarkuszy tlenku grafenu pod kątem funkcji immunologicznej. J. Interfejs koloidowy Sci. 2014, 432, 221–228, DOI: 10.1016/j.jcis.2014.07.004[Crossref], [PubMed], [CAS], Google Scholar123https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2cXht1GmsrrE&md5=40c342878ecea2e2f2efbb5e5d23b66eIn vitro evaluation of graphene oxide nanosheets on immune functionFeito, M. J.; Vila, M.; Matesanz, M. C.; Linares, J.; Goncalves, G.; Marques, P. A. A. P.; Vallet-Regi, M.; Rojo, J. M.; Portoles, M. T.Journal of Colloid and Interface Science (2014), 432 (), 221-228CODEN: JCISA5; ISSN:0021-9797. (Elsevier B.V.)Graphene oxide (GO) has attracted the scientific community attention due to its novel properties and wide range of potential applications including hyperthermia cancer therapy. However, little is known about the GO effects on the immune function which involves both innate and adaptive defense mechanisms through the activation of different cell populations and secretion of several cytokines. The effect of different GO nanosheets designed for hyperthermia cancer therapy on macrophage and lymphocyte function should be detd. before using GO for this application. The effects of GO nanosheets with 1 (1-GOs) and 6 arms (6-GOs) of polyethylene glycol on RAW-264.7 macrophages and primary splenocytes (as approxn. to the in vivo situation) were evaluated through the proinflammatory cytokine secretion and the modulation of cell proliferation in the presence of specific stimuli for either T-lymphocytes (Con A, anti-CD3 antibody) or B-lymphocytes/macrophages (lipopolysaccharide). 6-GOs significantly increased the secretion of TNF-α by RAW-264.7 macrophages without alteration of IL-6 and IL-1β levels. The treatment of primary splenocytes with 1-GOs and 6-GOs in the presence of Con A, anti-CD3 antibody and lipopolysaccharide, produced significant dose-dependent decreases of cell proliferation and IL-6 levels, revealing weak inflammatory properties of GOs which are favorable for hyperthermia cancer therapy.
- 124Luo, N.; Ni, D.; Yue, H.; Wei, W.; Ma, G. Grafen inżynierii powierzchniowej kieruje rozbieżne wyniki biologiczne w kierunku makrofagów. ACS Appl. Mater. Interfejsy 2015, 7, 5239– 5247, DOI: 10.1021/am5084607
- 125Luo, N.; Weber, J. K.; Wang, S.; Luan, B.; Yue, H.; Xi, X.; Du, J.; Yang, Z.; Wei, W.; Zhou, R.; Ma, G. PEGylowany tlenek grafenu wywołuje silne odpowiedzi immunologiczne pomimo pasywacji powierzchniowej. Nat. Commun. 2017, 8, 14537, DOI: 10.1038/ncomms14537[Crossref], [PubMed], [CAS], Google Scholar125https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2sXjsVGisLg%253D&md5=7151a492f80e7a3b3ea7fab18b520c73PEGylated graphene oxide elicits strong immunological responses despite surface passivationLuo, Nana; Weber, Jeffrey K.; Wang, Shuang; Luan, Binquan; Yue, Hua; Xi, Xiaobo; Du, Jing; Yang, Zaixing; Wei, Wei; Zhou, Ruhong; Ma, GuanghuiNature Communications (2017), 8 (), 14537CODEN: NCAOBW; ISSN:2041-1723. (Nature Publishing Group)Engineered nanomaterials promise to transform medicine at the bio-nano interface. However, it is important to elucidate how synthetic nanomaterials interact with crit. biol. systems before such products can be safely utilized in humans. Past evidence suggests that polyethylene glycol-functionalized (PEGylated) nanomaterials are largely biocompatible and elicit less dramatic immune responses than their pristine counterparts. We here report results that contradict these findings. We find that PEGylated graphene oxide nanosheets (nGO-PEGs) stimulate potent cytokine responses in peritoneal macrophages, despite not being internalized. Atomistic mol. dynamics simulations support a mechanism by which nGO-PEGs preferentially adsorb onto and/or partially insert into cell membranes, thereby amplifying interactions with stimulatory surface receptors. Further expts. demonstrate that nGO-PEG indeed provokes cytokine secretion by enhancing integrin β8-related signalling pathways. The present results inform that surface passivation does not always prevent immunol. reactions to 2D nanomaterials but also suggest applications for PEGylated nanomaterials wherein immune stimulation is desired.
- 126Wiemann, M.; A. Vennemann; Sauer, U. G.; Wiench, K.; Ma-Hock, L.; Landsiedel, R. Test in vitro alveolar macrofag do przewidywania krótkoterminowej toksyczności inhalacyjnej nanomateriałów. J. Nanobiotechnol. 2016, 14, 16, DOI: 10.1186/s12951-016-0164-2[Crossref], [PubMed], [CAS], Google Scholar126https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2sXis1eisLo%253D&md5=9853e6afcb20521bdd16383b353d9fbbAn in vitro alveolar macrophage assay for predicting the short-term inhalation toxicity of nanomaterialsWiemann, Martin; Vennemann, Antje; Sauer, Ursula G.; Wiench, Karin; Ma-Hock, Lan; Landsiedel, RobertJournal of Nanobiotechnology (2016), 14 (), 16/1-16/27CODEN: JNOAAO; ISSN:1477-3155. (BioMed Central Ltd.)Background: Most in vitro studies investigating nanomaterial pulmonary toxicity poorly correlate to in vivo inhalation studies. Alveolar macrophages (AMs) play an outstanding role during inhalation exposure since they effectively clear the alveoli from particles. This study addresses the applicability of an in vitro alveolar macrophage assay to distinguish biol. active from passive nanomaterials. Methods: Rat NR8383 alveolar macrophages were exposed to 18 inorg. nanomaterials, covering AlOOH, BaSO2, CeO2, Fe2O3, TiO2, ZrO2, and ZnO NMs, amorphous SiO2 and graphite nanoplatelets, and two nanosized org. pigments. ZrO2 and amorphous SiO2 were tested without and with surface functionalization. Non-nanosized quartz DQ12 and corundum were used as pos. and neg. controls, resp. The test materials were incubated with the cells in protein-free culture medium. Lactate dehydrogenase, glucuronidase, and tumor necrosis factor alpha were assessed after 16 h. In parallel, H2O2 was assessed after 1.5 h. Using the no-obsd.-adverse-effect concns. (NOAECs) from available rat short-term inhalation studies (STIS), the test materials were categorized as active (NOAEC < 10 mg/m3) or passive. Results:In vitro data reflected the STIS categorization if a particle surface area-based threshold of <6000 mm2/mL was used to det. the biol. relevance of the lowest obsd. significant in vitro effects. Significant effects that were recorded above this threshold were assessed as resulting from test material-unspecific cellular 'overload'. Test materials were assessed as active if ≥2 of the 4 in vitro parameters undercut this threshold. They were assessed as passive if 0 or 1 parameter was altered. An overall assay accuracy of 95 % was achieved. Conclusions: The in vitro NR8383 alveolar macrophage assay allows distinguishing active from passive nanomaterials. Thereby, it allows detg. whether in vivo short-term inhalation testing is necessary for hazard assessment. Results may also be used to group nanomaterials by biol. activity. Further work should aim at validating the assay.
- 127Mukherjee, S. P.; Lazzaretto, B.; Hultenby, K.; Newman, L.; Rodrigues, A. F.; Lozano, N.; Kostarelos, K.; Malmberg, P.; Fadeel, B. Tlenek grafenu wywołuje zmiany lipidowe błony i tworzenie zewnątrzkomórkowej pułapki neutrofilów. Chem. 2018, 4, 334-358, DOI: 10.1016/j.chempr.2017.12.017[Crossref], [CAS], Google Scholar127https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC1cXis1Shurc%253D&md5=e2529b3f746685f12a38aeed2bac7065Graphene Oxide Elicits Membrane Lipid Changes and Neutrophil Extracellular Trap FormationMukherjee, Sourav P.; Lazzaretto, Beatrice; Hultenby, Kjell; Newman, Leon; Rodrigues, Artur F.; Lozano, Neus; Kostarelos, Kostas; Malmberg, Per; Fadeel, BengtChem (2018), 4 (2), 334-358CODEN: CHEMVE; ISSN:2451-9294. (Cell Press)Understanding the biol. interactions of graphene-based materials is important for the safe use of these materials. Previous studies have explored the interaction between graphene oxide (GO) and macrophages but not the impact of GO on neutrophils, key cells of the immune system. Here, we synthesized GO sheets with differing lateral dimensions and showed by using an array of anal. and imaging techniques, including transmission and SEM, confocal microscopy, and time-of-flight secondary ion mass spectroscopy (ToF-SIMS), that GO elicited the formation of neutrophil extracellular traps (NETs). ToF-SIMS revealed pronounced perturbations of plasma membrane lipids, including a decrease in cholesterol and increased levels of oxidized cholesterol species. The induction of NETs was size dependent and assocd. with the prodn. of mitochondrial reactive oxygen species and calcium influx. Importantly, antioxidant treatment reduced the prodn. of NETs. These studies provide evidence that a previously undescribed biol. effect of GO manifests through direct effects on membrane lipids.
- 128J. Russier; León, V.; Orecchioni, M.; Hirata, E.; Virdis, P.; Fozza, C.; F. Sgarrella; Cuniberti, G.; Prato, M.; Vázquez, E.; Bianco, A.; Delogu, L. G. Kilkuwarstwowy grafen zabija selektywnie komórki nowotworowe od pacjentów z białaczką mielomonocytową. Angew. Chem., Int. Ed. 2017, 56, 3014–3019, DOI: 10.1002/anie.201700078[Crossref], [CAS], Google Scholar128https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2sXitVKnurc%253D&md5=e1e10e74bce00a2663cff7f18c732ea5Few-Layer Graphene Kills Selectively Tumor Cells from Myelomonocytic Leukemia PatientsRussier, Julie; Leon, Veronica; Orecchioni, Marco; Hirata, Eri; Virdis, Patrizia; Fozza, Claudio; Sgarrella, Francesco; Cuniberti, Gianaurelio; Prato, Maurizio; Vazquez, Ester; Bianco, Alberto; Delogu, Lucia G.Angewandte Chemie, International Edition (2017), 56 (11), 3014-3019CODEN: ACIEF5; ISSN:1433-7851. (Wiley-VCH Verlag GmbH & Co. KGaA)In the cure of cancer, a major cause of today's mortality, chemotherapy is the most common treatment, though serious frequent challenges are encountered by current anticancer drugs. We discovered that few-layer graphene (FLG) dispersions have a specific killer action on monocytes, showing neither toxic nor activation effects on other immune cells. We confirmed the therapeutic application of graphene on an aggressive type of cancer that is myelomonocytic leukemia, where the monocytes are in their malignant form. We demonstrated that graphene has the unique ability to target and boost specifically the necrosis of monocytic cancer cells. Moreover, the comparison between FLG and a common chemotherapeutic drug, etoposide, confirmed the higher specificity and toxicity of FLG. Since current chemotherapy treatments of leukemia still cause serious problems, these findings open the way to new and safer therapeutic approaches.
- 129Zhou, H.; Zhao, K.; Li, W.; Yang, N.; Liu, Y.; Chen, C.; Wei, T. The Interactions between Pristine Graphene and Macrophages and the Production of Cytokines/Chemokines via TLR- and NF-ΚB-Related Signaling Pathways. Biomaterials 2012, 33, 6933– 6942, DOI: 10.1016/j.biomaterials.2012.06.064[Crossref], [PubMed], [CAS], Google Scholar129https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC38XhtVaktrnL&md5=f8ebe6d7225d8dacea9c6501486ae425The interactions between pristine graphene and macrophages and the production of cytokines/chemokines via TLR- and NF-κB-related signaling pathwaysZhou, Hejiang; Zhao, Kai; Li, Wei; Yang, Na; Liu, Ying; Chen, Chunying; Wei, TaotaoBiomaterials (2012), 33 (29), 6933-6942CODEN: BIMADU; ISSN:0142-9612. (Elsevier Ltd.)Graphene may have attractive properties for some biomedical applications, but its potential adverse biol. effects, in particular, possible modulation of immune responses, require further investigation. Macrophages are one of the most important effector cells of the innate immune system, and play pivotal roles in the response to graphene exposure. We have previously reported that exposure of macrophages to high concns. of graphene triggers cell death via MAPK- and TGF-related pathways. However, little is known about the influence of exposure to low concns. of graphene on the function of macrophages. In the present investigation, we demonstrate the biol. effects of sub-cytotoxic concns. of com. pristine graphene on both primary murine macrophages and immortalized macrophages. Graphene significantly stimulates the secretion of Th1/Th2 cytokines including IL-1α, IL-6, IL-10, TNF-α and GM-CSF as well as chemokines such as MCP-1, MIP-1α, MIP-1β and RANTES, probably by activating TLR-mediated and NF-κB-dependent transcription. Furthermore, these graphene-induced factors alter the morphol. of naive macrophages by remodeling their actin assembly, decreasing their ability to adhere to the extracellular matrix, and attenuating their phagocytosis. This neg. feedback of the immune response of macrophages by graphene-induced factors may play an important role in the prevention of their over-activation after graphene exposure. These findings shed light on the interaction of graphene and macrophages in vitro. Further research is needed to systematically assess the biol. responses of graphene, both to improve its safety and to contribute to the design of new biol. applications.
- 130Li, Y.; Liu, Y.; Fu, Y.; Wei, T.; Le Guyader, L.; Gao, G.; Liu, R.-S.; Chang, Y.-Z.; Chen, C. The Triggering of Apoptosis in Macrophages by Pristine Graphene through the MAPK and TGF-Beta Signaling Pathways. Biomaterials 2012, 33, 402– 411, DOI: 10.1016/j.biomaterials.2011.09.091[Crossref], [PubMed], [CAS], Google Scholar130https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3MXhsVWkt7vM&md5=d043f49c7a23e66a4460069054b64f1cThe triggering of apoptosis in macrophages by pristine graphene through the MAPK and TGF-beta signaling pathwaysLi, Yang; Liu, Ying; Fu, Yujian; Wei, Taotao; Le Guyader, Laurent; Gao, Ge; Liu, Ru-Shi; Chang, Yan-Zhong; Chen, ChunyingBiomaterials (2012), 33 (2), 402-411CODEN: BIMADU; ISSN:0142-9612. (Elsevier Ltd.)With the development of nanotechnol. and the wide use of graphene, it has become necessary to assess the potential biol. adverse effects of graphene. However, most of the recent publications are focused on various modified graphenes. We demonstrated biol. effects of com. pristine graphene in murine RAW 264.7 macrophages, which is an important effector cells of the innate immune system. We found that the pristine graphene can induce cytotoxicity through the depletion of the mitochondrial membrane potential (MMP) and the increase of intracellular reactive oxygen species (ROS), then trigger apoptosis by activation of the mitochondrial pathway. The MAPKs (JNK, ERK and p38) as well as the TGF-beta-related signaling pathways were found to be activated in the pristine grapheme-treated cells, which activated Bim and Bax, two pro-apoptotic member of Bcl-2 protein family. Consequently, the caspase 3 and its downstream effector proteins such as PARP were activated and the execution of apoptosis was initiated. This study provides an insight for the suppression of the apoptosis induced by the graphene through the mitochondrial pathways, the MAPKs- and TGF-beta-related signaling pathways.
- 131Sasidharan, A.; Panchakarla, L. S.; Sadanandan, A. R.; Ashokan, A.; Chandran, P.; Girish, C. M.; Menon, D.; Nair, S. V.; Rao, C. N. R.; Koyakutty, M. Hemocompatibility and Macrophage Response of Pristine and Functionalized Graphene. Small 2012, 8, 1251– 1263, DOI: 10.1002/smll.201102393[Crossref], [PubMed], [CAS], Google Scholar131https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC38Xitlyguro%253D&md5=d81709c5605f862dc9c9068d8b351df8Hemocompatibility and Macrophage Response of Pristine and Functionalized GrapheneSasidharan, Abhilash; Panchakarla, Leela S.; Sadanandan, Aparna R.; Ashokan, Anusha; Chandran, Parwathy; Girish, Chundayil Madathil; Menon, Deepthy; Nair, Shantikumar V.; Rao, C. N. R.; Koyakutty, ManzoorSmall (2012), 8 (8), 1251-1263CODEN: SMALBC; ISSN:1613-6810. (Wiley-VCH Verlag GmbH & Co. KGaA)Graphene and its derivs. are being proposed for several important biomedical applications including drug delivery, gene delivery, contrast imaging, and anticancer therapy. Most of these applications demand i.v. injection of graphene and hence evaluation of its hemocompatibility is an essential prerequisite. Herein, both pristine and functionalized graphene are extensively characterized for their interactions with murine macrophage RAW 264.7 cells and human primary blood components. Detailed analyses of the potential uptake by macrophages, effects on its metabolic activity, membrane integrity, induction of reactive oxygen stress, hemolysis, platelet activation, platelet aggregation, coagulation cascade, cytokine induction, immune cell activation, and immune cell suppression are performed using optimized protocols for nanotoxicity evaluation. Electron microscopy, confocal Raman spectral mapping, and confocal fluorescence imaging studies show active interaction of both the graphene systems with macrophage cells, and the reactive oxygen species mediated toxicity effects of hydrophobic pristine samples are significantly reduced by surface functionalization. In the case of hemocompatibility, both types of graphene show excellent compatibility with red blood cells, platelets, and plasma coagulation pathways, and minimal alteration in the cytokine expression by human peripheral blood mononuclear cells. Further, both samples do not cause any premature immune cell activation or suppression up to a relatively high concn. of 75 μg mL-1 after 72 h of incubation under in vitro conditions. This study clearly suggests that the obsd. toxicity effects of pristine graphene towards macrophage cells can be easily averted by surface functionalization and both the systems show excellent hemocompatibility.
- 132Figarol, A.; Pourchez, J.; Boudard, D.; Forest, V.; Akono, C.; Tulliani, J.-M.; Lecompte, J.-P.; Cottier, M.; Bernache-Assollant, D.; Grosseau, P. In Vitro Toxicity of Carbon Nanotubes, Nano-Graphite and Carbon Black, Similar Impacts of Acid Functionalization. Toxicol. In Vitro 2015, 30, 476– 485, DOI: 10.1016/j.tiv.2015.09.014
- 133Li, Y.; Yuan, H.; von dem Bussche, A.; Creighton, M.; Hurt, R. H.; Kane, A. B.; Gao, H. Graphene Microsheets Enter Cells through Spontaneous Membrane Penetration at Edge Asperities and Corner Sites. Proc. Natl. Acad. Sci. U. S. A. 2013, 110, 12295– 12300, DOI: 10.1073/pnas.1222276110[Crossref], [PubMed], [CAS], Google Scholar133https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3sXht1emu7vL&md5=6857eb72d9a20857dfd8b5f6f6c491a7Graphene microsheets enter cells through spontaneous membrane penetration at edge asperities and corner sitesLi, Yinfeng; Yuan, Hongyan; von dem Bussche, Annette; Creighton, Megan; Hurt, Robert H.; Kane, Agnes B.; Gao, HuajianProceedings of the National Academy of Sciences of the United States of America (2013), 110 (30), 12295-12300,S12295/1-S12295/11CODEN: PNASA6; ISSN:0027-8424. (National Academy of Sciences)Understanding and controlling the interaction of graphene-based materials with cell membranes is key to the development of graphene-enabled biomedical technologies and to the management of graphene health and safety issues. Very little is known about the fundamental behavior of cell membranes exposed to ultrathin 2D synthetic materials. Here we investigate the interactions of graphene and few-layer graphene (FLG) microsheets with three cell types and with model lipid bilayers by combining coarse-grained mol. dynamics (MD), all-atom MD, anal. modeling, confocal fluorescence imaging, and electron microscopic imaging. The imaging expts. show edge-first uptake and complete internalization for a range of FLG samples of 0.5- to 10-μm lateral dimension. In contrast, the simulations show large energy barriers relative to kBT for membrane penetration by model graphene or FLG microsheets of similar size. More detailed simulations resolve this paradox by showing that entry is initiated at corners or asperities that are abundant along the irregular edges of fabricated graphene materials. Local piercing by these sharp protrusions initiates membrane propagation along the extended graphene edge and thus avoids the high energy barrier calcd. in simple idealized MD simulations. We propose that this mechanism allows cellular uptake of even large multilayer sheets of micrometer-scale lateral dimension, which is consistent with our multimodal bioimaging results for primary human keratinocytes, human lung epithelial cells, and murine macrophages.
- 134Orecchioni, M.; Bedognetti, D.; Newman, L.; Fuoco, C.; Spada, F.; Hendrickx, W.; Marincola, F. M.; Sgarrella, F.; Rodrigues, A. F.; Ménard-Moyon, C.; Cesareni, G.; Kostarelos, K.; Bianco, A.; Delogu, L. G. Single-Cell Mass Cytometry and Transcriptome Profiling Reveal the Impact of Graphene on Human Immune Cells. Nat. Commun. 2017, 8, 1109, DOI: 10.1038/s41467-017-01015-3[Crossref], [PubMed], [CAS], Google Scholar134https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A280%3ADC%252BC1M7js1ymtw%253D%253D&md5=299377d4ed810826c0596ffeb3a5a8ffSingle-cell mass cytometry and transcriptome profiling reveal the impact of graphene on human immune cellsOrecchioni Marco; Sgarrella Francesco; Delogu Lucia G; Bedognetti Davide; Hendrickx Wouter; Newman Leon; Rodrigues Artur Filipe; Kostarelos Kostas; Fuoco Claudia; Spada Filomena; Cesareni Gianni; Marincola Francesco M; Marincola Francesco M; Menard-Moyon Cecilia; Bianco Alberto; Delogu Lucia GNature communications (2017), 8 (1), 1109 ISSN:.Understanding the biomolecular interactions between graphene and human immune cells is a prerequisite for its utilization as a diagnostic or therapeutic tool. To characterize the complex interactions between graphene and immune cells, we propose an integrative analytical pipeline encompassing the evaluation of molecular and cellular parameters. Herein, we use single-cell mass cytometry to dissect the effects of graphene oxide (GO) and GO functionalized with amino groups (GONH2) on 15 immune cell populations, interrogating 30 markers at the single-cell level. Next, the integration of single-cell mass cytometry with genome-wide transcriptome analysis shows that the amine groups reduce the perturbations caused by GO on cell metabolism and increase biocompatibility. Moreover, GONH2 polarizes T-cell and monocyte activation toward a T helper-1/M1 immune response. This study describes an innovative approach for the analysis of the effects of nanomaterials on distinct immune cells, laying the foundation for the incorporation of single-cell mass cytometry on the experimental pipeline.
- 135Kotchey, G. P.; Allen, B. L.; Vedala, H.; Yanamala, N.; Kapralov, A. A.; Tyurina, Y. Y.; Klein-Seetharaman, J.; Kagan, V. E.; Star, A. The Enzymatic Oxidation of Graphene Oxide. ACS Nano 2011, 5, 2098– 2108, DOI: 10.1021/nn103265h[ACS Full Text
 ], [CAS], Google Scholar135https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3MXisVWlt7Y%253D&md5=99e0e84eec84028f107b63619527e1ebThe Enzymatic Oxidation of Graphene OxideKotchey, Gregg P.; Allen, Brett L.; Vedala, Harindra; Yanamala, Naveena; Kapralov, Alexander A.; Tyurina, Yulia Y.; Klein-Seetharaman, Judith; Kagan, Valerian E.; Star, AlexanderACS Nano (2011), 5 (3), 2098-2108CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)Two-dimensional graphitic carbon is a new material with many emerging applications, and studying its chem. properties is an important goal. Here, the authors reported a new phenomenon - the enzymic oxidn. of a single layer of graphitic carbon by horseradish peroxidase (HRP). In the presence of low concns. of hydrogen peroxide (∼40 μM), HRP catalyzed the oxidn. of graphene oxide, which resulted in the formation of holes on its basal plane. During the same period of anal., HRP failed to oxidize chem. reduced graphene oxide (RGO). The enzymic oxidn. was characterized by Raman, UV-visible, ESR, Fourier transform IR spectroscopy, TEM, at. force microscopy, SDS-PAGE, and gas chromatog.-mass spectrometry. Computational docking studies indicated that HRP was preferentially bound to the basal plane rather than the edge for both graphene oxide and RGO. Owing to the more dynamic nature of HRP on graphene oxide, the heme active site of HRP was in closer proximity to graphene oxide compared to RGO, thereby facilitating the oxidn. of the basal plane of graphene oxide. The authors also studied the electronic properties of the reduced intermediate product, holey reduced graphene oxide (hRGO), using field-effect transistor (FET) measurements. While RGO exhibited a V-shaped transfer characteristic similar to a single layer of graphene that was attributed to its zero band gap, hRGO demonstrated a p-type semiconducting behavior with a pos. shift in the Dirac points. This p-type behavior rendered hRGO, which can be conceptualized as interconnected graphene nanoribbons, as a potentially attractive material for FET sensors.
], [CAS], Google Scholar135https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3MXisVWlt7Y%253D&md5=99e0e84eec84028f107b63619527e1ebThe Enzymatic Oxidation of Graphene OxideKotchey, Gregg P.; Allen, Brett L.; Vedala, Harindra; Yanamala, Naveena; Kapralov, Alexander A.; Tyurina, Yulia Y.; Klein-Seetharaman, Judith; Kagan, Valerian E.; Star, AlexanderACS Nano (2011), 5 (3), 2098-2108CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)Two-dimensional graphitic carbon is a new material with many emerging applications, and studying its chem. properties is an important goal. Here, the authors reported a new phenomenon - the enzymic oxidn. of a single layer of graphitic carbon by horseradish peroxidase (HRP). In the presence of low concns. of hydrogen peroxide (∼40 μM), HRP catalyzed the oxidn. of graphene oxide, which resulted in the formation of holes on its basal plane. During the same period of anal., HRP failed to oxidize chem. reduced graphene oxide (RGO). The enzymic oxidn. was characterized by Raman, UV-visible, ESR, Fourier transform IR spectroscopy, TEM, at. force microscopy, SDS-PAGE, and gas chromatog.-mass spectrometry. Computational docking studies indicated that HRP was preferentially bound to the basal plane rather than the edge for both graphene oxide and RGO. Owing to the more dynamic nature of HRP on graphene oxide, the heme active site of HRP was in closer proximity to graphene oxide compared to RGO, thereby facilitating the oxidn. of the basal plane of graphene oxide. The authors also studied the electronic properties of the reduced intermediate product, holey reduced graphene oxide (hRGO), using field-effect transistor (FET) measurements. While RGO exhibited a V-shaped transfer characteristic similar to a single layer of graphene that was attributed to its zero band gap, hRGO demonstrated a p-type semiconducting behavior with a pos. shift in the Dirac points. This p-type behavior rendered hRGO, which can be conceptualized as interconnected graphene nanoribbons, as a potentially attractive material for FET sensors. - 136Zhang, C.; Chen, S.; Alvarez, P. J. J.; Chen, W. Reduced Graphene Oxide Enhances Horseradish Peroxidase Stability by Serving as Radical Scavenger and Redox Mediator. Carbon 2015, 94, 531– 538, DOI: 10.1016/j.carbon.2015.07.036[Crossref], [CAS], Google Scholar136https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2MXhtFyltLfM&md5=c5ecfa8a3062270d83a1fd3a38772336Reduced graphene oxide enhances horseradish peroxidase stability by serving as radical scavenger and redox mediatorZhang, Chengdong; Chen, Silong; Alvarez, Pedro J. J.; Chen, WeiCarbon (2015), 94 (), 531-538CODEN: CRBNAH; ISSN:0008-6223. (Elsevier Ltd.)Graphene-based nanomaterials have been widely studied as high-performance matrixes for enzyme immobilization and in the development of biosensors. Surface O-functionalities of graphene induce changes in chem. reactivity and electronic cond. of nanomaterials and may interfere with enzymic processes; however, the mechanisms are not fully understood. We compare the effects of three com. available graphene-based nanomaterials, namely a graphene, a graphene oxide (GO), and a reduced graphene oxide (RGO), on the activity/stability of horseradish peroxidase (HRP). Both graphene and GO significantly reduced enzyme stability by altering enzyme conformation, which was evidenced by CD spectroscopy. However, RGO improved enzyme stability up to 7-fold. This increased stability was attributed to the capability of RGO to quench superoxide radicals, which were primarily responsible for the enzyme deactivation. The basal plane of RGO, mainly through quinone moieties, may act as a redox mediator to facilitate enzymic turnover. Overall, the radical scavenging plus redox mediating capabilities of RGO suggest the potential for graphene-based nanomaterials to enhance enzyme engineering and enzyme-based sensors.
- 137Li, Y.; Feng, L.; Shi, X.; Wang, X.; Yang, Y.; Yang, K.; Liu, T.; Yang, G.; Liu, Z. Surface Coating-Dependent Cytotoxicity and Degradation of Graphene Derivatives: Towards the Design of Non-Toxic, Degradable Nano-Graphene. Small 2014, 10, 1544– 1554, DOI: 10.1002/smll.201303234[Crossref], [PubMed], [CAS], Google Scholar137https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3sXhvFOltLnN&md5=7d957ec738cb14bc2ed86811109ec653Surface Coating-Dependent Cytotoxicity and Degradation of Graphene Derivatives: Towards the Design of Non-Toxic, Degradable Nano-GrapheneLi, Yingjie; Feng, Liangzhu; Shi, Xiaoze; Wang, Xiaojing; Yang, Yinlong; Yang, Kai; Liu, Teng; Yang, Guangbao; Liu, ZhuangSmall (2014), 10 (8), 1544-1554CODEN: SMALBC; ISSN:1613-6810. (Wiley-VCH Verlag GmbH & Co. KGaA)With the increasing interests of using graphene and its derivs. in the area of biomedicine, the systematic evaluation of their potential risks and impacts to biol. systems is becoming critically important. In this work, we carefully study how surface coatings affect the cytotoxicity and extracellular biodegrdn. behaviors of graphene oxide (GO) and its derivs. Although naked GO could induce significant toxicity to macrophages, coating those two-dimensional nanomaterials with biocompatible macromols. such as polyethylene glycol (PEG) or bovine serum albumin (BSA) could greatly attenuate their toxicity, as independently evidenced by several different assay approaches. On the other hand, although GO can be gradually degraded through enzyme induced oxidization by horseradish peroxidase (HRP), both PEG and BSA coated GO or reduced GO (RGO) are rather resistant to HRP-induced biodegrdn. In order to obtain biocompatible functionalized GO that can still undergo enzymic degrdn., we conjugate PEG to GO via a cleavable disulfide bond, obtaining GO-SS-PEG with negligible toxicity and considerable degradability, promising for further biomedical applications.
- 138Kurapati, R.; Bonachera, F.; Russier, J.; Sureshbabu, A. R.; Ménard-Moyon, C.; Kostarelos, K.; Bianco, A. Covalent Chemical Functionalization Enhances the Biodegradation of Graphene Oxide. 2D Mater. 2018, 5, 015020, DOI: 10.1088/2053-1583/aa8f0a[Crossref], [CAS], Google Scholar138https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC1cXitlWkt7%252FM&md5=e499146a8790edc41f74dc075063f871Covalent chemical functionalization enhances the biodegradation of graphene oxideKurapati, Rajendra; Bonachera, Fanny; Russier, Julie; Sureshbabu, Adukamparai Rajukrishnan; Menard-Moyon, Cecilia; Kostarelos, Kostas; Bianco, Alberto2D Materials (2018), 5 (1), 015020/1-015020/11CODEN: DMATB7; ISSN:2053-1583. (IOP Publishing Ltd.)Biodegrdn. of the graphene-based materials is an emerging issue due to their estd. widespread usage in different industries. Indeed, a few concerns have been raised about their biopersistence. Here, we propose the design of surface-functionalized graphene oxide (GO) with the capacity to degrade more effectively compared to unmodified GO using horseradish peroxidase (HRP). For this purpose, we have functionalized the surface of GO with two well-known substrates of HRP namely coumarin and catechol. The biodegrdn. of all conjugates has been followed by Raman, dynamic light scattering and electron microscopy. Mol. docking and gel electrophoresis have been carried out to gain more insights into the interaction between GO conjugates and HRP. Our studies have revealed better binding when GO is functionalized with coumarin or catechol compared to control GOs. All results prove that GO functionalized with coumarin and catechol moieties display a faster and more efficient biodegrdn. over GO.
- 139Kurapati, R.; Russier, J.; Squillaci, M. A.; Treossi, E.; Ménard-Moyon, C.; Del Rio-Castillo, A. E.; Vazquez, E.; Samorì, P.; Palermo, V.; Bianco, A. Dispersibility-Dependent Biodegradation of Graphene Oxide by Myeloperoxidase. Small 2015, 11, 3985– 3994, DOI: 10.1002/smll.201500038[Crossref], [PubMed], [CAS], Google Scholar139https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2MXotVClu7o%253D&md5=6b1d363a023e256809fe95e39f42a2c8Dispersibility-dependent biodegradation of graphene oxide by myeloperoxidaseKurapati, Rajendra; Russier, Julie; Squillaci, Marco A.; Treossi, Emanuele; Menard-Moyon, Cecilia; Del Rio-Castillo, Antonio Esau; Vazquez, Ester; Samori, Paolo; Palermo, Vincenzo; Bianco, AlbertoSmall (2015), 11 (32), 3985-3994CODEN: SMALBC; ISSN:1613-6810. (Wiley-VCH Verlag GmbH & Co. KGaA)Understanding human health risks assocd. with the rapidly emerging graphene-based nanomaterials represents a great challenge because of the diversity of applications and the wide range of possible ways of exposure to this type of materials. Here, the biodegrdn. of graphene oxide (GO) sheets is reported by using myeloperoxidase (hMPO) derived from human neutrophils in the presence of a low concn. of H2O2. The degrdn. capability of the enzyme on 3 different GO samples contg. different degrees of oxidn. on their graphenic lattice, leading to a variable dispersibility in aq. media was compared; hMPO failed in degrading the most aggregated GO, but succeeded to completely metabolize highly dispersed GO samples. Spectroscopic and microscopic analyses provided unambiguous evidence for key roles played by hydrophilicity, neg. surface charge, and colloidal stability of the aq. GO in their biodegrdn. by hMPO.
- 140Mukherjee, S. P.; Gliga, A. R.; Lazzaretto, B.; Brandner, B.; Fielden, M.; Vogt, C.; Newman, L.; Rodrigues, A. F.; Shao, W.; Fournier, P. M.; Toprak, M. S.; Star, A.; Kostarelos, K.; Bhattacharya, K.; Fadeel, B. Graphene Oxide Is Degraded by Neutrophils and the Degradation Products Are Non-Genotoxic. Nanoscale 2018, 10, 1180– 1188, DOI: 10.1039/C7NR03552G[Crossref], [PubMed], [CAS], Google Scholar140https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2sXhvFyrs7nO&md5=c737f5199827451234cf2e958d6d7232Graphene oxide is degraded by neutrophils and the degradation products are non-genotoxicMukherjee, Sourav P.; Gliga, Anda R.; Lazzaretto, Beatrice; Brandner, Birgit; Fielden, Matthew; Vogt, Carmen; Newman, Leon; Rodrigues, Artur F.; Shao, Wenting; Fournier, Philip M.; Toprak, Muhammet S.; Star, Alexander; Kostarelos, Kostas; Bhattacharya, Kunal; Fadeel, BengtNanoscale (2018), 10 (3), 1180-1188CODEN: NANOHL; ISSN:2040-3372. (Royal Society of Chemistry)Neutrophils were previously shown to digest oxidized carbon nanotubes through a myeloperoxidase (MPO)-dependent mechanism, and graphene oxide (GO) was found to undergo degrdn. when incubated with purified MPO, but there are no studies to date showing degrdn. of GO by neutrophils. Here we produced endotoxin-free GO by a modified Hummers' method and asked whether primary human neutrophils stimulated to produce neutrophil extracellular traps or activated to undergo degranulation are capable of digesting GO. Biodegrdn. was assessed using a range of techniques including Raman spectroscopy, transmission electron microscopy, at. force microscopy, and mass spectrometry. GO sheets of differing lateral dimensions were effectively degraded by neutrophils. As the degrdn. products could have toxicol. implications, we also evaluated the impact of degraded GO on the bronchial epithelial cell line BEAS-2B. MPO-degraded GO was found to be non-cytotoxic and did not elicit any DNA damage. Taken together, these studies have shown that neutrophils can digest GO and that the biodegraded GO is non-toxic for human lung cells.
- 141Shvedova, A. A.; Kapralov, A. A.; Feng, W. H.; Kisin, E. R.; Murray, A. R.; Mercer, R. R.; St. Croix, C. M.; Lang, M. A.; Watkins, S. C.; Konduru, N. V.; Allen, B. L.; Conroy, J.; Kotchey, G. P.; Mohamed, B. M.; Meade, A. D.; Volkov, Y.; Star, A.; Fadeel, B.; Kagan, V. E. Impaired Clearance and Enhanced Pulmonary Inflammatory/Fibrotic Response to Carbon Nanotubes in Myeloperoxidase-Deficient Mice. PLoS One 2012, 7, e30923, DOI: 10.1371/journal.pone.0030923
- 142Kagan, V. E.; Kapralov, A. A.; St. Croix, C. M.; Watkins, S. C.; Kisin, E. R.; Kotchey, G. P.; Balasubramanian, K.; Vlasova, I. I.; Yu, J.; Kim, K.; Seo, W.; Mallampalli, R. K.; Star, A.; Shvedova, A. A. Lung Macrophages “Digest” Carbon Nanotubes Using a Superoxide/Peroxynitrite Oxidative Pathway. ACS Nano 2014, 8, 5610– 5621, DOI: 10.1021/nn406484b[ACS Full Text
 ], [CAS], Google Scholar142https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2cXosl2qs7Y%253D&md5=f943617b9d6ca76eb4c627b5764a3381Lung Macrophages "Digest" Carbon Nanotubes Using a Superoxide/Peroxynitrite Oxidative PathwayKagan, Valerian E.; Kapralov, Alexandr A.; St. Croix, Claudette M.; Watkins, Simon C.; Kisin, Elena R.; Kotchey, Gregg P.; Balasubramanian, Krishnakumar; Vlasova, Irina I.; Yu, Jaesok; Kim, Kang; Seo, Wanji; Mallampalli, Rama K.; Star, Alexander; Shvedova, Anna A.ACS Nano (2014), 8 (6), 5610-5621CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)In contrast to short-lived neutrophils, macrophages display persistent presence in the lung of animals after pulmonary exposure to carbon nanotubes. While effective in the clearance of bacterial pathogens and injured host cells, the ability of macrophages to "digest" carbonaceous nanoparticles has not been documented. Here, the authors used chem., biochem., and cell and animal models and demonstrated oxidative biodegrdn. of oxidatively functionalized single-walled carbon nanotubes via superoxide/NO* → peroxynitrite-driven oxidative pathways of activated macrophages facilitating clearance of nanoparticles from the lung.
], [CAS], Google Scholar142https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2cXosl2qs7Y%253D&md5=f943617b9d6ca76eb4c627b5764a3381Lung Macrophages "Digest" Carbon Nanotubes Using a Superoxide/Peroxynitrite Oxidative PathwayKagan, Valerian E.; Kapralov, Alexandr A.; St. Croix, Claudette M.; Watkins, Simon C.; Kisin, Elena R.; Kotchey, Gregg P.; Balasubramanian, Krishnakumar; Vlasova, Irina I.; Yu, Jaesok; Kim, Kang; Seo, Wanji; Mallampalli, Rama K.; Star, Alexander; Shvedova, Anna A.ACS Nano (2014), 8 (6), 5610-5621CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)In contrast to short-lived neutrophils, macrophages display persistent presence in the lung of animals after pulmonary exposure to carbon nanotubes. While effective in the clearance of bacterial pathogens and injured host cells, the ability of macrophages to "digest" carbonaceous nanoparticles has not been documented. Here, the authors used chem., biochem., and cell and animal models and demonstrated oxidative biodegrdn. of oxidatively functionalized single-walled carbon nanotubes via superoxide/NO* → peroxynitrite-driven oxidative pathways of activated macrophages facilitating clearance of nanoparticles from the lung. - 143Elgrabli, D.; Dachraoui, W.; Ménard-Moyon, C.; Liu, X. J.; Bégin, D.; Bégin-Colin, S.; Bianco, A.; Gazeau, F.; Alloyeau, D. Carbon Nanotube Degradation in Macrophages: Live Nanoscale Monitoring and Understanding of Biological Pathway. ACS Nano 2015, 9, 10113– 10124, DOI: 10.1021/acsnano.5b03708[ACS Full Text
 ], [CAS], Google Scholar143https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2MXhsVeqtr3J&md5=67ee157e24a3b4316d8058fbbb344c8eCarbon Nanotube Degradation in Macrophages: Live Nanoscale Monitoring and Understanding of Biological PathwayElgrabli, Dan; Dachraoui, Walid; Menard-Moyon, Cecilia; Liu, Xiao Jie; Begin, Dominique; Begin-Colin, Sylvie; Bianco, Alberto; Gazeau, Florence; Alloyeau, DamienACS Nano (2015), 9 (10), 10113-10124CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)Despite numerous applications, the cellular-clearance mechanism of multiwalled carbon nanotubes (MWCNTs) has not been clearly established yet. Previous in vitro studies showed the ability of oxidative enzymes to induce nanotube degrdn. Interestingly, these enzymes have the common capacity to produce reactive oxygen species (ROS). Here, we combined material and life science approaches for revealing an intracellular way taken by macrophages to degrade carbon nanotubes. We report the in situ monitoring of ROS-mediated MWCNT degrdn. by liq.-cell transmission electron microscopy. Two degrdn. mechanisms induced by hydroxyl radicals were extd. from these unseen dynamic nanoscale investigations: a non-site-specific thinning process of the walls and a site-specific transversal drilling process on pre-existing defects of nanotubes. Remarkably, similar ROS-induced structural injuries were obsd. on MWCNTs after aging into macrophages from 1 to 7 days. Beside unraveling oxidative transformations of MWCNT structure, we elucidated an important, albeit not exclusive, biol. pathway for MWCNT degrdn. in macrophages, involving NOX2 complex activation, superoxide prodn., and hydroxyl radical attack, which highlights the crit. role of oxidative stress in cellular processing of MWCNTs.
], [CAS], Google Scholar143https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2MXhsVeqtr3J&md5=67ee157e24a3b4316d8058fbbb344c8eCarbon Nanotube Degradation in Macrophages: Live Nanoscale Monitoring and Understanding of Biological PathwayElgrabli, Dan; Dachraoui, Walid; Menard-Moyon, Cecilia; Liu, Xiao Jie; Begin, Dominique; Begin-Colin, Sylvie; Bianco, Alberto; Gazeau, Florence; Alloyeau, DamienACS Nano (2015), 9 (10), 10113-10124CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)Despite numerous applications, the cellular-clearance mechanism of multiwalled carbon nanotubes (MWCNTs) has not been clearly established yet. Previous in vitro studies showed the ability of oxidative enzymes to induce nanotube degrdn. Interestingly, these enzymes have the common capacity to produce reactive oxygen species (ROS). Here, we combined material and life science approaches for revealing an intracellular way taken by macrophages to degrade carbon nanotubes. We report the in situ monitoring of ROS-mediated MWCNT degrdn. by liq.-cell transmission electron microscopy. Two degrdn. mechanisms induced by hydroxyl radicals were extd. from these unseen dynamic nanoscale investigations: a non-site-specific thinning process of the walls and a site-specific transversal drilling process on pre-existing defects of nanotubes. Remarkably, similar ROS-induced structural injuries were obsd. on MWCNTs after aging into macrophages from 1 to 7 days. Beside unraveling oxidative transformations of MWCNT structure, we elucidated an important, albeit not exclusive, biol. pathway for MWCNT degrdn. in macrophages, involving NOX2 complex activation, superoxide prodn., and hydroxyl radical attack, which highlights the crit. role of oxidative stress in cellular processing of MWCNTs. - 144Bai, H.; Jiang, W.; Kotchey, G. P.; Saidi, W. A.; Bythell, B. J.; Jarvis, J. M.; Marshall, A. G.; Robinson, R. A. S.; Star, A. Insight into the Mechanism of Graphene Oxide Degradation via the Photo-Fenton Reaction. J. Phys. Chem. C 2014, 118, 10519– 10529, DOI: 10.1021/jp503413s[ACS Full Text
 ], [CAS], Google Scholar144https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2cXmtVOnurs%253D&md5=98f13a2dbe6bc472a9910b159ef2560bInsight into the Mechanism of Graphene Oxide Degradation via the Photo-Fenton ReactionBai, Hao; Jiang, Wentao; Kotchey, Gregg P.; Saidi, Wissam A.; Bythell, Benjamin J.; Jarvis, Jacqueline M.; Marshall, Alan G.; Robinson, Rena A. S.; Star, AlexanderJournal of Physical Chemistry C (2014), 118 (19), 10519-10529CODEN: JPCCCK; ISSN:1932-7447. (American Chemical Society)Graphene is an attractive 2-dimensional C-based nanomaterial with great promise for applications including electronics, batteries, sensors, and composite materials. Recent work demonstrated C-based nanomaterials are degradable/biodegradable, but little work has been done to identify products formed during the degrdn. process. Since these products may have toxicol. implications and could leach into the environment or the human body, insights into mechanisms and structural elucidation remain important as C-based nanomaterials become commercialized. This work provided insight into a potential graphene oxide degrdn. mechanism via the photo-Fenton reaction. After 1 day of treatment, intermediate oxidn. products (150-1000 Da mol. wt.) were generated. Upon longer reaction times (i.e., days 2 and 3), these products were no longer present in high abundance, and the system was dominated by graphene quantum dots. Based on Fourier transform IR and mass spectrometry and NMR data, potential structures for these oxidn. products, which consist of oxidized polycyclic arom. hydrocarbons, are proposed.
], [CAS], Google Scholar144https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2cXmtVOnurs%253D&md5=98f13a2dbe6bc472a9910b159ef2560bInsight into the Mechanism of Graphene Oxide Degradation via the Photo-Fenton ReactionBai, Hao; Jiang, Wentao; Kotchey, Gregg P.; Saidi, Wissam A.; Bythell, Benjamin J.; Jarvis, Jacqueline M.; Marshall, Alan G.; Robinson, Rena A. S.; Star, AlexanderJournal of Physical Chemistry C (2014), 118 (19), 10519-10529CODEN: JPCCCK; ISSN:1932-7447. (American Chemical Society)Graphene is an attractive 2-dimensional C-based nanomaterial with great promise for applications including electronics, batteries, sensors, and composite materials. Recent work demonstrated C-based nanomaterials are degradable/biodegradable, but little work has been done to identify products formed during the degrdn. process. Since these products may have toxicol. implications and could leach into the environment or the human body, insights into mechanisms and structural elucidation remain important as C-based nanomaterials become commercialized. This work provided insight into a potential graphene oxide degrdn. mechanism via the photo-Fenton reaction. After 1 day of treatment, intermediate oxidn. products (150-1000 Da mol. wt.) were generated. Upon longer reaction times (i.e., days 2 and 3), these products were no longer present in high abundance, and the system was dominated by graphene quantum dots. Based on Fourier transform IR and mass spectrometry and NMR data, potential structures for these oxidn. products, which consist of oxidized polycyclic arom. hydrocarbons, are proposed. - 145Newman, L.; Lozano, N.; Zhang, M.; Iijima, S.; Yudasaka, M.; Bussy, C.; Kostarelos, K. Hypochlorite Degrades 2D Graphene Oxide Sheets Faster than 1D Oxidised Carbon Nanotubes and Nanohorns. npj 2D Mater Appl. 2017, 1, 39, DOI: 10.1038/s41699-017-0041-3
- 146Lalwani, G.; Xing, W.; Sitharaman, B. Enzymatic Degradation of Oxidized and Reduced Graphene Nanoribbons by Lignin Peroxidase. J. Mater. Chem. B 2014, 2, 6354– 6362, DOI: 10.1039/C4TB00976B[Crossref], [PubMed], [CAS], Google Scholar146https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2cXhtFyrs77I&md5=6111edbe822d119e291abad2aa2f99cfEnzymatic degradation of oxidized and reduced graphene nanoribbons by lignin peroxidaseLalwani, Gaurav; Xing, Weiliang; Sitharaman, BalajiJournal of Materials Chemistry B: Materials for Biology and Medicine (2014), 2 (37), 6354-6362CODEN: JMCBDV; ISSN:2050-7518. (Royal Society of Chemistry)The widespread use of graphene for various industrial and biomedical applications requires efficient remediation strategies during its disposal into waste streams. In addn., the interactions of graphene with the biota need thorough evaluation. In this study, we investigated the interactions of oxidized and reduced graphene oxide nanoribbons (GONRs and rGONRs) with lignin peroxidase (LiP), a ligninolytic enzyme released from white rot fungus. GONRs and rGONRs were treated with LiP in the presence and absence of veratryl alc. (VA; an electron transfer mediator and secondary metabolite of white rot fungi). Transmission electron microscopy showed the formation of large defects (holes) in the graphene sheet, which increased in diam. with increased degrdn. time. Raman spectroscopic anal. indicated that, within 96 h, in the presence of hydrogen peroxide and VA, the GONRs and rGONRs were completely and partially degraded by LiP, resp. Comparisons between groups with or without VA showed that degrdn. of GONRs was accelerated in the presence of VA. These results indicated that LiP could efficiently degrade GONRs and rGONRs in the presence of VA, suggesting that VA may be an essential factor needed to degrade rGONRs via LiP treatment. Thus, the wide presence of white rot fungi, and thereby LiP, in nature, could lead to efficient degrdn. of graphene present in the environment. Addnl., LiP, which has a higher theor. redox potential compared to horseradish peroxidases and myeloperoxidases, could be a better candidate for the environmental remediation of graphene.
- 147Liu, L.; Zhu, C.; Fan, M.; Chen, C.; Huang, Y.; Hao, Q.; Yang, J.; Wang, H.; Sun, D. Oxidation and Degradation of Graphitic Materials by Naphthalene-Degrading Bacteria. Nanoscale 2015, 7, 13619– 13628, DOI: 10.1039/C5NR02502H[Crossref], [PubMed], [CAS], Google Scholar147https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2MXhtFKisbnI&md5=d6a4b30177a9d6511df8c2f433a8ce49Oxidation and degradation of graphitic materials by naphthalene-degrading bacteriaLiu, Lin; Zhu, Chunlin; Fan, Mengmeng; Chen, Chuntao; Huang, Yang; Hao, Qingli; Yang, Jiazhi; Wang, Haiyan; Sun, DongpingNanoscale (2015), 7 (32), 13619-13628CODEN: NANOHL; ISSN:2040-3372. (Royal Society of Chemistry)Nowadays, biol. oxidizing graphitic materials is of great importance for practical applications as an eco-friendly and low-cost method. In this work, a bacterial strain is isolated from the contaminated soil in a graphite mine and its ability to oxidize graphite, graphene oxide (GO) and reduced graphene oxide (RGO) is confirmed. After being cultivated with bacteria, graphite is inhomogeneously oxidized, and moreover oxidized sheets exfoliated from graphite are detected in the medium. RGO shows a higher degree of oxidn. compared to graphite owing to more original defects, while GO breaks into small pieces and becomes full of holes. Both the holes in GO and the exfoliated sheets from graphite caused by bacteria have a size of below 1 μm, in agreement with the size of bacterial cells. Besides, the preliminary mechanism of the bacterial oxidn. is explored, suggesting that the contact between bacterial cells and materials promotes the oxidn. of graphitic materials. The ability of naphthalene-degrading bacteria to oxidize and degrade the graphitic materials shows the potential for producing GO in an eco-friendly way and degrading carbon nanomaterials in the environment.
- 148Zhang, Y.; Bai, Y.; Jia, J.; Gao, N.; Li, Y.; Zhang, R.; Jiang, G.; Yan, B. Perturbation of Physiological Systems by Nanoparticles. Chem. Soc. Rev. 2014, 43, 3762– 3809, DOI: 10.1039/C3CS60338E[Crossref], [PubMed], [CAS], Google Scholar148https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2cXmvFGhsbs%253D&md5=c4b0cd1141e0e945bda5e9e75c06a9cfPerturbation of physiological systems by nanoparticlesZhang, Yi; Bai, Yuhong; Jia, Jianbo; Gao, Ningning; Li, Yang; Zhang, Ruinan; Jiang, Guibin; Yan, BingChemical Society Reviews (2014), 43 (10), 3762-3809CODEN: CSRVBR; ISSN:0306-0012. (Royal Society of Chemistry)A review. Nanotechnol. is having a tremendous impact on our society. However, societal concerns about human safety under nanoparticle exposure may derail the broad application of this promising technol. Nanoparticles may enter the human body via various routes, including respiratory pathways, the digestive tract, skin contact, i.v. injection, and implantation. After absorption, nanoparticles are carried to distal organs by the bloodstream and the lymphatic system. During this process, they interact with biol. mols. and perturb physiol. systems. Although some ingested or absorbed nanoparticles are eliminated, others remain in the body for a long time. The human body is composed of multiple systems that work together to maintain physiol. homeostasis. The unexpected invasion of these systems by nanoparticles disturbs normal cell signaling, impairs cell and organ functions, and may even cause pathol. disorders. This review examines the comprehensive health risks of exposure to nanoparticles by discussing how nanoparticles perturb various physiol. systems as revealed by animal studies. The potential toxicity of nanoparticles to each physiol. system and the implications of disrupting the balance among systems are emphasized.
- 149Pelin, M.; Sosa, S.; Prato, M.; Tubaro, A. Occupational Exposure to Graphene Based Nanomaterials: Risk Assessment. Nanoscale 2018, 10, 15894– 15903, DOI: 10.1039/C8NR04950E[Crossref], [PubMed], [CAS], Google Scholar149https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC1cXhsFGlsbrL&md5=8668ab0056194ca6f5d304f622734bdfOccupational exposure to graphene based nanomaterials: risk assessmentPelin, Marco; Sosa, Silvio; Prato, Maurizio; Tubaro, AureliaNanoscale (2018), 10 (34), 15894-15903CODEN: NANOHL; ISSN:2040-3372. (Royal Society of Chemistry)Graphene-based materials (GBMs) are a family of novel materials including graphene, few layer graphene (FLG), graphene oxide (GO), reduced graphene oxide (rGO) and graphene nanoplatelets (GNP). Currently, the risk posed by them to human health is assocd. mainly with the occupational exposure during their industrial and small-scale prodn. or waste discharge. The most significant occupational exposure routes are inhalation, oral, cutaneous and ocular, inhalation being the majorly involved and most studied one. This manuscript presents a crit. up-to-date review of the available in vivo toxicity data of the most significant GBMs, after using these exposure routes. The few in vivo inhalation toxicity studies (limited to 5-days of repeated exposure and only one to 5 days per wk for 4 wk) indicate inflammatory/fibrotic effects at the pulmonary level, not always reversible after 14/90 days. More limited in vivo data are available for the oral and ocular exposure routes, whereas the studies on cutaneous toxicity are at the initial stage. A long persistence of GBMs in rodents is recorded, while contradictory genotoxic data are reported. Data gap identification is also provided. Based on the available data, the occupational exposure limit cannot be detd. More exptl. toxicity studies according to specific guidelines (tentatively validated for nanomaterials) and more information on the actual occupational exposure level to GBMs are needed. Furthermore, ADME (Absorption, Distribution, Metab., Excretion), genotoxicity, developmental and reproductive toxicity data related to the occupational exposure to GBMs have to be implemented. In addn., sub-chronic and/or chronic studies are still needed to completely exclude other toxic effects and/or carcinogenicity.
- 150Kenry, K.; Loh, K. P.; Lim, C. T. Molecular Interactions of Graphene Oxide with Human Blood Plasma Proteins. Nanoscale 2016, 8, 9425– 9441, DOI: 10.1039/C6NR01697A[Crossref], [PubMed], [CAS], Google Scholar150https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC28XltFGrt7s%253D&md5=77c10834b8e0a8277dac39f6c317a2b4Molecular interactions of graphene oxide with human blood plasma proteinsKenry; Loh, Kian Ping; Lim, Chwee TeckNanoscale (2016), 8 (17), 9425-9441CODEN: NANOHL; ISSN:2040-3372. (Royal Society of Chemistry)We investigate the mol. interactions between graphene oxide (GO) and human blood plasma proteins. To gain an insight into the bio-physico-chem. activity of GO in biol. and biomedical applications, we performed a series of biophys. assays to quantify the mol. interactions between GO with different lateral size distributions and the three essential human blood plasma proteins. We elucidate the various aspects of the GO-protein interactions, particularly, the adsorption, binding kinetics and equil., and conformational stability, through detn. of quant. parameters, such as GO-protein assocn. consts., binding cooperativity, and the binding-driven protein structural changes. We demonstrate that the mol. interactions between GO and plasma proteins are significantly dependent on the lateral size distribution and mean lateral sizes of the GO nanosheets and their subtle variations may markedly influence the GO-protein interactions. Consequently, we propose the existence of size-dependent mol. interactions between GO nanosheets and plasma proteins, and importantly, the presence of specific crit. mean lateral sizes of GO nanosheets in achieving very high assocn. and fluorescence quenching efficiency of the plasma proteins. We anticipate that this work will provide a basis for the design of graphene-based and other related nanomaterials for a plethora of biol. and biomedical applications.
- 151Mondal, S.; Thirupathi, R.; Rao, L. P.; Atreya, H. S. Unraveling the Dynamic Nature of Protein–graphene Oxide Interactions. RSC Adv. 2016, 6, 52539– 52548, DOI: 10.1039/C6RA03759C[Crossref], [CAS], Google Scholar151https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC28Xoslajsb0%253D&md5=67b77fd9e7b7d0c08ba5c3f321b4813dUnraveling the dynamic nature of protein-graphene oxide interactionsMondal, Somnath; Thirupathi, Ravula; Rao, Lokeswara P.; Atreya, Hanudatta S.RSC Advances (2016), 6 (58), 52539-52548CODEN: RSCACL; ISSN:2046-2069. (Royal Society of Chemistry)In recent years, Graphene Oxide (GO) and its derivs. have attracted significant attention owing to their unique physicochem., optical and conductive properties and have been used in a diverse range of applications. One of the properties of GO, which is important for its applications in biol. systems, is the nature of its interactions with biomols. such as proteins. We present here the dynamic aspects of the interaction of GO with human ubiquitin (8.6 kDa) unraveled using NMR (NMR) spectroscopy. This study, for the first time, reveals an interaction involving fast and reversible assocn.-dissocn. of the protein mols. from the surface of the GO sheet. The conformation of the protein is not affected due to the interactions. The interactions were found to be electrostatic in nature and are attributed to the polar functional groups present on the protein and GO sheets, which was verified by titrn. of GO with ubiquitin at different pH. Taken together, the study provides new insights into protein-GO interactions, and the NMR methods described will be of utility for probing such interactions in general while designing new chem. and biol. applications involving functionalized graphene oxide.
- 152Eedy, D. J. Carbon-Fibre-Induced Airborne Irritant Contact Dermatitis. Contact Dermatitis 1996, 35, 362– 363, DOI: 10.1111/j.1600-0536.1996.tb02418.x
- 153Shvedova, A.; Castranova, V.; Kisin, E.; Schwegler-Berry, D.; Murray, A.; Gandelsman, V.; Maynard, A.; Baron, P. Exposure to Carbon Nanotube Material: Assessment of Nanotube Cytotoxicity Using Human Keratinocyte Cells. J. Toxicol. Environ. Health, Part A 2003, 66, 1909– 1926, DOI: 10.1080/713853956[Crossref], [PubMed], [CAS], Google Scholar153https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BD3sXns1Gqsb0%253D&md5=e648e99fdcbaf6779d6ae2d29255e7f1Exposure to Carbon Nanotube Material: Assessment of Nanotube Cytotoxicity using Human Keratinocyte CellsShvedova, Anna; Castranova, Vincent; Kisin, Elena; Schwegler-Berry, Diane; Murray, Ashley; Gandelsman, Vadim; Maynard, Andrew; Baron, PaulJournal of Toxicology and Environmental Health, Part A (2003), 66 (20), 1909-1926CODEN: JTEHF8; ISSN:1528-7394. (Taylor & Francis, Inc.)Carbon nanotubes are new members of carbon allotropes similar to fullerenes and graphite. Because of their unique elec., mech., and thermal properties, carbon nanotubes are important for novel applications in the electronics, aerospace, and computer industries. Exposure to graphite and carbon materials has been assocd. with increased incidence of skin diseases, such as carbon fiber dermatitis, hyperkeratosis, and naevi. The authors investigated adverse effects of single-wall carbon nanotubes (SWCNT) using a cell culture of immortalized human epidermal keratinocytes (HaCaT). After 18 h of exposure of HaCaT to SWCNT, oxidative stress and cellular toxicity were indicated by formation of free radicals, accumulation of peroxidative products, antioxidant depletion, and loss of cell viability. Exposure to SWCNT also resulted in ultrastructural and morphol. changes in cultured skin cells. These data indicate that dermal exposure to unrefined SWCNT may lead to dermal toxicity due to accelerated oxidative stress in the skin of exposed workers.
- 154Pelin, M.; Fusco, L.; León, V.; Martín, C.; Criado, A.; Sosa, S.; Vázquez, E.; Tubaro, A.; Prato, M. Differential Cytotoxic Effects of Graphene and Graphene Oxide on Skin Keratinocytes. Sci. Rep. 2017, 7, 40572, DOI: 10.1038/srep40572[Crossref], [PubMed], [CAS], Google Scholar154https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2sXpslansA%253D%253D&md5=6d5cf887a80894cbc4c4802c837ee475Differential cytotoxic effects of graphene and graphene oxide on skin keratinocytesPelin, Marco; Fusco, Laura; Leon, Veronica; Martin, Cristina; Criado, Alejandro; Sosa, Silvio; Vazquez, Ester; Tubaro, Aurelia; Prato, MaurizioScientific Reports (2017), 7 (), 40572CODEN: SRCEC3; ISSN:2045-2322. (Nature Publishing Group)Impressive properties make graphene-based materials (GBMs) promising tools for nanoelectronics and biomedicine. However, safety concerns need to be cleared before mass prodn. of GBMs starts. As skin, together with lungs, displays the highest exposure to GBMs, it is of fundamental importance to understand what happens when GBMs get in contact with skin cells. The present study was carried out on HaCaT keratinocytes, an in vitro model of skin toxicity, on which the effects of four GBMs were evaluated: a few layer graphene, prepd. by ball-milling treatment (FLG), and three samples of graphene oxide (GOs, a research-grade GO1, and two com. GOs, GO2 and GO3). Even though no significant effects were obsd. after 24 h, after 72 h the less oxidized compd. (FLG) was the less cytotoxic, inducing mitochondrial and plasma-membrane damages with EC50s of 62.8μg/mL (WST-8 assay) and 45.5μg/mL (propidium iodide uptake), resp. By contrast, the largest and most oxidized compd., GO3, was the most cytotoxic, inducing mitochondrial and plasma-membrane damages with EC50s of 5.4 and 2.9μg/mL, resp. These results suggest that only high concns. and long exposure times to FLG and GOs could impair mitochondrial activity assocd. with plasma membrane damage, suggesting low cytotoxic effects at the skin level.
- 155Pelin, M.; Fusco, L.; Martín, C.; Sosa, S.; Frontiñán-Rubio, J.; González-Domínguez, J. M.; Durán-Prado, M.; Vázquez, E.; Prato, M.; Tubaro, A. Graphene and Graphene Oxide Induce ROS Production in Human HaCaT Skin Keratinocytes: The Role of Xanthine Oxidase and NADH Dehydrogenase. Nanoscale 2018, 10, 11820– 11830, DOI: 10.1039/C8NR02933D[Crossref], [PubMed], [CAS], Google Scholar155https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC1cXhtFSgtbnM&md5=41822560b94fae2258a1a3a11155f3b7Graphene and graphene oxide induce ROS production in human HaCaT skin keratinocytes: the role of xanthine oxidase and NADH dehydrogenasePelin, Marco; Fusco, Laura; Martin, Cristina; Sosa, Silvio; Frontinan-Rubio, Javier; Gonzalez-Dominguez, Jose Miguel; Duran-Prado, Mario; Vazquez, Ester; Prato, Maurizio; Tubaro, AureliaNanoscale (2018), 10 (25), 11820-11830CODEN: NANOHL; ISSN:2040-3372. (Royal Society of Chemistry)The extraordinary physicochem. properties of graphene-based nanomaterials (GBNs) make them promising tools in nanotechnol. and biomedicine. Considering the skin contact as one of the most feasible exposure routes to GBNs, the mechanism of toxicity of two GBNs (few-layer-graphene, FLG, and graphene oxide, GO) towards human HaCaT skin keratinocytes was investigated. Both materials induced a significant mitochondrial membrane depolarization: 72 h cell exposure to 100μg mL-1 FLG or GO increased mitochondrial depolarization by 44% and 56%, resp., while the pos. control valinomycin (0.1μg mL-1) increased mitochondrial depolarization by 48%. Since the effect was not prevented by cyclosporine-A, it appears to be unrelated to mitochondrial transition pore opening. By contrast, it seems to be mediated by reactive oxygen species (ROS) prodn.: FLG and GO induced time- and concn.-dependent cellular ROS prodn., significant already at the concn. of 0.4μg mL-1 after 24 h exposure. Among a panel of specific inhibitors of the major ROS-producing enzymes, diphenyliodonium, rotenone and allopurinol significantly reverted or even abolished FLG- or GO-induced ROS prodn. Intriguingly, the same inhibitors also significantly reduced FLG- or GO-induced mitochondrial depolarization and cytotoxicity. This study shows that FLG and GO induce a cytotoxic effect due to a sustained mitochondrial depolarization. This seems to be mediated by a significant cellular ROS prodn., caused by the activation of flavoprotein-based oxidative enzymes, such as NADH dehydrogenase and xanthine oxidase.
- 156Erf, G. F.; Falcon, D. M.; Sullivan, K. S.; Bourdo, S. E. T Lymphocytes Dominate Local Leukocyte Infiltration in Response to Intradermal Injection of Functionalized Graphene-Based Nanomaterial. J. Appl. Toxicol. 2017, 37, 1317– 1324, DOI: 10.1002/jat.3492[Crossref], [PubMed], [CAS], Google Scholar156https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2sXpvFymtLk%253D&md5=842901f9e05b9164d06023d5aea32306T lymphocytes dominate local leukocyte infiltration in response to intradermal injection of functionalized graphene-based nanomaterialErf, G. F.; Falcon, D. M.; Sullivan, K. S.; Bourdo, S. E.Journal of Applied Toxicology (2017), 37 (11), 1317-1324CODEN: JJATDK; ISSN:0260-437X. (John Wiley & Sons Ltd.)Graphene-based nanomaterials (GBN) have many potential biomedical applications. However, information regarding their biol. properties and interactions with cells and/or sol. factors within a complex tissue is limited. The objective of this study was to use the growing feather (GF) of chickens as a minimally invasive cutaneous test-site to assess and monitor leukocyte recruitment in response to intradermal GBN injection. Specifically, the dermis of 20 GFs per chicken was injected with 10 μl of phosphate-buffered saline (PBS)-vehicle or 10 μl of 300 μg ml-1 oxygen-functionalized (f) GBN (6 chickens/treatment). GFs were collected before- (0) and at 0.25, 1, 2, 3, 4, 5, and 7 days post-injection and used for leukocyte-population anal. of immunofluorescently stained pulp cell suspensions or histol. examn. Based on flow-cytometric cell population anal., lymphocytes and macrophages were the major leukocyte-populations infiltrating GFs in response to f-GBN presence. Compared with PBS-controls, levels of T cells (γδ-, αβ-, CD4- and CD8-T cells) were greatly elevated in f-GBN-injected GFs within 6 h and remained elevated throughout the 7-day examn. period. f-GBN's effects on local tissue leukocyte recruitment were not reflected in the blood, except for a higher percentage of lymphocytes on 7 days. These observations together with a visual examn. of f-GBN-injected GF tissue-sections suggest a delayed-type hypersensitivity-like, inflammatory cell-mediated response to the non-biodegradable f-GBN. The GF 'in vivo test-tube'system together with blood sampling provided unique insight into the time-course, qual., and quant. aspects of immune system activities initiated by the presence of f-GBN in a complex tissue of a living animal. Copyright © 2017 John Wiley & Sons, Ltd. StartCopTextCopyright © 2017 John Wiley & Sons, Ltd.
- 157Ou, L.; Song, B.; Liang, H.; Liu, J.; Feng, X.; Deng, B.; Sun, T.; Shao, L. Toxicity of Graphene-Family Nanoparticles: A General Review of the Origins and Mechanisms. Part. Part. Fibre Toxicol. 2016, 13, 57, DOI: 10.1186/s12989-016-0168-y[Crossref], [PubMed], [CAS], Google Scholar157https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2sXitVWqs7%252FJ&md5=e740c5bc6c7cbc7818df85fb2212af27Toxicity of graphene-family nanoparticles: a general review of the origins and mechanismsOu, Lingling; Song, Bin; Liang, Huimin; Liu, Jia; Feng, Xiaoli; Deng, Bin; Sun, Ting; Shao, LongquanParticle and Fibre Toxicology (2016), 13 (), 57/1-57/24CODEN: PFTABQ; ISSN:1743-8977. (BioMed Central Ltd.)Due to their unique physicochem. properties, graphene-family nanomaterials (GFNs) are widely used in many fields, esp. in biomedical applications. Currently, many studies have investigated the biocompatibility and toxicity of GFNs in vivo and in intro. Generally, GFNs may exert different degrees of toxicity in animals or cell models by following with different administration routes and penetrating through physiol. barriers, subsequently being distributed in tissues or located in cells, eventually being excreted out of the bodies. This review collects studies on the toxic effects of GFNs in several organs and cell models. We also point out that various factors det. the toxicity of GFNs including the lateral size, surface structure, functionalization, charge, impurities, aggregations, and corona effect ect. In addn., several typical mechanisms underlying GFN toxicity have been revealed, for instance, phys. destruction, oxidative stress, DNA damage, inflammatory response, apoptosis, autophagy, and necrosis. In these mechanisms, (toll-like receptors-) TLR-, transforming growth factor β- (TGF-β-) and tumor necrosis factor-alpha (TNF-α) dependent-pathways are involved in the signalling pathway network, and oxidative stress plays a crucial role in these pathways. In this review, we summarize the available information on regulating factors and the mechanisms of GFNs toxicity, and propose some challenges and suggestions for further investigations of GFNs, with the aim of completing the toxicol. mechanisms, and providing suggestions to improve the biol. safety of GFNs and facilitate their wide application.
- 158Roberts, J. R.; Mercer, R. R.; Stefaniak, A. B.; Seehra, M. S.; Geddam, U. K.; Chaudhuri, I. S.; Kyrlidis, A.; Kodali, V. K.; Sager, T.; Kenyon, A.; Bilgesu, S. A.; Eye, T.; Scabilloni, J. F.; Leonard, S. S.; Fix, N. R.; Schwegler-Berry, D.; Farris, B. Y.; Wolfarth, M. G.; Porter, D. W.; Castranova, V. Evaluation of Pulmonary and Systemic Toxicity Following Lung Exposure to Graphite Nanoplates: A Member of the Graphene-Based Nanomaterial Family. Part. Part. Fibre Toxicol. 2015, 13, 34, DOI: 10.1186/s12989-016-0145-5
- 159Schinwald, A.; Murphy, F. A.; Jones, A.; MacNee, W.; Donaldson, K. Graphene-Based Nanoplatelets: A New Risk to the Respiratory System as a Consequence of Their Unusual Aerodynamic Properties. ACS Nano 2012, 6, 736– 746, DOI: 10.1021/nn204229f[ACS Full Text
 ], [CAS], Google Scholar159https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3MXhs1GrurnP&md5=d6893da59ca929cc9cd61bad2a6a5d24Graphene-Based Nanoplatelets: A New Risk to the Respiratory System as a Consequence of Their Unusual Aerodynamic PropertiesSchinwald, Anja; Murphy, Fiona A.; Jones, Alan; MacNee, William; Donaldson, KenACS Nano (2012), 6 (1), 736-746CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)Graphene is a new nanomaterial with unusual and useful phys. and chem. properties. However, in the form of nanoplatelets this new, emerging material could pose unusual risks to the respiratory system after inhalation exposure. The graphene-based nanoplatelets used in this study are com. available and consist of several sheets of graphene (few-layer graphene). We first derived the respirability of graphene nanoplatelets (GP) from the basic principles of the aerodynamic behavior of plate-shaped particles which allowed us to calc. their aerodynamic diam. This showed that the nanoplatelets, which were up to 25 μm in diam., were respirable and so would deposit beyond the ciliated airways following inhalation. We therefore utilized models of pharyngeal aspiration and direct intrapleural installation of GP, as well as an in vitro model, to assess their inflammatory potential. These large but respirable GP were inflammogenic in both the lung and the pleural space. MIP-1α, MCP-1, MIP-2, IL-8, and IL-1β expression in the BAL, the pleural lavage, and cell culture supernatant from THP-1 macrophages were increased with GP exposure compared to controls but not with nanoparticulate carbon black (CB). In vitro, macrophages exposed to GP showed expression of IL-1β. This study highlights the importance of nanoplatelet form as a driver for in vivo and in vitro inflammogenicity by virtue of their respirable aerodynamic diam., despite a considerable 2-dimensional size which leads to frustrated phagocytosis when they deposit in the distal lungs and macrophages attempt to phagocytose them. Our data suggest that nanoplatelets pose a novel nanohazard and structure-toxicity relationship in nanoparticle toxicol.
], [CAS], Google Scholar159https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3MXhs1GrurnP&md5=d6893da59ca929cc9cd61bad2a6a5d24Graphene-Based Nanoplatelets: A New Risk to the Respiratory System as a Consequence of Their Unusual Aerodynamic PropertiesSchinwald, Anja; Murphy, Fiona A.; Jones, Alan; MacNee, William; Donaldson, KenACS Nano (2012), 6 (1), 736-746CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)Graphene is a new nanomaterial with unusual and useful phys. and chem. properties. However, in the form of nanoplatelets this new, emerging material could pose unusual risks to the respiratory system after inhalation exposure. The graphene-based nanoplatelets used in this study are com. available and consist of several sheets of graphene (few-layer graphene). We first derived the respirability of graphene nanoplatelets (GP) from the basic principles of the aerodynamic behavior of plate-shaped particles which allowed us to calc. their aerodynamic diam. This showed that the nanoplatelets, which were up to 25 μm in diam., were respirable and so would deposit beyond the ciliated airways following inhalation. We therefore utilized models of pharyngeal aspiration and direct intrapleural installation of GP, as well as an in vitro model, to assess their inflammatory potential. These large but respirable GP were inflammogenic in both the lung and the pleural space. MIP-1α, MCP-1, MIP-2, IL-8, and IL-1β expression in the BAL, the pleural lavage, and cell culture supernatant from THP-1 macrophages were increased with GP exposure compared to controls but not with nanoparticulate carbon black (CB). In vitro, macrophages exposed to GP showed expression of IL-1β. This study highlights the importance of nanoplatelet form as a driver for in vivo and in vitro inflammogenicity by virtue of their respirable aerodynamic diam., despite a considerable 2-dimensional size which leads to frustrated phagocytosis when they deposit in the distal lungs and macrophages attempt to phagocytose them. Our data suggest that nanoplatelets pose a novel nanohazard and structure-toxicity relationship in nanoparticle toxicol. - 160Schinwald, A.; Murphy, F.; Askounis, A.; Koutsos, V.; Sefiane, K.; Donaldson, K.; Campbell, C. J. Minimal Oxidation and Inflammogenicity of Pristine Graphene with Residence in the Lung. Nanotoxicology 2014, 8, 824– 832, DOI: 10.3109/17435390.2013.831502
- 161Park, E.-J.; Lee, G.-H.; Han, B. S.; Lee, B.-S.; Lee, S.; Cho, M.-H.; Kim, J.-H.; Kim, D.-W. Toxic Response of Graphene Nanoplatelets in Vivo and in Vitro. Arch. Toxicol. 2015, 89, 1557– 1568, DOI: 10.1007/s00204-014-1303-x[Crossref], [PubMed], [CAS], Google Scholar161https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2cXhtVOns7jE&md5=6d48dfebf8a4527c2c11e8ad49b82ecdToxic response of graphene nanoplatelets in vivo and in vitroPark, Eun-Jung; Lee, Gwang-Hee; Han, Beom Seok; Lee, Byoung-Seok; Lee, Somin; Cho, Myung-Haing; Kim, Jae-Ho; Kim, Dong-WanArchives of Toxicology (2015), 89 (9), 1557-1568CODEN: ARTODN; ISSN:0340-5761. (Springer)With the development of nanotechnol., myriad types of novel materials have been discovered at the nanoscale, among which the most interesting material is graphene. However, the toxicity data available on graphene are extremely limited. In this study, we explored toxic response of com. available graphene nanoplatelets (GNPs) in vivo and in vitro. The GNPs used in this study had a high surface area and feature considerably few defects. In mice, GNPs (2.5 and 5 mg/kg) remained in the lung until 28 days after a single instillation, and the secretion of inflammatory cytokines reached the maximal level at Day 14 and then decreased over time. In vitro study using BEAS-2B cells, a human bronchial epithelial cell line, GNPs located within autophagosome-like vacuoles 24 h after exposure. The GNPs (2.5, 5, 10, and 20 μg/mL) also dose-dependently reduced cell viability, which was accompanied by an increase in the portion of cells in the subG1 and S phases. Moreover, the GNPs down-regulated the generation of reactive oxygen species, suppressed ATP prodn., caused mitochondria damage, and elevated the levels of autophagy-related proteins. Based on these results, we suggest that GNPs provoked a subchronic inflammatory response in mice and that GNPs induced autophagy accompanying apoptosis via mitochondria damage in vitro.
- 162Park, E.-J.; Lee, S. J.; Lee, K.; Choi, Y. C.; Lee, B.-S.; Lee, G.-H.; Kim, D.-W. Pulmonary Persistence of Graphene Nanoplatelets May Disturb Physiological and Immunological Homeostasis. J. Appl. Toxicol. 2017, 37, 296– 309, DOI: 10.1002/jat.3361[Crossref], [PubMed], [CAS], Google Scholar162https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC28XhtF2mt77L&md5=288939a39b10dd9f495d94dfa8cd2729Pulmonary persistence of graphene nanoplatelets may disturb physiological and immunological homeostasisPark, Eun-Jung; Lee, Sang Jin; Lee, Kyuhong; Choi, Young Chul; Lee, Byoung-Seok; Lee, Gwang-Hee; Kim, Dong-WanJournal of Applied Toxicology (2017), 37 (3), 296-309CODEN: JJATDK; ISSN:0260-437X. (John Wiley & Sons Ltd.)Accumulated evidence suggests that chronic pulmonary accumulation of harmful particles cause adverse pulmonary and systemic health effects. In our previous study, most of the graphene nanoplatelet (GNP) remained in the lung until 28 days after a single instillation. In this study, we sought to evaluate the local and systemic health effect after a long pulmonary persistence of GNP. As expected, GNP remained in the lung on day 90 after a single intratracheal instillation (1.25, 2.5 and 5 mg kg-1). In the lung exposed at the highest dose, the total no. of cells and the percentage of lymphocytes significantly increased in the BAL fluid with an increase in both the no. of GNP-engulfed macrophages and the percentage of apoptotic cells. A Th1-shifted immune response, the elevated chemokine secretion and the enhanced expression of cytoskeletal-related genes were obsd. Addnl., the expression of natriuretic-related genes was noteworthy altered in the lungs. Moreover, the no. of white blood cells (WBC) and the percentage of macrophages and neutrophils clearly increased in the blood of mice exposed to a 5-mg kg-1 dose, whereas total protein, BUN and potassium levels significantly decreased. In conclusion, we suggest that the long persistence of GNP in the lung may cause adverse health effects by disturbing immunol.- and physiol.-homeostasis of our body. Copyright © 2016 John Wiley & Sons, Ltd.
- 163Shin, J. H.; Han, S. G.; Kim, J. K.; Kim, B. W.; Hwang, J. H.; Lee, J. S.; Lee, J. H.; Baek, J. E.; Kim, T. G.; Kim, K. S.; Lee, H. S.; Song, N. W.; Ahn, K.; Yu, I. J. 5-Day Repeated Inhalation and 28-Day Post-Exposure Study of Graphene. Nanotoxicology 2015, 9, 1023– 1031, DOI: 10.3109/17435390.2014.998306
- 164Kim, J. K.; Shin, J. H.; Lee, J. S.; Hwang, J. H.; Lee, J. H.; Baek, J. E.; Kim, T. G.; Kim, B. W.; Kim, J. S.; Lee, G. H.; Ahn, K.; Han, S. G.; Bello, D.; Yu, I. J. 28-Day Inhalation Toxicity of Graphene Nanoplatelets in Sprague-Dawley Rats. Nanotoxicology 2016, 10, 891– 901, DOI: 10.3109/17435390.2015.1133865
- 165Lee, J. K.; Jeong, A. Y.; Bae, J.; Seok, J. H.; Yang, J.-Y.; Roh, H. S.; Jeong, J.; Han, Y.; Jeong, J.; Cho, W.-S. The Role of Surface Functionalization on the Pulmonary Inflammogenicity and Translocation into Mediastinal Lymph Nodes of Graphene Nanoplatelets in Rats. Arch. Toxicol. 2017, 91, 667– 676, DOI: 10.1007/s00204-016-1706-y[Crossref], [PubMed], [CAS], Google Scholar165https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC28XntVOntro%253D&md5=dac00e3294aca9af5747b071c232ea07The role of surface functionalization on the pulmonary inflammogenicity and translocation into mediastinal lymph nodes of graphene nanoplatelets in ratsLee, Jong Kwon; Jeong, A. Young; Bae, Jiyeong; Seok, Ji Hyun; Yang, Jun-Young; Roh, Hang Sik; Jeong, Jiyoung; Han, Youngju; Jeong, Jayoung; Cho, Wan-SeobArchives of Toxicology (2017), 91 (2), 667-676CODEN: ARTODN; ISSN:0340-5761. (Springer)Graphene, a two-dimensional monocryst. layer of carbon atoms, has potential in many applications not only in material sciences, but also in the biomedical fields, but there is little information about the role of surface modification on the toxicity of graphene-based nanomaterials. Here, we evaluated the role of surface functionalization of the graphene nanoplatelets (GNPs) on the pulmonary inflammogenicity and translocation into mediastinal lymph nodes using a rat intratracheal instillation model. Six types of GNPs were used: All types of GNPs were based on the pristine GNPs (GNPdot), and different functional groups were conjugated onto them including a COOH (GNPCOOH), COH (GNPO2), N-H (GNPN2), Fx (GNPF), and N=H (GNPNH2). All types of GNPs showed very high potential for the generation of reactive oxygen species (ROS) in a dose-dependent manner when measured by a 2'7'-dichlorofluorescin diacetate assay. GNPs were instilled into the lungs of rats at 0.3 and 1 mg/rat for the evaluation of acute (24 h) inflammation and at 3 mg/rat for chronic (1 and 4 wk) inflammation. At 24 h after instillation, all types of GNPs showed good dose-dependent increases in polymorphonuclear leukocytes with a clear dose-dependency although significant increases compared to vehicle control were found only in pos. charged GNPs (GNPN2andGNPNH2). While the acute inflammation in all treatment groups was returned to control levels at 1 and 4 wk after instillation, GNPs showed similar patterns of translocation into the mediastinal lymph nodes with a higher degree over time. This study implies that the main factors of GNPs for producing lung inflammation are the potential for ROS generation and surface charge. In addn., functional groups on the GNPs might not play an important role in the extrapulmonary translocation into the mediastinal lymph nodes.
- 166Bengtson, S.; Knudsen, K. B.; Kyjovska, Z. O.; Berthing, T.; Skaug, V.; Levin, M.; Koponen, I. K.; Shivayogimath, A.; Booth, T. J.; Alonso, B.; Pesquera, A.; Zurutuza, A.; Thomsen, B. L.; Troelsen, J. T.; Jacobsen, N. R.; Vogel, U. Differences in Inflammation and Acute Phase Response but Similar Genotoxicity in Mice Following Pulmonary Exposure to Graphene Oxide and Reduced Graphene Oxide. PLoS One 2017, 12, e0178355, DOI: 10.1371/journal.pone.0178355[Crossref], [PubMed], [CAS], Google Scholar166https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2sXhslWhsr3M&md5=585e5fa50e54869664f3b270cb1c60cbDifferences in inflammation and acute phase response but similar genotoxicity in mice following pulmonary exposure to graphene oxide and reduced graphene oxideBengtson, Stefan; Knudsen, Kristina B.; Kyjovska, Zdenka O.; Berthing, Trine; Skaug, Vidar; Levin, Marcus; Koponen, Ismo K.; Shivayogimath, Abhay; Booth, Timothy J.; Alonso, Beatriz; Pesquera, Amaia; Zurutuza, Amaia; Thomsen, Birthe L.; Troelsen, Jesper T.; Jacobsen, Nicklas R.; Vogel, UllaPLoS One (2017), 12 (6), e0178355/1-e0178355/25CODEN: POLNCL; ISSN:1932-6203. (Public Library of Science)We investigated toxicity of 2-3 layered >1 μm sized graphene oxide (GO) and reduced graphene oxide (rGO) in mice following single intratracheal exposure with respect to pulmonary inflammation, acute phase response (biomarker for risk of cardiovascular disease) and genotoxicity. In addn., we assessed exposure levels of particulate matter emitted during prodn. of graphene in a clean room and in a normal industrial environment using chem. vapor deposition. Toxicity was evaluated at day 1, 3, 28 and 90 days (18, 54 and 162 μg/mouse), except for GO exposed mice at day 28 and 90 where only the lowest dose was evaluated. GO induced a strong acute inflammatory response together with a pulmonary (Serum-Amyloid A, Saa3) and hepatic (Saa1) acute phase response. rGO induced less acute, but a const. and prolonged inflammation up to day 90. Lung histopathol. showed particle agglomerates at day 90 without signs of fibrosis. In addn., DNA damage in BAL cells was obsd. across time points and doses for both GO and rGO. In conclusion, pulmonary exposure to GO and rGO induced inflammation, acute phase response and genotoxicity but no fibrosis.
- 167Bengtson, S.; Kling, K.; Madsen, A. M.; Noergaard, A. W.; Jacobsen, N. R.; Clausen, P. A.; Alonso, B.; Pesquera, A.; Zurutuza, A.; Ramos, R.; Okuno, H.; Dijon, J.; Wallin, H.; Vogel, U. No Cytotoxicity or Genotoxicity of Graphene and Graphene Oxide in Murine Lung Epithelial FE1 Cells in Vitro. Environ. Mol. Mutagen. 2016, 57, 469– 482, DOI: 10.1002/em.22017[Crossref], [PubMed], [CAS], Google Scholar167https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC28XotVWlt7c%253D&md5=676a69ea8ddf67b314ccd35ba7724e91No cytotoxicity or genotoxicity of graphene and graphene oxide in murine lung epithelial FE1 cells in vitroBengtson, Stefan; Kling, Kirsten; Madsen, Anne Mette; Noergaard, Asger W.; Jacobsen, Nicklas Raun; Clausen, Per Axel; Alonso, Beatriz; Pesquera, Amaia; Zurutuza, Amaia; Ramos, Raphael; Okuno, Hanako; Dijon, Jean; Wallin, Hakan; Vogel, UllaEnvironmental and Molecular Mutagenesis (2016), 57 (6), 469-482CODEN: EMMUEG; ISSN:1098-2280. (Wiley-Blackwell)Graphene and graphene oxide receive much attention these years, because they add attractive properties to a wide range of applications and products. Several studies have shown toxicol. effects of other carbon-based nanomaterials such as carbon black nanoparticles and carbon nanotubes in vitro and in vivo. Here, we report in-depth physicochem. characterization of three com. graphene materials, one graphene oxide (GO) and two reduced graphene oxides (rGO) and assess cytotoxicity and genotoxicity in the murine lung epithelial cell line FE1. The studied GO and rGO mainly consisted of 2-3 graphene layers with lateral sizes of 1-2 μm. GO had almost equimolar content of C, O, and H while the two rGO materials had lower contents of oxygen with C/O and C/H ratios of 8 and 12.8, resp. All materials had low levels of endotoxin and low levels of inorg. impurities, which were mainly sulfur, manganese, and silicon. GO generated more ROS than the two rGO materials, but none of the graphene materials influenced cytotoxicity in terms of cell viability and cell proliferation after 24 h. Furthermore, no genotoxicity was obsd. using the alk. comet assay following 3 or 24 h of exposure. We demonstrate that CP, few-layered GO and rGO with comparable lateral size (> 1 μm) do not induce significant cytotoxicity or genotoxicity in FE1 cells at relatively high doses (5-200 μg/mL).
- 168Poulsen, S. S.; Jackson, P.; Kling, K.; Knudsen, K. B.; Skaug, V.; Kyjovska, Z. O.; Thomsen, B. L.; Clausen, P. A.; Atluri, R.; Berthing, T.; Bengtson, S.; Wolff, H.; Jensen, K. A.; Wallin, H.; Vogel, U. Multi-Walled Carbon Nanotube Physicochemical Properties Predict Pulmonary Inflammation and Genotoxicity. Nanotoxicology 2016, 10, 1263– 1275, DOI: 10.1080/17435390.2016.1202351[Crossref], [PubMed], [CAS], Google Scholar168https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC28XhtFOhurfN&md5=c393d4fe14558d3a07e66f5867a1176cMulti-walled carbon nanotube physicochemical properties predict pulmonary inflammation and genotoxicityPoulsen, Sarah S.; Jackson, Petra; Kling, Kirsten; Knudsen, Kristina B.; Skaug, Vidar; Kyjovska, Zdenka O.; Thomsen, Birthe L.; Clausen, Per Axel; Atluri, Rambabu; Berthing, Trine; Bengtson, Stefan; Wolff, Henrik; Jensen, Keld A.; Wallin, Haakan; Vogel, UllaNanotoxicology (2016), 10 (9), 1263-1275CODEN: NANOGK; ISSN:1743-5404. (Taylor & Francis Ltd.)Lung deposition of multi-walled carbon nanotubes (MWCNT) induces pulmonary toxicity. Com. MWCNT vary greatly in physicochem. properties and consequently in biol. effects. To identify determinants of MWCNT-induced toxicity, we analyzed the effects of pulmonary exposure to 10 com. MWCNT (supplied in three groups of different dimensions, with one pristine and two/three surface modified in each group). We characterized morphol., chem. compn., surface area and functionalization levels. MWCNT were deposited in lungs of female C57BL/6J mice by intratracheal instillation of 0, 6, 18 or 54 μg/mouse. Pulmonary inflammation (neutrophil influx in bronchoalveolar lavage (BAL)) and genotoxicity were detd. on day 1, 28 or 92. Histopathol. of the lungs was performed on day 28 and 92. All MWCNT induced similar histol. changes. Lymphocytic aggregates were detected for all MWCNT on day 28 and 92. Using adjusted, multiple regression analyses, inflammation and genotoxicity were related to dose, time and physicochem. properties. The sp. surface area (BET) was identified as a pos. predictor of pulmonary inflammation on all post-exposure days. In addn., length significantly predicted pulmonary inflammation, whereas surface oxidn. (-OH and -COOH) was predictor of lowered inflammation on day 28. BET surface area, and therefore diam., significantly predicted genotoxicity in BAL fluid cells and lung tissue such that lower BET surface area or correspondingly larger diam. was assocd. with increased genotoxicity. This study provides information on possible toxicity-driving physicochem. properties of MWCNT. The results may contribute to safe-by-design manufg. of MWCNT, thereby minimizing adverse effects.
- 169Poulsen, S. S.; Saber, A. T.; Williams, A.; Andersen, O.; Købler, C.; Atluri, R.; Pozzebon, M. E.; Mucelli, S. P.; Simion, M.; Rickerby, D.; Mortensen, A.; Jackson, P.; Kyjovska, Z. O.; Mølhave, K.; Jacobsen, N. R.; Jensen, K. A.; Yauk, C. L.; Wallin, H.; Halappanavar, S.; Vogel, U. MWCNTs of Different Physicochemical Properties Cause Similar Inflammatory Responses, but Differences in Transcriptional and Histological Markers of Fibrosis in Mouse Lungs. Toxicol. Appl. Pharmacol. 2015, 284, 16– 32, DOI: 10.1016/j.taap.2014.12.011[Crossref], [PubMed], [CAS], Google Scholar169https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2MXmtlSisQ%253D%253D&md5=ad98017672f4322af10db305a1de672dMWCNTs of different physicochemical properties cause similar inflammatory responses, but differences in transcriptional and histological markers of fibrosis in mouse lungsPoulsen, Sarah S.; Saber, Anne T.; Williams, Andrew; Andersen, Ole; Koebler, Carsten; Atluri, Rambabu; Pozzebon, Maria E.; Mucelli, Stefano P.; Simion, Monica; Rickerby, David; Mortensen, Alicja; Jackson, Petra; Kyjovska, Zdenka O.; Moelhave, Kristian; Jacobsen, Nicklas R.; Jensen, Keld A.; Yauk, Carole L.; Wallin, Haakan; Halappanavar, Sabina; Vogel, UllaToxicology and Applied Pharmacology (2015), 284 (1), 16-32CODEN: TXAPA9; ISSN:0041-008X. (Elsevier Inc.)Multi-walled carbon nanotubes (MWCNTs) are an inhomogeneous group of nanomaterials that vary in lengths, shapes and types of metal contamination, which makes hazard evaluation difficult. Here we present a toxicogenomic anal. of female C57BL/6 mouse lungs following a single intratracheal instillation of 0, 18, 54 or 162 μg/mouse of a small, curled (CNTSmall, 0.8 ± 0.1 μm in length) or large, thick MWCNT (CNTLarge, 4 ± 0.4 μm in length). The two MWCNTs were extensively characterized by SEM and TEM imaging, thermogravimetric anal., and Brunauer-Emmett-Teller surface area anal. Lung tissues were harvested 24 h, 3 days and 28 days post-exposure. DNA microarrays were used to analyze gene expression, in parallel with anal. of bronchoalveolar lavage fluid, lung histol., DNA damage (comet assay) and the presence of reactive oxygen species (dichlorodihydrofluorescein assay), to profile and characterize related pulmonary endpoints. Overall changes in global transcription following exposure to CNTSmall or CNTLarge were similar. Both MWCNTs elicited strong acute phase and inflammatory responses that peaked at day 3, persisted up to 28 days, and were characterized by increased cellular influx in bronchoalveolar lavage fluid, interstitial pneumonia and gene expression changes. However, CNTLarge elicited an earlier onset of inflammation and DNA damage, and induced more fibrosis and a unique fibrotic gene expression signature at day 28, compared to CNTSmall. The results indicate that the extent of change at the mol. level during early response phases following an acute exposure is greater in mice exposed to CNTLarge, which may eventually lead to the different responses obsd. at day 28.
- 170Vranic, S.; Rodrigues, A. F.; Buggio, M.; Newman, L.; White, M. R. H.; Spiller, D. G.; Bussy, C.; Kostarelos, K. Live Imaging of Label-Free Graphene Oxide Reveals Critical Factors Causing Oxidative-Stress-Mediated Cellular Responses. ACS Nano 2018, 12, 1373– 1389, DOI: 10.1021/acsnano.7b07734[ACS Full Text
 ], [CAS], Google Scholar170https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC1cXhsFOisw%253D%253D&md5=2d227a016212a189d46e9b6055d2d48dLive Imaging of Label-Free Graphene Oxide Reveals Critical Factors Causing Oxidative-Stress-Mediated Cellular ResponsesVranic, Sandra; Rodrigues, Artur Filipe; Buggio, Maurizio; Newman, Leon; White, Michael R. H.; Spiller, David G.; Bussy, Cyrill; Kostarelos, KostasACS Nano (2018), 12 (2), 1373-1389CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)The interest in graphene and its translation into com. products have been expanding at high pace. In regard to previously described pulmonary safety concerns for carbon nanomaterials, there is a great need to define parameters guiding interactions between graphene-based materials and pulmonary system. The aim of present study was to det. the importance of two crit. parameters: lateral dimensions of the material and coating with proteins in relation to each other and their pulmonary impact. Endotoxin-free materials with distinct lateral dimensions - s-GO (50 - 200 nm) and l-GO (5 - 15 μm) were produced and thoroughly characterized. Exploiting intrinsic fluorescence of GO and using confocal live-cell imaging, we visualized the behavior of the cells in response to the material in real time. Although BEAS-2B cells internalized GO efficiently, l-GO was linked to higher plasma membrane interactions correlated with elevated ROS levels, pro-inflammatory response and greater cytotoxicity, in agreement with the oxidative stress paradigm. For both GO types, the presence of serum alleviated lipid peroxidn. of plasma membrane and decreased intracellular ROS levels. However, protein coating was not enough to entirely mitigate toxicity and inflammatory response induced by l-GO. In vitro results were validated in vivo, as l-GO was more prone to induce pulmonary granulomatous response in mice compared to s-GO. In conclusion, lateral dimension of GO played more important role than serum protein coating in detg. biol. responses to the material. It was also demonstrated that time-lapse imaging of live cells interacting with label-free GO sheets can be used as a tool to assess GO induced cytotoxicity.
], [CAS], Google Scholar170https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC1cXhsFOisw%253D%253D&md5=2d227a016212a189d46e9b6055d2d48dLive Imaging of Label-Free Graphene Oxide Reveals Critical Factors Causing Oxidative-Stress-Mediated Cellular ResponsesVranic, Sandra; Rodrigues, Artur Filipe; Buggio, Maurizio; Newman, Leon; White, Michael R. H.; Spiller, David G.; Bussy, Cyrill; Kostarelos, KostasACS Nano (2018), 12 (2), 1373-1389CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)The interest in graphene and its translation into com. products have been expanding at high pace. In regard to previously described pulmonary safety concerns for carbon nanomaterials, there is a great need to define parameters guiding interactions between graphene-based materials and pulmonary system. The aim of present study was to det. the importance of two crit. parameters: lateral dimensions of the material and coating with proteins in relation to each other and their pulmonary impact. Endotoxin-free materials with distinct lateral dimensions - s-GO (50 - 200 nm) and l-GO (5 - 15 μm) were produced and thoroughly characterized. Exploiting intrinsic fluorescence of GO and using confocal live-cell imaging, we visualized the behavior of the cells in response to the material in real time. Although BEAS-2B cells internalized GO efficiently, l-GO was linked to higher plasma membrane interactions correlated with elevated ROS levels, pro-inflammatory response and greater cytotoxicity, in agreement with the oxidative stress paradigm. For both GO types, the presence of serum alleviated lipid peroxidn. of plasma membrane and decreased intracellular ROS levels. However, protein coating was not enough to entirely mitigate toxicity and inflammatory response induced by l-GO. In vitro results were validated in vivo, as l-GO was more prone to induce pulmonary granulomatous response in mice compared to s-GO. In conclusion, lateral dimension of GO played more important role than serum protein coating in detg. biol. responses to the material. It was also demonstrated that time-lapse imaging of live cells interacting with label-free GO sheets can be used as a tool to assess GO induced cytotoxicity. - 171Drasler, B.; Kucki, M.; Delhaes, F.; Buerki-Thurnherr, T.; Vanhecke, D.; Korejwo, D.; Chortarea, S.; Barosova, H.; Hirsch, C.; Petri-Fink, A.; Rothen-Rutishauser, B.; Wick, P. Single Exposure to Aerosolized Graphene Oxide and Graphene Nanoplatelets Did Not Initiate an Acute Biological Response in a 3D Human Lung Model. Carbon 2018, 137, 125– 135, DOI: 10.1016/j.carbon.2018.05.012[Crossref], [CAS], Google Scholar171https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC1cXpvVKmsbw%253D&md5=4730c8f6e613eeab7c74e29c239e1330Single exposure to aerosolized graphene oxide and graphene nanoplatelets did not initiate an acute biological response in a 3D human lung modelDrasler, Barbara; Kucki, Melanie; Delhaes, Flavien; Buerki-Thurnherr, Tina; Vanhecke, Dimitri; Korejwo, Daria; Chortarea, Savvina; Barosova, Hana; Hirsch, Cordula; Petri-Fink, Alke; Rothen-Rutishauser, Barbara; Wick, PeterCarbon (2018), 137 (), 125-135CODEN: CRBNAH; ISSN:0008-6223. (Elsevier Ltd.)The increased mass prodn. of graphene related materials (GRM), intended for a broad spectrum of applications, demands a thorough assessment of their potential hazard to humans and the environment. Particularly, the paramount concern has been expressed in regard to their interaction with the respiratory system in occupational exposure settings. It has been shown that GRM are easily respirable and can interact with lung cells resulting in the induction of oxidative stress or pulmonary inflammation. However, a comprehensive assessment of potential biol. effects induced by GRM is currently hardly feasible to accomplish due to the lack of well-defined GRM materials and realistic exposure data. Herein, a 3D human lung model was combined with a com. aerosolization system to study potential side effects of GRM. Two representative types of GRM were aerosolized onto the lung epithelial tissue surface. After 24 h post exposure, selected biol. endpoints were evaluated, such as cell viability, morphol., barrier integrity, induction of (pro-)inflammation and oxidative stress reactions and compared with the ref. carbon black. Single exposure to all tested GRM at the two different exposure concns. (∼300 and 1000 ng/Cm2) did not initiate an observable adverse effect to the 3D lung model under acute exposure scenarios.
- 172Shurin, M. R.; Yanamala, N.; Kisin, E. R.; Tkach, A. V.; Shurin, G. V.; Murray, A. R.; Leonard, H. D.; Reynolds, J. S.; Gutkin, D. W.; Star, A.; Fadeel, B.; Savolainen, K.; Kagan, V. E.; Shvedova, A. A. Graphene Oxide Attenuates Th2-Type Immune Responses, but Augments Airway Remodeling and Hyperresponsiveness in a Murine Model of Asthma. ACS Nano 2014, 8, 5585– 5599, DOI: 10.1021/nn406454u[ACS Full Text
 ], [CAS], Google Scholar172https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2cXotlWgt7k%253D&md5=ad985867d575b425c42b0094bda74268Graphene Oxide Attenuates Th2-Type Immune Responses, but Augments Airway Remodeling and Hyperresponsiveness in a Murine Model of AsthmaShurin, Michael R.; Yanamala, Naveena; Kisin, Elena R.; Tkach, Alexey V.; Shurin, Galina V.; Murray, Ashley R.; Leonard, Howard D.; Reynolds, Jeffrey S.; Gutkin, Dmirtiy W.; Star, Alexander; Fadeel, Bengt; Savolainen, Kai; Kagan, Valerian E.; Shvedova, Anna A.ACS Nano (2014), 8 (6), 5585-5599CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)Several lines of evidence indicate that exposure to nanoparticles (NPs) is able to modify airway immune responses, thus facilitating the development of respiratory diseases. Graphene oxide (GO) is a promising carbonaceous nanomaterial with unique physicochem. properties, envisioned for a multitude of medical and industrial applications. In this paper, the authors detd. how exposure to GO modulates the allergic pulmonary response. Using a murine model of ovalbumin (OVA)-induced asthma, the authors revealed that GO, given at the sensitization stage, augmented airway hyperresponsiveness and airway remodeling in the form of goblet cell hyperplasia and smooth muscle hypertrophy. At the same time, the levels of the cytokines IL-4, IL-5, and IL-13 were reduced in broncho-alveolar lavage (BAL) fluid in GO-exposed mice. Exposure to GO during sensitization with OVA decreased eosinophil accumulation and increased recruitment of macrophages in BAL fluid. In line with the cytokine profiles, sensitization with OVA in the presence of GO stimulated the prodn. of OVA-specific IgG2a and down-regulated the levels of IgE and IgG1. Moreover, exposure to GO increased the macrophage prodn. of the mammalian chitinases, CHI3L1 and AMCase, whose expression is assocd. with asthma. Finally, mol. modeling has suggested that GO may directly interact with chitinase, affecting AMCase activity, which has been directly proven in the authors' studies. Thus, these data show that GO exposure attenuates Th2 immune response in a model of OVA-induced asthma, but leads to potentiation of airway remodeling and hyperresponsiveness, with the induction of mammalian chitinases.
], [CAS], Google Scholar172https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2cXotlWgt7k%253D&md5=ad985867d575b425c42b0094bda74268Graphene Oxide Attenuates Th2-Type Immune Responses, but Augments Airway Remodeling and Hyperresponsiveness in a Murine Model of AsthmaShurin, Michael R.; Yanamala, Naveena; Kisin, Elena R.; Tkach, Alexey V.; Shurin, Galina V.; Murray, Ashley R.; Leonard, Howard D.; Reynolds, Jeffrey S.; Gutkin, Dmirtiy W.; Star, Alexander; Fadeel, Bengt; Savolainen, Kai; Kagan, Valerian E.; Shvedova, Anna A.ACS Nano (2014), 8 (6), 5585-5599CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)Several lines of evidence indicate that exposure to nanoparticles (NPs) is able to modify airway immune responses, thus facilitating the development of respiratory diseases. Graphene oxide (GO) is a promising carbonaceous nanomaterial with unique physicochem. properties, envisioned for a multitude of medical and industrial applications. In this paper, the authors detd. how exposure to GO modulates the allergic pulmonary response. Using a murine model of ovalbumin (OVA)-induced asthma, the authors revealed that GO, given at the sensitization stage, augmented airway hyperresponsiveness and airway remodeling in the form of goblet cell hyperplasia and smooth muscle hypertrophy. At the same time, the levels of the cytokines IL-4, IL-5, and IL-13 were reduced in broncho-alveolar lavage (BAL) fluid in GO-exposed mice. Exposure to GO during sensitization with OVA decreased eosinophil accumulation and increased recruitment of macrophages in BAL fluid. In line with the cytokine profiles, sensitization with OVA in the presence of GO stimulated the prodn. of OVA-specific IgG2a and down-regulated the levels of IgE and IgG1. Moreover, exposure to GO increased the macrophage prodn. of the mammalian chitinases, CHI3L1 and AMCase, whose expression is assocd. with asthma. Finally, mol. modeling has suggested that GO may directly interact with chitinase, affecting AMCase activity, which has been directly proven in the authors' studies. Thus, these data show that GO exposure attenuates Th2 immune response in a model of OVA-induced asthma, but leads to potentiation of airway remodeling and hyperresponsiveness, with the induction of mammalian chitinases. - 173Lee, B.-J.; Kim, B.; Lee, K. Air Pollution Exposure and Cardiovascular Disease. Toxicol. Res. 2014, 30, 71– 75, DOI: 10.5487/TR.2014.30.2.071[Crossref], [PubMed], [CAS], Google Scholar173https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2cXhsFKnt7fK&md5=f22d9e6d8907ce022bfa4e94d13ea597Air pollution exposure and cardiovascular diseaseLee, Byeong-Jae; Kim, Bumseok; Lee, KyuhongToxicological Research (Seoul, Republic of Korea) (2014), 30 (2), 71-75CODEN: TROED7; ISSN:1976-8257. (Korean Society of Toxicology)A review. Ambient air pollution (AAP) and particulate matters (PM) have been closely assocd. with adverse health effects such as respiratory disease and cardiovascular diseases. Previous studies have examd. the adverse health effects assocd. with short- and long-term exposure to AAP and outdoor PM on respiratory disease. However, the effect of PM size (PM2.5 and PM10) on cardiovascular disease has not been well studied. Thus, it remains unclear how the size of the inhalable particles (coarse, fine, or ultrafine) affects mortality and morbidity. Airborne PM concns. are commonly used for ambient air quality management worldwide, owing to the known effects on cardiorespiratory health. In this article, we assess the relationship between cardiovascular diseases and PM, with a particular focus on PM size. We discuss the assocn. of PM2.5 and PM10, nitrogen dioxide (NO2), and elemental carbon with mortality and morbidity due to cardiovascular diseases, stroke, and altered blood pressure, based on epidemiol. studies. In addn., we provide evidence that the adverse health effects of AAP and PM are more pronounced among the elderly, children, and people with preexisting cardiovascular and respiratory conditions. Finally, we critically summarize the literature pertaining to cardiovascular diseases, including atherosclerosis and stroke, and introduce potential studies to better understand the health significance of AAP and PM on cardiovascular disease.
- 174Du, Y.; Xu, X.; Chu, M.; Guo, Y.; Wang, J. Air Particulate Matter and Cardiovascular Disease: The Epidemiological, Biomedical and Clinical Evidence. J. Thorac. Dis. 2016, 8, E8– E19, DOI: 10.3978/j.issn.2072-1439.2015.11.37
- 175Donaldson, K.; Duffin, R.; Langrish, J. P.; Miller, M. R.; Mills, N. L.; Poland, C. A.; Raftis, J.; Shah, A.; Shaw, C. A.; Newby, D. E. Nanoparticles and the Cardiovascular System: A Critical Review. Nanomedicine 2013, 8, 403– 423, DOI: 10.2217/nnm.13.16
- 176Contreras-Torres, F. F.; Rodríguez-Galván, A.; Guerrero-Beltrán, C. E.; Martínez-Lorán, E.; Vázquez-Garza, E.; Ornelas-Soto, N.; García-Rivas, G. Differential Cytotoxicity and Internalization of Graphene Family Nanomaterials in Myocardial Cells. Mater. Sci. Eng., C 2017, 73, 633– 642, DOI: 10.1016/j.msec.2016.12.080[Crossref], [PubMed], [CAS], Google Scholar176https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2sXislKluw%253D%253D&md5=d30d69ca06eed799b5c340ab67e31e4fDifferential cytotoxicity and internalization of graphene family nanomaterials in myocardial cellsContreras-Torres, Flavio F.; Rodriguez-Galvan, Andres; Guerrero-Beltran, Carlos E.; Martinez-Loran, Erick; Vazquez-Garza, Eduardo; Ornelas-Soto, Nancy; Garcia-Rivas, GerardoMaterials Science & Engineering, C: Materials for Biological Applications (2017), 73 (), 633-642CODEN: MSCEEE; ISSN:0928-4931. (Elsevier B.V.)Given the well-known phys. properties of graphene oxide (GO), numerous applications for this novel nanomaterial have been recently envisioned to improve the performance of biomedical devices. However, the toxicol. assessment of GO, which strongly depends on the used material and the studied cell line, is a fundamental task that needs to be performed prior to its use in biomedical applications. Therefore, the toxicol. characterization of GO is still ongoing. This study contributes to this, aiming to synthesize and characterize GO particles and thus investigate their toxic effects in myocardial cells. Herein, GO particles were produced from graphite using the Tour method and subsequent mild redn. was carried out to obtain low-reduced GO (LRGO) particles. A qual. anal. of the viability, cellular uptake, and internalization of particles was carried out using GO (∼ 54% content of oxygen) and LRGO (∼ 37% content of oxygen) and graphite. GO and LRGO reduce the viability of cardiac cells at IC50 of 652.1 ± 1.2 and 129.4 ± 1.2μg/mL, resp. This shows that LRGO particles produce a five-fold increase in cytotoxicity when compared to GO. The cell uptake pattern of GO and LRGO particles demonstrated that cardiac cells retain a similar complexity to control cells. Morphol. alterations examd. with electron microscopy showed that internalization by GO and LRGO-treated cells (100μg/mL) occurred affecting the cell structure. These results suggest that the viability of H9c2 cells can be assocd. with the surface chem. of GO and LRGO, as defined by the amt. of oxygen functionalities, the no. of graphitic domains, and the size of particles. High angle annular dark-field scanning transmission electron microscopy, dynamic light-scattering, Fourier-transform IR, Raman, and X-ray photoelectron spectroscopies were used to characterize the as-prepd. materials.
- 177Singh, S. K.; Singh, M. K.; Nayak, M. K.; Kumari, S.; Shrivastava, S.; Grácio, J. J. A.; Dash, D. Thrombus Inducing Property of Atomically Thin Graphene Oxide Sheets. ACS Nano 2011, 5, 4987– 4996, DOI: 10.1021/nn201092p[ACS Full Text
 ], [CAS], Google Scholar177https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3MXmtlynu7s%253D&md5=e1df0fce48e100362b8fcc35cfcb7b57Thrombus Inducing Property of Atomically Thin Graphene Oxide SheetsSingh, Sunil K.; Singh, Manoj K.; Nayak, Manasa K.; Kumari, Sharda; Shrivastava, Siddhartha; Gracio, Jose J. A.; Dash, DebabrataACS Nano (2011), 5 (6), 4987-4996CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)Graphene oxide (GO), the new two-dimensional carbon nanomaterial, is extensively investigated for potential biomedical applications. Thus, it is pertinent to critically evaluate its untoward effects on physiol. of tissue systems including blood platelets, the cells responsible for maintenance of hemostasis and thrombus formation. Here we report for the first time that atomically thin GO sheets elicited strong aggregatory response in platelets through activation of Src kinases and release of calcium from intracellular stores. Compounding this, i.v. administration of GO was found to induce extensive pulmonary thromboembolism in mice. Prothrombotic character of GO was dependent on surface charge distribution as reduced GO (RGO) was significantly less effective in aggregating platelets. Our findings raise a concern on putative biomedical applications of GO in the form of diagnostic and therapeutic tools where its prothrombotic property should be carefully investigated.
], [CAS], Google Scholar177https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3MXmtlynu7s%253D&md5=e1df0fce48e100362b8fcc35cfcb7b57Thrombus Inducing Property of Atomically Thin Graphene Oxide SheetsSingh, Sunil K.; Singh, Manoj K.; Nayak, Manasa K.; Kumari, Sharda; Shrivastava, Siddhartha; Gracio, Jose J. A.; Dash, DebabrataACS Nano (2011), 5 (6), 4987-4996CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)Graphene oxide (GO), the new two-dimensional carbon nanomaterial, is extensively investigated for potential biomedical applications. Thus, it is pertinent to critically evaluate its untoward effects on physiol. of tissue systems including blood platelets, the cells responsible for maintenance of hemostasis and thrombus formation. Here we report for the first time that atomically thin GO sheets elicited strong aggregatory response in platelets through activation of Src kinases and release of calcium from intracellular stores. Compounding this, i.v. administration of GO was found to induce extensive pulmonary thromboembolism in mice. Prothrombotic character of GO was dependent on surface charge distribution as reduced GO (RGO) was significantly less effective in aggregating platelets. Our findings raise a concern on putative biomedical applications of GO in the form of diagnostic and therapeutic tools where its prothrombotic property should be carefully investigated. - 178Singh, S. K.; Singh, M. K.; Kulkarni, P. P.; Sonkar, V. K.; Grácio, J. J. A.; Dash, D. Amine-Modified Graphene: Thrombo-Protective Safer Alternative to Graphene Oxide for Biomedical Applications. ACS Nano 2012, 6, 2731– 2740, DOI: 10.1021/nn300172t[ACS Full Text
 ], [CAS], Google Scholar178https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC38XjtVGhsrs%253D&md5=d9fd9e78af28fee43abd76d2e8ed8730Amine-Modified Graphene: Thrombo-Protective Safer Alternative to Graphene Oxide for Biomedical ApplicationsSingh, Sunil K.; Singh, Manoj K.; Kulkarni, Paresh P.; Sonkar, Vijay K.; Gracio, Jose J. A.; Dash, DebabrataACS Nano (2012), 6 (3), 2731-2740CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)Graphene and its derivs. have attracted significant research interest based on their application potential in different fields including biomedicine. However, recent reports have pointed to serious toxic effects of this nanomaterial on cells and organisms. Graphene oxide (GO) was found to be highly thrombogenic in mouse and evoked strong aggregatory response in human platelets. As platelets play a central role in hemostasis and thrombus formation, thrombotoxicity of GO potentially limits its biomedical applications. Surface chem. of nanomaterials is a crit. determinant of biocompatibility, and thus differentially functionalized nanomaterials exhibit varied cellular toxicity. Amine-modified carbon nanotubes have recently been shown to possess cytoprotective action, which was not exhibited by their relatively toxic carboxylated counterparts. The authors, therefore, evaluated the effect of amine modification of graphene on platelet reactivity. Remarkably, the results revealed for the first time that amine-modified graphene (G-NH2) had absolutely no stimulatory effect on human platelets nor did it induce pulmonary thromboembolism in mice following i.v. administration. Further, it did not evoke lysis of erythrocytes, another major cellular component in blood. These findings contrasted strikingly the observations with GO and reduced GO (RGO). In conclusion, G-NH2 is not endowed with thrombotoxic property unlike other commonly investigated graphene derivs. and is thus potentially safe for in vivo biomedical applications.
], [CAS], Google Scholar178https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC38XjtVGhsrs%253D&md5=d9fd9e78af28fee43abd76d2e8ed8730Amine-Modified Graphene: Thrombo-Protective Safer Alternative to Graphene Oxide for Biomedical ApplicationsSingh, Sunil K.; Singh, Manoj K.; Kulkarni, Paresh P.; Sonkar, Vijay K.; Gracio, Jose J. A.; Dash, DebabrataACS Nano (2012), 6 (3), 2731-2740CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)Graphene and its derivs. have attracted significant research interest based on their application potential in different fields including biomedicine. However, recent reports have pointed to serious toxic effects of this nanomaterial on cells and organisms. Graphene oxide (GO) was found to be highly thrombogenic in mouse and evoked strong aggregatory response in human platelets. As platelets play a central role in hemostasis and thrombus formation, thrombotoxicity of GO potentially limits its biomedical applications. Surface chem. of nanomaterials is a crit. determinant of biocompatibility, and thus differentially functionalized nanomaterials exhibit varied cellular toxicity. Amine-modified carbon nanotubes have recently been shown to possess cytoprotective action, which was not exhibited by their relatively toxic carboxylated counterparts. The authors, therefore, evaluated the effect of amine modification of graphene on platelet reactivity. Remarkably, the results revealed for the first time that amine-modified graphene (G-NH2) had absolutely no stimulatory effect on human platelets nor did it induce pulmonary thromboembolism in mice following i.v. administration. Further, it did not evoke lysis of erythrocytes, another major cellular component in blood. These findings contrasted strikingly the observations with GO and reduced GO (RGO). In conclusion, G-NH2 is not endowed with thrombotoxic property unlike other commonly investigated graphene derivs. and is thus potentially safe for in vivo biomedical applications. - 179Monasterio, B. G.; Alonso, B.; Sot, J.; García-Arribas, A. B.; Gil-Cartón, D.; Valle, M.; Zurutuza, A.; Goñi, F. M. Coating Graphene Oxide with Lipid Bilayers Greatly Decreases Its Hemolytic Properties. Langmuir 2017, 33, 8181– 8191, DOI: 10.1021/acs.langmuir.7b01552
- 180Cao, Y.; Li, J.; Liu, F.; Li, X.; Jiang, Q.; Cheng, S.; Gu, Y. Consideration of Interaction between Nanoparticles and Food Components for the Safety Assessment of Nanoparticles Following Oral Exposure: A Review. Environ. Toxicol. Pharmacol. 2016, 46, 206– 210, DOI: 10.1016/j.etap.2016.07.023[Crossref], [PubMed], [CAS], Google Scholar180https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC28Xht12ms7bM&md5=624420917170b7725dbde8a4d0c15ee1Consideration of interaction between nanoparticles and food components for the safety assessment of nanoparticles following oral exposure: A reviewCao, Yi; Li, Juan; Liu, Fang; Li, Xiyue; Jiang, Qin; Cheng, Shanshan; Gu, YuxiuEnvironmental Toxicology and Pharmacology (2016), 46 (), 206-210CODEN: ETOPFR; ISSN:1382-6689. (Elsevier B.V.)A review. Nanoparticles (NPs) are increasingly used in food, and the toxicity of NPs following oral exposure should be carefully assessed to ensure the safety. Indeed, a no. of studies have shown that oral exposure to NPs, esp. solid NPs, may induce toxicol. responses both in vivo and in vitro. However, most of the toxicol. studies only used NPs for oral exposure, and the potential interaction between NPs and food components in real life was ignored. In this review, we summarized the relevant studies and suggested that the interaction between NPs and food components may exist by that (1) NPs directly affect nutrients absorption through disruption of microvilli or alteration in expression of nutrient transporter genes; (2) food components directly affect NP absorption through physico-chem. modification; (3) the presence of food components affect oxidative stress induced by NPs. All of these interactions may eventually enhance or reduce the toxicol. responses induced by NPs following oral exposure. Studies only using NPs for oral exposure may therefore lead to misinterpretation and underestimation/overestimation of toxicity of NPs, and it is necessary to assess the synergistic effects of NPs in a complex system when considering the safety of NPs used in food.
- 181Pietroiusti, A.; Bergamaschi, E.; Campagna, M.; Campagnolo, L.; De Palma, G.; Iavicoli, S.; Leso, V.; Magrini, A.; Miragoli, M.; Pedata, P.; Palombi, L.; Iavicoli, I. The Unrecognized Occupational Relevance of the Interaction between Engineered Nanomaterials and the Gastro-Intestinal Tract: A Consensus Paper from a Multidisciplinary Working Group. Part. Fibre Toxicol. 2017, 14, 47, DOI: 10.1186/s12989-017-0226-0[Crossref], [PubMed], [CAS], Google Scholar181https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC1cXitVyrtb%252FI&md5=1c885a9cc0a0008b3a88acc7637d317aThe unrecognized occupational relevance of the interaction between engineered nanomaterials and the gastro-intestinal tract: a consensus paper from a multidisciplinary working groupPietroiusti, Antonio; Bergamaschi, Enrico; Campagna, Marcello; Campagnolo, Luisa; De Palma, Giuseppe; Iavicoli, Sergio; Leso, Veruscka; Magrini, Andrea; Miragoli, Michele; Pedata, Paola; Palombi, Leonardo; Iavicoli, IvoParticle and Fibre Toxicology (2017), 14 (), 47/1-47/23CODEN: PFTABQ; ISSN:1743-8977. (BioMed Central Ltd.)Background: There is a fundamental gap of knowledge on the health effects caused by the interaction of engineered nanomaterials (ENM) with the gastro-intestinal tract (GIT). This is partly due to the incomplete knowledge of the complex phys. and chem. transformations that ENM undergo in the GIT, and partly to the widespread belief that GIT health effects of ENM are much less relevant than pulmonary effects. However, recent exptl. findings, considering the role of new players in gut physiol. (e.g. the microbiota), shed light on several outcomes of the interaction ENM/GIT. Along with this new information, there is growing direct and indirect evidence that not only ingested ENM, but also inhaled ENM may impact on the GIT. This fact, which may have relevant implications in occupational setting, has never been taken into consideration. This review paper summarizes the opinions and findings of a multidisciplinary team of experts, focusing on two main aspects of the issue: 1) ENM interactions within the GIT and their possible consequences, and 2) relevance of gastro-intestinal effects of inhaled ENMs. Under point 1, we analyzed how luminal gut-constituents, including mucus, may influence the adherence of ENM to cell surfaces in a size-dependent manner, and how intestinal permeability may be affected by different physico-chem. characteristics of ENM. Cytotoxic, oxidative, genotoxic and inflammatory effects on different GIT cells, as well as effects on microbiota, are also discussed. Concerning point 2, recent studies highlight the relevance of gastro-intestinal handling of inhaled ENM, showing significant excretion with feces of inhaled ENM and supporting the hypothesis that GIT should be considered an important target of extrapulmonary effects of inhaled ENM. Conclusions: In spite of recent insights on the relevance of the GIT as a target for toxic effects of nanoparticles, there is still a major gap in knowledge regarding the impact of the direct vs. indirect oral exposure. This fact probably applies also to larger particles and dictates careful consideration in workers, who carry the highest risk of exposure to particulate matter.
- 182Abreu, M. T. Toll-like Receptor Signalling in the Intestinal Epithelium: How Bacterial Recognition Shapes Intestinal Function. Nat. Rev. Immunol. 2010, 10, 131– 144, DOI: 10.1038/nri2707[Crossref], [PubMed], [CAS], Google Scholar182https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3cXpslGnug%253D%253D&md5=c87fdf236f3b94f4cf14dc6d50cfe066Toll-like receptor signalling in the intestinal epithelium: how bacterial recognition shapes intestinal functionAbreu, Maria T.Nature Reviews Immunology (2010), 10 (2), 131-144CODEN: NRIABX; ISSN:1474-1733. (Nature Publishing Group)A review. A single layer of epithelial cells lines the small and large intestines and functions as a barrier between commensal bacteria and the rest of the body. Ligation of Toll-like receptors (TLRs) on intestinal epithelial cells by bacterial products promotes epithelial cell proliferation, secretion of IgA into the gut lumen and expression of antimicrobial peptides. As described in this Review, this establishes a microorganism-induced program of epithelial cell homeostasis and repair in the intestine. Dysregulation of this process can result in chronic inflammatory and over-exuberant repair responses, and it is assocd. with the development of colon cancer. Thus, dysregulated TLR signaling by intestinal epithelial cells may explain how colonic bacteria and inflammation promote colorectal cancer.
- 183Mabbott, N. A.; Donaldson, D. S.; Ohno, H.; Williams, I. R.; Mahajan, A. Microfold (M) Cells: Important Immunosurveillance Posts in the Intestinal Epithelium. Mucosal Immunol. 2013, 6, 666– 677, DOI: 10.1038/mi.2013.30[Crossref], [PubMed], [CAS], Google Scholar183https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3sXnvFyqt7k%253D&md5=4b5f5a5b8f4c10f8adcb585e94798ca0Microfold (M) cells: important immunosurveillance posts in the intestinal epitheliumMabbott, N. A.; Donaldson, D. S.; Ohno, H.; Williams, I. R.; Mahajan, A.Mucosal Immunology (2013), 6 (4), 666-677CODEN: MIUMAK; ISSN:1933-0219. (Nature Publishing Group)A review. The transcytosis of antigens across the gut epithelium by microfold cells (M cells) is important for the induction of efficient immune responses to some mucosal antigens in Peyer's patches. Recently, substantial progress has been made in our understanding of the factors that influence the development and function of M cells. This review highlights these important advances, with particular emphasis on: the host genes which control the functional maturation of M cells; how this knowledge has led to the rapid advance in our understanding of M-cell biol. in the steady state and during aging; mols. expressed on M cells which appear to be used as "immunosurveillance" receptors to sample pathogenic microorganisms in the gut; how certain pathogens appear to exploit M cells to infect the host; and finally how this knowledge has been used to specifically target antigens to M cells to attempt to improve the efficacy of mucosal vaccines.
- 184Ensign, L. M.; Cone, R.; Hanes, J. Oral Drug Delivery with Polymeric Nanoparticles: The Gastrointestinal Mucus Barriers. Adv. Drug Delivery Rev. 2012, 64, 557– 570, DOI: 10.1016/j.addr.2011.12.009[Crossref], [PubMed], [CAS], Google Scholar184https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC38Xls1emt7c%253D&md5=76ac5075bc0cdf79ad3d8cd6868371faOral drug delivery with polymeric nanoparticles: The gastrointestinal mucus barriersEnsign, Laura M.; Cone, Richard; Hanes, JustinAdvanced Drug Delivery Reviews (2012), 64 (6), 557-570CODEN: ADDREP; ISSN:0169-409X. (Elsevier B.V.)A review. Oral delivery is the most common method for drug administration. However, poor soly., stability, and bioavailability of many drugs make achieving therapeutic levels via the gastrointestinal (GI) tract challenging. Drug delivery must overcome numerous hurdles, including the acidic gastric environment and the continuous secretion of mucus that protects the GI tract. Nanoparticle drug carriers that can shield drugs from degrdn. and deliver them to intended sites within the GI tract may enable more efficient and sustained drug delivery. However, the rapid secretion and shedding of GI tract mucus can significantly limit the effectiveness of nanoparticle drug delivery systems. Many types of nanoparticles are efficiently trapped in and rapidly removed by mucus, making controlled release in the GI tract difficult. This review addresses the protective barrier properties of mucus secretions, how mucus affects the fate of orally administered nanoparticles, and recent developments in nanoparticles engineered to penetrate the mucus barrier.
- 185Sun, H.; Chow, E. C.; Liu, S.; Du, Y.; Pang, K. S. The Caco-2 Cell Monolayer: Usefulness and Limitations. Expert Opin. Drug Metab. Toxicol. 2008, 4, 395– 411, DOI: 10.1517/17425255.4.4.395[Crossref], [PubMed], [CAS], Google Scholar185https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BD1cXltVWmt7w%253D&md5=ec3241fe391b0cde5f63d261e91165e4The Caco-2 cell monolayer: usefulness and limitationsSun, Huadong; Chow, Edwin C. Y.; Liu, Shanjun; Du, Yimin; Pang, K. SandyExpert Opinion on Drug Metabolism & Toxicology (2008), 4 (4), 395-411CODEN: EODMAP; ISSN:1742-5255. (Informa Healthcare)A review. Background: The Caco-2 monolayer has been used extensively for the high-throughput screening of drug permeability and identification of substrates, inhibitors, and inducers of intestinal transporters, esp. P-glycoprotein (P-gp). Traditionally, the Caco-2 monolayer is viewed as a single barrier rather than a polarized cell monolayer consisting of metabolic enzymes that are sandwiched between two membrane barriers with distinctly different transporters. Objective: This review addressed the usefulness and limitations of the Caco-2 cell monolayer in drug discovery and mechanistic studies. Methods: This mini-review covered applications of the Caco-2 monolayer, clarified misconceptions, and critically addressed issues on data interpretation. Conclusion: The catenary model extends the usefulness of Caco-2 monolayer and provides proper mechanistic insight and data interpretation.
- 186Dorier, M.; Brun, E.; Veronesi, G.; Barreau, F.; Pernet-Gallay, K.; Desvergne, C.; Rabilloud, T.; Carapito, C.; Herlin-Boime, N.; Carrière, M. Impact of Anatase and Rutile Titanium Dioxide Nanoparticles on Uptake Carriers and Efflux Pumps in Caco-2 Gut Epithelial Cells. Nanoscale 2015, 7, 7352– 7360, DOI: 10.1039/C5NR00505A
- 187van der Zande, M.; Undas, A. K.; Kramer, E.; Monopoli, M. P.; Peters, R. J.; Garry, D.; Antunes Fernandes, E. C.; Hendriksen, P. J.; Marvin, H. J. P.; Peijnenburg, A. A.; Bouwmeester, H. Different Responses of Caco-2 and MCF-7 Cells to Silver Nanoparticles Are Based on Highly Similar Mechanisms of Action. Nanotoxicology 2016, 10, 1431– 1441, DOI: 10.1080/17435390.2016.1225132[Crossref], [PubMed], [CAS], Google Scholar187https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC28XhsV2hsbbF&md5=caec0c4c7dc29b19b6e730144c804a15Different responses of Caco-2 and MCF-7 cells to silver nanoparticles are based on highly similar mechanisms of actionvan der Zande, Meike; Undas, Anna K.; Kramer, Evelien; Monopoli, Marco P.; Peters, Ruud J.; Garry, David; Antunes Fernandes, Elsa C.; Hendriksen, Peter J.; Marvin, Hans J. P.; Peijnenburg, Ad A.; Bouwmeester, HansNanotoxicology (2016), 10 (10), 1431-1441CODEN: NANOGK; ISSN:1743-5404. (Taylor & Francis Ltd.)The mode of action of silver nanoparticles (AgNPs) is suggested to be exerted through both Ag+ and AgNP dependent mechanisms. Ingestion is one of the major NP exposure routes, and potential effects are often studied using Caco-2 cells, a well-established model for the gut epithelium. MCF-7 cells are epithelial breast cancer cells with extensive well-characterized toxicogenomics profiles. In the present study, we aimed to gain a deeper understanding of the cellular mol. responses in Caco-2 and MCF-7 cells after AgNP exposure in order to evaluate whether epithelial cells derived from different tissues demonstrated similar responses. These insights could possibly reduce the size of cell panels for NP hazard identification screening purposes. AgNPs of 20, 30, 60, and 110 nm, and AgNO3 were exposed for 6 h and 24 h. AgNPs were shown to be taken up and dissolve intracellularly. Compared with MCF-7 cells, Caco-2 cells showed a higher sensitivity to AgNPs, slower gene expression kinetics and absence of NP size-dependent responses. However, on a mol. level, no significant differences were obsd. between the two cell types. Transcriptomic anal. showed that Ag(NP) exposure caused (oxidative) stress responses, possibly leading to cell death in both cell lines. There was no indication for effects specifically induced by AgNPs. Responses to AgNPs appeared to be induced by silver ions released from the AgNPs. In conclusion, differences in mRNA responses to AgNPs between Caco-2 and MCF-7 cells were mainly related to timing and magnitude, but not to a different underlying mechanism.
- 188Vila, L.; García-Rodríguez, A.; Cortés, C.; Marcos, R.; Hernández, A. Assessing the Effects of Silver Nanoparticles on Monolayers of Differentiated Caco-2 Cells, as a Model of Intestinal Barrier. Food Chem. Toxicol. 2018, 116, 1– 10, DOI: 10.1016/j.fct.2018.04.008[Crossref], [PubMed], [CAS], Google Scholar188https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC1cXnt1Kgt7c%253D&md5=22549024c256d617e82247f340dccc9aAssessing the effects of silver nanoparticles on monolayers of differentiated Caco-2 cells, as a model of intestinal barrierVila, Laura; Garcia-Rodriguez, Alba; Cortes, Constanza; Marcos, Ricard; Hernandez, AlbaFood and Chemical Toxicology (2018), 116 (Part_B), 1-10CODEN: FCTOD7; ISSN:0278-6915. (Elsevier Ltd.)Since ingestion is one of the main routes of entry of nanoparticles (NPs) in our organism, simple and fast in vitro models of the intestinal barrier can be helpful to evaluate NPs risk. The human colon adenocarcinoma Caco-2 cell line has been extensively used due to its ability to differentiate, forming a well-structured cell monolayer. In this study, we have used these differentiated cells as a model of intestinal barrier to evaluate a wide set of effects caused by exposure to silver nanoparticles (AgNPs) with an av. size of 7.74nm. Different parameters such as toxicity, monolayer integrity and permeability (assessed by changes in cells' morphol. and gene expression pattern), internalization (uptake), translocation, and induction of DNA damage (DNA breaks and oxidative DNA damage) were evaluated. No significant effects were obsd. on the monolayer's integrity/permeability after exposure to silver nanoparticles, although cellular uptake was demonstrated by using confocal microscopy. Despite the obsd. uptake, no translocation of AgNPs to the basolateral chamber was demonstrated with any of the different exptl. approaches used. The genotoxic effects evaluated using the comet assay indicate that, although AgNPs were not able to induce direct DNA breaks, its exposure induced a significant increase in the oxidative DNA damage levels, at non-toxic concns.
- 189Susewind, J.; de Souza Carvalho-Wodarz, C.; Repnik, U.; Collnot, E.-M.; Schneider-Daum, N.; Griffiths, G. W.; Lehr, C.-M. A 3D Co-Culture of Three Human Cell Lines to Model the Inflamed Intestinal Mucosa for Safety Testing of Nanomaterials. Nanotoxicology 2016, 10, 53– 62, DOI: 10.3109/17435390.2015.1008065[Crossref], [PubMed], [CAS], Google Scholar189https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC28Xjs12mt70%253D&md5=4dcf052f62404442b1bb7bd965fbd9e3A 3D co-culture of three human cell lines to model the inflamed intestinal mucosa for safety testing of nanomaterialsSusewind, Julia; Carvalho-Wodarz, Cristiane de Souza; Repnik, Urska; Collnot, Eva-Maria; Schneider-Daum, Nicole; Griffiths, Gareth Wyn; Lehr, Claus-MichaelNanotoxicology (2016), 10 (1), 53-62CODEN: NANOGK; ISSN:1743-5404. (Taylor & Francis Ltd.)Oral exposure to nanomaterials is a current concern, asking for innovative biol. test systems to assess their safety, esp. also in conditions of inflammatory disorders. Aim of this study was to develop a 3D intestinal model, consisting of Caco-2 cells and two human immune cell lines, suitable to assess nanomaterial toxicity, in either healthy or diseased conditions. Human macrophages (THP-1) and human dendritic cells (MUTZ-3) were embedded in a collagen scaffold and seeded on the apical side of transwell inserts. Caco-2 cells were seeded on top of this layer, forming a 3D model of the intestinal mucosa. Toxicity of engineered nanoparticles (NM101 TiO2, NM300 Ag, Au) was evaluated in non-inflamed and inflamed co-cultures, and also compared to non-inflamed Caco-2 monocultures. Inflammation was elicited by IL-1β, and interactions with engineered NPs were addressed by different endpoints. The 3D co-culture showed well preserved ultrastructure and significant barrier properties. Ag NPs were found to be more toxic than TiO2 or Au NPs. But once inflamed with IL-1β, the co-cultures released higher amts. of IL-8 compared to Caco-2 monocultures. However, the cytotoxicity of Ag NPs was higher in Caco-2 monocultures than in 3D co-cultures. The naturally higher IL-8 prodn. in the co-cultures was enhanced even further by the Ag NPs. This study shows that it is possible to mimic inflamed conditions in a 3D co-culture model of the intestinal mucosa. The fact that it is based on three easily available human cell lines makes this model valuable to study the safety of nanomaterials in the context of inflammation.
- 190In, J. G.; Foulke-Abel, J.; Estes, M. K.; Zachos, N. C.; Kovbasnjuk, O.; Donowitz, M. Human Mini-Guts: New Insights into Intestinal Physiology and Host–pathogen Interactions. Nat. Rev. Gastroenterol. Hepatol. 2016, 13, 633– 642, DOI: 10.1038/nrgastro.2016.142[Crossref], [PubMed], [CAS], Google Scholar190https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC28XhsF2qsrfM&md5=c267c296105978fb71acb9ba7b7f31e9Human mini-guts: new insights into intestinal physiology and host-pathogen interactionsIn, Julie G.; Foulke-Abel, Jennifer; Estes, Mary K.; Zachos, Nicholas C.; Kovbasnjuk, Olga; Donowitz, MarkNature Reviews Gastroenterology & Hepatology (2016), 13 (11), 633-642CODEN: NRGHA9; ISSN:1759-5045. (Nature Publishing Group)The development of indefinitely propagating human 'mini-guts' has led to a rapid advance in gastrointestinal research related to transport physiol., developmental biol., pharmacol., and pathophysiol. These mini-guts, also called enteroids or colonoids, are derived from LGR5+ intestinal stem cells isolated from the small intestine or colon. Addn. of WNT3A and other growth factors promotes stemness and results in viable, physiol. functional human intestinal or colonic cultures that develop a crypt-villus axis and can be differentiated into all intestinal epithelial cell types. The success of research using human enteroids has highlighted the limitations of using animals or in vitro, cancer-derived cell lines to model transport physiol. and pathophysiol. For example, curative or preventive therapies for acute enteric infections have been limited, mostly due to the lack of a physiol. human intestinal model. However, the human enteroid model enables specific functional studies of secretion and absorption in each intestinal segment as well as observations of the earliest mol. events that occur during enteric infections. This Review describes studies characterizing these human mini-guts as a physiol. model to investigate intestinal transport and host-pathogen interactions.
- 191Kim, H. J.; Huh, D.; Hamilton, G.; Ingber, D. E. Human Gut-on-a-Chip Inhabited by Microbial Flora That Experiences Intestinal Peristalsis-like Motions and Flow. Lab Chip 2012, 12, 2165– 2174, DOI: 10.1039/c2lc40074j[Crossref], [PubMed], [CAS], Google Scholar191https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC38XnsFOntLk%253D&md5=e8af2c5cc2df26ff4e9e3ddc9aa43d37Human gut-on-a-chip inhabited by microbial flora that experiences intestinal peristalsis-like motions and flowKim, Hyun Jung; Huh, Dongeun; Hamilton, Geraldine; Ingber, Donald E.Lab on a Chip (2012), 12 (12), 2165-2174CODEN: LCAHAM; ISSN:1473-0189. (Royal Society of Chemistry)Development of an in vitro living cell-based model of the intestine that mimics the mech., structural, absorptive, transport and pathophysiol. properties of the human gut along with its crucial microbial symbionts could accelerate pharmaceutical development, and potentially replace animal testing. Here, we describe a biomimetic human gut-on-a-chip' microdevice composed of two microfluidic channels sepd. by a porous flexible membrane coated with extracellular matrix (ECM) and lined by human intestinal epithelial (Caco-2) cells that mimics the complex structure and physiol. of living intestine. The gut microenvironment is recreated by flowing fluid at a low rate (30 μL h-1) producing low shear stress (0.02 dyne cm-2) over the microchannels, and by exerting cyclic strain (10%; 0.15 Hz) that mimics physiol. peristaltic motions. Under these conditions, a columnar epithelium develops that polarizes rapidly, spontaneously grows into folds that recapitulate the structure of intestinal villi, and forms a high integrity barrier to small mols. that better mimics whole intestine than cells in cultured in static Transwell models. In addn., a normal intestinal microbe (Lactobacillus rhamnosus GG) can be successfully co-cultured for extended periods (>1 wk) on the luminal surface of the cultured epithelium without compromising epithelial cell viability, and this actually improves barrier function as previously obsd. in humans. Thus, this gut-on-a-chip recapitulates multiple dynamic phys. and functional features of human intestine that are crit. for its function within a controlled microfluidic environment that is amenable for transport, absorption, and toxicity studies, and hence it should have great value for drug testing as well as development of novel intestinal disease models.
- 192Nguyen, T. H. D.; Lin, M.; Mustapha, A. Toxicity of Graphene Oxide on Intestinal Bacteria and Caco-2 Cells. J. Food Prot. 2015, 78, 996– 1002, DOI: 10.4315/0362-028X.JFP-14-463[Crossref], [PubMed], [CAS], Google Scholar192https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2MXovVynsr8%253D&md5=316ac4a77198b04cba643fe432c4d629Toxicity of graphene oxide on intestinal bacteria and caco-2 cellsNguyen, Trang H. D.; Lin, Mengshi; Mustapha, AzlinJournal of Food Protection (2015), 78 (5), 996-1002CODEN: JFPRDR; ISSN:0362-028X. (International Association for Food Protection)In recent years, novel nanomaterials have received much attention due to their great potential for applications in agriculture, food safety, and food packaging. Among them, graphene and graphene oxide (GO) are emerging as promising nanomaterials that may have a profound impact on food packaging. However, there are some concerns from consumers and the scientific community about the potential toxicity and biocompatibility of nanomaterials. In this study, we investigated the antibacterial properties of GO against human intestinal bacteria. The cytotoxicity of GO was also studied in vitro using the Caco-2 cell line derived from a colon carcinoma. Electron microscopy was used to investigate the morphol. of GO and the interaction between GO flakes and Caco-2 cells. GO at different concns. (10 to 500 μg/mL) exhibited no toxicity against the selected bacteria and a mild cytotoxic action on Caco-2 cells after 24 h of exposure. The results show that weak adsorption of medium nutrients may contribute to GO's low toxicity. This study suggests that GO is biocompatible and has a potential to be used in agriculture and food science, indicating that more studies are needed to exploit its potential applications.
- 193Ruiz, O. N.; Fernando, K. A. S.; Wang, B.; Brown, N. A.; Luo, P. G.; McNamara, N. D.; Vangsness, M.; Sun, Y.-P.; Bunker, C. E. Graphene Oxide: A Nonspecific Enhancer of Cellular Growth. ACS Nano 2011, 5, 8100– 8107, DOI: 10.1021/nn202699t[ACS Full Text
 ], [CAS], Google Scholar193https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3MXht1ChtLjL&md5=3786cb6e4489747ae572db417fff6745Graphene Oxide: A Nonspecific Enhancer of Cellular GrowthRuiz, Oscar N.; Fernando, K. A. Shiral; Wang, Baojiang; Brown, Nicholas A.; Luo, Pengju George; McNamara, Nicholas D.; Vangsness, Marlin; Sun, Ya-Ping; Bunker, Christopher E.ACS Nano (2011), 5 (10), 8100-8107CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)There have been multiple conflicting reports about the biocompatibility and antimicrobial activity of graphene oxide. To address this, we conducted a study to characterize the antimicrobial properties of graphene oxide (GO) and its biocompatibility with mammalian cells. When GO was added to a bacterial culture at 25 μg/mL, the results showed that bacteria grew faster and to a higher optical d. than cultures without GO. SEM indicated that bacteria formed dense biofilms in the presence of GO. This was shown by a large mass of aggregated cells and extracellular polymeric material. Bacterial growth on filters coated with 25 and 75 μg of GO grew 2 and 3 times better than on filters without GO. Closer anal. showed that bacteria were able to attach and proliferate preferentially in areas contg. the highest GO levels. Graphene oxide films failed to produce growth inhibition zones around them, indicating a lack of antibacterial properties. Also, bacteria were able to grow on GO films to 9.5 × 109 cells from an initial inoculation of 1.0 × 106, indicating that it also lacks bacteriostatic activity. Thus, silver-coated GO films were able to produce clearing zones and cell death. Also, graphene oxide was shown to greatly enhance the attachment and proliferation of mammalian cells. This study conclusively demonstrates that graphene oxide does not have intrinsic antibacterial, bacteriostatic, and cytotoxic properties in both bacteria and mammalian cells. Furthermore, graphene oxide acts as a general enhancer of cellular growth by increasing cell attachment and proliferation.
], [CAS], Google Scholar193https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3MXht1ChtLjL&md5=3786cb6e4489747ae572db417fff6745Graphene Oxide: A Nonspecific Enhancer of Cellular GrowthRuiz, Oscar N.; Fernando, K. A. Shiral; Wang, Baojiang; Brown, Nicholas A.; Luo, Pengju George; McNamara, Nicholas D.; Vangsness, Marlin; Sun, Ya-Ping; Bunker, Christopher E.ACS Nano (2011), 5 (10), 8100-8107CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)There have been multiple conflicting reports about the biocompatibility and antimicrobial activity of graphene oxide. To address this, we conducted a study to characterize the antimicrobial properties of graphene oxide (GO) and its biocompatibility with mammalian cells. When GO was added to a bacterial culture at 25 μg/mL, the results showed that bacteria grew faster and to a higher optical d. than cultures without GO. SEM indicated that bacteria formed dense biofilms in the presence of GO. This was shown by a large mass of aggregated cells and extracellular polymeric material. Bacterial growth on filters coated with 25 and 75 μg of GO grew 2 and 3 times better than on filters without GO. Closer anal. showed that bacteria were able to attach and proliferate preferentially in areas contg. the highest GO levels. Graphene oxide films failed to produce growth inhibition zones around them, indicating a lack of antibacterial properties. Also, bacteria were able to grow on GO films to 9.5 × 109 cells from an initial inoculation of 1.0 × 106, indicating that it also lacks bacteriostatic activity. Thus, silver-coated GO films were able to produce clearing zones and cell death. Also, graphene oxide was shown to greatly enhance the attachment and proliferation of mammalian cells. This study conclusively demonstrates that graphene oxide does not have intrinsic antibacterial, bacteriostatic, and cytotoxic properties in both bacteria and mammalian cells. Furthermore, graphene oxide acts as a general enhancer of cellular growth by increasing cell attachment and proliferation. - 194Kucki, M.; Rupper, P.; Sarrieu, C.; Melucci, M.; Treossi, E.; Schwarz, A.; León, V.; Kraegeloh, A.; Flahaut, E.; Vázquez, E.; Palermo, V.; Wick, P. Interaction of Graphene-Related Materials with Human Intestinal Cells: An in Vitro Approach. Nanoscale 2016, 8, 8749– 8760, DOI: 10.1039/C6NR00319B
- 195Guarnieri, D.; Sánchez-Moreno, P.; Del Rio Castillo, A. E.; Bonaccorso, F.; Gatto, F.; Bardi, G.; Martín, C.; Vázquez, E.; Catelani, T.; Sabella, S.; Pompa, P. P. Biotransformation and Biological Interaction of Graphene and Graphene Oxide during Simulated Oral Ingestion. Small 2018, 14, 1800227, DOI: 10.1002/smll.201800227
- 196Nicholson, J. K.; Holmes, E.; Kinross, J.; Burcelin, R.; Gibson, G.; Jia, W.; Pettersson, S. Host-Gut Microbiota Metabolic Interactions. Science 2012, 336, 1262– 1267, DOI: 10.1126/science.1223813[Crossref], [PubMed], [CAS], Google Scholar196https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC38XnvFekt7c%253D&md5=a4383140dbfa427c36adb44d30add530Host-Gut Microbiota Metabolic InteractionsNicholson, Jeremy K.; Holmes, Elaine; Kinross, James; Burcelin, Remy; Gibson, Glenn; Jia, Wei; Pettersson, SvenScience (Washington, DC, United States) (2012), 336 (6086), 1262-1267CODEN: SCIEAS; ISSN:0036-8075. (American Association for the Advancement of Science)A review. The compn. and activity of the gut microbiota codevelop with the host from birth and is subject to a complex interplay that depends on the host genome, nutrition, and life-style. The gut microbiota is involved in the regulation of multiple host metabolic pathways, giving rise to interactive host-microbiota metabolic, signaling, and immune-inflammatory axes that physiol. connect the gut, liver, muscle, and brain. A deeper understanding of these axes is a prerequisite for optimizing therapeutic strategies to manipulate the gut microbiota to combat disease and improve health.
- 197Chen, H.; Zhao, R.; Wang, B.; Zheng, L.; Ouyang, H.; Wang, H.; Zhou, X.; Zhang, D.; Chai, Z.; Zhao, Y.; Feng, W. Acute Oral Administration of Single-Walled Carbon Nanotubes Increases Intestinal Permeability and Inflammatory Responses: Association with the Changes in Gut Microbiota in Mice. Adv. Healthcare Mater. 2018, 7, 1701313, DOI: 10.1002/adhm.201701313
- 198Kreyling, W. G.; Semmler-Behnke, M.; Takenaka, S.; Möller, W. Differences in the Biokinetics of Inhaled Nano- versus Micrometer-Sized Particles. Acc. Chem. Res. 2013, 46, 714– 722, DOI: 10.1021/ar300043r
- 199Hougaard, K. S.; Campagnolo, L.; Fadeel, B.; Gulumian, M.; Kagan, V. E.; Møller, P.; Jacobsen, N. R.; Savolainen, K. M. Developmental Toxicity of Engineered Nanomaterials. Reprod. Dev. Toxicol. 2017, 333– 357, DOI: 10.1016/B978-0-12-804239-7.00019-6
- 200Ema, M.; Kobayashi, N.; Naya, M.; Hanai, S.; Nakanishi, J. Reproductive and Developmental Toxicity Studies of Manufactured Nanomaterials. Reprod. Toxicol. 2010, 30, 343– 352, DOI: 10.1016/j.reprotox.2010.06.002[Crossref], [PubMed], [CAS], Google Scholar200https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3cXhtFGhtbvO&md5=b42c5a954d1de15dfbecb055928f7f9dReproductive and developmental toxicity studies of manufactured nanomaterialsEma, Makoto; Kobayashi, Norihiro; Naya, Masato; Hanai, Sosuke; Nakanishi, JunkoReproductive Toxicology (2010), 30 (3), 343-352CODEN: REPTED; ISSN:0890-6238. (Elsevier B.V.)A review. This paper reviews studies in vivo and in vitro on the reproductive and developmental toxicity of manufd. nanomaterials including metallic and metal oxide-based particles, fullerenes (C60), carbon black (CB), and luminescent particles. Studies in vivo showed increased allergic susceptibility in offspring of mouse dams intranasally insufflated with respirable-size titanium dioxide (TiO2), adverse effects on spermatogenesis and histopathol. changes in the testes and changes in gene expression in the brain of mouse offspring after maternal s.c. injection of TiO2 nanoparticles, transfer to rat fetuses of radiolabeled gold nanoparticles and C60 after maternal i.v. injection, death and morphol. abnormalities in mouse embryos after maternal i.p. injection of C60, and adverse effects on spermatogenesis in mouse offspring after maternal intratracheal instillation of CB nanoparticles. Studies in vitro revealed that TiO2 and CB nanoparticles affected the viability of mouse Leydig cells, that gold nanoparticles reduced the motility of human sperm, that silver, aluminum, and molybdenum trioxide were toxic to mouse spermatogonia stem cells, that silica nanoparticles and C60 inhibited the differentiation of mouse embryonic stem cells and midbrain cells, resp., and that cadmium selenium-core quantum dots inhibited pre- and postimplantation development of mouse embryos. Although this paper provides initial information on the potential reproductive and developmental toxicity of manufd. nanomaterials, further studies, esp. in vivo, using characterized nanoparticles, relevant routes of administration, and doses closely reflecting expected levels of exposure are needed.
- 201Liang, S.; Xu, S.; Zhang, D.; He, J.; Chu, M. Reproductive Toxicity of Nanoscale Graphene Oxide in Male Mice. Nanotoxicology 2015, 9, 92– 105, DOI: 10.3109/17435390.2014.893380
- 202Skovmand, A.; Jacobsen Lauvås, A.; Christensen, P.; Vogel, U.; Sørig Hougaard, K.; Goericke-Pesch, S. Pulmonary Exposure to Carbonaceous Nanomaterials and Sperm Quality. Part. Part. Fibre Toxicol. 2018, 15, 10, DOI: 10.1186/s12989-018-0242-8[Crossref], [PubMed], [CAS], Google Scholar202https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC1cXitFOku7bM&md5=231f96118742e1479a368f27a181fba4Pulmonary exposure to carbonaceous nanomaterials and sperm qualitySkovmand, Astrid; Lauvaes, Anna Jacobsen; Christensen, Preben; Vogel, Ulla; Hougaard, Karin Soerig; Goericke-Pesch, SandraParticle and Fibre Toxicology (2018), 15 (), 10/1-10/12CODEN: PFTABQ; ISSN:1743-8977. (BioMed Central Ltd.)Background: Semen quality parameters are potentially affected by nanomaterials in several ways: Inhaled nanosized particles are potent inducers of pulmonary inflammation, leading to the release of inflammatory mediators. Small amts. of particles may translocate from the lungs into the lung capillaries, enter the systemic circulation and ultimately reach the testes. Both the inflammatory response and the particles may induce oxidative stress which can directly affect spermatogenesis. Furthermore, spermatogenesis may be indirectly affected by changes in the hormonal milieu as systemic inflammation is a potential modulator of endocrine function. The aim of this study was to investigate the effects of pulmonary exposure to carbonaceous nanomaterials on sperm quality parameters in an exptl. mouse model. Methods: Effects on sperm quality after pulmonary inflammation induced by carbonaceous nanomaterials were investigated by intratracheally instilling sexually mature male NMRI mice with four different carbonaceous nanomaterials dispersed in nanopure water: graphene oxide (18 μg/mouse/i.t.), Flammruss 101, Printex 90 and SRM1650b (0.1 mg/mouse/i.t. each) weekly for seven consecutive weeks. Pulmonary inflammation was detd. by differential cell count in bronchoalveolar lavage fluid. Epididymal sperm concn. and motility were measured by computer-assisted sperm anal. Epididymal sperm viability and morphol. abnormalities were assessed manually using Hoechst 33,342/PI flourescent and Spermac staining, resp. Epididymal sperm were assessed with regard to sperm DNA integrity (damage). Daily sperm prodn. was measured in the testis, and testosterone levels were measured in blood plasma by ELISA. Results: Neutrophil nos. in the bronchoalveolar fluid showed sustained inflammatory response in the nanoparticleexposed groups one week after the last instillation. No significant changes in epididymal sperm parameters, daily sperm prodn. or plasma testosterone levels were found. Conclusion: Despite the sustained pulmonary inflammatory response, an eight week exposure to graphene oxide, Flammruss 101, Printex 90 and the diesel particle SRM1650b in the present study did not appear to affect semen parameters, daily sperm prodn. or testosterone concn. in male NMRI mice.
- 203Xu, S.; Zhang, Z.; Chu, M. Long-Term Toxicity of Reduced Graphene Oxide Nanosheets: Effects on Female Mouse Reproductive Ability and Offspring Development. Biomaterials 2015, 54, 188– 200, DOI: 10.1016/j.biomaterials.2015.03.015
- 204Chen, Y.; Hu, X.; Sun, J.; Zhou, Q. Specific Nanotoxicity of Graphene Oxide during Zebrafish Embryogenesis. Nanotoxicology 2016, 10, 42– 52, DOI: 10.3109/17435390.2015.1005032[Crossref], [PubMed], [CAS], Google Scholar204https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC28Xjs12mtrc%253D&md5=674566476ae7831ba8709a90c408c0b1Specific nanotoxicity of graphene oxide during zebrafish embryogenesisChen, Yuming; Hu, Xiangang; Sun, Jing; Zhou, QixingNanotoxicology (2016), 10 (1), 42-52CODEN: NANOGK; ISSN:1743-5404. (Taylor & Francis Ltd.)Graphene oxide (GO) has shown great potential for biol., medical, energy and electronic applications. As a consequence of these diverse applications, GO release into the ecosystem is inevitable; however, the corresponding risks are largely unknown, particularly with respect to the crit. period of embryogenesis. This study revealed that GO adhered to and enveloped the chorion of zebrafish embryos mainly via hydroxyl group interactions, blocked the pore canals of the chorionic membrane, and caused marked hypoxia and hatching delay. Furthermore, GO spontaneously penetrated the chorion, entered the embryo via endocytosis, damaged the mitochondria and primarily translocated to the eye, heart and yolk sac regions, which are involved in the circulatory system of zebrafish. In these organs, GO induced excessive generation of reactive oxygen species and increased oxidative stress, DNA damage and apoptosis. Graphene oxide also induced developmental malformation of the eye, cardiac/yolk sac edema, tail flexure and heart rate redn. In contrast to the common dose-effect relationships of nanoparticles, the adverse effects of GO on heart rate and tail/spinal cord flexure increased and then decreased as the GO concn. increased. These findings emphasize the specific adverse effects of GO on embryogenesis and highlight the potential ecol. and health risks of GO.
- 205Chwalibog, A.; Wierzbicki, M.; Sawosz, E.; Grodzik, M.; Hotowy, A.; Prasek, M.; Jaworski, S.; Sawosz, F. Carbon Nanoparticles Downregulate Expression of Basic Fibroblast Growth Factor in the Heart during Embryogenesis. Int. J. Nanomed. 2013, 8, 3427– 3435, DOI: 10.2147/IJN.S49745
- 206Muoth, C.; Aengenheister, L.; Kucki, M.; Wick, P.; Buerki-Thurnherr, T. Nanoparticle Transport across the Placental Barrier: Pushing the Field Forward!. Nanomedicine 2016, 11, 941– 957, DOI: 10.2217/nnm-2015-0012
- 207Huang, X.; Zhang, F.; Sun, X.; Choi, K.-Y.; Niu, G.; Zhang, G.; Guo, J.; Lee, S.; Chen, X. The Genotype-Dependent Influence of Functionalized Multiwalled Carbon Nanotubes on Fetal Development. Biomaterials 2014, 35, 856– 865, DOI: 10.1016/j.biomaterials.2013.10.027
- 208Qi, W.; Bi, J.; Zhang, X.; Wang, J.; Wang, J.; Liu, P.; Li, Z.; Wu, W. Damaging Effects of Multi-Walled Carbon Nanotubes on Pregnant Mice with Different Pregnancy Times. Sci. Rep. 2015, 4, 4352, DOI: 10.1038/srep04352
- 209Campagnolo, L.; Massimiani, M.; Palmieri, G.; Bernardini, R.; Sacchetti, C.; Bergamaschi, A.; Vecchione, L.; Magrini, A.; Bottini, M.; Pietroiusti, A. Biodistribution and Toxicity of Pegylated Single Wall Carbon Nanotubes in Pregnant Mice. Part. Part. Fibre Toxicol. 2013, 10, 21, DOI: 10.1186/1743-8977-10-21[Crossref], [PubMed], [CAS], Google Scholar209https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3sXhtVSrsrbL&md5=6b49b09365f66eea92407a2d424cad33Biodistribution and toxicity of pegylated single wall carbon nanotubes in pregnant miceCampagnolo, Luisa; Massimiani, Micol; Palmieri, Graziana; Bernardini, Roberta; Sacchetti, Cristiano; Bergamaschi, Antonio; Vecchione, Lucia; Magrini, Andrea; Bottini, Massimo; Pietroiusti, AntonioParticle and Fibre Toxicology (2013), 10 (), 21CODEN: PFTABQ; ISSN:1743-8977. (BioMed Central Ltd.)Background: Single wall carbon nanotubes (SWCNTs) are considered promising nanoparticles for industrial and biomedical applications; however their potential toxicity in several biol. systems, including the feto-placental unit, has been demonstrated. Functionalization of SWCNTs with polyethylene glycol chains (PEG-SWCNTs) dramatically reduces their toxicity, and for this reason PEG-SWCNTs are candidates for biomedical applications. However, no data are available on their safety for the developing embryo, in spite of the clin. and social relevance of this topic. The purpose of this study is therefore to investigate the safety of PEG-SWCNTs for their use as biomedical carriers in pregnancy. Methods: For toxicol. studies, amino-functionalized PEG-SWCNT were i.v. injected in CD1 pregnant mice at different doses (range 0.1-30 μg/mouse), in single or multiple administrations. For biodistribution studies, fluorescently labeled PEG-SWCNTs were obtained by acylation of terminal PEG amino groups with near IR emitting fluorochromes (PEG-SWCNT-750) and injected at the dosage of 10 μg/mouse, at either day 5.5 (when the placenta is still developing) or day 14.5 of gestation (when the maturation of the placenta is complete). Results: We found no adverse effects both on embryos and dams up to the dose of 10 μg/mouse. At the dose of 30 μg/mouse, occasional teratogenic effects, assocd. with placental damage, were detected both when administered as a single bolus (1 out of 10 dams; 1 malformed embryo) or as multiple doses (2 out of 10 dams; 5 malformed embryos). The difference in the prevalence of dams with malformed embryos between the 30 μg exposed group and controls approached the statistical significance (p = 0.06). Hepatic damage in dams was seen only in the multiple exposure group (4 out of 10; p = 0.04 when compared with the single exposure group or controls). PEG-SWCNT-750 reached the conceptus when administered early in pregnancy. At later stages, PEGSWCNT-750 were detected in the placenta and the yolk sac, but not in the embryo. Conclusions: PEG-SWCNTs may cause occasional teratogenic effects in mice beyond a threshold dose. Such effect might depend on their ability to reach the feto-placenta unit. Although not automatically transferable to humans, these data should be considered if exposing women during pregnancy.
- 210Philbrook, N. A.; Walker, V. K.; Afrooz, A. R. M. N.; Saleh, N. B.; Winn, L. M. Investigating the Effects of Functionalized Carbon Nanotubes on Reproduction and Development in Drosophila Melanogaster and CD-1 Mice. Reprod. Toxicol. 2011, 32, 442– 448, DOI: 10.1016/j.reprotox.2011.09.002[Crossref], [PubMed], [CAS], Google Scholar210https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3MXhsFegtrbO&md5=a4e88361f1f1226306a4a5ffb92f778cInvestigating the effects of functionalized carbon nanotubes on reproduction and development in Drosophila melanogaster and CD-1 micePhilbrook, Nicola A.; Walker, Virginia K.; Afrooz, A. R. M. Nabiul; Saleh, Navid B.; Winn, Louise M.Reproductive Toxicology (2011), 32 (4), 442-448CODEN: REPTED; ISSN:0890-6238. (Elsevier B.V.)Despite numerous applications for functionalized carbon nanotubes (fCNTs) in consumer products, such as electronics, and food packaging, as well as their development as drug delivery vehicles, the consequence of their uptake by living systems has been understudied. In particular, the impact of fCNTs on early development of different species is largely unknown. Here we investigated the effect of ingested hydroxyl-fCNTs on reprodn. and development in two model organisms: Drosophila and CD-1 mice. While fCNTs had no measurable impact on Drosophila, a single oral dose of fCNTs (10 mg/kg) administered to pregnant CD-1 dams during organogenesis significantly increased the no. of resorptions and resulted in fetal morphol. and skeletal abnormalities. The obsd. difference between the responses of these two models likely reflects their physiol. and/or differences in administration. This research underscores the need to examine the effects of fCNTs on reproductive health and development before the opportunities for maternal exposure by fCNTs increase further.
- 211Fu, C.; Liu, T.; Li, L.; Liu, H.; Liang, Q.; Meng, X. Effects of Graphene Oxide on the Development of Offspring Mice in Lactation Period. Biomaterials 2015, 40, 23– 31, DOI: 10.1016/j.biomaterials.2014.11.014[Crossref], [PubMed], [CAS], Google Scholar211https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2cXitVaktbjO&md5=4b0fb5267503a73aa1eea996c0221b3dEffects of graphene oxide on the development of offspring mice in lactation periodFu, Changhui; Liu, Tianlong; Li, Linlin; Liu, Huiyu; Liang, Qinghua; Meng, XianweiBiomaterials (2015), 40 (), 23-31CODEN: BIMADU; ISSN:0142-9612. (Elsevier Ltd.)The potential toxicity of graphene oxide (GO) has attracted much attention with numerous promising biomedical applications in recent years. However, information about GO on the development of filial animals is rare. In this work, we studied the potential developmental toxicity of GO when they entered the body of maternal mice and their offspring by oral exposure with two doses. The results showed that the increase of body wt., body length and tail length of the filial mice received GO at 0.5 mg mL-1 (about 0.8 mg each mouse) every day in the lactation period was significantly retarded comparing with the control group. The anatomy and histol. results revealed the delayed developments of offspring in high dosage group. We also evaluated the possible toxicol. mechanism caused by GO and found that the length of the intestinal villus of the filial mice received high concn. GO were decreased significantly compared with the control group. It can be concluded that GO showed many neg. effects on the development of mice in the lactation period. These findings can be significant for the development of graphene materials-based drug delivery system and other biomedical applications in the future.
- 212Kucki, M.; Aengenheister, L.; Diener, L.; Rippl, A. V.; Vranic, S.; Newman, L.; Vazquez, E.; Kostarelos, K.; Wick, P.; Buerki-Thurnherr, T. Impact of Graphene Oxide on Human Placental Trophoblast Viability, Functionality and Barrier Integrity. 2D Mater. 2018, 5, 035014, DOI: 10.1088/2053-1583/aab9e2
- 213Mendonça, M. C. P.; Soares, E. S.; de Jesus, M. B.; Ceragioli, H. J.; Ferreira, M. S.; Catharino, R. R.; da Cruz-Höfling, M. A. Reduced Graphene Oxide Induces Transient Blood–brain Barrier Opening: An in Vivo Study. J. Nanobiotechnol. 2015, 13, 78, DOI: 10.1186/s12951-015-0143-z[Crossref], [PubMed], [CAS], Google Scholar213https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC28XitVKisLnN&md5=1522e6c2bc44964d1ebef3909830a8c4Reduced graphene oxide induces transient blood-brain barrier opening: an in vivo studyMendonca, Monique Culturato Padilha; Soares, Edilene Siqueira; de Jesus, Marcelo Bispo; Ceragioli, Helder Jose; Ferreira, Monica Siqueira; Catharino, Rodrigo Ramos; da Cruz-Hoefling, Maria AliceJournal of Nanobiotechnology (2015), 13 (), 78/1-78/13CODEN: JNOAAO; ISSN:1477-3155. (BioMed Central Ltd.)Background: The blood-brain barrier (BBB) is a complex phys. and functional barrier protecting the central nervous system from phys. and chem. insults. Nevertheless, it also constitutes a barrier against therapeutics for treating neurol. disorders. In this context, nanomaterial-based therapy provides a potential alternative for overcoming this problem. Graphene family has attracted significant interest in nanomedicine because their unique physicochem. properties make them amenable to applications in drug/gene delivery and neural interface. Results: In this study, reduced graphene oxide (rGO) systemically-injected was found mainly located in the thalamus and hippocampus of rats. The entry of rGO involved a transitory decrease in the BBB paracellular tightness, as demonstrated at anatomical (Evans blue dye infusion), subcellular (transmission electron microscopy) and mol. (junctional protein expression) levels. Addnl., we examd. the usefulness of matrix-assisted laser desorption/ionization (MALDI) mass spectrometry imaging (MSI) as a new imaging method for detecting the temporal distribution of nanomaterials throughout the brain. Conclusions: rGO was able to be detected and monitored in the brain over time provided by a novel application for MALDI-MSI and could be a useful tool for treating a variety of brain disorders that are normally unresponsive to conventional treatment because of BBB impermeability.
- 214Pietroiusti, A.; Massimiani, M.; Fenoglio, I.; Colonna, M.; Valentini, F.; Palleschi, G.; Camaioni, A.; Magrini, A.; Siracusa, G.; Bergamaschi, A.; Sgambato, A.; Campagnolo, L. Low Doses of Pristine and Oxidized Single-Wall Carbon Nanotubes Affect Mammalian Embryonic Development. ACS Nano 2011, 5, 4624– 4633, DOI: 10.1021/nn200372g[ACS Full Text
 ], [CAS], Google Scholar214https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3MXmvFKqtbg%253D&md5=1f419d8ce7dc23fe075d9dc129a1ac81Low Doses of Pristine and Oxidized Single-Wall Carbon Nanotubes Affect Mammalian Embryonic DevelopmentPietroiusti, Antonio; Massimiani, Micol; Fenoglio, Ivana; Colonna, Massimiliano; Valentini, Federica; Palleschi, Giuseppe; Camaioni, Antonella; Magrini, Andrea; Siracusa, Gregorio; Bergamaschi, Antonio; Sgambato, Alessandro; Campagnolo, LuisaACS Nano (2011), 5 (6), 4624-4633CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)Several in vitro and in vivo studies suggest local and systemic effects following exposure to carbon nanotubes. No data are available, however, on their possible embryotoxicity in mammals. In this study, the authors tested the effect of pristine and oxidized single-wall carbon nanotubes (SWCNTs) on the development of the mouse embryo. To this end, SWCNTs (from 10 ng to 30 μg/mouse) were administered to female mice soon after implantation (postcoital day 5.5); 10 days later, animals were sacrificed, and uteri, placentas, and fetuses examd. A high percentage of early miscarriages and fetal malformations was obsd. in females exposed to oxidized SWCNTs, while lower percentages were found in animals exposed to the pristine material. The lowest ED was 100 ng/mouse. Extensive vascular lesions and increased prodn. of reactive oxygen species (ROS) were detected in placentas of malformed but not of normally developed fetuses. Increased ROS levels were likewise detected in malformed fetuses. No increased ROS prodn. or evident morphol. alterations were obsd. in maternal tissues. No fetal and placental abnormalities were ever obsd. in control animals. In parallel, SWCNT embryotoxicity was evaluated using the embryonic stem cell test (EST), a validated in vitro assay developed for predicting embryotoxicity of sol. chem. compds., but never applied in full to nanoparticles. The EST predicted the in vivo data, identifying oxidized SWCNTs as the more toxic compd.
], [CAS], Google Scholar214https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3MXmvFKqtbg%253D&md5=1f419d8ce7dc23fe075d9dc129a1ac81Low Doses of Pristine and Oxidized Single-Wall Carbon Nanotubes Affect Mammalian Embryonic DevelopmentPietroiusti, Antonio; Massimiani, Micol; Fenoglio, Ivana; Colonna, Massimiliano; Valentini, Federica; Palleschi, Giuseppe; Camaioni, Antonella; Magrini, Andrea; Siracusa, Gregorio; Bergamaschi, Antonio; Sgambato, Alessandro; Campagnolo, LuisaACS Nano (2011), 5 (6), 4624-4633CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)Several in vitro and in vivo studies suggest local and systemic effects following exposure to carbon nanotubes. No data are available, however, on their possible embryotoxicity in mammals. In this study, the authors tested the effect of pristine and oxidized single-wall carbon nanotubes (SWCNTs) on the development of the mouse embryo. To this end, SWCNTs (from 10 ng to 30 μg/mouse) were administered to female mice soon after implantation (postcoital day 5.5); 10 days later, animals were sacrificed, and uteri, placentas, and fetuses examd. A high percentage of early miscarriages and fetal malformations was obsd. in females exposed to oxidized SWCNTs, while lower percentages were found in animals exposed to the pristine material. The lowest ED was 100 ng/mouse. Extensive vascular lesions and increased prodn. of reactive oxygen species (ROS) were detected in placentas of malformed but not of normally developed fetuses. Increased ROS levels were likewise detected in malformed fetuses. No increased ROS prodn. or evident morphol. alterations were obsd. in maternal tissues. No fetal and placental abnormalities were ever obsd. in control animals. In parallel, SWCNT embryotoxicity was evaluated using the embryonic stem cell test (EST), a validated in vitro assay developed for predicting embryotoxicity of sol. chem. compds., but never applied in full to nanoparticles. The EST predicted the in vivo data, identifying oxidized SWCNTs as the more toxic compd. - 215Schmidt, A.; Morales-Prieto, D. M.; Pastuschek, J.; Fröhlich, K.; Markert, U. R. Only Humans Have Human Placentas: Molecular Differences between Mice and Humans. J. Reprod. Immunol. 2015, 108, 65– 71, DOI: 10.1016/j.jri.2015.03.001[Crossref], [PubMed], [CAS], Google Scholar215https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2MXksV2iu7o%253D&md5=3d6a128a9ffa0e85fae95020b42518a5Only humans have human placentas: molecular differences between mice and humansSchmidt, Andre; Morales-Prieto, Diana M.; Pastuschek, Jana; Froehlich, Karolin; Markert, Udo R.Journal of Reproductive Immunology (2015), 108 (), 65-71CODEN: JRIMDR; ISSN:0165-0378. (Elsevier Ireland Ltd.)The placenta is one of the organs with the highest evolutionary diversity among animal species. In consequence, an animal model that reflects human placentation exactly does not exist. However, the mouse is the most frequently used animal model for placenta and pregnancy research. It possesses a hemochorial placenta, which is similar, but also different from the human placenta. The question whether the similarities are sufficient for the achievement of useful results with regard to human pregnancy was debated recently at the 11th Congress of the European Society for Reproductive Immunol. (Budapest, Hungary). Here, we discuss the mol. features of the human placenta that are restricted to primates or even to humans. Many of the primate-specific genetic novelties, e.g., the large microRNA cluster on chromosome 19, have been detected during the last 10-15 years and could not be referred to in earlier discussions. Now, in the light of recent findings and a better understanding of interspecies differences, we conclude that the mouse model is often overvalued. Owing to the increasing no. of known human-specific factors in human placentation we consider that many aspects of human placentation can only be understood on the basis of expts. on human cells and tissues in combination with data collections from human subject studies.
- 216Scaini, D.; Ballerini, L. Nanomaterials at the Neural Interface. Curr. Opin. Neurobiol. 2018, 50, 50– 55, DOI: 10.1016/j.conb.2017.12.009[Crossref], [PubMed], [CAS], Google Scholar216https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2sXitVCmsbvF&md5=3a19385eebf419c45bd5130134ccd4d5Nanomaterials at the neural interfaceScaini, Denis; Ballerini, LauraCurrent Opinion in Neurobiology (2018), 50 (), 50-55CODEN: COPUEN; ISSN:0959-4388. (Elsevier Ltd.)Interfacing the nervous system with devices able to efficiently record or modulate the elec. activity of neuronal cells represents the underlying foundation of future theranostic applications in neurol. and of current openings in neuroscience research. These devices, usually sensing cell activity via microelectrodes, should be characterized by safe working conditions in the biol. milieu together with a well-controlled operation-life. The stable device/neuronal elec. coupling at the interface requires tight interactions between the electrode surface and the cell membrane. This neuro-electrode hybrid represents the hyphen between the soft nature of neural tissue, generating elec. signals via ion motions, and the rigid realm of microelectronics and medical devices, dealing with electrons in motion. Efficient integration of these entities is essential for monitoring, analyzing and controlling neuronal signaling but poses significant technol. challenges. Improving the cell/electrode interaction and thus the interface performance requires novel engineering of (nano)materials: tuning at the nanoscale electrode's properties may lead to engineer interfacing probes that better camouflaged with their biol. target. In this brief review, we highlight the most recent concepts in nanotechnologies and nanomaterials that might help reducing the mismatch between tissue and electrode, focusing on the device's mech. properties and its biol. integration with the tissue.
- 217Rauti, R.; Lozano, N.; León, V.; Scaini, D.; Musto, M.; Rago, I.; Ulloa Severino, F. P.; Fabbro, A.; Casalis, L.; Vázquez, E.; Kostarelos, K.; Prato, M.; Ballerini, L. Graphene Oxide Nanosheets Reshape Synaptic Function in Cultured Brain Networks. ACS Nano 2016, 10, 4459– 4471, DOI: 10.1021/acsnano.6b00130[ACS Full Text
 ], [CAS], Google Scholar217https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC28Xlt1Gjtrg%253D&md5=08a16f99ced41f8cdcb9a78856027191Graphene Oxide Nanosheets Reshape Synaptic Function in Cultured Brain NetworksRauti, Rossana; Lozano, Neus; Leon, Veronica; Scaini, Denis; Musto, Mattia; Rago, Ilaria; Ulloa Severino, Francesco P.; Fabbro, Alessandra; Casalis, Loredana; Vazquez, Ester; Kostarelos, Kostas; Prato, Maurizio; Ballerini, LauraACS Nano (2016), 10 (4), 4459-4471CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)Graphene offers promising advantages for biomedical applications. However, adoption of graphene technol. in biomedicine also poses important challenges in terms of understanding cell responses, cellular uptake, or the intracellular fate of sol. graphene derivs. In the biol. microenvironment, graphene nanosheets might interact with exposed cellular and subcellular structures, resulting in unexpected regulation of sophisticated biol. signaling. More broadly, biomedical devices based on the design of these 2D planar nanostructures for interventions in the central nervous system require an accurate understanding of their interactions with the neuronal milieu. Here, we describe the ability of graphene oxide nanosheets to down-regulate neuronal signaling without affecting cell viability.
], [CAS], Google Scholar217https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC28Xlt1Gjtrg%253D&md5=08a16f99ced41f8cdcb9a78856027191Graphene Oxide Nanosheets Reshape Synaptic Function in Cultured Brain NetworksRauti, Rossana; Lozano, Neus; Leon, Veronica; Scaini, Denis; Musto, Mattia; Rago, Ilaria; Ulloa Severino, Francesco P.; Fabbro, Alessandra; Casalis, Loredana; Vazquez, Ester; Kostarelos, Kostas; Prato, Maurizio; Ballerini, LauraACS Nano (2016), 10 (4), 4459-4471CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)Graphene offers promising advantages for biomedical applications. However, adoption of graphene technol. in biomedicine also poses important challenges in terms of understanding cell responses, cellular uptake, or the intracellular fate of sol. graphene derivs. In the biol. microenvironment, graphene nanosheets might interact with exposed cellular and subcellular structures, resulting in unexpected regulation of sophisticated biol. signaling. More broadly, biomedical devices based on the design of these 2D planar nanostructures for interventions in the central nervous system require an accurate understanding of their interactions with the neuronal milieu. Here, we describe the ability of graphene oxide nanosheets to down-regulate neuronal signaling without affecting cell viability. - 218Bramini, M.; Sacchetti, S.; Armirotti, A.; Rocchi, A.; Vázquez, E.; León Castellanos, V.; Bandiera, T.; Cesca, F.; Benfenati, F. Graphene Oxide Nanosheets Disrupt Lipid Composition, Ca 2+ Homeostasis, and Synaptic Transmission in Primary Cortical Neurons. ACS Nano 2016, 10, 7154– 7171, DOI: 10.1021/acsnano.6b03438
- 219High, B.; Cole, A. A.; Chen, X.; Reese, T. S. Electron Microscopic Tomography Reveals Discrete Transcleft Elements at Excitatory and Inhibitory Synapses. Front. Synaptic Neurosci. 2015, 7, 9, DOI: 10.3389/fnsyn.2015.00009[Crossref], [PubMed], [CAS], Google Scholar219https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A280%3ADC%252BC2MbnsV2lsw%253D%253D&md5=41b2a1ff44d8a7c62f28cda84068ae20Electron microscopic tomography reveals discrete transcleft elements at excitatory and inhibitory synapsesHigh Brigit; Chen Xiaobing; Reese Thomas S; Cole Andy AFrontiers in synaptic neuroscience (2015), 7 (), 9 ISSN:1663-3563.Electron microscopy has revealed an abundance of material in the clefts of synapses in the mammalian brain, and the biochemical and functional characteristics of proteins occupying synaptic clefts are well documented. However, the detailed spatial organization of the proteins in the synaptic clefts remains unclear. Electron microscope tomography provides a way to delineate and map the proteins spanning the synaptic cleft because freeze substitution preserves molecular details with sufficient contrast to visualize individual cleft proteins. Segmentation and rendering of electron dense material connected across the cleft reveals discrete structural elements that are readily classified into five types at excitatory synapses and four types at inhibitory synapses. Some transcleft elements resemble shapes and sizes of known proteins and could represent single dimers traversing the cleft. Some of the types of cleft elements at inhibitory synapses roughly matched the structure and proportional frequency of cleft elements at excitatory synapses, but the patterns of deployments in the cleft are quite different. Transcleft elements at excitatory synapses were often evenly dispersed in clefts of uniform (18 nm) width but some types show preference for the center or edges of the cleft. Transcleft elements at inhibitory synapses typically were confined to a peripheral region of the cleft where it narrowed to only 6 nm wide. Transcleft elements in both excitatory and inhibitory synapses typically avoid places where synaptic vesicles attach to the presynaptic membrane. These results illustrate that elements spanning synaptic clefts at excitatory and inhibitory synapses consist of distinct structures arranged by type in a specific but different manner at excitatory and inhibitory synapses.
- 220Falchi, A. M.; Sogos, V.; Saba, F.; Piras, M.; Congiu, T.; Piludu, M. Astrocytes Shed Large Membrane Vesicles That Contain Mitochondria, Lipid Droplets and ATP. Histochem. Cell Biol. 2013, 139, 221– 231, DOI: 10.1007/s00418-012-1045-x[Crossref], [PubMed], [CAS], Google Scholar220https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3sXhvV2nuro%253D&md5=5cfc41682abb1e7410ae68f9f63cb035Astrocytes shed large membrane vesicles that contain mitochondria, lipid droplets and ATPFalchi, Angela Maria; Sogos, Valeria; Saba, Francesca; Piras, Monica; Congiu, Terenzio; Piludu, MarcoHistochemistry and Cell Biology (2013), 139 (2), 221-231CODEN: HCBIFP; ISSN:0948-6143. (Springer)Various cells types, including stem and progenitor cells, can exchange complex information via plasma membrane-derived vesicles, which can carry signals both in their limiting membrane and lumen. Astrocytes, traditionally regarded as mere supportive cells, play previously unrecognized functions in neuronal modulation and are capable of releasing signalling mols. of different functional significance. In the present study, we provide direct evidence that human fetal astrocytes in culture, expressing the same feature as immature and reactive astrocytes, release membrane vesicles larger than the microvesicles described up to now. We found that these large vesicles, ranging from 1-5 to 8 μm in diam. and expressing on their surface β1-integrin proteins, contain mitochondria and lipid droplets together with ATP. We documented vesicle content with fluorescent-specific dyes and with the immunocytochem. technique we confirmed that mitochondria and lipid droplets were co-localized in the same vesicle. SEM and transmission electron microscopy confirmed that astrocytes shed from surface membrane vesicles of the same size as the ones detected by fluorescence microscopy. Our results report for the first time that cultured astrocytes, activated by repetitive stimulation of ATP released from neighboring cells, shed from their surface large membrane vesicles contg. mitochondria and lipid droplets.
- 221Antonyak, M. A.; Cerione, R. A. Microvesicles as Mediators of Intercellular Communication in Cancer. Methods Mol. Biol. 2014, 1165, 147– 173, DOI: 10.1007/978-1-4939-0856-1_11[Crossref], [PubMed], [CAS], Google Scholar221https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A280%3ADC%252BC2cjjvFertQ%253D%253D&md5=526160258bdbe772ef24a18f51b6b9e0Microvesicles as mediators of intercellular communication in cancerAntonyak Marc A; Cerione Richard AMethods in molecular biology (Clifton, N.J.) (2014), 1165 (), 147-73 ISSN:.The discovery that cancer cells generate large membrane-enclosed packets of epigenetic information, known as microvesicles (MVs), that can be transferred to other cells and influence their behavior (Antonyak et al., Small GTPases 3:219-224, 2012; Cocucci et al., Trends Cell Biol 19:43-51, 2009; Rak, Semin Thromb Hemost 36:888-906, 2010; Skog et al., Nat Cell Biol 10:1470-1476, 2008) has added a unique perspective to the classical paracrine signaling paradigm. This is largely because, in addition to growth factors and cytokines, MVs contain a variety of components that are not usually thought to be released into the extracellular environment by viable cells including plasma membrane-associated proteins, cytosolic- and nuclear-localized proteins, as well as nucleic acids, particularly RNA transcripts and micro-RNAs (Skog et al., Nat Cell Biol 10:1470-1476, 2008; Al-Nedawi et al., Nat Cell Biol 10:619-624, 2008; Antonyak et al., Proc Natl Acad Sci U S A 108:4852-4857, 2011; Balaj et al., Nat Commun 2:180, 2011; Choi et al., J Proteome Res 6:4646-4655, 2007; Del Conde et al., Blood 106:1604-1611, 2005; Gallo et al., PLoS One 7:e30679, 2012; Graner et al., FASEB J 23:1541-1557, 2009; Grange et al., Cancer Res 71:5346-5356, 2011; Hosseini-Beheshti et al., Mol Cell Proteomics 11:863-885, 2012; Martins et al., Curr Opin Oncol 25:66-75, 2013; Noerholm et al., BMC Cancer 12:22, 2012; Zhuang et al., EMBO J 31:3513-3523, 2012). When transferred between cancer cells, MVs have been shown to stimulate signaling events that promote cell growth and survival (Al-Nedawi et al., Nat Cell Biol 10:619-624, 2008). Cancer cell-derived MVs can also be taken up by normal cell types that surround the tumor, an outcome that helps shape the tumor microenvironment, trigger tumor vascularization, and even confer upon normal recipient cells the transformed characteristics of a cancer cell (Antonyak et al., Proc Natl Acad Sci U S A 108:4852-4857, 2011; Martins et al., Curr Opin Oncol 25:66-75, 2013; Al-Nedawi et al., Proc Natl Acad Sci U S A 106:3794-3799, 2009; Ge et al., Cancer Microenviron 5:323-332, 2012). Thus, the production of MVs by cancer cells plays crucial roles in driving the expansion of the primary tumor. However, it is now becoming increasingly clear that MVs are also stable in the circulation of cancer patients, where they can mediate long-range effects and contribute to the formation of the pre-metastatic niche, an essential step in metastasis (Skog et al., Nat Cell Biol 10:1470-1476, 2008; Noerholm et al., BMC Cancer 12:22, 2012; Peinado et al., Nat Med 18:883-891, 2012; Piccin et al., Blood Rev 21:157-171, 2007; van der Vos et al., Cell Mol Neurobiol 31:949-959, 2011). These findings, when taken together with the fact that MVs are being aggressively pursued as diagnostic markers, as well as being considered as potential targets for intervention against cancer (Antonyak et al., Small GTPases 3:219-224, 2012; Hosseini-Beheshti et al., Mol Cell Proteomics 11:863-885, 2012; Martins et al., Curr Opin Oncol 25:66-75, 2013; Ge et al., Cancer Microenviron 5:323-332, 2012; Peinado et al., Nat Med 18:883-891, 2012; Piccin et al., Blood Rev 21:157-171, 2007; Al-Nedawi et al., Cell Cycle 8:2014-2018, 2009; Cocucci and Meldolesi, Curr Biol 21:R940-R941, 2011; D'Souza-Schorey and Clancy, Genes Dev 26:1287-1299, 2012; Shao et al., Nat Med 18:1835-1840, 2012), point to critically important roles for MVs in human cancer progression that can potentially be exploited to develop new targeted approaches for treating this disease.
- 222Gottipati, M. K.; Bekyarova, E.; Brenner, M.; Haddon, R. C.; Parpura, V. Changes in the Morphology and Proliferation of Astrocytes Induced by Two Modalities of Chemically Functionalized Single-Walled Carbon Nanotubes Are Differentially Mediated by Glial Fibrillary Acidic Protein. Nano Lett. 2014, 14, 3720– 3727, DOI: 10.1021/nl4048114
- 223Shams, H.; Holt, B. D.; Mahboobi, S. H.; Jahed, Z.; Islam, M. F.; Dahl, K. N.; Mofrad, M. R. K. Actin Reorganization through Dynamic Interactions with Single-Wall Carbon Nanotubes. ACS Nano 2014, 8, 188– 197, DOI: 10.1021/nn402865e[ACS Full Text
 ], [CAS], Google Scholar223https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3sXhvFKntLzL&md5=06441e0aa094cafbaaa3b5a6387c468aActin Reorganization through Dynamic Interactions with Single-Wall Carbon NanotubesShams, Hengameh; Holt, Brian D.; Mahboobi, Seyed Hanif; Jahed, Zeinab; Islam, Mohammad F.; Dahl, Kris Noel; Mofrad, Mohammad R. K.ACS Nano (2014), 8 (1), 188-197CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)Single-wall carbon nanotubes (SWCNTs) have been widely used for biol. applications in recent years, and thus, it is crit. to understand how these inert nanomaterials influence cell behavior. Recently, it has been obsd. that cellular phenotypes such as proliferation, force generation and growth change upon SWCNT treatment, and SWCNTs directly affect the organization and redistribution of the actin cytoskeleton. However, the interactions between SWCNTs and actin at the mol. level or how this interaction changes actin structure remain largely unknown. Here, we investigated direct interaction of actin with SWCNT using all-atom mol. dynamics (MD) simulations and near-IR (NIR) spectroscopy of actin-dispersed SWCNTs. Actin can stably bind to the SWCNT surfaces via hydrophobic interactions but still allows nanotubes to slide and rotate on the actin surface. Our results establish several nanoscale conformational changes for the actin-SWCNT complexes, and we suggest these changes likely induce reorganization of actin filaments obsd. at larger scales.
], [CAS], Google Scholar223https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3sXhvFKntLzL&md5=06441e0aa094cafbaaa3b5a6387c468aActin Reorganization through Dynamic Interactions with Single-Wall Carbon NanotubesShams, Hengameh; Holt, Brian D.; Mahboobi, Seyed Hanif; Jahed, Zeinab; Islam, Mohammad F.; Dahl, Kris Noel; Mofrad, Mohammad R. K.ACS Nano (2014), 8 (1), 188-197CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)Single-wall carbon nanotubes (SWCNTs) have been widely used for biol. applications in recent years, and thus, it is crit. to understand how these inert nanomaterials influence cell behavior. Recently, it has been obsd. that cellular phenotypes such as proliferation, force generation and growth change upon SWCNT treatment, and SWCNTs directly affect the organization and redistribution of the actin cytoskeleton. However, the interactions between SWCNTs and actin at the mol. level or how this interaction changes actin structure remain largely unknown. Here, we investigated direct interaction of actin with SWCNT using all-atom mol. dynamics (MD) simulations and near-IR (NIR) spectroscopy of actin-dispersed SWCNTs. Actin can stably bind to the SWCNT surfaces via hydrophobic interactions but still allows nanotubes to slide and rotate on the actin surface. Our results establish several nanoscale conformational changes for the actin-SWCNT complexes, and we suggest these changes likely induce reorganization of actin filaments obsd. at larger scales. - 224Tian, X.; Yang, Z.; Duan, G.; Wu, A.; Gu, Z.; Zhang, L.; Chen, C.; Chai, Z.; Ge, C.; Zhou, R. Graphene Oxide Nanosheets Retard Cellular Migration via Disruption of Actin Cytoskeleton. Small 2017, 13, 1602133, DOI: 10.1002/smll.201602133
- 225Tu, Q.; Pang, L.; Chen, Y.; Zhang, Y.; Zhang, R.; Lu, B.; Wang, J. Effects of Surface Charges of Graphene Oxide on Neuronal Outgrowth and Branching. Analyst 2014, 139, 105– 115, DOI: 10.1039/C3AN01796F[Crossref], [PubMed], [CAS], Google Scholar225https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3sXhvVGhtbrF&md5=125f02728d3e3c26be7d83599bdc5583Effects of surface charges of graphene oxide on neuronal outgrowth and branchingTu, Qin; Pang, Long; Chen, Yun; Zhang, Yanrong; Zhang, Rui; Lu, Bingzhang; Wang, JinyiAnalyst (Cambridge, United Kingdom) (2014), 139 (1), 105-115CODEN: ANALAO; ISSN:0003-2654. (Royal Society of Chemistry)Graphene oxides with different surface charges were fabricated from carboxylated graphene oxide by chem. modification with amino- (-NH2), poly-m-aminobenzene sulfonic acid- (-NH2/-SO3H), or methoxyl- (-OCH3) terminated functional groups. The chem. functionalized graphene oxides and the carboxylated graphene oxide were characterized by IR spectroscopy, XPS, UV-Vis spectrometry, ζ potential measurements, field emission SEM, and contact angle analyses. Subsequently, the resulting graphene oxides were used as substrates for culturing primary rat hippocampal neurons to investigate neurite outgrowth and branching. The morphol. features of neurons that directly reflect their potential capability in synaptic transmission were characterized. The results demonstrate that the chem. properties of graphene oxide can be systematically modified by attaching different functional groups that confer known characteristics to the substrate. By manipulating the charge carried by the functionalized graphene oxides, the outgrowth and branching of neuronal processes can be controlled. Compared with neutral, zwitterionic, or neg. charged graphene oxides, pos. charged graphene oxide was found to be more beneficial for neurite outgrowth and branching. The ability to chem. modify graphene oxide to control neurite outgrowth could be implemented clin., esp. in cases wherein long-term presence of outgrowth modulation is necessary.
- 226Fabbro, A.; Scaini, D.; León, V.; Vázquez, E.; Cellot, G.; Privitera, G.; Lombardi, L.; Torrisi, F.; Tomarchio, F.; Bonaccorso, F.; Bosi, S.; Ferrari, A. C.; Ballerini, L.; Prato, M. Graphene-Based Interfaces Do Not Alter Target Nerve Cells. ACS Nano 2016, 10, 615– 623, DOI: 10.1021/acsnano.5b05647[ACS Full Text
 ], [CAS], Google Scholar226https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2MXitVygsbbL&md5=874aa49131b4623dbc19db6732f80942Graphene-Based Interfaces Do Not Alter Target Nerve CellsFabbro, Alessandra; Scaini, Denis; Leon, Veronica; Vazquez, Ester; Cellot, Giada; Privitera, Giulia; Lombardi, Lucia; Torrisi, Felice; Tomarchio, Flavia; Bonaccorso, Francesco; Bosi, Susanna; Ferrari, Andrea C.; Ballerini, Laura; Prato, MaurizioACS Nano (2016), 10 (1), 615-623CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)Neural-interfaces rely on the ability of electrodes to transduce stimuli into elec. patterns delivered to the brain. In addn. to sensitivity to the stimuli, stability in the operating conditions and efficient charge transfer to neurons, the electrodes should not alter the physiol. properties of the target tissue. Graphene is emerging as a promising material for neuro-interfacing applications, given its outstanding physico-chem. properties. Here, we use graphene-based substrates (GBSs) to interface neuronal growth. We test our GBSs on brain cell cultures by measuring functional and synaptic integrity of the emerging neuronal networks. We show that GBSs are permissive interfaces, even when uncoated by cell adhesion layers, retaining unaltered neuronal signaling properties, thus being suitable for carbon-based neural prosthetic devices.
], [CAS], Google Scholar226https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2MXitVygsbbL&md5=874aa49131b4623dbc19db6732f80942Graphene-Based Interfaces Do Not Alter Target Nerve CellsFabbro, Alessandra; Scaini, Denis; Leon, Veronica; Vazquez, Ester; Cellot, Giada; Privitera, Giulia; Lombardi, Lucia; Torrisi, Felice; Tomarchio, Flavia; Bonaccorso, Francesco; Bosi, Susanna; Ferrari, Andrea C.; Ballerini, Laura; Prato, MaurizioACS Nano (2016), 10 (1), 615-623CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)Neural-interfaces rely on the ability of electrodes to transduce stimuli into elec. patterns delivered to the brain. In addn. to sensitivity to the stimuli, stability in the operating conditions and efficient charge transfer to neurons, the electrodes should not alter the physiol. properties of the target tissue. Graphene is emerging as a promising material for neuro-interfacing applications, given its outstanding physico-chem. properties. Here, we use graphene-based substrates (GBSs) to interface neuronal growth. We test our GBSs on brain cell cultures by measuring functional and synaptic integrity of the emerging neuronal networks. We show that GBSs are permissive interfaces, even when uncoated by cell adhesion layers, retaining unaltered neuronal signaling properties, thus being suitable for carbon-based neural prosthetic devices. - 227Kitko, K. E.; Hong, T.; Lazarenko, R. M.; Ying, D.; Xu, Y.-Q.; Zhang, Q. Membrane Cholesterol Mediates the Cellular Effects of Monolayer Graphene Substrates. Nat. Commun. 2018, 9, 796, DOI: 10.1038/s41467-018-03185-0[Crossref], [PubMed], [CAS], Google Scholar227https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A280%3ADC%252BC1MrkvVOitg%253D%253D&md5=14687e7ebb114583fcc83d4d9a9ce80bMembrane cholesterol mediates the cellular effects of monolayer graphene substratesKitko Kristina E; Lazarenko Roman M; Zhang Qi; Kitko Kristina E; Xu Ya-Qiong; Zhang Qi; Hong Tu; Ying Da; Xu Ya-Qiong; Xu Ya-QiongNature communications (2018), 9 (1), 796 ISSN:.Graphene possesses extraordinary properties that promise great potential in biomedicine. However, fully leveraging these properties requires close contact with the cell surface, raising the concern of unexpected biological consequences. Computational models have demonstrated that graphene preferentially interacts with cholesterol, a multifunctional lipid unique to eukaryotic membranes. Here we demonstrate an interaction between graphene and cholesterol. We find that graphene increases cell membrane cholesterol and potentiates neurotransmission, which is mediated by increases in the number, release probability, and recycling rate of synaptic vesicles. In fibroblasts grown on graphene, we also find an increase in cholesterol, which promotes the activation of P2Y receptors, a family of receptor regulated by cholesterol. In both cases, direct manipulation of cholesterol levels elucidates that a graphene-induced cholesterol increase underlies the observed potentiation of each cell signaling pathway. These findings identify cholesterol as a mediator of graphene's cellular effects, providing insight into the biological impact of graphene.
- 228Pampaloni, N. P.; Lottner, M.; Giugliano, M.; Matruglio, A.; D’Amico, F.; Prato, M.; Garrido, J. A.; Ballerini, L.; Scaini, D. Single-Layer Graphene Modulates Neuronal Communication and Augments Membrane Ion Currents. Nat. Nanotechnol. 2018, 13, 755– 764, DOI: 10.1038/s41565-018-0163-6[Crossref], [PubMed], [CAS], Google Scholar228https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC1cXhtFeisb3L&md5=bdcc538e4ad665bc3e11625580b109c6Single-layer graphene modulates neuronal communication and augments membrane ion currentsPampaloni, Niccolo Paolo; Lottner, Martin; Giugliano, Michele; Matruglio, Alessia; D'Amico, Francesco; Prato, Maurizio; Garrido, Jose Antonio; Ballerini, Laura; Scaini, DenisNature Nanotechnology (2018), 13 (8), 755-764CODEN: NNAABX; ISSN:1748-3387. (Nature Research)The use of graphene-based materials to engineer sophisticated biosensing interfaces that can adapt to the central nervous system requires a detailed understanding of how such materials behave in a biol. context. Graphene's peculiar properties can cause various cellular changes, but the underlying mechanisms remain unclear. Here, we show that single-layer graphene increases neuronal firing by altering membrane-assocd. functions in cultured cells. Graphene tunes the distribution of extracellular ions at the interface with neurons, a key regulator of neuronal excitability. The resulting biophys. changes in the membrane include stronger potassium ion currents, with a shift in the fraction of neuronal firing phenotypes from adapting to tonically firing. By using exptl. and theor. approaches, we hypothesize that the graphene-ion interactions that are maximized when single-layer graphene is deposited on elec. insulating substrates are crucial to these effects.
- 229Li, N.; Zhang, X.; Song, Q.; Su, R.; Zhang, Q.; Kong, T.; Liu, L.; Jin, G.; Tang, M.; Cheng, G. The Promotion of Neurite Sprouting and Outgrowth of Mouse Hippocampal Cells in Culture by Graphene Substrates. Biomaterials 2011, 32, 9374– 9382, DOI: 10.1016/j.biomaterials.2011.08.065[Crossref], [PubMed], [CAS], Google Scholar229https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3MXht1Oqu77K&md5=7f898b8db97b9a382fa33ff48457da6dThe promotion of neurite sprouting and outgrowth of mouse hippocampal cells in culture by graphene substratesLi, Ning; Zhang, Xuemin; Song, Qin; Su, Ruigong; Zhang, Qi; Kong, Tao; Liu, Liwei; Jin, Gang; Tang, Mingliang; Cheng, GuoshengBiomaterials (2011), 32 (35), 9374-9382CODEN: BIMADU; ISSN:0142-9612. (Elsevier Ltd.)Graphene has been demonstrated in many biomedical applications and its potentials for neural interfacing. Emerging concerns on graphene, as a biomedical material, are its biocompatibility and how biol. targeted tissue/cells respond to it. Relatively few studies attempted to address the interactions of graphene or its derivs. with the tissues/cells, while very few reports on neural system. In this study, we tried to explore how neurites, one of the key structures for neural functions, are affected by graphene during the development until maturation in a mouse hippocampal culture model. The results reveal that graphene substrates exhibited excellent biocompatibility, as cell viability and morphol. were not affected. Meanwhile, neurite nos. and av. neurite length on graphene were significantly enhanced during 2-7 days after cell seeding compared with tissue culture polystyrene (TCPS) substrates. Esp. on Day 2 of the neural development period, graphene substrates efficiently promoted neurite sprouting and outgrowth to the maximal extent. Addnl., expression of growth-assoc. protein-43 (GAP-43) was examd. in both graphene and TCPS groups. Western blot anal. showed that GAP-43 expression was greatly enhanced in graphene group compared to TCPS group, which might result in the boost of neurite sprouting and outgrowth. This study suggests the potential of graphene as a material for neural interfacing and provides insight into the future biomedical applications of graphene.
- 230Tang, M.; Song, Q.; Li, N.; Jiang, Z.; Huang, R.; Cheng, G. Enhancement of Electrical Signaling in Neural Networks on Graphene Films. Biomaterials 2013, 34, 6402– 6411, DOI: 10.1016/j.biomaterials.2013.05.024[Crossref], [PubMed], [CAS], Google Scholar230https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3sXovVWitLc%253D&md5=716b52bb7c704ee6363edf161cde492aEnhancement of electrical signaling in neural networks on graphene filmsTang, Mingliang; Song, Qin; Li, Ning; Jiang, Ziyun; Huang, Rong; Cheng, GuoshengBiomaterials (2013), 34 (27), 6402-6411CODEN: BIMADU; ISSN:0142-9612. (Elsevier Ltd.)One of the key challenges for neural tissue engineering is to exploit supporting materials with robust functionalities not only to govern cell-specific behaviors, but also to form functional neural network. The unique elec. and mech. properties of graphene imply it as a promising candidate for neural interfaces, but little is known about the details of neural network formation on graphene as a scaffold material for tissue engineering. Therapeutic regenerative strategies aim to guide and enhance the intrinsic capacity of the neurons to reorganize by promoting plasticity mechanisms in a controllable manner. Here, we investigated the impact of graphene on the formation and performance in the assembly of neural networks in neural stem cell (NSC) culture. Using calcium imaging and electrophysiol. recordings, we demonstrate the capabilities of graphene to support the growth of functional neural circuits, and improve neural performance and elec. signaling in the network. These results offer a better understanding of interactions between graphene and NSCs, also they clearly present the great potentials of graphene as neural interface in tissue engineering.
- 231Djilas, M.; Olès, C.; Lorach, H.; Bendali, A.; Dégardin, J.; Dubus, E.; Lissorgues-Bazin, G.; Rousseau, L.; Benosman, R.; Ieng, S.-H.; Joucla, S.; Yvert, B.; Bergonzo, P.; Sahel, J.; Picaud, S. Three-Dimensional Electrode Arrays for Retinal Prostheses: Modeling, Geometry Optimization and Experimental Validation. J. Neural Eng. 2011, 8, 046020, DOI: 10.1088/1741-2560/8/4/046020[Crossref], [PubMed], [CAS], Google Scholar231https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A280%3ADC%252BC3MnpslCksA%253D%253D&md5=c3f302dd615b6c74c21f5b9cd1e23d59Three-dimensional electrode arrays for retinal prostheses: modeling, geometry optimization and experimental validationDjilas M; Oles C; Lorach H; Bendali A; Degardin J; Dubus E; Lissorgues-Bazin G; Rousseau L; Benosman R; Ieng S-H; Joucla S; Yvert B; Bergonzo P; Sahel J; Picaud SJournal of neural engineering (2011), 8 (4), 046020 ISSN:.Three-dimensional electrode geometries were proposed to increase the spatial resolution in retinal prostheses aiming at restoring vision in blind patients. We report here the results from a study in which finite-element modeling was used to design and optimize three-dimensional electrode geometries. Proposed implants exhibit an array of well-like shapes containing stimulating electrodes at their bottom, while the common return grid electrode surrounds each well on the implant top surface. Extending stimulating electrodes and/or the grid return electrode on the walls of the cavities was also considered. The goal of the optimization was to find model parameters that maximize the focalization of electrical stimulation, and therefore the spatial resolution of the electrode array. The results showed that electrode geometries with a well depth of 30 μm yield a tenfold increase in selectivity compared to the planar structures of similar electrode dimensions. Electrode array prototypes were microfabricated and implanted in dystrophic rats to determine if the tissue would behave as hypothesized in the model. Histological examination showed that retinal bipolar cells integrate the electrode well, creating isolated cell clusters. The modeling analysis showed that the stimulation current is confounded within the electrode well, leading to selective electrical stimulation of the individual bipolar cell clusters and thereby to electrode arrays with higher spatial resolution.
- 232Heim, M.; Rousseau, L.; Reculusa, S.; Urbanova, V.; Mazzocco, C.; Joucla, S.; Bouffier, L.; Vytras, K.; Bartlett, P.; Kuhn, A.; Yvert, B. Combined Macro-/Mesoporous Microelectrode Arrays for Low-Noise Extracellular Recording of Neural Networks. J. Neurophysiol. 2012, 108, 1793– 1803, DOI: 10.1152/jn.00711.2011[Crossref], [PubMed], [CAS], Google Scholar232https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A280%3ADC%252BC38jlvFSnug%253D%253D&md5=651d4fbd43fef7301aaf8b650d11399bCombined macro-/mesoporous microelectrode arrays for low-noise extracellular recording of neural networksHeim Matthias; Rousseau Lionel; Reculusa Stephane; Urbanova Veronika; Mazzocco Claire; Joucla Sebastien; Bouffier Laurent; Vytras Karel; Bartlett Philip; Kuhn Alexander; Yvert BlaiseJournal of neurophysiology (2012), 108 (6), 1793-803 ISSN:.Microelectrode arrays (MEAs) are appealing tools to probe large neural ensembles and build neural prostheses. Microelectronics microfabrication technologies now allow building high-density MEAs containing several hundreds of microelectrodes. However, several major problems become limiting factors when the size of the microelectrodes decreases. In particular, regarding recording of neural activity, the intrinsic noise level of a microelectrode dramatically increases when the size becomes small (typically below 20-μm diameter). Here, we propose to overcome this limitation using a template-based, single-scale meso- or two-scale macro-/mesoporous modification of the microelectrodes, combining the advantages of an overall small geometric surface and an active surface increased by several orders of magnitude. For this purpose, standard platinum MEAs were covered with a highly porous platinum overlayer obtained by lyotropic liquid crystal templating possibly in combination with a microsphere templating approach. These porous coatings were mechanically more robust than Pt-black coating and avoid potential toxicity issues. They had a highly increased active surface, resulting in a noise level ∼3 times smaller than that of conventional flat electrodes. This approach can thus be used to build highly dense arrays of small-size microelectrodes for sensitive neural signal detection.
- 233Gaffaney, J. D.; Dunning, F. M.; Wang, Z.; Hui, E.; Chapman, E. R. Synaptotagmin C2B Domain Regulates Ca 2+ -Triggered Fusion in Vitro. J. Biol. Chem. 2008, 283, 31763– 31775, DOI: 10.1074/jbc.M803355200
- 234Weerth, S. H.; Holtzclaw, L. A.; Russell, J. T. Signaling Proteins in Raft-like Microdomains Are Essential for Ca2+ Wave Propagation in Glial Cells. Cell Calcium 2007, 41, 155– 167, DOI: 10.1016/j.ceca.2006.06.006
- 235Chiacchiaretta, M.; Bramini, M.; Rocchi, A.; Armirotti, A.; Giordano, E.; Vázquez, E.; Bandiera, T.; Ferroni, S.; Cesca, F.; Benfenati, F. Graphene Oxide Upregulates the Homeostatic Functions of Primary Astrocytes and Modulates Astrocyte-to-Neuron Communication. Nano Lett. 2018, 18, 5827– 5838, DOI: 10.1021/acs.nanolett.8b02487[ACS Full Text
 ], [CAS], Google Scholar235https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC1cXhsVKju7nI&md5=256111935163f311c3f4e2bdf9566f80Graphene Oxide Upregulates the Homeostatic Functions of Primary Astrocytes and Modulates Astrocyte-to-Neuron CommunicationChiacchiaretta, Martina; Bramini, Mattia; Rocchi, Anna; Armirotti, Andrea; Giordano, Emanuele; Vazquez, Ester; Bandiera, Tiziano; Ferroni, Stefano; Cesca, Fabrizia; Benfenati, FabioNano Letters (2018), 18 (9), 5827-5838CODEN: NALEFD; ISSN:1530-6984. (American Chemical Society)Graphene-based materials are the focus of intense research efforts to devise novel theranostic strategies for targeting the central nervous system. In this work, we have investigated the consequences of long-term exposure of primary rat astrocytes to pristine graphene (GR) and graphene oxide (GO) flakes. We demonstrate that GR/GO interfere with a variety of intracellular processes as a result of their internalization through the endo-lysosomal pathway. Graphene-exposed astrocytes acquire a more differentiated morphol. phenotype assocd. with extensive cytoskeletal rearrangements. Profound functional alterations are induced by GO internalization, including the upregulation of inward-rectifying K+ channels and of Na+-dependent glutamate uptake, which are linked to the astrocyte capacity to control the extracellular homeostasis. Interestingly, GO-pretreated astrocytes promote the functional maturation of co-cultured primary neurons by inducing an increase in intrinsic excitability and in the d. of GABAergic synapses. The results indicate that graphene nanomaterials profoundly affect astrocyte physiol. in vitro, with consequences for neuronal network activity. This work supports the view that GO-based materials could be of great interest to address pathologies of the central nervous system assocd. to astrocyte dysfunctions.
], [CAS], Google Scholar235https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC1cXhsVKju7nI&md5=256111935163f311c3f4e2bdf9566f80Graphene Oxide Upregulates the Homeostatic Functions of Primary Astrocytes and Modulates Astrocyte-to-Neuron CommunicationChiacchiaretta, Martina; Bramini, Mattia; Rocchi, Anna; Armirotti, Andrea; Giordano, Emanuele; Vazquez, Ester; Bandiera, Tiziano; Ferroni, Stefano; Cesca, Fabrizia; Benfenati, FabioNano Letters (2018), 18 (9), 5827-5838CODEN: NALEFD; ISSN:1530-6984. (American Chemical Society)Graphene-based materials are the focus of intense research efforts to devise novel theranostic strategies for targeting the central nervous system. In this work, we have investigated the consequences of long-term exposure of primary rat astrocytes to pristine graphene (GR) and graphene oxide (GO) flakes. We demonstrate that GR/GO interfere with a variety of intracellular processes as a result of their internalization through the endo-lysosomal pathway. Graphene-exposed astrocytes acquire a more differentiated morphol. phenotype assocd. with extensive cytoskeletal rearrangements. Profound functional alterations are induced by GO internalization, including the upregulation of inward-rectifying K+ channels and of Na+-dependent glutamate uptake, which are linked to the astrocyte capacity to control the extracellular homeostasis. Interestingly, GO-pretreated astrocytes promote the functional maturation of co-cultured primary neurons by inducing an increase in intrinsic excitability and in the d. of GABAergic synapses. The results indicate that graphene nanomaterials profoundly affect astrocyte physiol. in vitro, with consequences for neuronal network activity. This work supports the view that GO-based materials could be of great interest to address pathologies of the central nervous system assocd. to astrocyte dysfunctions. - 236Cole, M.; Lindeque, P.; Halsband, C.; Galloway, T. S. Microplastics as Contaminants in the Marine Environment: A Review. Mar. Pollut. Bull. 2011, 62, 2588– 2597, DOI: 10.1016/j.marpolbul.2011.09.025[Crossref], [PubMed], [CAS], Google Scholar236https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3MXhsV2gsrfM&md5=ce50c3eecf36919311e3b05e13467174Microplastics as contaminants in the marine environment: A reviewCole, Matthew; Lindeque, Pennie; Halsband, Claudia; Galloway, Tamara S.Marine Pollution Bulletin (2011), 62 (12), 2588-2597CODEN: MPNBAZ; ISSN:0025-326X. (Elsevier Ltd.)A review. Since the mass prodn. of plastics began in the 1940s, microplastic contamination of the marine environment was a growing problem. Here, a review of the literature was conducted with the following objectives: (1) to summarize the properties, nomenclature and sources of microplastics; (2) to discuss the routes by which microplastics enter the marine environment; (3) to evaluate the methods by which microplastics are detected in the marine environment; (4) to assess spatial and temporal trends of microplastic abundance; and (5) to discuss the environmental impact of microplastics. Microplastics are both abundant and widespread within the marine environment, found in their highest concns. along coastlines and within mid-ocean gyres. Ingestion of microplastics was demonstrated in a range of marine organisms, a process which may facilitate the transfer of chem. additives or hydrophobic waterborne pollutants to biota. The authors conclude by highlighting key future research areas for scientists and policymakers.
- 237Montagner, A.; Bosi, S.; Tenori, E.; Bidussi, M.; Alshatwi, A. A.; Tretiach, M.; Prato, M.; Syrgiannis, Z. Ecotoxicological Effects of Graphene-Based Materials. 2D Mater. 2017, 4, 012001, DOI: 10.1088/2053-1583/4/1/012001
- 238Liu, S.; Zeng, T. H.; Hofmann, M.; Burcombe, E.; Wei, J.; Jiang, R.; Kong, J.; Chen, Y. Antibacterial Activity of Graphite, Graphite Oxide, Graphene Oxide, and Reduced Graphene Oxide: Membrane and Oxidative Stress. ACS Nano 2011, 5, 6971– 6980, DOI: 10.1021/nn202451x[ACS Full Text
 ], [CAS], Google Scholar238https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3MXhtVyls73L&md5=2b9a3ae97cc102efe556269af91473ebAntibacterial activity of graphite, graphite oxide, graphene oxide, and reduced graphene oxide: Membrane and oxidative stressLiu, Shao-Bin; Zeng, Ting-Ying Helen; Hofmann, Mario; Burcombe, Ehdi; Wei, Jun; Jiang, Rong-Rong; Kong, Jing; Chen, YuanACS Nano (2011), 5 (9), 6971-6980CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)Health and environmental impacts of graphene-based materials need to be thoroughly evaluated before their potential applications. Graphene has strong cytotoxicity toward bacteria. To better understand its antimicrobial mechanism, we compared the antibacterial activity of four types of graphene-based materials (graphite (Gt), graphite oxide (GtO), graphene oxide (GO), and reduced graphene oxide (rGO)) toward a bacterial model: Escherichia coli. Under similar concn. and incubation conditions, GO dispersion shows the highest antibacterial activity, sequentially followed by rGO, Gt, and GtO. Scanning electron microscope (SEM) and dynamic light scattering analyses show that GO aggregates have the smallest av. size among the four types of materials. SEM images display that the direct contacts with graphene nanosheets disrupt cell membrane. No superoxide anion (O2·-) induced reactive oxygen species (ROS) prodn. is detected. However, the four types of materials can oxidize glutathione, which serves as redox state mediator in bacteria. Conductive rGO and Gt have higher oxidn. capacities than insulating GO and GtO. Results suggest that antimicrobial actions are contributed by both membrane and oxidn. stress. We propose that a three-step antimicrobial mechanism, previously used for carbon nanotubes, is applicable to graphene-based materials. It includes initial cell deposition on graphene-based materials, membrane stress caused by direct contact with sharp nanosheets, and the ensuing superoxide anion-independent oxidn. The authors envision that physicochem. properties of graphene-based materials, such as d. of functional groups, size, and cond., can be precisely tailored to either reducing their health and environmental risks or increasing their application potentials.
], [CAS], Google Scholar238https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3MXhtVyls73L&md5=2b9a3ae97cc102efe556269af91473ebAntibacterial activity of graphite, graphite oxide, graphene oxide, and reduced graphene oxide: Membrane and oxidative stressLiu, Shao-Bin; Zeng, Ting-Ying Helen; Hofmann, Mario; Burcombe, Ehdi; Wei, Jun; Jiang, Rong-Rong; Kong, Jing; Chen, YuanACS Nano (2011), 5 (9), 6971-6980CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)Health and environmental impacts of graphene-based materials need to be thoroughly evaluated before their potential applications. Graphene has strong cytotoxicity toward bacteria. To better understand its antimicrobial mechanism, we compared the antibacterial activity of four types of graphene-based materials (graphite (Gt), graphite oxide (GtO), graphene oxide (GO), and reduced graphene oxide (rGO)) toward a bacterial model: Escherichia coli. Under similar concn. and incubation conditions, GO dispersion shows the highest antibacterial activity, sequentially followed by rGO, Gt, and GtO. Scanning electron microscope (SEM) and dynamic light scattering analyses show that GO aggregates have the smallest av. size among the four types of materials. SEM images display that the direct contacts with graphene nanosheets disrupt cell membrane. No superoxide anion (O2·-) induced reactive oxygen species (ROS) prodn. is detected. However, the four types of materials can oxidize glutathione, which serves as redox state mediator in bacteria. Conductive rGO and Gt have higher oxidn. capacities than insulating GO and GtO. Results suggest that antimicrobial actions are contributed by both membrane and oxidn. stress. We propose that a three-step antimicrobial mechanism, previously used for carbon nanotubes, is applicable to graphene-based materials. It includes initial cell deposition on graphene-based materials, membrane stress caused by direct contact with sharp nanosheets, and the ensuing superoxide anion-independent oxidn. The authors envision that physicochem. properties of graphene-based materials, such as d. of functional groups, size, and cond., can be precisely tailored to either reducing their health and environmental risks or increasing their application potentials. - 239Maleki Dizaj, S.; Mennati, A.; Jafari, S.; Khezri, K.; Adibkia, K. Antimicrobial Activity of Carbon-Based Nanoparticles. Adv. Pharm. Bull. 2015, 5, 19– 23, DOI: 10.5681/apb.2015.003[Crossref], [PubMed], [CAS], Google Scholar239https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A280%3ADC%252BC2MnmtVGksg%253D%253D&md5=624a6585ed6794a537dbd9c42fbba8dcAntimicrobial activity of carbon-based nanoparticlesMaleki Dizaj Solmaz; Jafari Samira; Mennati Afsaneh; Khezri Khadejeh; Adibkia KhosroAdvanced pharmaceutical bulletin (2015), 5 (1), 19-23 ISSN:2228-5881.Due to the vast and inappropriate use of the antibiotics, microorganisms have begun to develop resistance to the commonly used antimicrobial agents. So therefore, development of the new and effective antimicrobial agents seems to be necessary. According to some recent reports, carbon-based nanomaterials such as fullerenes, carbon nanotubes (CNTs) (especially single-walled carbon nanotubes (SWCNTs)) and graphene oxide (GO) nanoparticles show potent antimicrobial properties. In present review, we have briefly summarized the antimicrobial activity of carbon-based nanoparticles together with their mechanism of action. Reviewed literature show that the size of carbon nanoparticles plays an important role in the inactivation of the microorganisms. As major mechanism, direct contact of microorganisms with carbon nanostructures seriously affects their cellular membrane integrity, metabolic processes and morphology. The antimicrobial activity of carbon-based nanostructures may interestingly be investigated in the near future owing to their high surface/volume ratio, large inner volume and other unique chemical and physical properties. In addition, application of functionalized carbon nanomaterials as carriers for the ordinary antibiotics possibly will decrease the associated resistance, enhance their bioavailability and provide their targeted delivery.
- 240Akhavan, O.; Ghaderi, E. Toxicity of Graphene and Graphene Oxide Nanowalls Against Bacteria. ACS Nano 2010, 4, 5731– 5736, DOI: 10.1021/nn101390x[ACS Full Text
 ], [CAS], Google Scholar240https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3cXht1Kht77K&md5=6b3b3fc77f35bddc2137e17da2d887cdToxicity of graphene and graphene oxide nanowalls against bacteriaAkhavan, Omid; Ghaderi, ElhamACS Nano (2010), 4 (10), 5731-5736CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)Bacterial toxicity of graphene nanosheets in the form of graphene nanowalls deposited on stainless steel substrates was investigated for both Gram-pos. and Gram-neg. models of bacteria. The graphene oxide nanowalls were obtained by electrophoretic deposition of Mg2+-graphene oxide nanosheets synthesized by a chem. exfoliation method. On the basis of measuring the efflux of cytoplasmic materials of the bacteria, it was found that the cell membrane damage of the bacteria caused by direct contact of the bacteria with the extremely sharp edges of the nanowalls was the effective mechanism in the bacterial inactivation. In this regard, the Gram-neg. Escherichia coli with an outer membrane were more resistant to the cell membrane damage caused by the nanowalls than the Gram-pos. Staphylococcus aureus lacking the outer membrane. Moreover, the graphene oxide nanowalls reduced by hydrazine were more toxic to the bacteria than the unreduced graphene oxide nanowalls. The better antibacterial activity of the reduced nanowalls was assigned to the better charge transfer between the bacteria and the more sharpened edges of the reduced nanowalls, during the contact interaction.
], [CAS], Google Scholar240https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3cXht1Kht77K&md5=6b3b3fc77f35bddc2137e17da2d887cdToxicity of graphene and graphene oxide nanowalls against bacteriaAkhavan, Omid; Ghaderi, ElhamACS Nano (2010), 4 (10), 5731-5736CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)Bacterial toxicity of graphene nanosheets in the form of graphene nanowalls deposited on stainless steel substrates was investigated for both Gram-pos. and Gram-neg. models of bacteria. The graphene oxide nanowalls were obtained by electrophoretic deposition of Mg2+-graphene oxide nanosheets synthesized by a chem. exfoliation method. On the basis of measuring the efflux of cytoplasmic materials of the bacteria, it was found that the cell membrane damage of the bacteria caused by direct contact of the bacteria with the extremely sharp edges of the nanowalls was the effective mechanism in the bacterial inactivation. In this regard, the Gram-neg. Escherichia coli with an outer membrane were more resistant to the cell membrane damage caused by the nanowalls than the Gram-pos. Staphylococcus aureus lacking the outer membrane. Moreover, the graphene oxide nanowalls reduced by hydrazine were more toxic to the bacteria than the unreduced graphene oxide nanowalls. The better antibacterial activity of the reduced nanowalls was assigned to the better charge transfer between the bacteria and the more sharpened edges of the reduced nanowalls, during the contact interaction. - 241Efremova, L. V.; Vasilchenko, A. S.; Rakov, E. G.; Deryabin, D. G. Toxicity of Graphene Shells, Graphene Oxide, and Graphene Oxide Paper Evaluated with Escherichia Coli Biotests. BioMed Res. Int. 2015, 2015, 869361, DOI: 10.1155/2015/869361[Crossref], [PubMed], [CAS], Google Scholar241https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A280%3ADC%252BC28%252FnvFSlsg%253D%253D&md5=50213ed46350b8293abf51732d691413Toxicity of Graphene Shells, Graphene Oxide, and Graphene Oxide Paper Evaluated with Escherichia coli BiotestsEfremova Ludmila V; Deryabin Dmitry G; Vasilchenko Alexey S; Rakov Eduard GBioMed research international (2015), 2015 (), 869361 ISSN:.The plate-like graphene shells (GS) produced by an original methane pyrolysis method and their derivatives graphene oxide (GO) and graphene oxide paper (GO-P) were evaluated with luminescent Escherichia coli biotests and additional bacterial-based assays which together revealed the graphene-family nanomaterials' toxicity and bioactivity mechanisms. Bioluminescence inhibition assay, fluorescent two-component staining to evaluate cell membrane permeability, and atomic force microscopy data showed GO expressed bioactivity in aqueous suspension, whereas GS suspensions and the GO-P surface were assessed as nontoxic materials. The mechanism of toxicity of GO was shown not to be associated with oxidative stress in the targeted soxS::lux and katG::lux reporter cells; also, GO did not lead to significant mechanical disruption of treated bacteria with the release of intracellular DNA contents into the environment. The well-coordinated time- and dose-dependent surface charge neutralization and transport and energetic disorders in the Escherichia coli cells suggest direct membrane interaction, internalization, and perturbation (i.e., "membrane stress") as a clue to graphene oxide's mechanism of toxicity.
- 242Gurunathan, S.; Woong Han, J.; Abdal Daye, A.; Eppakayala, V.; Kim, J. Oxidative Stress-Mediated Antibacterial Activity of Graphene Oxide and Reduced Graphene Oxide in Pseudomonas Aeruginosa. Int. J. Nanomed. 2012, 7, 5901, DOI: 10.2147/IJN.S37397[Crossref], [PubMed], [CAS], Google Scholar242https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC38XhvV2jsL3I&md5=7d0716fb44db8085b1ac2fa83d0cff8fOxidative stress-mediated antibacterial activity of graphene oxide and reduced graphene oxide in Pseudomonas aeruginosaGurunathan, Sangiliyandi; Han, Jae Woong; Abdal Dayem, Ahmed; Eppakayala, Vasuki; Kim, Jin-HoiInternational Journal of Nanomedicine (2012), 7 (), 5901-5914CODEN: IJNNHQ; ISSN:1178-2013. (Dove Medical Press Ltd.)Graphene holds great promise for potential use in next-generation electronic and photonic devices due to its unique high carrier mobility, good optical transparency, large surface area and biocompatibility. The aim of this study was to study the antibacterial effects of graphene oxide (GO) and reduced graphene oxide (rGO) in Pseudomonas aeruginosa. The authors used a novel reducing agent, beta-mercaptoethanol (BME), for synthesis of graphene to avoid the use of toxic materials. To uncover the impacts of GO and rGO on human health, the antibacterial activity of two types of graphene-based material toward a bacterial model P. aeruginosa was studied and compared. The synthesized GO and rGO were characterized by UV-visible absorption spectroscopy, particle-size analyzer, x-ray diffraction, SEM and Raman spectroscopy. Further, to explain the antimicrobial activity of graphene oxide and reduced graphene oxide, the authors employed various assays, such as cell growth, cell viability, reactive oxygen species generation and DNA fragmentation. UV-visible spectra of the samples confirmed the transition of GO into graphene. Dynamic light-scattering analyses showed the av. size among the two types of graphene materials. X-ray diffraction data validated the structure of graphene sheets and high-resoln. SEM was employed to study the morphologies of prepd. graphene. Raman spectroscopy data indicated the removal of oxygen-contg. functional groups from the surface of GO and the formation of graphene. The exposure of cells to GO and rGO induced the prodn. of superoxide radical anion and loss of cell viability. Results suggest that the antibacterial activities are contributed to by loss of cell viability, induced oxidative stress and DNA fragmentation. Thus, the antibacterial activities of GO and rGO against P. aeruginosa were compared. The loss of P. aeruginosa viability increased in a dose- and time-dependent manner. Exposure to GO and rGO induced significant prodn. of superoxide radical anion compared to control. GO and rGO showed dose-dependent antibacterial activity against P. aeruginosa cells through the generation of reactive oxygen species, leading to cell death, which was further confirmed through resulting nuclear fragmentation. The data presented here are novel in that GO and rGO are effective bactericidal agents against P. aeruginosa, which would be used as a future antibacterial agent.
- 243Guo, Z.; Xie, C.; Zhang, P.; Zhang, J.; Wang, G.; He, X.; Ma, Y.; Zhao, B.; Zhang, Z. Toxicity and Transformation of Graphene Oxide and Reduced Graphene Oxide in Bacteria Biofilm. Sci. Total Environ. 2017, 580, 1300– 1308, DOI: 10.1016/j.scitotenv.2016.12.093[Crossref], [PubMed], [CAS], Google Scholar243https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC28XitFehsrbM&md5=b44d5023f1950d0403a463e6b7efdee1Toxicity and transformation of graphene oxide and reduced graphene oxide in bacteria biofilmGuo, Zhiling; Xie, Changjian; Zhang, Peng; Zhang, Junzhe; Wang, Guohua; He, Xiao; Ma, Yuhui; Zhao, Bin; Zhang, ZhiyongScience of the Total Environment (2017), 580 (), 1300-1308CODEN: STENDL; ISSN:0048-9697. (Elsevier B.V.)Impact of graphene based material (GNMs) on bacteria biofilm has not been well understood yet. In this study, the authors compared the impact of graphene oxide (GO) and reduced graphene oxide (rGO) on biofilm formation and development in Luria-Bertani (LB) medium using Escherichia coli and Staphylococcus aureus as models. GO significantly enhanced the cell growth, biofilm formation, and biofilm development even up to a concn. of 500 mg/L. In contrast, rGO (≥50 mg/L) strongly inhibited cell growth and biofilm formation. However, the inhibitory effects of rGO (50 mg/L and 100 mg/L) were attenuated in the mature phase (>24 h) and eliminated at 48 h. GO at 250 mg/L decreased the reactive oxygen species (ROS) levels in biofilm and extracellular region at mature phase. ROS levels were significantly increased by rGO at early phase, while they returned to the same levels as control at mature phase. These results suggest that oxidative stress contributed to the inhibitory effect of rGO on bacterial biofilm. The authors further found that supplement of extracellular polymeric substances (EPS) in the growth medium attenuated the inhibitory effect of rGO on the growth of developed biofilm. XPS results showed that rGO were oxidized to GO which can enhance the bacterial growth. The authors deduced that the elimination of the toxicity of rGO at mature phase was contributed by EPS protection and the oxidn. of rGO. This study provides new insights into the interaction of GNMs with bacteria biofilm.
- 244Combarros, R. G.; Collado, S.; Díaz, M. Toxicity of Graphene Oxide on Growth and Metabolism of Pseudomonas Putida. J. Hazard. Mater. 2016, 310, 246– 252, DOI: 10.1016/j.jhazmat.2016.02.038[Crossref], [PubMed], [CAS], Google Scholar244https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC28XjtlCnsrs%253D&md5=0e9a8534216eeb4f31ccc36840ba5e4bToxicity of graphene oxide on growth and metabolism of Pseudomonas putidaCombarros, R. G.; Collado, S.; Diaz, M.Journal of Hazardous Materials (2016), 310 (), 246-252CODEN: JHMAD9; ISSN:0304-3894. (Elsevier B.V.)The increasing consumption of graphene derivs. leads to greater presence of these materials in wastewater treatment plants and ecol. systems. The toxicity effect of graphene oxide (GO) on the microbial functions involved in the biol. wastewater treatment process is studied, using Pseudomonas putida and salicylic acid (SA) as bacterial and pollutant models. A multiparametric flow cytometry (FC) method has been developed to measure the metabolic activity and viability of P. putida in contact with GO. A continuous redn. in the percentages of viable cells and a slight increase, lower than 5%, in the percentages of damaged and dead cells, suggest that P. putida in contact with GO loses the membrane integrity but preserves metabolic activity. The growth of P. putida was strongly inhibited by GO, since 0.05 mg mL-1 of GO reduced the max. growth by a third, and the inhibition was considerably greater for GO concns. higher than 0.1 mg mL-1. The specific SA removal rate decreased with GO concn. up to 0.1 mg mL-1 indicating that while GO always reduces the growth of P. putida, for concns. higher than 0.1 mg mL-1, it also reduces its activity. Similar behavior is obsd. using simulated urban and industrial wastewaters, the obsd. effects being more acute in the industrial wastewaters.
- 245Tu, Y.; Lv, M.; Xiu, P.; Huynh, T.; Zhang, M.; Castelli, M.; Liu, Z.; Huang, Q.; Fan, C.; Fang, H.; Zhou, R. Destructive Extraction of Phospholipids from Escherichia Coli Membranes by Graphene Nanosheets. Nat. Nanotechnol. 2013, 8, 594– 601, DOI: 10.1038/nnano.2013.125[Crossref], [PubMed], [CAS], Google Scholar245https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3sXhtVKhtL7O&md5=7f60957a5cc3b8008520ab5aeb9858adDestructive extraction of phospholipids from Escherichia coli membranes by graphene nanosheetsTu, Yusong; Lv, Min; Xiu, Peng; Huynh, Tien; Zhang, Meng; Castelli, Matteo; Liu, Zengrong; Huang, Qing; Fan, Chunhai; Fang, Haiping; Zhou, RuhongNature Nanotechnology (2013), 8 (8), 594-601CODEN: NNAABX; ISSN:1748-3387. (Nature Publishing Group)Understanding how nanomaterials interact with cell membranes is related to how they cause cytotoxicity and is therefore crit. for designing safer biomedical applications. Recently, graphene (a two-dimensional nanomaterial) was shown to have antibacterial activity on Escherichia coli, but its underlying mol. mechanisms remain unknown. Here we show exptl. and theor. that pristine graphene and graphene oxide nanosheets can induce the degrdn. of the inner and outer cell membranes of Escherichia coli, and reduce their viability. TEM shows three rough stages, and mol. dynamics simulations reveal the at. details of the process. Graphene nanosheets can penetrate into and ext. large amts. of phospholipids from the cell membranes because of the strong dispersion interactions between graphene and lipid mols. This destructive extn. offers a novel mechanism for the mol. basis of graphene's cytotoxicity and antibacterial activity.
- 246Li, R.; Mansukhani, N. D.; Guiney, L. M.; Ji, Z.; Zhao, Y.; Chang, C. H.; French, C. T.; Miller, J. F.; Hersam, M. C.; Nel, A. E.; Xia, T. Identification and Optimization of Carbon Radicals on Hydrated Graphene Oxide for Ubiquitous Antibacterial Coatings. ACS Nano 2016, 10, 10966– 10980, DOI: 10.1021/acsnano.6b05692[ACS Full Text
 ], [CAS], Google Scholar246https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC28XhvFens7fN&md5=1bdf8bf923e831e15dd16c705281b26bIdentification and Optimization of Carbon Radicals on Hydrated Graphene Oxide for Ubiquitous Antibacterial CoatingsLi, Ruibin; Mansukhani, Nikhita D.; Guiney, Linda M.; Ji, Zhaoxia; Zhao, Yichao; Chang, Chong Hyun; French, Christopher T.; Miller, Jeff F.; Hersam, Mark C.; Nel, Andre E.; Xia, TianACS Nano (2016), 10 (12), 10966-10980CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)While the antibacterial properties of graphene oxide (GO) have been demonstrated across a spectrum of bacteria, the crit. role of functional groups is unclear. To address this important issue, we utilized redn. and hydration methods to establish a GO library with different oxidn., hydroxyl, and carbon radical (•C) levels that can be used to study the impact on antibacterial activity. Using antibiotic-resistant bacteria as a test platform, we found that the •C d. is most proximately assocd. with bacterial killing. Accordingly, hydrated GO (hGO), with the highest •C d., had the strongest antibacterial effects through membrane binding and induction of lipid peroxidn. To explore its potential applications, we demonstrated that coating of catheter and glass surfaces with hGO is capable of killing drug-resistant bacteria. In summary, •C is the principle surface moiety that can be utilized for clin. applications of GO-based antibacterial coatings.
], [CAS], Google Scholar246https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC28XhvFens7fN&md5=1bdf8bf923e831e15dd16c705281b26bIdentification and Optimization of Carbon Radicals on Hydrated Graphene Oxide for Ubiquitous Antibacterial CoatingsLi, Ruibin; Mansukhani, Nikhita D.; Guiney, Linda M.; Ji, Zhaoxia; Zhao, Yichao; Chang, Chong Hyun; French, Christopher T.; Miller, Jeff F.; Hersam, Mark C.; Nel, Andre E.; Xia, TianACS Nano (2016), 10 (12), 10966-10980CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)While the antibacterial properties of graphene oxide (GO) have been demonstrated across a spectrum of bacteria, the crit. role of functional groups is unclear. To address this important issue, we utilized redn. and hydration methods to establish a GO library with different oxidn., hydroxyl, and carbon radical (•C) levels that can be used to study the impact on antibacterial activity. Using antibiotic-resistant bacteria as a test platform, we found that the •C d. is most proximately assocd. with bacterial killing. Accordingly, hydrated GO (hGO), with the highest •C d., had the strongest antibacterial effects through membrane binding and induction of lipid peroxidn. To explore its potential applications, we demonstrated that coating of catheter and glass surfaces with hGO is capable of killing drug-resistant bacteria. In summary, •C is the principle surface moiety that can be utilized for clin. applications of GO-based antibacterial coatings. - 247Lu, X.; Feng, X.; Werber, J. R.; Chu, C.; Zucker, I.; Kim, J.-H.; Osuji, C. O.; Elimelech, M. Enhanced Antibacterial Activity through the Controlled Alignment of Graphene Oxide Nanosheets. Proc. Natl. Acad. Sci. U. S. A. 2017, 114, E9793– E9801, DOI: 10.1073/pnas.1710996114[Crossref], [PubMed], [CAS], Google Scholar247https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2sXhslagtbvJ&md5=31b1dc68115ba48371cb8836d9f54b97Enhanced antibacterial activity through the controlled alignment of graphene oxide nanosheetsLu, Xinglin; Feng, Xunda; Werber, Jay R.; Chu, Chiheng; Zucker, Ines; Kim, Jae-Hong; Osuji, Chinedum O.; Elimelech, MenachemProceedings of the National Academy of Sciences of the United States of America (2017), 114 (46), E9793-E9801CODEN: PNASA6; ISSN:0027-8424. (National Academy of Sciences)The cytotoxicity of 2D graphene-based nanomaterials (GBNs) is highly important for engineered applications and environmental health. However, the isotropic orientation of GBNs, most notably graphene oxide (GO), in previous exptl. studies obscured the interpretation of cytotoxic contributions of nanosheet edges. Here, we investigate the orientation-dependent interaction of GBNs with bacteria using GO composite films. To produce the films, GO nanosheets are aligned in a magnetic field, immobilized by crosslinking of the surrounding matrix, and exposed on the surface through oxidative etching. Characterization by small-angle X-ray scattering and at. force microscopy confirms that GO nanosheets align progressively well with increasing magnetic field strength and that the alignment is effectively preserved by crosslinking. When contacted with the model bacterium Escherichia coli, GO nanosheets with vertical orientation exhibit enhanced antibacterial activity compared with random and horizontal orientations. Further characterization is performed to explain the enhanced antibacterial activity of the film with vertically aligned GO. Using phospholipid vesicles as a model system, we observe that GO nanosheets induce phys. disruption of the lipid bilayer. Addnl., we find substantial GO-induced oxidn. of glutathione, a model intracellular antioxidant, paired with limited generation of reactive oxygen species, suggesting that oxidn. occurs through a direct electron-transfer mechanism. These phys. and chem. mechanisms both require nanosheet penetration of the cell membrane, suggesting that the enhanced antibacterial activity of the film with vertically aligned GO stems from an increased d. of edges with a preferential orientation for membrane disruption. The importance of nanosheet penetration for cytotoxicity has direct implications for the design of engineering surfaces using GBNs.
- 248Pandit, S.; Cao, Z.; Mokkapati, V. R. S. S.; Celauro, E.; Yurgens, A.; Lovmar, M.; Westerlund, F.; Sun, J.; Mijakovic, I. Vertically Aligned Graphene Coating Is Bactericidal and Prevents the Formation of Bacterial Biofilms. Adv. Mater. Interfaces 2018, 5, 1701331, DOI: 10.1002/admi.201701331
- 249Navarro, E.; Baun, A.; Behra, R.; Hartmann, N. B.; Filser, J.; Miao, A.-J.; Quigg, A.; Santschi, P. H.; Sigg, L. Environmental Behavior and Ecotoxicity of Engineered Nanoparticles to Algae, Plants, and Fungi. Ecotoxicology 2008, 17, 372– 386, DOI: 10.1007/s10646-008-0214-0[Crossref], [PubMed], [CAS], Google Scholar249https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BD1cXmsVKrsLc%253D&md5=d3512118ea8fc0a5ff4646610757f075Environmental behavior and ecotoxicity of engineered nanoparticles to algae, plants, and fungiNavarro, Enrique; Baun, Anders; Behra, Renata; Hartmann, Nanna B.; Filser, Juliane; Miao, Ai-Jun; Quigg, Antonietta; Santschi, Peter H.; Sigg, LauraEcotoxicology (2008), 17 (5), 372-386CODEN: ECOTEL; ISSN:0963-9292. (Springer)A review. Developments in nanotechnol. are leading to a rapid proliferation of new materials that are likely to become a source of engineered nanoparticles (ENPs) to the environment, where their possible ecotoxicol. impacts remain unknown. The surface properties of ENPs are of essential importance for their aggregation behavior, and thus for their mobility in aquatic and terrestrial systems and for their interactions with algae, plants and, fungi. Interactions of ENPs with natural org. matter have to be considered as well, as those will alter the ENPs aggregation behavior in surface waters or in soils. Cells of plants, algae, and fungi possess cell walls that constitute a primary site for interaction and a barrier for the entrance of ENPs. Mechanisms allowing ENPs to pass through cell walls and membranes are as yet poorly understood. Inside cells, ENPs might directly provoke alterations of membranes and other cell structures and mols., as well as protective mechanisms. Indirect effects of ENPs depend on their chem. and phys. properties and may include phys. restraints (clogging effects), solubilization of toxic ENP compds., or prodn. of reactive oxygen species. Many questions regarding the bioavailability of ENPs, their uptake by algae, plants, and fungi and the toxicity mechanisms remain to be elucidated.
- 250Tang, Y.; Tian, J.; Li, S.; Xue, C.; Xue, Z.; Yin, D.; Yu, S. Combined Effects of Graphene Oxide and Cd on the Photosynthetic Capacity and Survival of Microcystis Aeruginosa. Sci. Total Environ. 2015, 532, 154– 161, DOI: 10.1016/j.scitotenv.2015.05.081
- 251Saiz-Jimenez, C. The Conservation of Subterranean Cultural Heritage; CRC Press: Leiden, The Netherlands, 2014.
- 252Cheng, C.; Li, S.; Thomas, A.; Kotov, N. A.; Haag, R. Functional Graphene Nanomaterials Based Architectures: Biointeractions, Fabrications, and Emerging Biological Applications. Chem. Rev. 2017, 117, 1826– 1914, DOI: 10.1021/acs.chemrev.6b00520[ACS Full Text
 ], [CAS], Google Scholar252https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2sXmvVajtg%253D%253D&md5=ffbdb41eedafcc8b66762eec9a89e7e2Functional Graphene Nanomaterials Based Architectures: Biointeractions, Fabrications, and Emerging Biological ApplicationsCheng, Chong; Li, Shuang; Thomas, Arne; Kotov, Nicholas A.; Haag, RainerChemical Reviews (Washington, DC, United States) (2017), 117 (3), 1826-1914CODEN: CHREAY; ISSN:0009-2665. (American Chemical Society)A review. Functional graphene nanomaterials (FGNs) are fast emerging materials with extremely unique phys. and chem. properties and physiol. ability to interfere and /or interact with bioorganisms; as a result, FGNs present manifold possibilities for diverse biol. applications. Beyond their use in drug/gene delivery, phototherapy and bioimaging, recent studies have revealed that FGNs can significantly promote interfacial biointeractions, in particular, with proteins, mammalian cells/stem cells, and microbials. FGNs can adsorb and conc. nutrition factors including proteins from physiol. media. This accelerates the formation of extracellular matrix, which eventually promotes cell colonization by providing a more beneficial microenvironment for cell adhesion and growth. Furthermore, FGNs can also interact with cocultured cells by phys. or chem. stimulation, which significantly mediate their cellular signaling and biol. performance. In this review, the authors elucidate FGNs-bioorganism interactions and summarize recent advancements on designing FGN-based two-dimensional and three-dimensional architectures as multifunctional biol. platforms. The authors have also discussed the representative biol. applications regarding these FGN-based bioactive architectures. Furthermore, the future perspectives and emerging challenges will also be highlighted. Due to the lack of comprehensive reviews in this emerging field, this review may catch great interest and inspire many new opportunities across a broad range of disciplines.
], [CAS], Google Scholar252https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2sXmvVajtg%253D%253D&md5=ffbdb41eedafcc8b66762eec9a89e7e2Functional Graphene Nanomaterials Based Architectures: Biointeractions, Fabrications, and Emerging Biological ApplicationsCheng, Chong; Li, Shuang; Thomas, Arne; Kotov, Nicholas A.; Haag, RainerChemical Reviews (Washington, DC, United States) (2017), 117 (3), 1826-1914CODEN: CHREAY; ISSN:0009-2665. (American Chemical Society)A review. Functional graphene nanomaterials (FGNs) are fast emerging materials with extremely unique phys. and chem. properties and physiol. ability to interfere and /or interact with bioorganisms; as a result, FGNs present manifold possibilities for diverse biol. applications. Beyond their use in drug/gene delivery, phototherapy and bioimaging, recent studies have revealed that FGNs can significantly promote interfacial biointeractions, in particular, with proteins, mammalian cells/stem cells, and microbials. FGNs can adsorb and conc. nutrition factors including proteins from physiol. media. This accelerates the formation of extracellular matrix, which eventually promotes cell colonization by providing a more beneficial microenvironment for cell adhesion and growth. Furthermore, FGNs can also interact with cocultured cells by phys. or chem. stimulation, which significantly mediate their cellular signaling and biol. performance. In this review, the authors elucidate FGNs-bioorganism interactions and summarize recent advancements on designing FGN-based two-dimensional and three-dimensional architectures as multifunctional biol. platforms. The authors have also discussed the representative biol. applications regarding these FGN-based bioactive architectures. Furthermore, the future perspectives and emerging challenges will also be highlighted. Due to the lack of comprehensive reviews in this emerging field, this review may catch great interest and inspire many new opportunities across a broad range of disciplines. - 253Du, S.; Zhang, P.; Zhang, R.; Lu, Q.; Liu, L.; Bao, X.; Liu, H. Reduced Graphene Oxide Induces Cytotoxicity and Inhibits Photosynthetic Performance of the Green Alga Scenedesmus Obliquus. Chemosphere 2016, 164, 499– 507, DOI: 10.1016/j.chemosphere.2016.08.138[Crossref], [PubMed], [CAS], Google Scholar253https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC28XhsV2rtr3K&md5=030f7e164f42bf60911481f5653f9cedReduced graphene oxide induces cytotoxicity and inhibits photosynthetic performance of the green alga Scenedesmus obliquusDu, Shaoting; Zhang, Peng; Zhang, Ranran; Lu, Qi; Liu, Lin; Bao, Xiaowei; Liu, HuijunChemosphere (2016), 164 (), 499-507CODEN: CMSHAF; ISSN:0045-6535. (Elsevier Ltd.)Increased use of graphene materials might ultimately lead to their release into the environment. However, only a few studies have investigated the impact of graphene-based materials on green plants. In this study, the impact of reduced graphene oxide (RGO) on the microalgae Scenedesmus obliquus was evaluated to det. its phytotoxicity. Treatment with RGO suppressed the growth of the microalgae. The 72-h IC50 values of RGO evaluated using the logistic and Gompertz models were 148 and 151 mg L-1, resp. RGO significantly inhibited Chl a and Chl a/b levels in the algal cells. Chlorophyll a fluorescence anal. showed that RGO significantly down-regulated photosystem II activity. The mechanism of how RGO inhibited algal growth and photosynthetic performance was detd. by analyzing the alterations in ultrastructural morphol. RGO adhered to the algal cell surface as a semitranslucent coating. Cell wall damage and membrane integrity loss occurred in the treated cells. Moreover, nuclear chromatin clumping and starch grain no. increase were noted. These changes might be attributed to the increase in malondialdehyde and reactive oxygen species levels, which might have exceeded the scavenging ability of antioxidant enzymes (including peroxidase and superoxide dismutase). RGO impaired the extra- and intra-cellular morphol. and increased oxidative stress and thus inhibited algal growth and photosynthesis.
- 254Zhao, J.; Cao, X.; Wang, Z.; Dai, Y.; Xing, B. Mechanistic Understanding toward the Toxicity of Graphene-Family Materials to Freshwater Algae. Water Res. 2017, 111, 18– 27, DOI: 10.1016/j.watres.2016.12.037[Crossref], [PubMed], [CAS], Google Scholar254https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2sXhslGq&md5=3988f947ca81406be169c5d62977fcf1Mechanistic understanding toward the toxicity of graphene-family materials to freshwater algaeZhao, Jian; Cao, Xuesong; Wang, Zhenyu; Dai, Yanhui; Xing, BaoshanWater Research (2017), 111 (), 18-27CODEN: WATRAG; ISSN:0043-1354. (Elsevier Ltd.)We systematically investigated the toxicity mechanism of three graphene-family materials (GFMs), graphene oxide (GO), reduced graphene oxide (rGO) and multi-layer graphene (MG), to algae (Chlorella pyrenoidosa). GFMs exhibited much higher toxicity than other carbon materials (carbon nanotube and graphite), with the 96 h median effective concn. (EC50) values of 37.3 (GO), 34.0 (rGO), and 62.2 (MG) mg/L. Shading effect contributed approx. 16.4% of growth inhibition by GO due to its higher dispersibility and transformation while the other GFMs did not show any shading effect. Hydrophobic rGO and MG more readily heteroagglomerated with algae than GO, thus likely leading to more direct contacts with algae. Flow cytometry results showed significant decrease of membrane integrity after GFM exposure, and rGO caused the highest membrane damage, which was confirmed by the increased DNA and K+ efflux. The obsd. membrane damage was caused by a combination of oxidative stress and phys. penetration/extn. Moreover, all the three GFMs could adsorb macronutrients (N, P, Mg, and Ca) from the algal medium, thus leading to nutrient depletion-induced indirect toxicity. GO showed the highest nutrient depletion (53% of total toxicity) due to its abundant functional groups. The information provided in this work will be useful for understanding toxicity mechanism and environmental risk of different GFMs in aquatic environments.
- 255Hu, X.; Ouyang, S.; Mu, L.; An, J.; Zhou, Q. Effects of Graphene Oxide and Oxidized Carbon Nanotubes on the Cellular Division, Microstructure, Uptake, Oxidative Stress, and Metabolic Profiles. Environ. Sci. Technol. 2015, 49, 10825– 10833, DOI: 10.1021/acs.est.5b02102[ACS Full Text
 ], [CAS], Google Scholar255https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2MXhtlOntLbL&md5=771df09763ebca939ca26450d6817f48Effects of Graphene Oxide and Oxidized Carbon Nanotubes on the Cellular Division, Microstructure, Uptake, Oxidative Stress, and Metabolic ProfilesHu, Xiangang; Ouyang, Shaohu; Mu, Li; An, Jing; Zhou, QixingEnvironmental Science & Technology (2015), 49 (18), 10825-10833CODEN: ESTHAG; ISSN:0013-936X. (American Chemical Society)Nanomaterial oxides are common formations of nanomaterials in the natural environment. Herein, the nanotoxicol. of typical graphene oxide (GO) and carboxyl single-walled carbon nanotubes (C-SWCNT) was compared. The results showed that cell division of Chlorella vulgaris was promoted at 24 h and then inhibited at 96 h after nanomaterial exposure. At 96 h, GO and C-SWCNT inhibited the rates of cell division by 0.08-15% and 0.8-28.3%, resp. Both GO and C-SWCNT covered the cell surface, but the uptake percentage of C-SWCNT was 2-fold higher than that of GO. C-SWCNT induced stronger plasmolysis and mitochondrial membrane potential loss and decreased the cell viability to a greater extent than GO. Moreover, C-SWCNT-exposed cells exhibited more starch grains and lysosome formation and higher reactive oxygen species (ROS) levels than GO-exposed cells. Metabolomics anal. revealed significant differences in the metabolic profiles among the control, C-SWCNT and GO groups. The metabs. of alkanes, lysine, octadecadienoic acid and valine was assocd. with ROS and could be considered as new biomarkers of ROS. The nanotoxicol. mechanisms involved the inhibition of fatty acid, amino acid and small mol. acid metabs. These findings provide new insights into the effects of GO and C-SWCNT on cellular responses.
], [CAS], Google Scholar255https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2MXhtlOntLbL&md5=771df09763ebca939ca26450d6817f48Effects of Graphene Oxide and Oxidized Carbon Nanotubes on the Cellular Division, Microstructure, Uptake, Oxidative Stress, and Metabolic ProfilesHu, Xiangang; Ouyang, Shaohu; Mu, Li; An, Jing; Zhou, QixingEnvironmental Science & Technology (2015), 49 (18), 10825-10833CODEN: ESTHAG; ISSN:0013-936X. (American Chemical Society)Nanomaterial oxides are common formations of nanomaterials in the natural environment. Herein, the nanotoxicol. of typical graphene oxide (GO) and carboxyl single-walled carbon nanotubes (C-SWCNT) was compared. The results showed that cell division of Chlorella vulgaris was promoted at 24 h and then inhibited at 96 h after nanomaterial exposure. At 96 h, GO and C-SWCNT inhibited the rates of cell division by 0.08-15% and 0.8-28.3%, resp. Both GO and C-SWCNT covered the cell surface, but the uptake percentage of C-SWCNT was 2-fold higher than that of GO. C-SWCNT induced stronger plasmolysis and mitochondrial membrane potential loss and decreased the cell viability to a greater extent than GO. Moreover, C-SWCNT-exposed cells exhibited more starch grains and lysosome formation and higher reactive oxygen species (ROS) levels than GO-exposed cells. Metabolomics anal. revealed significant differences in the metabolic profiles among the control, C-SWCNT and GO groups. The metabs. of alkanes, lysine, octadecadienoic acid and valine was assocd. with ROS and could be considered as new biomarkers of ROS. The nanotoxicol. mechanisms involved the inhibition of fatty acid, amino acid and small mol. acid metabs. These findings provide new insights into the effects of GO and C-SWCNT on cellular responses. - 256Nogueira, P. F. M.; Nakabayashi, D.; Zucolotto, V. The Effects of Graphene Oxide on Green Algae Raphidocelis Subcapitata. Aquat. Toxicol. 2015, 166, 29– 35, DOI: 10.1016/j.aquatox.2015.07.001[Crossref], [PubMed], [CAS], Google Scholar256https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2MXhtF2rtrzE&md5=2fd1bb57adaabe853a3f7e0071dc4405The effects of graphene oxide on green algae Raphidocelis subcapitataNogueira, P. F. M.; Nakabayashi, D.; Zucolotto, V.Aquatic Toxicology (2015), 166 (), 29-35CODEN: AQTODG; ISSN:0166-445X. (Elsevier B.V.)Graphene represents a new class of nanomaterials that has attracted great interest due to its unique elec., thermal, and mech. properties. Once disposed in the environment, graphene can interact with biol. systems and is expected to exhibit toxicol. effects. The ecotoxicity of graphene and its derivs., viz.: graphene oxide (GO) depends on their physicochem. properties, including purity, diam., length, surface charge, functionalization and aggregation state. In this study we evaluated the effects of graphene oxide (GO) on green algae Raphidocelis subcapitata. The algae were exposed to different concns. of GO pre-equilibrated for 24 h with oligotrophic freshwater medium (20 mL ) during incubation in a growth chamber under controlled conditions: 120 μEm-2 s-1 illumination; 12:12 h light dark cycle and const. temp. of 22 ± 2 °C. Algal growth was monitored daily for 96 h by direct cell counting. Reactive oxygen species level (ROS), membrane damage (cell viability) and autofluorescence (chl-a fluorescence) were evaluated using fluorescent staining and further analyzed by flow cytometry. The toxic effects from GO, as obsd. in algal d. and autofluorescence, started at concns. from 20 and 10 μg mL-1, resp. Such toxicity is probably the result of ROS generation and membrane damage (cell viability). The shading effect caused by GO agglomeration in culture medium may also contribute to reduce algal d. The results reported here provide knowledge regarding the GO toxicity on green algae, contributing to a better understanding of its environmental behavior and impacts.
- 257Pereira, M. M.; Mouton, L.; Yéprémian, C.; Couté, A.; Lo, J.; Marconcini, J. M.; Ladeira, L. O.; Raposo, N. R.; Brandão, H. M.; Brayner, R. Ecotoxicological Effects of Carbon Nanotubes and Cellulose Nanofibers in Chlorella Vulgaris. J. Nanobiotechnol. 2014, 12, 15, DOI: 10.1186/1477-3155-12-15[Crossref], [PubMed], [CAS], Google Scholar257https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2MXivVahs7c%253D&md5=0391218499eb7b573f841e2b7667f5f9Ecotoxicological effects of carbon nanotubes and cellulose nanofibers in Chlorella vulgarisPereira, Michele M.; Mouton, Ludovic; Yepremian, Claude; Coute, Alain; Lo, Joanne; Marconcini, Jose M.; Ladeira, Luiz O.; Raposo, Nadia R. B.; Brandao, Humberto M.; Brayner, RobertaJournal of Nanobiotechnology (2014), 12 (), 15/1-15/13, 13 pp.CODEN: JNOAAO; ISSN:1477-3155. (BioMed Central Ltd.)Background: MWCNT and CNF are interesting NPs that possess great potential for applications in various fields such as water treatment, reinforcement materials and medical devices. However, the rapid dissemination of NPs can impact the environment and in the human health. Thus, the aim of this study was to evaluate the MWCNT and cotton CNF toxicol. effects on freshwater green microalgae Chlorella vulgaris. Results: Exposure to MWCNT and cotton CNF led to redns. on algal growth and cell viability. NP exposure induced reactive oxygen species (ROS) prodn. and a decreased of intracellular ATP levels. Addn. of NPs further induced ultrastructural cell damage. MWCNTs penetrate the cell membrane and individual MWCNTs are seen in the cytoplasm while no evidence of cotton CNFs was found inside the cells. Cellular uptake of MWCNT was obsd. in algae cells cultured in BB medium, but cells cultured in Seine river water did not internalize MWCNTs. Conclusions: Under the conditions tested, such results confirmed that exposure to MWCNTs and to cotton CNFs affects cell viability and algal growth.
- 258Dubinsky, Z.; Schofield, O. From the Light to the Darkness: Thriving at the Light Extremes in the Oceans. Hydrobiologia 2010, 639, 153– 171, DOI: 10.1007/s10750-009-0026-0
- 259Garacci, M.; Barret, M.; Mouchet, F.; Sarrieu, C.; Lonchambon, P.; Flahaut, E.; Gauthier, L.; Silvestre, J.; Pinelli, E. Few Layer Graphene Sticking by Biofilm of Freshwater Diatom Nitzschia Palea as a Mitigation to Its Ecotoxicity. Carbon 2017, 113, 139– 150, DOI: 10.1016/j.carbon.2016.11.033[Crossref], [CAS], Google Scholar259https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC28XhvFGjsLzO&md5=b9f4153fc1e708d2dc2a0d1f6d89ef38Few Layer Graphene sticking by biofilm of freshwater diatom Nitzschia palea as a mitigation to its ecotoxicityGaracci, M.; Barret, M.; Mouchet, F.; Sarrieu, C.; Lonchambon, P.; Flahaut, E.; Gauthier, L.; Silvestre, J.; Pinelli, E.Carbon (2017), 113 (), 139-150CODEN: CRBNAH; ISSN:0008-6223. (Elsevier Ltd.)Carbon-based nanoparticles such as graphene have many applications leading to their industrial prodn. Few-Layer Graphene (FLG) is thus likely to be found in the environment, and esp. in rivers. In this study, the effect of FLG on the photosynthetic benthic diatom Nitzschia palea was assessed making distinction between the impact of a direct contact with FLG and a shading effect of FLG on diatoms. Growth inhibition of diatoms exposed to FLG at 50 mg L-1 was obsd. at 48 h of exposure assocd. with an increase in diatoms mortality. At 144 h, the growth rate was recovered. However, in shading condition, at 48 h of FLG exposure, a persistent growth inhibition was obsd. at 50 mg L-1. Microscopic observations and a monitoring of FLG concn. in the medium allowed to conclude that exo-polymeric substances (EPS), naturally secreted by N. palea, strongly interact with FLG, sticking nanoparticles at the bottom of wells. Our results highlight the potential mechanisms of clarification of the water column by diatoms biofilms, by sticking FLG even at high concn. Overall, these results suggest that one potential toxicity process of graphene could be a combination of direct and shading effect leading to a strong interaction between biofilm and nanoparticles.
- 260Lüttge, U.; Büdel, B. Resurrection Kinetics of Photosynthesis in Desiccation-Tolerant Terrestrial Green Algae (Chlorophyta) on Tree Bark. Plant Biol. 2010, 12, 437– 444, DOI: 10.1111/j.1438-8677.2009.00249.x[Crossref], [PubMed], [CAS], Google Scholar260https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3cXlslWqur4%253D&md5=b7d32b4fed607fa9237d67f6a5345c0bResurrection kinetics of photosynthesis in desiccation-tolerant terrestrial green algae (Chlorophyta) on tree barkLuettge, U.; Buedel, B.Plant Biology (Hoboken, NJ, United States) (2010), 12 (3), 437-444CODEN: PBIOFN; ISSN:1435-8603. (Wiley-Blackwell)The rough bark of orchard trees (Malus) around Darmstadt is predominantly covered in red to purple-brown layers (biofilms) of epiphytic terrestrial alga of Trentepohlia umbrina. The smooth bark of forest trees (Fagus sylvatica L. and Acer sp.) in the same area is covered by bright green biofilms composed of the green algae Desmococcus, Apatococcus and Trebouxia, with a few cells of Coccomyxa and "Chlorella" trebouxioides between them. These algae are desiccation tolerant. After samples of bark with the biofilms were kept in dry air in darkness for various periods of time, potential quantum yield of PSII, Fv/Fm, recovered during rehydration upon rewetting. The kinetics and degree of recovery depended on the length of time that the algae were kept in dry air in the desiccated state. Recovery was better for green biofilm samples, i.e. quite good even after 80 days of desiccation (Fv/Fm = ca. 50% of initial value), than the red samples, where recovery was only adequate up to ca. 30-40 days of desiccation (Fv/Fm = ca. 20-55% of initial value). It is concluded that the different bark types constitute different ecophysiol. niches that can be occupied by the algae and that can be distinguished by their capacity to recover from desiccation after different times in the dry state.
- 261Holzinger, A.; Karsten, U. Desiccation Stress and Tolerance in Green Algae: Consequences for Ultrastructure, Physiological and Molecular Mechanisms. Front. Plant Sci. 2013, 4, 327, DOI: 10.3389/fpls.2013.00327[Crossref], [PubMed], [CAS], Google Scholar261https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A280%3ADC%252BC3sbjtlCksA%253D%253D&md5=9da7309cdb7b416da9081de08714a033Desiccation stress and tolerance in green algae: consequences for ultrastructure, physiological and molecular mechanismsHolzinger Andreas; Karsten UlfFrontiers in plant science (2013), 4 (), 327 ISSN:1664-462X.Although most green algae typically occur in aquatic ecosystems, many species also live partly or permanently under aeroterrestrial conditions, where the cells are exposed to the atmosphere and hence regularly experience dehydration. The ability of algal cells to survive in an air-dried state is termed desiccation tolerance. The mechanisms involved in desiccation tolerance of green algae are still poorly understood, and hence the aim of this review is to summarize recent findings on the effects of desiccation and osmotic water loss. Starting from structural changes, physiological, and biochemical consequences of desiccation will be addressed in different green-algal lineages. The available data clearly indicate a range of strategies, which are rather different in streptophycean and non-streptophycean green algae. While members of the Trebouxiophyceae exhibit effective water loss-prevention mechanisms based on the biosynthesis and accumulation of particular organic osmolytes such as polyols, these compounds are so far not reported in representatives of the Streptophyta. In members of the Streptophyta such as Klebsormidium, the most striking observation is the appearance of cross-walls in desiccated samples, which are strongly undulating, suggesting a high degree of mechanical flexibility. This aids in maintaining structural integrity in the dried state and allows the cell to maintain turgor pressure for a prolonged period of time during the dehydration process. Physiological strategies in aeroterrestrial green algae generally include a rapid reduction of photosynthesis during desiccation, but also a rather quick recovery after rewetting, whereas aquatic species are sensitive to drying. The underlying mechanisms such as the affected molecular components of the photosynthetic machinery are poorly understood in green algae. Therefore, modern approaches based on transcriptomics, proteomics, and/or metabolomics are urgently needed to better understand the molecular mechanisms involved in desiccation-stress physiology of these organisms. The very limited existing information is described in the present review.
- 262Montagner, A.; Bosi, S.; Tenori, E.; Bidussi, M.; Alshatwi, A. A.; Tretiach, M.; Prato, M.; Syrgiannis, Z. Ecotoxicological Effects of Graphene-Based Materials. 2D Mater. 2017, 4, 012001, DOI: 10.1088/2053-1583/4/1/012001
- 263Wang, Y.; Chang, C. H.; Ji, Z.; Bouchard, D. C.; Nisbet, R. M.; Schimel, J. P.; Gardea-Torresdey, J. L.; Holden, P. A. Agglomeration Determines Effects of Carbonaceous Nanomaterials on Soybean Nodulation, Dinitrogen Fixation Potential, and Growth in Soil. ACS Nano 2017, 11, 5753– 5765, DOI: 10.1021/acsnano.7b01337[ACS Full Text
 ], [CAS], Google Scholar263https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2sXos1agtb8%253D&md5=6b2e1df4924948a58dd7b0f130883e2eAgglomeration Determines Effects of Carbonaceous Nanomaterials on Soybean Nodulation, Dinitrogen Fixation Potential, and Growth in SoilWang, Ying; Chang, Chong Hyun; Ji, Zhaoxia; Bouchard, Dermont C.; Nisbet, Roger M.; Schimel, Joshua P.; Gardea-Torresdey, Jorge L.; Holden, Patricia A.ACS Nano (2017), 11 (6), 5753-5765CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)The potential effects of carbonaceous nanomaterials (CNMs) on agricultural plants are of concern. However, little research has been performed using plants cultivated to maturity in soils contaminated with various CNMs at different concns. Here, we grew soybean for 39 days to seed prodn. in soil amended with 0.1, 100, or 1000 mg kg-1 of either multi-walled carbon nanotubes (MWCNTs), graphene nanoplatelets (GNPs), or carbon black (CB), and studied plant growth, nodulation, and dinitrogen (N2) fixation potential. Plants in all CNM treatments flowered earlier (producing 60 to 372% more flowers when reprodn. started) than the unamended controls. The low MWCNT-treated plants were shorter (by 15%) with slower leaf cover expansion (by 26%) and less final leaf area (by 24%) than the controls. Nodulation and N2 fixation potential appeared neg. impacted by CNMs, with stronger effects at lower CNM concns. All CNM treatments reduced the whole-plant N2 fixation potential, with the highest redns. (by over 91%) in the low and medium CB, and the low MWCNT, treatments. CB and GNPs appeared to accumulate inside nodules as obsd. by transmission electron microscopy. CNM dispersal in aq. soil exts. was studied to explain the inverse dose-response relationships, showing that CNMs at higher concns. were more agglomerated (over 90% CNMs settled as agglomerates >3 μm after 12 h) and therefore proportionally less bioavailable. Overall, our findings suggest that lower concns. of CNMs in soils could be more impactful to leguminous N2 fixation, owing to greater CNM dispersal and therefore increased bioavailability at lower concns.
], [CAS], Google Scholar263https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2sXos1agtb8%253D&md5=6b2e1df4924948a58dd7b0f130883e2eAgglomeration Determines Effects of Carbonaceous Nanomaterials on Soybean Nodulation, Dinitrogen Fixation Potential, and Growth in SoilWang, Ying; Chang, Chong Hyun; Ji, Zhaoxia; Bouchard, Dermont C.; Nisbet, Roger M.; Schimel, Joshua P.; Gardea-Torresdey, Jorge L.; Holden, Patricia A.ACS Nano (2017), 11 (6), 5753-5765CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)The potential effects of carbonaceous nanomaterials (CNMs) on agricultural plants are of concern. However, little research has been performed using plants cultivated to maturity in soils contaminated with various CNMs at different concns. Here, we grew soybean for 39 days to seed prodn. in soil amended with 0.1, 100, or 1000 mg kg-1 of either multi-walled carbon nanotubes (MWCNTs), graphene nanoplatelets (GNPs), or carbon black (CB), and studied plant growth, nodulation, and dinitrogen (N2) fixation potential. Plants in all CNM treatments flowered earlier (producing 60 to 372% more flowers when reprodn. started) than the unamended controls. The low MWCNT-treated plants were shorter (by 15%) with slower leaf cover expansion (by 26%) and less final leaf area (by 24%) than the controls. Nodulation and N2 fixation potential appeared neg. impacted by CNMs, with stronger effects at lower CNM concns. All CNM treatments reduced the whole-plant N2 fixation potential, with the highest redns. (by over 91%) in the low and medium CB, and the low MWCNT, treatments. CB and GNPs appeared to accumulate inside nodules as obsd. by transmission electron microscopy. CNM dispersal in aq. soil exts. was studied to explain the inverse dose-response relationships, showing that CNMs at higher concns. were more agglomerated (over 90% CNMs settled as agglomerates >3 μm after 12 h) and therefore proportionally less bioavailable. Overall, our findings suggest that lower concns. of CNMs in soils could be more impactful to leguminous N2 fixation, owing to greater CNM dispersal and therefore increased bioavailability at lower concns. - 264Begum, P.; Fugetsu, B. Induction of Cell Death by Graphene in Arabidopsis Thaliana (Columbia Ecotype) T87 Cell Suspensions. J. Hazard. Mater. 2013, 260, 1032– 1041, DOI: 10.1016/j.jhazmat.2013.06.063[Crossref], [PubMed], [CAS], Google Scholar264https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3sXht1ylu7zM&md5=96bdb824dedc9dacd0d8165f9e22d972Induction of cell death by graphene in Arabidopsis thaliana (Columbia ecotype) T87 cell suspensionsBegum, Parvin; Fugetsu, BunshiJournal of Hazardous Materials (2013), 260 (), 1032-1041CODEN: JHMAD9; ISSN:0304-3894. (Elsevier B.V.)The toxicity of graphene on suspensions of Arabidopsis thaliana (Columbia ecotype) T87 cells was investigated by examg. the morphol., mitochondrial dysfunction, reactive oxygen species generation (ROS), and translocation of graphene as the toxicol. endpoints. The cells were grown in Jouanneau and Peaud-Lenoel (JPL) media and exposed to graphene at concns. 0-80 mg/L. Morphol. changes were obsd. by scanning electron microscope and the adverse effects such as fragmented nuclei, membrane damage, mitochondrial dysfunction was obsd. with fluorescence microscopy by staining with Hoechst 33342/propidium iodide and succinate dehydrogenase (mitochondrial bioenergetic enzyme). Anal. of intracellular ROS by 2',7'-dichlorofluorescein diacetate demonstrated that graphene induced a 3.3-fold increase in ROS, suggesting that ROS are key mediators in the cell death signaling pathway. Transmission electron microscopy verified the translocation of graphene into cells and an endocytosis-like structure was obsd. which suggested graphene entering into the cells by endocytosis. In conclusion, our results show that graphene induced cell death in T87 cells through mitochondrial damage mediated by ROS.
- 265Wang, Q.; Zhao, S.; Zhao, Y.; Rui, Q.; Wang, D. Toxicity and Translocation of Graphene Oxide in Arabidopsis Plants under Stress Conditions. RSC Adv. 2014, 4, 60891– 60901, DOI: 10.1039/C4RA10621K[Crossref], [CAS], Google Scholar265https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2cXhsl2nsr7M&md5=96adef44a2318dbca0fc060c81524e28Toxicity and translocation of graphene oxide in Arabidopsis plants under stress conditionsWang, Qianqian; Zhao, Shengqing; Zhao, Yunli; Rui, Qi; Wang, DayongRSC Advances (2014), 4 (105), 60891-60901CODEN: RSCACL; ISSN:2046-2069. (Royal Society of Chemistry)In the present study, we investigated the toxicity and translocation of graphene oxide (GO) in the μg L-1 range in Arabidopsis plants under both normal and stress conditions. Exposure to GO for 4 wk did not cause adverse effects on the development of Arabidopsis seedlings. In contrast, the combined exposure to GO and PEG 6000 (20%) or NaCl (200 mM) resulted in a more severe loss of morphol., decrease in fresh wt. or root length, and increase in root-to-shoot ratio in Arabidopsis seedlings compared with exposure to stress alone. The combined exposure to GO and PEG 6000 (20%) or NaCl (200 mM) resulted in a greater increase in hydrogen peroxide content or membrane ion leakage, decrease in superoxide dismutase activity or catalase activity, and induction of reactive oxygen species prodn. in Arabidopsis seedlings compared with exposure to stress alone. The combined exposure to GO and PEG 6000 (20%) or NaCl (200 mM) induced more severe alterations in expression patterns of genes required for development, abiotic stress, and membrane ion leakage in Arabidopsis seedlings. Moreover, under stress conditions, more GO was distributed in Arabidopsis seedlings and GO was translocated from roots to leaves. We hypothesize that, under stress conditions, GO may induce oxidative stress and membrane ion leakage, which may in turn induce GO translocation from the roots to the leaves. Our results will be useful for understanding toxicity and translocation of GO under different environmental conditions.
- 266Zhao, S.; Wang, Q.; Zhao, Y.; Rui, Q.; Wang, D. Toxicity and Translocation of Graphene Oxide in Arabidopsis Thaliana. Environ. Toxicol. Pharmacol. 2015, 39, 145– 156, DOI: 10.1016/j.etap.2014.11.014[Crossref], [PubMed], [CAS], Google Scholar266https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2cXitVyksrnF&md5=c1d5256dd7da1f77f70d3aeab2e98839Toxicity and translocation of graphene oxide in Arabidopsis thalianaZhao, Shengqing; Wang, Qianqian; Zhao, Yunli; Rui, Qi; Wang, DayongEnvironmental Toxicology and Pharmacology (2015), 39 (1), 145-156CODEN: ETOPFR; ISSN:1382-6689. (Elsevier B.V.)The authors investigated the possible safety property and translocation of graphene oxide (GO) in the range of μg/L in Arabidopsis. GO exposure did not obviously influence germination, seed development, shoot and root development of seedlings, and flowering time. Meanwhile, GO exposure could not induce severe H2O2 prodn., increase in malondialdehyde content, formation of oxidative stress, and altered activities of antioxidant enzymes. Moreover, GO exposure did not change expression patterns of examd. genes required for germination, photomorphogenesis, root development, and transition from vegetative to reproductive development. In the seedling, the authors did not observe severe GO accumulation in mesophyll and parenchyma cells of leaf or stem, and in sieve element in leaf, stem, or root. In contrast, the authors obsd. the severe GO accumulation in root hair and root parenchyma cells. The authors' results provide the physiol. basis for safety property of GO at the examd. concns. in Arabidopsis plants. Furthermore, the authors' data imply that although GO was absorbed by Arabidopsis plants through root hairs, plants might still have strong ability to be against GO translocation into stem or leaves. In addn., the authors found that cotyledon might serve as an important site for GO distribution during the early development.
- 267Chen, L.; Wang, C.; Li, H.; Qu, X.; Yang, S.-T.; Chang, X.-L. Bioaccumulation and Toxicity of 13 C-Skeleton Labeled Graphene Oxide in Wheat. Environ. Sci. Technol. 2017, 51, 10146– 10153, DOI: 10.1021/acs.est.7b00822
- 268Liu, S.; Wei, H.; Li, Z.; Li, S.; Yan, H.; He, Y.; Tian, Z. Effects of Graphene on Germination and Seedling Morphology in Rice. J. Nanosci. Nanotechnol. 2015, 15, 2695– 2701, DOI: 10.1166/jnn.2015.9254[Crossref], [PubMed], [CAS], Google Scholar268https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2MXls1Cltbk%253D&md5=eee12e9c95715ae90e03f3984ca48f70Effects of graphene on germination and seedling morphology in riceLiu, Shangjie; Wei, Hongmin; Li, Zhiyang; Li, Shun; Yan, Han; He, Yong; Tian, ZhihongJournal of Nanoscience and Nanotechnology (2015), 15 (4), 2695-2701CODEN: JNNOAR; ISSN:1533-4880. (American Scientific Publishers)The effects of graphene on the germination and growth of rice seeds were studied. Seeds were treated with graphene solns. at different concns. Obvious delaying effects on the germination rate were obsd. with the increasing of graphene concn. The growth of radicle and plumule was inhibited. And also, the morphol. (root length, stem length, adventitious no., root fresh wt., fresh wt. of over ground part and root cap ratio) of rice seedlings was certainly affected. After been treated by different concns. of graphene for 16 d, promoting effects on adventitious root no., root fresh wt. and fresh wt. of over ground part were obsd. at concn. of 5 mg/L. Significant inhibitions on the stem length and fresh wt. of over ground part were obsd. at concn. of 50 mg/L. In addn., all the indexes were inhibited at concns. of 100 mg/L and 200 mg/L. It indicates that graphene certainly inhibit the morphogenesis of rice seedlings. But the mechanism by which graphene of 5 mg/L improves part of growth indexes still needs further study.
- 269Anjum, N. A.; Singh, N.; Singh, M. K.; Sayeed, I.; Duarte, A. C.; Pereira, E.; Ahmad, I. Single-Bilayer Graphene Oxide Sheet Impacts and Underlying Potential Mechanism Assessment in Germinating Faba Bean (Vicia Faba L.). Sci. Total Environ. 2014, 472, 834– 841, DOI: 10.1016/j.scitotenv.2013.11.018[Crossref], [PubMed], [CAS], Google Scholar269https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2cXht1KjtLw%253D&md5=d315abb33f325eb98ecf55689035da87Single-bilayer graphene oxide sheet impacts and underlying potential mechanism assessment in germinating faba bean (Vicia faba L.)Anjum, Naser A.; Singh, Neetu; Singh, Manoj K.; Sayeed, Iqbal; Duarte, Armando C.; Pereira, Eduarda; Ahmad, IqbalScience of the Total Environment (2014), 472 (), 834-841CODEN: STENDL; ISSN:0048-9697. (Elsevier B.V.)This study investigates the impact of different single-bilayer graphene oxide sheet (hereafter 'graphene oxide', GO; size: 0.5-5 μm) concns. (0, 100, 200, 400, 800 and 1600 mg L- 1) and underlying potential mechanisms in germinating faba bean (Vicia faba L.) seedlings. The study revealed both pos. and neg. concn.-dependent GO-effects on V. faba. Significant neg. impacts of GO concns. (ordered by magnitude of effect: 1600 >200>100 mg GO L- 1) were indicated by decreases in growth parameters and the activity of H2O2-decompg. enzymes (ascorbate peroxidase, APX; catalase, CAT), and by increases in the levels of electrolyte leakage (EL), H2O2, and lipid and protein oxidn. The pos. impacts of 400 and 800 mg GO L- 1 included significant improvements in V. faba health status indicated by decreased levels of EL, H2O2, and lipid and protein oxidn., and by enhanced H2O2-decompg. APX and CAT activity, and increased proline and seed-relative water content. V. faba seedlings-polypeptide patterns strongly substantiated these GO-concn. effects. Overall, the pos. effects of these two GO concns. (800 >400 mg L- 1) on V. faba seedlings indicate their safe nature and allow to suggest further studies.
- 270Chichiriccò, G.; Poma, A. Penetration and Toxicity of Nanomaterials in Higher Plants. Nanomaterials 2015, 5, 851– 873, DOI: 10.3390/nano5020851[Crossref], [PubMed], [CAS], Google Scholar270https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2MXpvFCrurk%253D&md5=40f9442a645358e732a2f8f36bc2a786Penetration and toxicity of nanomaterials in higher plantsChichiricco, Giuseppe; Poma, AnnaNanomaterials (2015), 5 (2), 851-873CODEN: NANOKO; ISSN:2079-4991. (MDPI AG)Nanomaterials (NMs) comprise either inorg. particles consisting of metals, oxides, and salts that exist in nature and may be also produced in the lab., or org. particles originating only from the lab., having at least one dimension between 1 and 100 nm in size. According to shape, size, surface area, and charge, NMs have different mech., chem., elec., and optical properties that make them suitable for technol. and biomedical applications and thus they are being increasingly produced and modified. Despite their beneficial potential, their use may be hazardous to health owing to the capacity to enter the animal and plant body and interact with cells. Studies on NMs involve technologists, biologists, physicists, chemists, and ecologists, so there are numerous reports that are significantly raising the level of knowledge, esp. in the field of nanotechnol.; however, many aspects concerning nanobiol. remain undiscovered, including the interactions with plant biomols. In this review we examine current knowledge on the ways in which NMs penetrate plant organs and interact with cells, with the aim of shedding light on the reactivity of NMs and toxicity to plants. These points are discussed critically to adjust the balance with regard to the risk to the health of the plants as well as providing some suggestions for new studies on this topic.
- 271Begum, P.; Ikhtiari, R.; Fugetsu, B. Graphene Phytotoxicity in the Seedling Stage of Cabbage, Tomato, Red Spinach, and Lettuce. Carbon 2011, 49, 3907– 3919, DOI: 10.1016/j.carbon.2011.05.029[Crossref], [CAS], Google Scholar271https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3MXotlChur8%253D&md5=01e1aba97e9af8d853793ce41263da0cGraphene phytotoxicity in the seedling stage of cabbage, tomato, red spinach, and lettuceBegum, Parvin; Ikhtiari, Refi; Fugetsu, BunshiCarbon (2011), 49 (12), 3907-3919CODEN: CRBNAH; ISSN:0008-6223. (Elsevier Ltd.)The effects of graphene on root and shoot growth, biomass, shape, cell death, and reactive oxygen species (ROS) of cabbage, tomato, red spinach, and lettuce, were investigated using a concn. range from 500 to 2000 mg/L. The results of the combined morphol. and physiol. analyses indicate that after 20 days of exposure under our exptl. conditions, graphene significantly inhibited plant growth and biomass compared to a control. The no. and size of leaves of the graphene-treated plants were reduced in a dose-dependent manner. Significant effects also were detected showing a concn.-dependent increase in ROS and cell death as well as visible symptoms of necrotic lesions, indicating graphene-induced adverse effects on cabbage, tomato, and red spinach mediated by oxidative stress necrosis. Little or no significant toxic effect was obsd. with lettuce seedlings under the same conditions. The potential effect of graphene largely depends on dose, exposure time, and plant species and deserves further attention.
- 272Candotto Carniel, F.; Gorelli, D.; Flahaut, E.; Fortuna, L.; Del Casino, C.; Cai, G.; Nepi, M.; Prato, M.; Tretiach, M. Graphene Oxide Impairs the Pollen Performance of Nicotiana Tabacum and Corylus Avellana Suggesting Potential Negative Effects on the Sexual Reproduction of Seed Plants. Environ. Sci.: Nano 2018, 5, 1608– 1617, DOI: 10.1039/C8EN00052B[Crossref], [CAS], Google Scholar272https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC1cXhtVGntrjM&md5=258ee7be9036602f9b8194a14d492907Graphene oxide impairs the pollen performance of Nicotiana tabacum and Corylus avellana suggesting potential negative effects on the sexual reproduction of seed plantsCandotto Carniel, Fabio; Gorelli, Davide; Flahaut, Emmanuel; Fortuna, Lorenzo; Del Casino, Cecilia; Cai, Giampiero; Nepi, Massimo; Prato, Maurizio; Tretiach, MauroEnvironmental Science: Nano (2018), 5 (7), 1608-1617CODEN: ESNNA4; ISSN:2051-8161. (Royal Society of Chemistry)The prodn. of graphene based materials (GBMs) is steadily increasing but the effects of the possible release of GBMs in the environment are far from being understood. Graphene oxide (GO) is among the most active GBMs and it causes widely varying effects on the vegetative body of seed plants. However, nothing is known yet about its potential effects on the reproductive process. This study addresses the effects of GO on pollen germination and pollen tube elongation in the model species Nicotiana tabacum and in the non-model species Corylus avellana. In vitro germination expts. were conducted without or with GO (control and treated samples, resp.) at concns. of 25, 50 and 100 μg mL-1. Pollen germination and tube elongation were affected at GO concns. ≥50 μg mL-1, decreasing by 20% and 19% in N. tabacum and by 68% and 58% in C. avellana, resp. GO did not affect the viability of N. tabacum pollen, but doubled the frequency of bent tubes. Microscopy observations of pollen tubes exposed to a cell-permeant, dual-excitation ratiometric pH indicator revealed that GO affected the intracellular pH homeostasis. Further germination expts. on C. avellana conducted by inverting the pH conditions of the control and treated (100 μg GO mL-1) samples demonstrated that the main factor influencing the pollen performance is the acidic properties of GO. This might affect the reproductive process of numerous seed plants thus being relevant from an environmental point of view.
- 273Zhang, W.; Wang, C.; Li, Z.; Lu, Z.; Li, Y.; Yin, J.-J.; Zhou, Y.-T.; Gao, X.; Fang, Y.; Nie, G.; Zhao, Y. Unraveling Stress-Induced Toxicity Properties of Graphene Oxide and the Underlying Mechanism. Adv. Mater. 2012, 24, 5391– 5397, DOI: 10.1002/adma.201202678[Crossref], [PubMed], [CAS], Google Scholar273https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC38Xht1GltbbL&md5=cbb583e05af4c21f2ba877a83fa72285Unraveling Stress-induced Toxicity Properties of Graphene Oxide and the Underlying MechanismZhang, Wendi; Wang, Chi; Li, Zhongjun; Lu, Zhenzhen; Li, Yiye; Yin, Jun-Jie; Zhou, Yu-Ting; Gao, Xingfa; Fang, Ying; Nie, Guangjun; Zhao, YuliangAdvanced Materials (Weinheim, Germany) (2012), 24 (39), 5391-5397CODEN: ADVMEW; ISSN:0935-9648. (Wiley-VCH Verlag GmbH & Co. KGaA)Here, the authors used a simple animal model, Caenorhabditis elegans (C. elegans) to investigate in vivo the toxic profile of graphene oxide (GO) and functionalized GO modified with PEGylated poly-L-lysine (PLL-PEG) (GO/PP) under both normal and stress conditions. With this simple model, the potential in vivo toxicity of nanosheets under stress was studied using juglone or heat for stress. The authors found in the cyt C/H2O2 system, the addn. of GO/PP significantly enhanced the yield of DMPOX and slightly advanced the appearance of DMPOX. Addnl. studies showed DMPOX was formed exclusively in the presence of both cytochrome c (cyto c) and H2O2. DMPO was not oxidized to DMPOX by either GO/PP alone or GO/PP with H2O2, meaning that the cyt c intermediate caused the accumulation of DMPOX and that GO/PP assisted the electron transfer in this pathway. The role of the cyt c/H2O2 system might constitute one of the important pathways for the toxicity mechanism of nanosheets under these or other pathophysiol. conditions.
- 274Jung, S.-K.; Qu, X.; Aleman-Meza, B.; Wang, T.; Riepe, C.; Liu, Z.; Li, Q.; Zhong, W. Multi-Endpoint, High-Throughput Study of Nanomaterial Toxicity in Caenorhabditis Elegans. Environ. Sci. Technol. 2015, 49, 2477– 2485, DOI: 10.1021/es5056462[ACS Full Text
 ], [CAS], Google Scholar274https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2MXhsVCgsbk%253D&md5=388936461e00d7f81dce0e453df8f172Multi-endpoint, High-Throughput Study of Nanomaterial Toxicity in Caenorhabditis elegansJung, Sang-Kyu; Qu, Xiaolei; Aleman-Meza, Boanerges; Wang, Tianxiao; Riepe, Celeste; Liu, Zheng; Li, Qilin; Zhong, WeiweiEnvironmental Science & Technology (2015), 49 (4), 2477-2485CODEN: ESTHAG; ISSN:0013-936X. (American Chemical Society)The booming nanotechnol. industry has raised public concerns about the environmental health and safety impact of engineered nanomaterials (ENMs). High-throughput assays are needed to obtain toxicity data for the rapidly increasing no. of ENMs. Here the authors present a suite of high-throughput methods to study nanotoxicity in intact animals using Caenorhabditis elegans as a model. At the population level, the authors' system measures food consumption of thousands of animals to evaluate population fitness. At the organism level, the authors' automated system analyzes hundreds of individual animals for body length, locomotion speed, and lifespan. To demonstrate the utility of the authors' system, the authors applied this technol. to test the toxicity of 20 nanomaterials at four concns. Only fullerene nanoparticles (nC60), fullerol, TiO2, and CeO2 showed little or no toxicity. Various degrees of toxicity were detected from different forms of carbon nanotubes, graphene, carbon black, Ag, and fumed SiO2 nanoparticles. Aminofullerene and UV-irradiated nC60 also showed small but significant toxicity. The authors further investigated the effects of nanomaterial size, shape, surface chem., and exposure conditions on toxicity. The authors' data are publicly available at the open-access nanotoxicity database ww.QuantWorm.org/nano.
], [CAS], Google Scholar274https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2MXhsVCgsbk%253D&md5=388936461e00d7f81dce0e453df8f172Multi-endpoint, High-Throughput Study of Nanomaterial Toxicity in Caenorhabditis elegansJung, Sang-Kyu; Qu, Xiaolei; Aleman-Meza, Boanerges; Wang, Tianxiao; Riepe, Celeste; Liu, Zheng; Li, Qilin; Zhong, WeiweiEnvironmental Science & Technology (2015), 49 (4), 2477-2485CODEN: ESTHAG; ISSN:0013-936X. (American Chemical Society)The booming nanotechnol. industry has raised public concerns about the environmental health and safety impact of engineered nanomaterials (ENMs). High-throughput assays are needed to obtain toxicity data for the rapidly increasing no. of ENMs. Here the authors present a suite of high-throughput methods to study nanotoxicity in intact animals using Caenorhabditis elegans as a model. At the population level, the authors' system measures food consumption of thousands of animals to evaluate population fitness. At the organism level, the authors' automated system analyzes hundreds of individual animals for body length, locomotion speed, and lifespan. To demonstrate the utility of the authors' system, the authors applied this technol. to test the toxicity of 20 nanomaterials at four concns. Only fullerene nanoparticles (nC60), fullerol, TiO2, and CeO2 showed little or no toxicity. Various degrees of toxicity were detected from different forms of carbon nanotubes, graphene, carbon black, Ag, and fumed SiO2 nanoparticles. Aminofullerene and UV-irradiated nC60 also showed small but significant toxicity. The authors further investigated the effects of nanomaterial size, shape, surface chem., and exposure conditions on toxicity. The authors' data are publicly available at the open-access nanotoxicity database ww.QuantWorm.org/nano. - 275Zhao, Y.; Wu, Q.; Wang, D. An Epigenetic Signal Encoded Protection Mechanism Is Activated by Graphene Oxide to Inhibit Its Induced Reproductive Toxicity in Caenorhabditis Elegans. Biomaterials 2016, 79, 15– 24, DOI: 10.1016/j.biomaterials.2015.11.052
- 276Yang, R.; Ren, M.; Rui, Q.; Wang, D. A Mir-231-Regulated Protection Mechanism against the Toxicity of Graphene Oxide in Nematode Caenorhabditis Elegans. Sci. Rep. 2016, 6, 32214, DOI: 10.1038/srep32214[Crossref], [PubMed], [CAS], Google Scholar276https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC28XhsVWmsLvL&md5=46fa7e74be417569088d1b8b34c0e0bfA mir-231-Regulated Protection Mechanism against the Toxicity of Graphene Oxide in Nematode Caenorhabditis elegansYang, Ruilong; Ren, Mingxia; Rui, Qi; Wang, DayongScientific Reports (2016), 6 (), 32214CODEN: SRCEC3; ISSN:2045-2322. (Nature Publishing Group)Recently, several dysregulated microRNAs (miRNAs) have been identified in organisms exposed to graphene oxide (GO). However, their biol. functions and mechanisms of the action are still largely unknown. Here, we investigated the mol. mechanism of mir-231 in the regulation of GO toxicity using in vivo assay system of Caenorhabditis elegans. We found that GO exposure inhibited the expression of mir-231::GFP in multiple tissues, in particular in the intestine. mir-231 acted in intestine to regulate the GO toxicity, and overexpression of mir-231 in intestine caused a susceptible property of nematodes to GO toxicity. smk-1 encoding a homolog to mammalian SMEK functioned as a targeted gene for mir-231, and was also involved in the intestinal regulation of GO toxicity. Mutation of smk-1 gene induced a susceptible property to GO toxicity, whereas the intestinal overexpression of smk-1 resulted in a resistant property to GO toxicity. Moreover, mutation of smk-1 gene suppressed the resistant property of mir-231 mutant to GO toxicity. In nematodes, SMK-1 further acted upstream of the transcriptional factor DAF-16/FOXO in insulin signaling pathway to regulate GO toxicity. Therefore, mir-231 may encode a GO-responsive protection mechanism against the GO toxicity by suppressing the function of the SMK-1 - DAF-16 signaling cascade in nematodes.
- 277Ren, M.; Zhao, L.; Lv, X.; Wang, D. Antimicrobial Proteins in the Response to Graphene Oxide in Caenorhabditis Elegans. Nanotoxicology 2017, 11, 578– 590, DOI: 10.1080/17435390.2017.1329954[Crossref], [PubMed], [CAS], Google Scholar277https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2sXosVahsL8%253D&md5=21918060a5d7c0c64ed030619cc5707dAntimicrobial proteins in the response to graphene oxide in Caenorhabditis elegansRen, Mingxia; Zhao, Li; Lv, Xiao; Wang, DayongNanotoxicology (2017), 11 (4), 578-590CODEN: NANOGK; ISSN:1743-5404. (Taylor & Francis Ltd.)Upon exposure to environmental engineered nanomaterials (ENMs), animals will activate certain response signals to protect themselves from the toxic effects. However, the underlying mol. mechanisms for this response are still largely unclear. Using in vivo assay system of Caenorhabditis elegans, we here found that antimicrobial proteins of LYS-1, LYS-8, SPP-1, DOD-6, and F55G11.4 were activated by graphene oxide (GO) exposure. These antimicrobial proteins functioned as mol. targets of transcriptional factor DAF-16 in insulin signaling pathway, and acted in intestine to regulate the response to GO. Among these antimicrobial proteins, DOD-6, F55G11.4, and SPP-1 participated in the formation of signaling cascade of DAF-16-DOD-6-SOD-3-F55G11.4/SPP-1 in response to GO exposure by activating the antioxidn. system. Different from this, LYS-1 and LYS-8, two lysozymes, mediated TUB-2 signaling and DAF-8-DAF-5 signaling cascade, resp., to regulate the response to GO exposure. During the regulation of response to GO exposure, LYS-1 and LYS-8 acted synergistically, which could be largely explained by the obsd. synergistic interaction between TUB-2 and DAF-8. Therefore, our results demonstrate the crucial protection role of antimicrobial proteins for animals in response to environmental ENMs' exposure. The elucidated different signaling cascades mediated by antimicrobial proteins provide important mol. targets for future toxicity assessment and chem. modification of GO.
- 278Zanni, E.; De Bellis, G.; Bracciale, M. P.; Broggi, A.; Santarelli, M. L.; Sarto, M. S.; Palleschi, C.; Uccelletti, D. Graphite Nanoplatelets and Caenorhabditis Elegans : Insights from an in Vivo Model. Nano Lett. 2012, 12, 2740– 2744, DOI: 10.1021/nl204388p[ACS Full Text
 ], [CAS], Google Scholar278https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC38XntlOhu7s%253D&md5=a139e0455282de8b09f0789f1a488cbdGraphite Nanoplatelets and Caenorhabditis elegans: Insights from an in Vivo ModelZanni, Elena; De Bellis, Giovanni; Bracciale, Maria P.; Broggi, Alessandra; Santarelli, Maria L.; Sarto, Maria S.; Palleschi, Claudio; Uccelletti, DanielaNano Letters (2012), 12 (6), 2740-2744CODEN: NALEFD; ISSN:1530-6984. (American Chemical Society)We evaluated the toxicity of graphite nanoplatelets (GNPs) in the model organism Caenorhabditis elegans. The GNPs resulted nontoxic by measuring longevity as well as reproductive capability end points. An imaging technique based on Fourier transform IR spectroscopy (FT-IR) mapping was also developed to analyze the GNPs spatial distribution inside the nematodes. Conflicting reports on the in vitro antimicrobial properties of graphene-based nanomaterials prompted us to challenge the host-pathogen system C. elegans-Pseudomonas aeruginosa to assess these findings through an in vivo model.
], [CAS], Google Scholar278https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC38XntlOhu7s%253D&md5=a139e0455282de8b09f0789f1a488cbdGraphite Nanoplatelets and Caenorhabditis elegans: Insights from an in Vivo ModelZanni, Elena; De Bellis, Giovanni; Bracciale, Maria P.; Broggi, Alessandra; Santarelli, Maria L.; Sarto, Maria S.; Palleschi, Claudio; Uccelletti, DanielaNano Letters (2012), 12 (6), 2740-2744CODEN: NALEFD; ISSN:1530-6984. (American Chemical Society)We evaluated the toxicity of graphite nanoplatelets (GNPs) in the model organism Caenorhabditis elegans. The GNPs resulted nontoxic by measuring longevity as well as reproductive capability end points. An imaging technique based on Fourier transform IR spectroscopy (FT-IR) mapping was also developed to analyze the GNPs spatial distribution inside the nematodes. Conflicting reports on the in vitro antimicrobial properties of graphene-based nanomaterials prompted us to challenge the host-pathogen system C. elegans-Pseudomonas aeruginosa to assess these findings through an in vivo model. - 279Dziewięcka, M.; Karpeta-Kaczmarek, J.; Augustyniak, M.; Majchrzycki, Ł.; Augustyniak-Jabłokow, M. A. Evaluation of in Vivo Graphene Oxide Toxicity for Acheta Domesticus in Relation to Nanomaterial Purity and Time Passed from the Exposure. J. Hazard. Mater. 2016, 305, 30– 40, DOI: 10.1016/j.jhazmat.2015.11.021[Crossref], [PubMed], [CAS], Google Scholar279https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2MXhvFWktLrJ&md5=adda3ee3eaa8dc433bb4d19be14368bdEvaluation of in vivo graphene oxide toxicity for Acheta domesticus in relation to nanomaterial purity and time passed from the exposureDziewiecka, Marta; Karpeta-Kaczmarek, Julia; Augustyniak, Maria; Majchrzycki, Lukasz; Augustyniak-Jablokow, Maria A.Journal of Hazardous Materials (2016), 305 (), 30-40CODEN: JHMAD9; ISSN:0304-3894. (Elsevier B.V.)Graphene and its oxidized form-graphene oxide (GO) have become exceptionally popular in industry and medicine due to their unique properties. However, there are suspicions that GO can cause adverse effects. Therefore, comprehensive knowledge on its potential toxicity is essential. This research assesses the in vivo toxicity of pure and Mn-contg. GO, which were injected into the hemolymph of Acheta domesticus. The activity of catalase (CAT) and glutathione peroxidases (GSTPx) as well as heat shock protein (HSP 70) and total antioxidant capacity (TAC) levels were measured at consecutive time points 1, 24, 48 and 72 h after injection. Neither pure GO nor GO contg. Mn were neutral to the organism. The results proved the intensification of oxidative stress after GO injection, which was confirmed by increased enzyme activity. The organism seems to cope with this stress, esp. in the 1st 24 h after injection. In the following days, increasing HSP 70 levels were obsd., which might suggest the synthesis of new proteins and the removal of old and damaged ones. With that in mind, the potential toxicity of the studied material, which could lead to serious and permanent damage to the organism, should still be taken into consideration.
- 280Pretti, C.; Oliva, M.; Pietro, R. Di; Monni, G.; Cevasco, G.; Chiellini, F.; Pomelli, C.; Chiappe, C. Ecotoxicity of Pristine Graphene to Marine Organisms. Ecotoxicol. Environ. Saf. 2014, 101, 138– 145, DOI: 10.1016/j.ecoenv.2013.11.008[Crossref], [PubMed], [CAS], Google Scholar280https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2cXitV2isLw%253D&md5=00902f967ebd259aa4cdf4419cd7a5a6Ecotoxicity of pristine graphene to marine organismsPretti, Carlo; Oliva, Matteo; Di Pietro, Roberta; Monni, Gianfranca; Cevasco, Giorgio; Chiellini, Federica; Pomelli, Christian; Chiappe, CinziaEcotoxicology and Environmental Safety (2014), 101 (), 138-145CODEN: EESADV; ISSN:0147-6513. (Elsevier B.V.)The ecotoxicity of pristine graphene nanoparticles (GNC1, PGMF) in model marine organisms was investigated. PGMF resulted more toxic than GNC1 to the bioluminescent bacterium Vibrio fischeri and the unicellular alga Dunaliella tertiolecta on the basis of EC50 values (end-points: inhibition of bioluminescence and growth, resp.). No acute toxicity was demonstrated with respect to the crustacean Artemia salina although light microscope images showed the presence of PGMF and GNC1 aggregates into the gut; a 48-h exposure expt. revealed an altered pattern of oxidative stress biomarkers, resulting in a significant increase of catalase activities in both PGMF and GNC1 1 mg/L treated A. salina and a significant increase of glutathione peroxidase activities in PGMF (0.1 and 1 mg/L) treated A. salina. Increased levels of lipid peroxidn. of membranes was also obsd. in PGMF 1 mg/L exposed A. salina.
- 281Guo, X.; Dong, S.; Petersen, E. J.; Gao, S.; Huang, Q.; Mao, L. Biological Uptake and Depuration of Radio-Labeled Graphene by Daphnia Magna. Environ. Sci. Technol. 2013, 47, 12524– 12531, DOI: 10.1021/es403230u[ACS Full Text
 ], [CAS], Google Scholar281https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3sXhsFOks7zF&md5=fd543c0638766968697113101f744dd8Biological uptake and depuration of radio-labeled graphene by daphnia magnaGuo, Xiangke; Dong, Shipeng; Petersen, Elijah J.; Gao, Shixiang; Huang, Qingguo; Mao, LiangEnvironmental Science & Technology (2013), 47 (21), 12524-12531CODEN: ESTHAG; ISSN:0013-936X. (American Chemical Society)Graphene layers are potential candidates in a large no. of applications. However, little is known about their ecotoxicol. risks largely as a result of a lack of quantification techniques in complex environmental matrixes. In this study, graphene was synthesized by means of graphitization and exfoliation of sandwich-like FePO4/dodecylamine hybrid nanosheets, and 14C was incorporated in the synthesis. 14C-labeled graphene was spiked to artificial freshwater and the uptake and depuration of graphene by Daphnia magna were assessed. After exposure for 24 h to a 250 μg/L soln. of graphene, the graphene concn. in the organism was nearly 1% of the organism dry mass. These organisms excreted the graphene to clean artificial freshwater and achieved roughly const. body burdens after 24 h depuration periods regardless of the initial graphene exposure concn. Addn. of algae and humic acid to water during the depuration period resulted in release of a significant fraction (>90%) of the accumulated graphene, but some still remained in the organism. Accumulated graphene in adult Daphnia was likely transferred to the neonates. The uptake and elimination results provided here support the environmental risk assessment of graphene and the graphene quantification method is a powerful tool for addnl. studies.
], [CAS], Google Scholar281https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3sXhsFOks7zF&md5=fd543c0638766968697113101f744dd8Biological uptake and depuration of radio-labeled graphene by daphnia magnaGuo, Xiangke; Dong, Shipeng; Petersen, Elijah J.; Gao, Shixiang; Huang, Qingguo; Mao, LiangEnvironmental Science & Technology (2013), 47 (21), 12524-12531CODEN: ESTHAG; ISSN:0013-936X. (American Chemical Society)Graphene layers are potential candidates in a large no. of applications. However, little is known about their ecotoxicol. risks largely as a result of a lack of quantification techniques in complex environmental matrixes. In this study, graphene was synthesized by means of graphitization and exfoliation of sandwich-like FePO4/dodecylamine hybrid nanosheets, and 14C was incorporated in the synthesis. 14C-labeled graphene was spiked to artificial freshwater and the uptake and depuration of graphene by Daphnia magna were assessed. After exposure for 24 h to a 250 μg/L soln. of graphene, the graphene concn. in the organism was nearly 1% of the organism dry mass. These organisms excreted the graphene to clean artificial freshwater and achieved roughly const. body burdens after 24 h depuration periods regardless of the initial graphene exposure concn. Addn. of algae and humic acid to water during the depuration period resulted in release of a significant fraction (>90%) of the accumulated graphene, but some still remained in the organism. Accumulated graphene in adult Daphnia was likely transferred to the neonates. The uptake and elimination results provided here support the environmental risk assessment of graphene and the graphene quantification method is a powerful tool for addnl. studies. - 282Souza, J. P.; Venturini, F. P.; Santos, F.; Zucolotto, V. Chronic Toxicity in Ceriodaphnia Dubia Induced by Graphene Oxide. Chemosphere 2018, 190, 218– 224, DOI: 10.1016/j.chemosphere.2017.10.018[Crossref], [PubMed], [CAS], Google Scholar282https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2sXhs1aktLnE&md5=a26fe6addedb2abf71c2f6ed4b9eee80Chronic toxicity in Ceriodaphnia dubia induced by graphene oxideSouza, Jaqueline P.; Venturini, Francine P.; Santos, Fabricio; Zucolotto, ValtencirChemosphere (2018), 190 (), 218-224CODEN: CMSHAF; ISSN:0045-6535. (Elsevier Ltd.)The unique physico-chem. properties of nanomaterials have allowed their application in different areas including electronics, energy storage, nanomedicine, environmental remediation and biotechnol. Graphene and its derivs., in particular, have been com. available, with prediction for increasing their prodn. in the next years, in a way that their release into aquatic environments is very likely to occur, and the impacts of such situation on organisms are still not completely understood. In this context, we evaluated graphene oxide (GO) effects on the freshwater cladoceran Ceriodaphnia dubia through acute and chronic toxicity, feeding rates, and reactive oxygen species (ROS) generation. The mean effective concn. (EC50) estd. during acute exposure was 1.25 mg L-1 of GO. The chronic exposure resulted in significant decrease in the no. of neonates. The feeding rates were also decreased by GO exposure. Sub-lethal concns. of GO caused an increase in ROS generation in the organisms. Our results indicated that GO cause acute and chronic effects to C. dubia. In the presence of GO there was a shift in the available energy for self-maintenance rather than feeding or reprodn. activities. This study provides useful information on GO concns. that might impair the aquatic biota, and supports regulatory efforts concerning the environmental safety of this product.
- 283De Marchi, L.; Neto, V.; Pretti, C.; Figueira, E.; Brambilla, L.; Rodriguez-Douton, M. J.; Rossella, F.; Tommasini, M.; Furtado, C.; Soares, A. M. V. M.; Freitas, R. Physiological and Biochemical Impacts of Graphene Oxide in Polychaetes: The Case of Diopatra Neapolitana. Comp. Biochem. Physiol., Part C: Toxicol. Pharmacol. 2017, 193, 50– 60, DOI: 10.1016/j.cbpc.2017.01.005[Crossref], [PubMed], [CAS], Google Scholar283https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2sXhvF2is74%253D&md5=77df10be735c1b176d7fcc5442cd8cecPhysiological and biochemical impacts of graphene oxide in polychaetes: The case of Diopatra neapolitanaDe Marchi, Lucia; Neto, Victor; Pretti, Carlo; Figueira, Etelvina; Brambilla, Luigi; Rodriguez-Douton, Maria Jesus; Rossella, Francesco; Tommasini, Matteo; Furtado, Clascidia; Soares, Amadeu M. V. M.; Freitas, RosaComparative Biochemistry and Physiology, Part C: Toxicology & Pharmacology (2017), 193 (), 50-60CODEN: CBPPFK; ISSN:1532-0456. (Elsevier)Graphene oxide (GO) is an important carbon nanomaterial (NM) that has been used, but limited literature is available regarding the impacts induced in aquatic organisms by this pollutant and, in particular in invertebrate species. The polychaete Diopatra neapolitana has frequently been used to evaluate the effects of environmental disturbances in estuarine systems due to its ecol. and socio-economic importance but to our knowledge no information is available on D. neapolitana physiol. and biochem. alterations due to GO exposure. Thus, the present study aimed to assess the toxic effects of different concns. of GO (0.01; 0.10 and 1.00 mg/L) in D. neapolitana physiol. (regenerative capacity) and biochem. (energy reserves, metabolic activity and oxidative stress related biomarkers) performance, after 28 days of exposure. The results obtained revealed that the exposure to GO induced neg. effects on the regenerative capacity of D. neapolitana, with organisms exposed to higher concns. regenerating less segments and taking longer periods to completely regenerate. GO also seemed to alter energy-related responses, esp. glycogen content, with higher values in polychaetes exposed to GO which may result from a decreased metab. (measured by electron transport system activity), when exposed to GO. Furthermore, under GO contamination D. neapolitana presented cellular damage, despite higher activities of antioxidant and biotransformation enzymes in individuals exposed to GO.
- 284Zhang, P.; Selck, H.; Tangaa, S. R.; Pang, C.; Zhao, B. Bioaccumulation and Effects of Sediment-Associated Gold- and Graphene Oxide Nanoparticles on Tubifex Tubifex. J. Environ. Sci. 2017, 51, 138– 145, DOI: 10.1016/j.jes.2016.08.015
- 285Hu, C.; Wang, Q.; Zhao, H.; Wang, L.; Guo, S.; Li, X. Ecotoxicological Effects of Graphene Oxide on the Protozoan Euglena Gracilis. Chemosphere 2015, 128, 184– 190, DOI: 10.1016/j.chemosphere.2015.01.040[Crossref], [PubMed], [CAS], Google Scholar285https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2MXisFCju7c%253D&md5=7dfec61a766c7d9668eaab3ec67e74b9Ecotoxicological effects of graphene oxide on the protozoan Euglena gracilisHu, Changwei; Wang, Qing; Zhao, Haitao; Wang, Lizhi; Guo, Shaofen; Li, XiulingChemosphere (2015), 128 (), 184-190CODEN: CMSHAF; ISSN:0045-6535. (Elsevier Ltd.)Potential environmental risks posed by nanomaterials increase with their extensive prodn. and application. As a newly emerging carbon material, graphene oxide (GO) exhibits excellent electrochem. properties and has promising applications in many areas. However, the ecotoxicity of GO to organisms, esp. aquatic organisms, remains poorly understood. Accordingly, this study examd. the toxicity of GO with protozoa Euglena gracilis as test organism. Growth inhibition test was initially performed to investigate acute toxic effects. Protozoa were subsequently exposed to GO ranging from 0.5 mg L-1 to 5 mg L-1 for 10 d. The growth, photosynthetic pigment content, activities of antioxidant enzymes, ultrastructure of the protozoa, as well as the shading effect of GO, were analyzed to det. the mechanism of the toxicity effect. Results showed that the 96 h EC50 value of GO in E. gracilis was 3.76 ± 0.74 mg L-1. GO at a concn. of 2.5 mg L-1 exerted significant (P < 0.01) adverse effects on the organism. These effects were evidenced by the inhibition of growth and the enhancement of malondialdehyde content and antioxidant enzyme activities. Shading effect and oxidative stress may be responsible for GO toxicity.
- 286Mesarič, T.; Sepčič, K.; Piazza, V.; Gambardella, C.; Garaventa, F.; Drobne, D.; Faimali, M. Effects of Nano Carbon Black and Single-Layer Graphene Oxide on Settlement, Survival and Swimming Behaviour of Amphibalanus Amphitrite Larvae. Chem. Ecol. 2013, 29, 643– 652, DOI: 10.1080/02757540.2013.817563[Crossref], [CAS], Google Scholar286https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3sXhtFelt7jM&md5=a90d9fb7da3c7ec15c32a0ee0bfba1d3Effects of nano carbon black and single-layer graphene oxide on settlement, survival and swimming behaviour of Amphibalanus amphitrite larvaeMesaric, Tina; Sepcic, Kristina; Piazza, Veronica; Gambardella, Chiara; Garaventa, Francesca; Drobne, Damjana; Faimali, MarcoChemistry and Ecology (2013), 29 (7), 643-652CODEN: CHECDY; ISSN:0275-7540. (Taylor & Francis Ltd.)The effects of two carbon-based nanomaterials, nano-sized carbon black (nCB), and single-layer graphene oxide (GO) on settlement of Amphibalanus amphitrite (Cirripedia, Crustacea) cypris larvae (cyprids) were assessed after 24, 48, and 72 h of exposure. Addnl., the effects of these nanomaterials on the mortality and swimming behavior of the nauplius larvae (nauplii) of the same organism were detd. after 24 and 48 h. The data indicate that nCB is more effective as a potential antisettlement agent than single-layer GO; moreover, nCB did not show any adverse effects on the larvae. The swimming behavior of II stage nauplii of A. amphitrite exposed to a suspension of nCB was inhibited only at very high nCB concns. (≥0.5 mg/mL). Single-layer GO, on the contrary, showed lower antisettlement effects and was more active in altering the survival and inhibiting the swimming behavior of the nauplii. An indication of the toxic or non-toxic mechanisms of the antisettlement properties of both of these nanomaterials is provided by the reversibility of the antisettlement activity. In conclusion, we propose nCB as an innovative antifouling nanomaterial that shows low toxicity towards the model organism (crustaceans) used in this study.
- 287Grillo, R.; Rosa, A. H.; Fraceto, L. F. Engineered Nanoparticles and Organic Matter: A Review of the State-of-the-Art. Chemosphere 2015, 119, 608– 619, DOI: 10.1016/j.chemosphere.2014.07.049[Crossref], [PubMed], [CAS], Google Scholar287https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2cXhtlKmur7N&md5=00d72651e7e12319408856a3b1313420Engineered nanoparticles and organic matter: A review of the state-of-the-artGrillo, Renato; Rosa, Andre H.; Fraceto, Leonardo F.Chemosphere (2015), 119 (), 608-619CODEN: CMSHAF; ISSN:0045-6535. (Elsevier Ltd.)A review. Growth in the development and prodn. of engineered nanoparticles (ENPs) in recent years has increased the potential for interactions of these nanomaterials with aquatic and terrestrial environments. Carefully designed studies are therefore required in order to understand the fate, transport, stability, and toxicity of nanoparticles. Natural org. matter (NOM), such as the humic substances found in water, sediment, and soil, is one of the substances capable of interacting with ENPs. This review presents the findings of studies of the interaction of ENPs and NOM, and the possible effects on nanoparticle stability and the toxicity of these materials in the environment. In addn., ENPs and NOM are utilized for many different purposes, including the removal of metals and org. compds. from effluents, and the development of new electronic sensors and other devices for the detection of active substances. Discussion is therefore provided of some of the ways in which NOM can be used in the prodn. of nanoparticles. Although there has been an increase in the no. of studies in this area, further progress is needed to improve understanding of the dynamic interactions between ENPs and NOM.
- 288Castro, V. L.; Clemente, Z.; Jonsson, C.; Silva, M.; Vallim, J. H.; de Medeiros, A. M. Z.; Martinez, D. S. T. Nanoecotoxicity Assessment of Graphene Oxide and Its Relationship with Humic Acid. Environ. Toxicol. Chem. 2018, 37, 1998– 2012, DOI: 10.1002/etc.4145
- 289Maes, H. M.; Stibany, F.; Giefers, S.; Daniels, B.; Deutschmann, B.; Baumgartner, W.; Schäffer, A. Accumulation and Distribution of Multiwalled Carbon Nanotubes in Zebrafish (Danio Rerio). Environ. Sci. Technol. 2014, 48, 12256– 12264, DOI: 10.1021/es503006v
- 290Liu, X. T.; Mu, X. Y.; Wu, X. L.; Meng, L. X.; Guan, W. B.; Ma, Y. Q.; Sun, H.; Wang, C. J.; Li, X. F. Toxicity of Multi-Walled Carbon Nanotubes, Graphene Oxide, and Reduced Graphene Oxide to Zebrafish Embryos. Biomed. Environ. Sci. 2014, 27, 676– 683, DOI: 10.3967/bes2014.103
- 291Chen, L.; Hu, P.; Zhang, L.; Huang, S.; Luo, L.; Huang, C. Toxicity of Graphene Oxide and Multi-Walled Carbon Nanotubes against Human Cells and Zebrafish. Sci. China: Chem. 2012, 55, 2209– 2216, DOI: 10.1007/s11426-012-4620-z[Crossref], [CAS], Google Scholar291https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC38XhsVCgtLrN&md5=bb9b76afef0af3c4dd70b26906ba88e3Toxicity of graphene oxide and multi-walled carbon nanotubes against human cells and zebrafishChen, Li Qiang; Hu, Ping Ping; Zhang, Li; Huang, Si Zhou; Luo, Ling Fei; Huang, Cheng ZhiScience China: Chemistry (2012), 55 (10), 2209-2216CODEN: SCCCCS; ISSN:1869-1870. (Science China Press)Graphene possesses unique phys. and chem. properties, which have inspired a wide range of potential biomedical applications. However, little is known about the adverse effects of graphene on the human body and ecol. environment. The purpose of our work is to make assessment on the toxicity of graphene oxide (GO) against human cell line (human bone marrow neuroblastoma cell line and human epithelial carcinoma cell line) and zebrafish (Danio rerio) by comparing the toxic effects of GO with its sister, multi-walled carbon nanotubes (MWNTs). The results show that GO has a moderate toxicity to organisms since it can induce minor (about 20%) cell growth inhibition and slight hatching delay of zebrafish embryos at a dosage of 50 mg/L, but did not result in significant increase of apoptosis in embryo, while MWNTs exhibit acute toxicity leading to a strong inhibition of cell proliferation and serious morphol. defects in developing embryos even at relatively low concn. of 25 mg/L. The distinctive toxicity of GO and MWNTs should be ascribed to the different models of interaction between nanomaterials and organisms, which arises from the different geometric structures of nanomaterials. Collectively, our work suggests that GO does actual toxicity to organisms posing potential environmental risks and the result is also shedding light on the geometrical structure-dependent toxicity of graphitic nanomaterials.
- 292Souza, J. P.; Baretta, J. F.; Santos, F.; Paino, I. M. M.; Zucolotto, V. Toxicological Effects of Graphene Oxide on Adult Zebrafish (Danio Rerio). Aquat. Toxicol. 2017, 186, 11– 18, DOI: 10.1016/j.aquatox.2017.02.017[Crossref], [PubMed], [CAS], Google Scholar292https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2sXjsVKhsLc%253D&md5=8e5234e2751cf6425cb2c274018e16baToxicological effects of graphene oxide on adult zebrafish (Danio rerio)Souza, Jaqueline P.; Baretta, Jessica F.; Santos, Fabricio; Paino, Ieda M. M.; Zucolotto, ValtencirAquatic Toxicology (2017), 186 (), 11-18CODEN: AQTODG; ISSN:0166-445X. (Elsevier B.V.)Graphene exhibits unique phys. and chem. properties that facilitate its application in many fields, including electronics and biomedical areas. However, the use of graphene and its derivs. could result in accumulation in aquatic environments, and the risks posed by these compds. for organisms are not completely understood. In this study, we investigated the effects of graphene oxide (GO) on adult zebrafish (Danio rerio). Exptl. fish were exposed to 2, 10 or 20 mg L-1 GO, and the cytotoxicity, genotoxicity and oxidative stress were assessed. The morphol. of the gills and liver tissues was also analyzed. Graphene oxide exposure led to an increase in the no. of gill cells that were in early apoptotic and necrotic stages, but genotoxicity was not obsd. in blood cells. We also obsd. the generation of Reactive Oxygen Species (ROS) in gill cells. Structural anal. revealed injuries to gill tissues, including a dilated marginal channel, lamellar fusion, clubbed tips, swollen mucocytes, epithelial lifting, aneurysms, and necrosis. Liver tissues also presented lesions such as peripherally located nuclei. Furthermore, hepatocytes exhibited a non-uniform shape, picnotic nuclei, vacuole formation, cell rupture, and necrosis. Our results showed that sub-LDs of graphene oxide could be harmful to fish species and thus represent risks for the aquatic food chain.
- 293Zhang, X.; Zhou, Q.; Zou, W.; Hu, X. Molecular Mechanisms of Developmental Toxicity Induced by Graphene Oxide at Predicted Environmental Concentrations. Environ. Sci. Technol. 2017, 51, 7861– 7871, DOI: 10.1021/acs.est.7b01922[ACS Full Text
 ], [CAS], Google Scholar293https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2sXpvFOms74%253D&md5=ee7aeaccf2c5d85622b8daa87d7649eeMolecular Mechanisms of Developmental Toxicity Induced by Graphene Oxide at Predicted Environmental ConcentrationsZhang, Xingli; Zhou, Qixing; Zou, Wei; Hu, XiangangEnvironmental Science & Technology (2017), 51 (14), 7861-7871CODEN: ESTHAG; ISSN:0013-936X. (American Chemical Society)Developmental toxicity is a crit. issue in nanotoxicity. However, very little is known about the effects of graphene oxide (GO, a widely used carbon material) at predicted environmental concns. on biol. development or the specific mol. mechanisms. The present study established that the development of zebrafish embryos exposed to trace concns. (1-100 μg/L) of GO was impaired because of DNA modification, protein carbonylation and excessive generation of reactive oxygen species (ROS), esp. the superoxide radical. Noticeably, there was a non-monotonic response of zebrafish developmental toxicity to GO at μg/L to mg/L levels. Transcriptomics anal. revealed that disturbing collagen- and matrix metalloproteinase (MMP)-related genes affected the skeletal and cardiac development of zebrafish. Moreover, metabolomics anal. showed that the inhibition of amino acid metab. and the ratios of unsatd. fatty acids (UFAs) to satd. fatty acids (SFAs) contributed to the above developmental toxicity. The present work verifies the developmental toxicity of GO at trace concns. and illustrates for the first time the specific mol. mechanisms thereof. Because of the potential developmental toxicity of GO at trace concns., government administrators and nanomaterial producers should consider its potential risks prior to the widespread environmental exposure to GO.
], [CAS], Google Scholar293https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2sXpvFOms74%253D&md5=ee7aeaccf2c5d85622b8daa87d7649eeMolecular Mechanisms of Developmental Toxicity Induced by Graphene Oxide at Predicted Environmental ConcentrationsZhang, Xingli; Zhou, Qixing; Zou, Wei; Hu, XiangangEnvironmental Science & Technology (2017), 51 (14), 7861-7871CODEN: ESTHAG; ISSN:0013-936X. (American Chemical Society)Developmental toxicity is a crit. issue in nanotoxicity. However, very little is known about the effects of graphene oxide (GO, a widely used carbon material) at predicted environmental concns. on biol. development or the specific mol. mechanisms. The present study established that the development of zebrafish embryos exposed to trace concns. (1-100 μg/L) of GO was impaired because of DNA modification, protein carbonylation and excessive generation of reactive oxygen species (ROS), esp. the superoxide radical. Noticeably, there was a non-monotonic response of zebrafish developmental toxicity to GO at μg/L to mg/L levels. Transcriptomics anal. revealed that disturbing collagen- and matrix metalloproteinase (MMP)-related genes affected the skeletal and cardiac development of zebrafish. Moreover, metabolomics anal. showed that the inhibition of amino acid metab. and the ratios of unsatd. fatty acids (UFAs) to satd. fatty acids (SFAs) contributed to the above developmental toxicity. The present work verifies the developmental toxicity of GO at trace concns. and illustrates for the first time the specific mol. mechanisms thereof. Because of the potential developmental toxicity of GO at trace concns., government administrators and nanomaterial producers should consider its potential risks prior to the widespread environmental exposure to GO. - 294Mouchet, F.; Landois, P.; Flahaut, E.; Pinelli, E.; Gauthier, L. Assessment of the Potential in Vivo Ecotoxicity of Double-Walled Carbon Nanotubes (DWNTs) in Water, Using the Amphibian Ambystoma Mexicanum. Nanotoxicology 2007, 1, 149– 156, DOI: 10.1080/17435390701556080
- 295Mouchet, F.; Landois, P.; Sarremejean, E.; Bernard, G.; Puech, P.; Pinelli, E.; Flahaut, E.; Gauthier, L. Characterisation and in Vivo Ecotoxicity Evaluation of Double-Wall Carbon Nanotubes in Larvae of the Amphibian Xenopus Laevis. Aquat. Toxicol. 2008, 87, 127– 137, DOI: 10.1016/j.aquatox.2008.01.011[Crossref], [PubMed], [CAS], Google Scholar295https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BD1cXktlejs7g%253D&md5=6a875275b5226bc710e965de7b30b67bCharacterisation and in vivo ecotoxicity evaluation of double-wall carbon nanotubes in larvae of the amphibian Xenopus laevisMouchet, Florence; Landois, Perine; Sarremejean, Elodie; Bernard, Guillaume; Puech, Pascal; Pinelli, Eric; Flahaut, Emmanuel; Gauthier, LauryAquatic Toxicology (2008), 87 (2), 127-137CODEN: AQTODG; ISSN:0166-445X. (Elsevier B.V.)Because of their outstanding properties, carbon nanotubes (CNTs) are being assessed for inclusion in many manufd. products. Due to their massive prodn. and growing no. of potential applications, the impact of CNTs on the environment must be taken into consideration. The present investigation evaluates the ecotoxicol. potential of double-walled carbon nanotubes (DWNTs) in the amphibian larvae Xenopus laevis at a large range of concns. in water (from 10 to 500 mg L-1). Acute toxicity and genotoxicity were analyzed after 12 days of static exposure in lab. conditions. Acute toxicity was evaluated according to the mortality and the growth of larvae. The genotoxic effects were analyzed by scoring the micronucleated erythrocytes of the circulating blood of larvae according to the International Std. micronucleus assay. Moreover, histol. prepns. of larval intestine were prepd. after 12 days of exposure for observation using optical and transmission electron microscopy (TEM). Finally, the intestine of an exposed larva was prepd. on a slide for analyze by Raman imaging. The results showed no genotoxicity in erythrocytes of larvae exposed to DWNTs in water, but acute toxicity at every concn. of DWNTs studied which was related to phys. blockage of the gills and/or digestive tract. Indeed, black masses suggesting the presence of CNTs were obsd. inside the intestine using optical microscopy and TEM, and confirmed by Raman spectroscopy anal. Assessing the risks of CNTs requires better understanding, esp. including mechanistic and environmental investigations.
- 296Mouchet, F.; Landois, P.; Puech, P.; Pinelli, E.; Flahaut, E.; Gauthier, L. Carbon Nanotube Ecotoxicity in Amphibians: Assessment of Multiwalled Carbon Nanotubes and Comparison with Double-Walled Carbon Nanotubes. Nanomedicine 2010, 5, 963– 974, DOI: 10.2217/nnm.10.60
- 297Muzi, L.; Mouchet, F.; Cadarsi, S.; Janowska, I.; Russier, J.; Ménard-Moyon, C.; Risuleo, G.; Soula, B.; Galibert, A.-M.; Flahaut, E.; Pinelli, E.; Gauthier, L.; Bianco, A. Examining the Impact of Multi-Layer Graphene Using Cellular and Amphibian Models. 2D Mater. 2016, 3, 025009, DOI: 10.1088/2053-1583/3/2/025009[Crossref], [CAS], Google Scholar297https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC28XitVCmt73I&md5=84a2ec4bf3863208d1a18db8489492c6Examining the impact of multi-layer graphene using cellular and amphibian modelsMuzi, Laura; Mouchet, Florence; Cadarsi, Stephanie; Janowska, Izabela; Russier, Julie; Menard-Moyon, Cecilia; Risuleo, Gianfranco; Soula, Brigitte; Galibert, Anne-Marie; Flahaut, Emmanuel; Pinelli, Eric; Gauthier, Laury; Bianco, Alberto2D Materials (2016), 3 (2), 025009/1-025009/10CODEN: DMATB7; ISSN:2053-1583. (IOP Publishing Ltd.)In the last few years, graphene has been defined as the revolutionary material showing an incredible expansion in industrial applications. Different graphene forms have been applied in several contexts, spreading from energy technologies and electronics to food and agriculture technologies. Graphene showed promises also in the biomedical field. Hopeful results have been already obtained in diagnostic, drug delivery, tissue regeneration and photothermal cancer ablation. In view of the enormous development of graphene-based technologies, a careful assessment of its impact on health and environment is demanded. It is evident how investigating the graphene toxicity is of fundamental importance in the context of medical purposes. On the other hand, the nanomaterial present in the environment, likely to be generated all along the industrial life-cycle, may have harmful effects on living organisms. In the present work, an important contribution on the impact of multi-layer graphene (MLG) on health and environment is given by using a multifaceted approach. For the first purpose, the effect of the material on two mammalian cell models was assessed. Key cytotoxicity parameters were considered such as cell viability and inflammatory response induction. This was combined with an evaluation of MLG toxicity towards Xenopus laevis, used as both in vivo and environmental model organism.
- 298Mottier, A.; Mouchet, F.; Laplanche, C.; Cadarsi, S.; Lagier, L.; Arnault, J.-C.; Girard, H. A.; León, V.; Vázquez, E.; Sarrieu, C.; Pinelli, E.; Gauthier, L.; Flahaut, E. Surface Area of Carbon Nanoparticles: A Dose Metric for a More Realistic Ecotoxicological Assessment. Nano Lett. 2016, 16, 3514– 3518, DOI: 10.1021/acs.nanolett.6b00348[ACS Full Text
 ], [CAS], Google Scholar298https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC28XmvVKltb0%253D&md5=ec22485edc1de1c9851bc99b00dc2317Surface Area of Carbon Nanoparticles: A Dose Metric for a More Realistic Ecotoxicological AssessmentMottier, Antoine; Mouchet, Florence; Laplanche, Christophe; Cadarsi, Stephanie; Lagier, Laura; Arnault, Jean-Charles; Girard, Hugues A.; Leon, Veronica; Vazquez, Ester; Sarrieu, Cyril; Pinelli, Eric; Gauthier, Laury; Flahaut, EmmanuelNano Letters (2016), 16 (6), 3514-3518CODEN: NALEFD; ISSN:1530-6984. (American Chemical Society)Engineered nanoparticles such as graphenes, nanodiamonds, and carbon nanotubes correspond to different allotropes of carbon and are among the best candidates for applications in fast-growing nanotechnol. It is thus likely that they may get into the environment at each step of their life cycle: prodn., use, and disposal. The aquatic compartment concs. pollutants and is expected to be esp. impacted. The toxicity of a compd. is conventionally evaluated using mass concn. as a quant. measure of exposure. However, several studies have highlighted that such a metric is not the best descriptor at the nanoscale. Here we compare the inhibition of Xenopus laevis larvae growth after in vivo exposure to different carbon nanoparticles for 12 days using different dose metrics and clearly show that surface area is the most relevant descriptor of toxicity for different types of carbon allotropes.
], [CAS], Google Scholar298https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC28XmvVKltb0%253D&md5=ec22485edc1de1c9851bc99b00dc2317Surface Area of Carbon Nanoparticles: A Dose Metric for a More Realistic Ecotoxicological AssessmentMottier, Antoine; Mouchet, Florence; Laplanche, Christophe; Cadarsi, Stephanie; Lagier, Laura; Arnault, Jean-Charles; Girard, Hugues A.; Leon, Veronica; Vazquez, Ester; Sarrieu, Cyril; Pinelli, Eric; Gauthier, Laury; Flahaut, EmmanuelNano Letters (2016), 16 (6), 3514-3518CODEN: NALEFD; ISSN:1530-6984. (American Chemical Society)Engineered nanoparticles such as graphenes, nanodiamonds, and carbon nanotubes correspond to different allotropes of carbon and are among the best candidates for applications in fast-growing nanotechnol. It is thus likely that they may get into the environment at each step of their life cycle: prodn., use, and disposal. The aquatic compartment concs. pollutants and is expected to be esp. impacted. The toxicity of a compd. is conventionally evaluated using mass concn. as a quant. measure of exposure. However, several studies have highlighted that such a metric is not the best descriptor at the nanoscale. Here we compare the inhibition of Xenopus laevis larvae growth after in vivo exposure to different carbon nanoparticles for 12 days using different dose metrics and clearly show that surface area is the most relevant descriptor of toxicity for different types of carbon allotropes. - 299Lagier, L.; Mouchet, F.; Laplanche, C.; Mottier, A.; Cadarsi, S.; Evariste, L.; Sarrieu, C.; Lonchambon, P.; Pinelli, E.; Flahaut, E.; Gauthier, L. Surface Area of Carbon-Based Nanoparticles Prevails on Dispersion for Growth Inhibition in Amphibians. Carbon 2017, 119, 72– 81, DOI: 10.1016/j.carbon.2017.04.016[Crossref], [CAS], Google Scholar299https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2sXmsVeitrw%253D&md5=6f28e4115ab70ef90740b500692c636cSurface area of carbon-based nanoparticles prevails on dispersion for growth inhibition in amphibiansLagier, L.; Mouchet, F.; Laplanche, C.; Mottier, A.; Cadarsi, S.; Evariste, L.; Sarrieu, C.; Lonchambon, P.; Pinelli, E.; Flahaut, E.; Gauthier, L.Carbon (2017), 119 (), 72-81CODEN: CRBNAH; ISSN:0008-6223. (Elsevier Ltd.)The attractive properties of carbon-based nanoparticles such as graphene and its derivs. or carbon nanotubes lead to their use in many application fields, whether they are raw or functionalized, such as oxidized. These particles may finally contaminate the aquatic compartment, which is a major receptacle of pollutants. The study of their impact on aquatic organisms is thus essential. At the nano scale, recent studies have highlighted that sp. surface area should be used as the most relevant descriptor of toxicity instead of the conventional mass concn. By using a dose-response model, this work compares the chronic toxicity obsd. on Xenopus laevis larvae after 12-day in vivo exposure to raw, oxidized carbon allotropes, or in the presence of chem. dispersant. The authors show that chem. dispersion does not influence the obsd. chronic toxicity, whether it is through surface chem. (oxidn. state) or through the addn. of a dispersant. The biol. hypothesis leading to growth inhibition are discussed. Finally, these results confirm that surface area is the more suited metric unit describing growth inhibition.
- 300Auffan, M.; Tella, M.; Santaella, C.; Brousset, L.; Paillès, C.; Barakat, M.; Espinasse, B.; Artells, E.; Issartel, J.; Masion, A.; Rose, J.; Wiesner, M. R.; Achouak, W.; Thiéry, A.; Bottero, J.-Y. An Adaptable Mesocosm Platform for Performing Integrated Assessments of Nanomaterial Risk in Complex Environmental Systems. Sci. Rep. 2015, 4, 5608, DOI: 10.1038/srep05608
- 301Bour, A.; Mouchet, F.; Silvestre, J.; Gauthier, L.; Pinelli, E. Environmentally Relevant Approaches to Assess Nanoparticles Ecotoxicity: A Review. J. Hazard. Mater. 2015, 283, 764– 777, DOI: 10.1016/j.jhazmat.2014.10.021[Crossref], [PubMed], [CAS], Google Scholar301https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2cXhvVCms7zI&md5=91eeae0d69c9d990bce0e54ce9a74232Environmentally relevant approaches to assess nanoparticles ecotoxicity: A reviewBour, Agathe; Mouchet, Florence; Silvestre, Jerome; Gauthier, Laury; Pinelli, EricJournal of Hazardous Materials (2015), 283 (), 764-777CODEN: JHMAD9; ISSN:0304-3894. (Elsevier B.V.)A review concerning engineered nanoparticle (NP) environmental fate and ecotoxicity using environmentally relevant exposure methods is given. These exposure methods differ from standardized protocols and can be classified into 3 groups: exptl. trophic chains which study trophic routes; multi-species exposures under lab. conditions which allow for complex, controlled exposure; and outdoor exposures more similar to environmentally realistic conditions. The majority of micro- or mesocosm studies focused on NP partitioning and bioaccumulation. One other major study parameter, NP ecotoxicity, has been assessed in single species, single species via the trophic route, and at the community level. The induction of biochem. defense systems, immuno-modulation, growth and reprodn. effects, behavioral alterations, and mortality have been used as indicators of major toxicity, depending on the studied species. The major effects of NP on microbial and algal communities include modifications of community compn. and diversity, decreased biomass, and community activity changes. Topics discussed include: organismal NP uptake and accumulation; exposure methods for integrated NP ecotoxicity (lab. trophic route, indoor multi-species, outdoor); studied end-points and main results (NP partitioning and biogeochem. analyses, NP toxicity); discussion (integrated studies approaching environmental conditions are emerging, serious gaps remain); and summary.
- 302Mottier, A.; Mouchet, F.; Pinelli, É.; Gauthier, L.; Flahaut, E. Environmental Impact of Engineered Carbon Nanoparticles: From Releases to Effects on the Aquatic Biota. Curr. Opin. Biotechnol. 2017, 46, 1– 6, DOI: 10.1016/j.copbio.2016.11.024[Crossref], [PubMed], [CAS], Google Scholar302https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2sXhs1Oluw%253D%253D&md5=5ba691077aeef4c73d145f895ff37472Environmental impact of engineered carbon nanoparticles: from releases to effects on the aquatic biotaMottier, Antoine; Mouchet, Florence; Pinelli, Eric; Gauthier, Laury; Flahaut, EmmanuelCurrent Opinion in Biotechnology (2017), 46 (), 1-6CODEN: CUOBE3; ISSN:0958-1669. (Elsevier B.V.)Nano-ecotoxicol. is an emerging science which aims to assess the environmental effect of nanotechnologies. The development of this particular aspect of ecotoxicol. was made necessary in order to evaluate the potential impact of recently produced and used materials: nanoparticles (NPs). Among all the types of NPs, carbon nanoparticles (CNPs) esp. draw attention giving the increasing no. of applications and integration into consumer products. However the potential impacts of CNPs in the environment remain poorly known. This review aims to point out the crit. issues and aspects that will govern the toxicity of CNPs in the environment.
- 303Bour, A.; Mouchet, F.; Verneuil, L.; Evariste, L.; Silvestre, J.; Pinelli, E.; Gauthier, L. Toxicity of CeO2 Nanoparticles at Different Trophic Levels – Effects on Diatoms, Chironomids and Amphibians. Chemosphere 2015, 120, 230– 236, DOI: 10.1016/j.chemosphere.2014.07.012
- 304Bour, A.; Mouchet, F.; Cadarsi, S.; Silvestre, J.; Verneuil, L.; Baqué, D.; Chauvet, E.; Bonzom, J.-M.; Pagnout, C.; Clivot, H.; Fourquaux, I.; Tella, M.; Auffan, M.; Gauthier, L.; Pinelli, E. Toxicity of CeO 2 Nanoparticles on a Freshwater Experimental Trophic Chain: A Study in Environmentally Relevant Conditions through the Use of Mesocosms. Nanotoxicology 2016, 10, 245– 255, DOI: 10.3109/17435390.2015.1053422
- 305Hu, X.; Kang, J.; Lu, K.; Zhou, R.; Mu, L.; Zhou, Q. Graphene Oxide Amplifies the Phytotoxicity of Arsenic in Wheat. Sci. Rep. 2015, 4, 6122, DOI: 10.1038/srep06122
- 306Wang, D.; Wang, G.; Zhang, G.; Xu, X.; Yang, F. Using Graphene Oxide to Enhance the Activity of Anammox Bacteria for Nitrogen Removal. Bioresour. Technol. 2013, 131, 527– 530, DOI: 10.1016/j.biortech.2013.01.099[Crossref], [PubMed], [CAS], Google Scholar306https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3sXisVKjtr8%253D&md5=f8140bbab4f8b68d642d4d1364dbd6e9Using graphene oxide to enhance the activity of anammox bacteria for nitrogen removalWang, Dong; Wang, Guowen; Zhang, Guoquan; Xu, Xiaochen; Yang, FenglinBioresource Technology (2013), 131 (), 527-530CODEN: BIRTEB; ISSN:0960-8524. (Elsevier Ltd.)Graphene oxide (GO) was applied to enhance the activity of anaerobic ammonium oxidn. (anammox) bacteria for N removal. A GO dose-dependent effect on anammox bacteria was obsd. through batch tests. The results showed that the activity increased as the GO dose was varied within 0.05-0.1 g/L. A max. 10.26% increase of anaerobic ammonium oxidizing activity was achieved at 0.1 g/L GO. Anal. of extracellular polymeric substances (EPS) indicated that the highest carbohydrate, protein, and total EPS contents (42.5, 125.7, and 168.2 mg/g volatile suspended solids, resp.) were obtained with 0.1 g/L GO. Appropriate GO dose stimulated EPS prodn. to promote the activity of anammox bacteria. Transmission electron microscopy showed the large surface area of GO benefited cell attachment. These findings proved that the application of GO was an effective approach to enhancing the activity of anammox bacteria.
- 307Du, J.; Hu, X.; Zhou, Q. Graphene Oxide Regulates the Bacterial Community and Exhibits Property Changes in Soil. RSC Adv. 2015, 5, 27009– 27017, DOI: 10.1039/C5RA01045D[Crossref], [CAS], Google Scholar307https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2MXktFels7w%253D&md5=1bb0d4aee78428e9df21dcf50a354467Graphene oxide regulates the bacterial community and exhibits property changes in soilDu, Junjie; Hu, Xiangang; Zhou, QixingRSC Advances (2015), 5 (34), 27009-27017CODEN: RSCACL; ISSN:2046-2069. (Royal Society of Chemistry)The extensive use of pristine graphene oxide (PGO) increases its environmental release. The interactions of PGO with soils, one of the ultimate repositories for discharged nanomaterial, remain unclear. In the present study, a pyrosequencing anal. based on the bacterial 16S rRNA gene showed that the bacterial community in a PGO-soil sample (PGOS) became richer and more diverse compared with a control soil sample (CS). PGO altered the structure of soil bacterial communities, with some nitrogen-fixing and dissimilatory iron reducing bacteria being selectively enriched, esp. at the genus level. SGO (soil-modified graphene oxide) exhibited a greater thickness, a higher C/O ratio, a rougher texture, a lower transparency and a smaller size than PGO. Nitrogen-contg. groups and the elements including Mg, Al, Si, K, Ca and Fe were detected in SGO. The changes in surface groups were consistent with the formation of org. mols. coating the SGO. SGO, which exhibited fewer neg. charges, was more unstable than PGO. In addn., SGO presented higher chem. activity than PGO; for example, SGO exhibited more unpaired electrons and disordered structures. This work highlights the crit. interactions of PGO and soil which deserve comprehensive consideration in assessing the risks of nanomaterials.
- 308Xiong, T.; Yuan, X.; Wang, H.; Leng, L.; Li, H.; Wu, Z.; Jiang, L.; Xu, R.; Zeng, G. Implication of Graphene Oxide in Cd-Contaminated Soil: A Case Study of Bacterial Communities. J. Environ. Manage. 2018, 205, 99– 106, DOI: 10.1016/j.jenvman.2017.09.067
- 309Ghosal, D.; Ghosh, S.; Dutta, T. K.; Ahn, Y. Current State of Knowledge in Microbial Degradation of Polycyclic Aromatic Hydrocarbons (PAHs): A Review. Front. Microbiol. 2016, 7, 1369, DOI: 10.3389/fmicb.2016.01369[Crossref], [PubMed], [CAS], Google Scholar309https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A280%3ADC%252BC2svhtVyhtQ%253D%253D&md5=ad7c00b8bc46197167f2142b54ea4efeCurrent State of Knowledge in Microbial Degradation of Polycyclic Aromatic Hydrocarbons (PAHs): A ReviewGhosal Debajyoti; Ghosh Shreya; Dutta Tapan K; Ahn YounghoFrontiers in microbiology (2016), 7 (), 1369 ISSN:1664-302X.Polycyclic aromatic hydrocarbons (PAHs) include a group of organic priority pollutants of critical environmental and public health concern due to their toxic, genotoxic, mutagenic and/or carcinogenic properties and their ubiquitous occurrence as well as recalcitrance. The increased awareness of their various adverse effects on ecosystem and human health has led to a dramatic increase in research aimed toward removing PAHs from the environment. PAHs may undergo adsorption, volatilization, photolysis, and chemical oxidation, although transformation by microorganisms is the major neutralization process of PAH-contaminated sites in an ecologically accepted manner. Microbial degradation of PAHs depends on various environmental conditions, such as nutrients, number and kind of the microorganisms, nature as well as chemical property of the PAH being degraded. A wide variety of bacterial, fungal and algal species have the potential to degrade/transform PAHs, among which bacteria and fungi mediated degradation has been studied most extensively. In last few decades microbial community analysis, biochemical pathway for PAHs degradation, gene organization, enzyme system, genetic regulation for PAH degradation have been explored in great detail. Although, xenobiotic-degrading microorganisms have incredible potential to restore contaminated environments inexpensively yet effectively, but new advancements are required to make such microbes effective and more powerful in removing those compounds, which were once thought to be recalcitrant. Recent analytical chemistry and genetic engineering tools might help to improve the efficiency of degradation of PAHs by microorganisms, and minimize uncertainties of successful bioremediation. However, appropriate implementation of the potential of naturally occurring microorganisms for field bioremediation could be considerably enhanced by optimizing certain factors such as bioavailability, adsorption and mass transfer of PAHs. The main purpose of this review is to provide an overview of current knowledge of bacteria, halophilic archaea, fungi and algae mediated degradation/transformation of PAHs. In addition, factors affecting PAHs degradation in the environment, recent advancement in genetic, genomic, proteomic and metabolomic techniques are also highlighted with an aim to facilitate the development of a new insight into the bioremediation of PAH in the environment.
- 310Xu, Y.; Zhou, N.-Y. Microbial Remediation of Aromatics-Contaminated Soil. Front. Environ. Sci. Eng. 2017, 11, 1, DOI: 10.1007/s11783-017-0894-x[Crossref], [CAS], Google Scholar310https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2sXhs1KhtLfI&md5=447097f1def89835f7fcfe07adc385b8Copper recovery from waste printed circuit boards concentrated metal scraps by electrolysisLiu, Xiaonan; Tan, Qiuxia; Li, Yungui; Xu, Zhonghui; Chen, MengjunFrontiers of Environmental Science & Engineering (2017), 11 (5), 1-5CODEN: FESECJ; ISSN:2095-221X. (Higher Education Press)Copper recovery is the core of waste printed circuit boards (WPCBs) treatment. In this study, we proposed a feasible and efficient way to recover copper from WPCBs concd. metal scraps by direct electrolysis and factors that affect copper recovery rate and purity, mainly CuSO4·5H2O concn., NaCl concn., H2SO4 concn. and c.d., were discussed in detail. The results indicated that copper recovery rate increased first with the increase of CuSO4·5H2O, NaCl, H2SO4 and c.d. and then decreased with further increasing these conditions. NaCl, H2SO4 and c.d. also showed a similar impact on copper purity, which also increased first and then decreased. Copper purity increased with the increase of CuSO4·5H2O. When the concn. of CuSO4·5H2O, NaCl and H2SO4 was resp. 90, 40 and 118 g/L and c.d. was 80 mA/cm2, copper recovery rate and purity was up to 97.32% and 99.86%, resp. Thus, electrolysis proposes a feasible and prospective approach for waste printed circuit boards recycle, even for e-waste, though more researches are needed for industrial application.
- 311Tortella, G. R.; Diez, M. C.; Durán, N. Fungal Diversity and Use in Decomposition of Environmental Pollutants. Crit. Rev. Microbiol. 2005, 31, 197– 212, DOI: 10.1080/10408410500304066[Crossref], [PubMed], [CAS], Google Scholar311https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BD2MXht1Kntb7J&md5=83b6ea122e3e2449a15d1b779f5d5fddFungal diversity and use in decomposition of environmental pollutantsTortella, Gonzalo R.; Diez, Maria Cristina; Duran, NelsonCritical Reviews in Microbiology (2005), 31 (4), 197-212CODEN: CRVMAC; ISSN:1040-841X. (Taylor & Francis, Inc.)A review. This article presents a crit. review of the actual state of fungal activities on environmental pollutants, fungal diversity, the use of fungi in the degrdn. of chem. pollutants, enzyme degrading systems and perspectives on the use of fungi in bioremediation and unexplored research. The ability of fungi to transform or metabolize chem. pollutants has received much attention due to environmental persistence and chem. toxicity. The fungal degrdn. of xenobiotics is looked upon as an effective method of removing these pollutants from the environment by a process which is currently known as bioremediation. This review summarizes information from fundamental works that have revealed that a wide variety of fungi are capable of degrading an equally wide range of toxic chem. The capacity of non-ligninolytic and ligninolytic fungi in the bioremediation of polycyclic arom. hydrocarbon (PAHs), benzene-toluene-ethylbenzene-xylene (BTEX), chlorophenols, polychlorinated biphenyl, munitions waste and pesticides have been discussed. Besides this, several extracellular enzymes are involved in the metab. of xenobiotic compds. as well as other factors related to these processes.
- 312Schreiner, K. M.; Filley, T. R.; Blanchette, R. A.; Bowen, B. B.; Bolskar, R. D.; Hockaday, W. C.; Masiello, C. A.; Raebiger, J. W. White-Rot Basidiomycete-Mediated Decomposition of C 60 Fullerol. Environ. Sci. Technol. 2009, 43, 3162– 3168, DOI: 10.1021/es801873q
- 313Xie, J.; Ming, Z.; Li, H.; Yang, H.; Yu, B.; Wu, R.; Liu, X.; Bai, Y.; Yang, S.-T. Toxicity of Graphene Oxide to White Rot Fungus Phanerochaete Chrysosporium. Chemosphere 2016, 151, 324– 331, DOI: 10.1016/j.chemosphere.2016.02.097[Crossref], [PubMed], [CAS], Google Scholar313https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC28XjvVGnt7c%253D&md5=3322ce069120d8689a34c69ab012399aToxicity of graphene oxide to white rot fungus Phanerochaete chrysosporiumXie, Jingru; Ming, Zhu; Li, Hongliang; Yang, Hua; Yu, Baowei; Wu, Ruihan; Liu, Xiaoyang; Bai, Yitong; Yang, Sheng-TaoChemosphere (2016), 151 (), 324-331CODEN: CMSHAF; ISSN:0045-6535. (Elsevier Ltd.)With the wide prodn. and applications of graphene and its derivs., their toxicity to the environment has received much attention nowadays. In this study, we investigated the toxicity of graphene oxide (GO) to white rot fungus (Phanerochaete chrysosporium). GO was prepd. by modified Hummers method and well characterized before use. P. chrysosporium was exposed to GO at the concns. of 0-4 mg/mL for 7 d. The fresh and dry wts., pH values of culture media, structures, ultrastructures, IR spectra and activities of the decompn. of pollutants were measured to reveal the hazards of GO to P. chrysosporium. Our results indicated that low concns. of GO stimulated the growth of P. chrysosporium. The exposure to GO induced more acidic pH values of the culture media after 7 d. GO induced the disruption of the fiber structure of P. chrysosporium, while at 4 mg/mL some very long and thick fibers were formed. Such changes were reflected in the SEM investigations, where the disruption of fibers was obsd. In the ultrastructural investigations, the shape of P. chrysosporium cells changed and more vesicles were found upon the exposure to GO. The IR spectroscopy analyses suggested that the chem. compns. of mycelia were not changed qual. Beyond the toxicity, GO did not alter the activities of P. chrysosporium at low concns., but led to the complete loss of activity at high concns. The implication to the ecol. safety of graphene is discussed.
- 314Yang, H.; Feng, S.; Ma, Q.; Ming, Z.; Bai, Y.; Chen, L.; Yang, S.-T. Influence of Reduced Graphene Oxide on the Growth, Structure and Decomposition Activity of White-Rot Fungus Phanerochaete Chrysosporium. RSC Adv. 2018, 8, 5026– 5033, DOI: 10.1039/C7RA12364G[Crossref], [CAS], Google Scholar314https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC1cXhsl2rsrY%253D&md5=e109dec9ca5dc69a4735ca5df7b59470Influence of reduced graphene oxide on the growth, structure and decomposition activity of white-rot fungus Phanerochaete chrysosporiumYang, Hua; Feng, Shicheng; Ma, Qiang; Ming, Zhu; Bai, Yitong; Chen, Lingyun; Yang, Sheng-TaoRSC Advances (2018), 8 (9), 5026-5033CODEN: RSCACL; ISSN:2046-2069. (Royal Society of Chemistry)Graphene materials have attracted great interest nowadays due to their large-scale prodn. and wide applications. It is urgent to evaluate the ecol. and environmental risk of graphene materials for the healthy development of the graphene industry. Herein, we evaluated the influence of reduced graphene oxide (RGO) on the growth, structure and decompn. activity of white-rot fungus, whose decompn. function is vital for carbon cycle. RGO slightly stimulated the fresh wt. and dry wt. gains of Phanerochaete chrysosporium. A larger no. of fibrous structures were obsd. at low RGO concns. in P. chrysosporium, which was consistent with the elongation of cells obsd. under a transmission electron microscope. RGO did not affect the chem. compn. of P. chrysosporium. Moreover, the laccase prodn. of P. chrysosporium was not influenced by RGO. The degrdn. activities of P. chrysosporium for dye and wood appeared to be promoted slightly, but the differences were insignificant compared to the control. Therefore, RGO had low toxicity to white-rot fungus and was relatively safe for the carbon cycle.
- 315Ankley, G. T.; Bennett, R. S.; Erickson, R. J.; Hoff, D. J.; Hornung, M. W.; Johnson, R. D.; Mount, D. R.; Nichols, J. W.; Russom, C. L.; Schmieder, P. K.; Serrrano, J. A.; Tietge, J. E.; Villeneuve, D. L. Adverse Outcome Pathways: A Conceptual Framework to Support Ecotoxicology Research and Risk Assessment. Environ. Toxicol. Chem. 2010, 29, 730– 741, DOI: 10.1002/etc.34[Crossref], [PubMed], [CAS], Google Scholar315https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3cXjt12ju7Y%253D&md5=3b2dfc0652b76d1bed60b8885091dbc2Adverse outcome pathways: a conceptual framework to support ecotoxicology research and risk assessmentAnkley, Gerald T.; Bennett, Richard S.; Erickson, Russell J.; Hoff, Dale J.; Hornung, Michael W.; Johnson, Rodney D.; Mount, David R.; Nichols, John W.; Russom, Christine L.; Schmieder, Patricia K.; Serrrano, Jose A.; Tietge, Joseph E.; Villeneuve, Daniel L.Environmental Toxicology and Chemistry (2010), 29 (3), 730-741CODEN: ETOCDK; ISSN:0730-7268. (John Wiley & Sons Ltd.)A review. Ecol. risk assessors face increasing demands to assess more chems., with greater speed and accuracy, and to do so using fewer resources and exptl. animals. New approaches in biol. and computational sciences may be able to generate mechanistic information that could help in meeting these challenges. However, to use mechanistic data to support chem. assessments, there is a need for effective translation of this information into endpoints meaningful to ecol. risk - effects on survival, development, and reprodn. in individual organisms and, by extension, impacts on populations. Here we discuss a framework designed for this purpose, the adverse outcome pathway (AOP). An AOP is a conceptual construct that portrays existing knowledge concerning the linkage between a direct mol. initiating event and an adverse outcome at a biol. level of organization relevant to risk assessment. The practical utility of AOPs for ecol. risk assessment of chems. is illustrated using five case examples. The examples demonstrate how the AOP concept can focus toxicity testing in terms of species and endpoint selection, enhance across-chem. extrapolation, and support prediction of mixt. effects. The examples also show how AOPs facilitate use of mol. or biochem. endpoints (sometimes referred to as biomarkers) for forecasting chem. impacts on individuals and populations. In the concluding sections of the paper, we discuss how AOPs can help to guide research that supports chem. risk assessments and advocate for the incorporation of this approach into a broader systems biol. framework.
- 316Leist, M.; Ghallab, A.; Graepel, R.; Marchan, R.; Hassan, R.; Bennekou, S. H.; Limonciel, A.; Vinken, M.; Schildknecht, S.; Waldmann, T.; Danen, E.; van Ravenzwaay, B.; Kamp, H.; Gardner, I.; Godoy, P.; Bois, F. Y.; Braeuning, A.; Reif, R.; Oesch, F.; Drasdo, D. Adverse Outcome Pathways: Opportunities, Limitations and Open Questions. Arch. Toxicol. 2017, 91, 3477– 3505, DOI: 10.1007/s00204-017-2045-3[Crossref], [PubMed], [CAS], Google Scholar316https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2sXhs12ltrrJ&md5=202b42123eb30e9685bc6cd6d1c6b88cAdverse outcome pathways: opportunities, limitations and open questionsLeist, Marcel; Ghallab, Ahmed; Graepel, Rabea; Marchan, Rosemarie; Hassan, Reham; Bennekou, Susanne Hougaard; Limonciel, Alice; Vinken, Mathieu; Schildknecht, Stefan; Waldmann, Tanja; Danen, Erik; van Ravenzwaay, Ben; Kamp, Hennicke; Gardner, Iain; Godoy, Patricio; Bois, Frederic Y.; Braeuning, Albert; Reif, Raymond; Oesch, Franz; Drasdo, Dirk; Hoehme, Stefan; Schwarz, Michael; Hartung, Thomas; Braunbeck, Thomas; Beltman, Joost; Vrieling, Harry; Sanz, Ferran; Forsby, Anna; Gadaleta, Domenico; Fisher, Ciaran; Kelm, Jens; Fluri, David; Ecker, Gerhard; Zdrazil, Barbara; Terron, Andrea; Jennings, Paul; van der Burg, Bart; Dooley, Steven; Meijer, Annemarie H.; Willighagen, Egon; Martens, Marvin; Evelo, Chris; Mombelli, Enrico; Taboureau, Olivier; Mantovani, Alberto; Hardy, Barry; Koch, Bjorn; Escher, Sylvia; van Thriel, Christoph; Cadenas, Cristina; Kroese, D.; van de Water, Bob; Hengstler, Jan G.Archives of Toxicology (2017), 91 (11), 3477-3505CODEN: ARTODN; ISSN:0340-5761. (Springer)Adverse outcome pathways (AOPs) are a recent toxicol. construct that connects, in a formalized, transparent and quality-controlled way, mechanistic information to apical endpoints for regulatory purposes. AOP links a mol. initiating event (MIE) to the adverse outcome (AO) via key events (KE), in a way specified by key event relationships (KER). Although this approach to formalize mechanistic toxicol. information only started in 2010, over 200 AOPs have already been established. At this stage, new requirements arise, such as the need for harmonization and re-assessment, for continuous updating, as well as for alerting about pitfalls, misuses and limits of applicability. In this review, the history of the AOP concept and its most prominent strengths are discussed, including the advantages of a formalized approach, the systematic collection of wt. of evidence, the linkage of mechanisms to apical end points, the examn. of the plausibility of epidemiol. data, the identification of crit. knowledge gaps and the design of mechanistic test methods. To prep. the ground for a broadened and appropriate use of AOPs, some widespread misconceptions are explained. Moreover, potential weaknesses and shortcomings of the current AOP rule set are addressed (1) to facilitate the discussion on its further evolution and (2) to better define appropriate vs. less suitable application areas. Exemplary toxicol. studies are presented to discuss the linearity assumptions of AOP, the management of event modifiers and compensatory mechanisms, and whether a sepn. of toxicodynamics from toxicokinetics including metab. is possible in the framework of pathway plasticity. Suggestions on how to compromise between different needs of AOP stakeholders have been added. A clear definition of open questions and limitations is provided to encourage further progress in the field.
- 317Groso, A.; Petri-Fink, A.; Magrez, A.; Riediker, M.; Meyer, T. Management of Nanomaterials Safety in Research Environment. Part. Part. Fibre Toxicol. 2010, 7, 40, DOI: 10.1186/1743-8977-7-40[Crossref], [PubMed], [CAS], Google Scholar317https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A280%3ADC%252BC3M7gt1SktA%253D%253D&md5=e68c48393049da69b8c1c831975d0116Management of nanomaterials safety in research environmentGroso Amela; Petri-Fink Alke; Magrez Arnaud; Riediker Michael; Meyer ThierryParticle and fibre toxicology (2010), 7 (), 40 ISSN:.Despite numerous discussions, workshops, reviews and reports about responsible development of nanotechnology, information describing health and environmental risk of engineered nanoparticles or nanomaterials is severely lacking and thus insufficient for completing rigorous risk assessment on their use. However, since preliminary scientific evaluations indicate that there are reasonable suspicions that activities involving nanomaterials might have damaging effects on human health; the precautionary principle must be applied. Public and private institutions as well as industries have the duty to adopt preventive and protective measures proportionate to the risk intensity and the desired level of protection. In this work, we present a practical, 'user-friendly' procedure for a university-wide safety and health management of nanomaterials, developed as a multi-stakeholder effort (government, accident insurance, researchers and experts for occupational safety and health). The process starts using a schematic decision tree that allows classifying the nano laboratory into three hazard classes similar to a control banding approach (from Nano 3--highest hazard to Nano1--lowest hazard). Classifying laboratories into risk classes would require considering actual or potential exposure to the nanomaterial as well as statistical data on health effects of exposure. Due to the fact that these data (as well as exposure limits for each individual material) are not available, risk classes could not be determined. For each hazard level we then provide a list of required risk mitigation measures (technical, organizational and personal). The target 'users' of this safety and health methodology are researchers and safety officers. They can rapidly access the precautionary hazard class of their activities and the corresponding adequate safety and health measures. We succeed in convincing scientist dealing with nano-activities that adequate safety measures and management are promoting innovation and discoveries by ensuring them a safe environment even in the case of very novel products. The proposed measures are not considered as constraints but as a support to their research. This methodology is being implemented at the Ecole Polytechnique de Lausanne in over 100 research labs dealing with nanomaterials. It is our opinion that it would be useful to other research and academia institutions as well.
- 318Imhof, C.; Clark, K.; Meyer, T.; Schmid, K.; Riediker, M. Research and Development—where People Are Exposed to Nanomaterials. J. Occup. Health 2015, 57, 179– 188, DOI: 10.1539/joh.14-0189-FS[Crossref], [PubMed], [CAS], Google Scholar318https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2MXnvValurg%253D&md5=a4a1de89973b63391241eb2265cc2d7dResearch and development-where people are exposed to nanomaterialsImhof, Chantal; Clark, Katherine; Meyer, Thierry; Schmid, Kaspar; Riediker, MichaelJournal of Occupational Health (2015), 57 (2), 179-188CODEN: JOCHFV; ISSN:1341-9145. (Japan Society for Occupational Health)Objectives: Many nanomaterials (materials with structures smaller than 100 nm) have chem., phys. and bioactive characteristics of interest for novel applications. Considerable research efforts have been launched in this field. This study aimed to study exposure scenarios commonly encountered in research settings. Methods: We studied one of the leading Swiss universities and first identified all research units dealing with nanomaterials. After a preliminary evaluation of quantities and process types used, a detailed anal. was conducted in units where more than a few micrograms were used per wk. Results: In the investigated labs., background levels were usually low and in the range of a few thousand particles per cubic centimeter. Powder applications resulted in concns. of 10,000 to 100,000 particles/cm3 when measured inside fume hoods, but there were no or mostly minimal increases in the breathing zone of researchers. Mostly low exposures were obsd. for activities involving liq. applications. However, centrifugation and lyophilization of nanoparticle-contg. solns. resulted in high particle no. levels (up to 300,000 particles/cm3) in work spaces where researchers did not always wear respiratory protection. No significant increases were found for processes involving nanoparticles bound to surfaces, nor were they found in labs. that were visualizing properties and structure of small amts. of nanomaterials. Conclusions: Research activities in modern labs. equipped with control techniques were assocd. with minimal releases of nanomaterials into the working space. However, the focus should not only be on processes involving nanopowders but should also be on processes involving nanoparticle-contg. liqs., esp. if the work involves phys. agitation, aerosolization or drying of the liqs.
- 319Spinazzè, A.; Cattaneo, A.; Campagnolo, D.; Bollati, V.; Bertazzi, P. A.; Cavallo, D. M. Engineered Nanomaterials Exposure in the Production of Graphene. Aerosol Sci. Technol. 2016, 50, 812– 821, DOI: 10.1080/02786826.2016.1195906[Crossref], [CAS], Google Scholar319https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC28XhtVCmt7fN&md5=ae8df74c9e4e496ffd7379e984537f28Engineered nanomaterials exposure in the production of grapheneSpinazze, Andrea; Cattaneo, Andrea; Campagnolo, Davide; Bollati, Valentina; Bertazzi, Pier Alberto; Cavallo, Domenico M.Aerosol Science and Technology (2016), 50 (8), 812-821CODEN: ASTYDQ; ISSN:0278-6826. (Taylor & Francis, Inc.)The objective of this study was to obtain the multi-metric occupational exposure assessment to graphene family nanomaterials (GFNs) particles of workers engaged in the large-scale prodn. of graphene. The study design consisted of the combination of (i) direct-reading instruments, used to evaluate the total particle no. concns. relative to the background concn. (time series with spatial approach) and the mean size-dependent characteristics of particles (mean diam. and surface-area concn.) and (ii) filter-based air sampling for the detn. of size-resolved particle mass concns. The data obtained from direct reading measurement were then used to est. the 8-h time weighted av. (8-h TWA) exposure to GFNs particles for workers involved in different working tasks. Workers were generally exposed to 8-h TWA GFNs particle levels lower than the proposed ref. value (40,000 particle/cm3). Furthermore, despite high short-term exposure conditions were present during specific operations of the prodn. process, the possibility of significant exposure peaks is not likely to be expected. The estd. 8-h TWA concn. showed differences between the unexposed (<100 particle/cm3; <0.05 μg/m3) and exposed subjects (mean concn. ranging from 909 to 6438 particle/cm3 and from 0.38 to 3.86 μg/m3). The research outcomes can be of particular interest because the exposure of workers in real working conditions was assessed with a multi-metric approach; in this regard, the study suggests that workers who are directly involved in some specific working task (material sampling for quality control) have higher potential for occupational exposure than operators who are in charge of routine prodn. work. 2016 American Assocn. for Aerosol Research.
- 320Lee, J. H.; Han, J. H.; Kim, J. H.; Kim, B.; Bello, D.; Kim, J. K.; Lee, G. H.; Sohn, E. K.; Lee, K.; Ahn, K.; Faustman, E. M.; Yu, I. J. Exposure Monitoring of Graphene Nanoplatelets Manufacturing Workplaces. Inhalation Toxicol. 2016, 28, 281– 291, DOI: 10.3109/08958378.2016.1163442[Crossref], [PubMed], [CAS], Google Scholar320https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC28Xlslamtbc%253D&md5=e14eed454c2c824c98698d6b334c31f7Exposure monitoring of graphene nanoplatelets manufacturing workplacesLee, Ji Hyun; Han, Jong Hun; Kim, Jae Hyun; Kim, Boowook; Bello, Dhimiter; Kim, Jin Kwon; Lee, Gun Ho; Sohn, Eun Kyung; Lee, Kyungmin; Ahn, Kangho; Faustman, Elaine M.; Yu, Il JeInhalation Toxicology (2016), 28 (6), 281-291CODEN: INHTE5; ISSN:0895-8378. (Taylor & Francis Ltd.)Graphenes have emerged as a highly promising, two-dimensional engineered nanomaterial that can possibly substitute carbon nanotubes. They are being explored in numerous R&D and industrial applications in labs. across the globe, leading to possible human and environmental exposures to them. Yet, there are no published data on graphene exposures in occupational settings and no readily available methods for their detection and quantitation exist. This study investigates for the first time the potential exposure of workers and research personnel to graphenes in two research facilities and evaluates the status of the control measures. One facility manufs. graphene using graphite exfoliation and chem. vapor deposition (CVD), while the other facility grows graphene on a copper plate using CVD, which is then transferred to a polyethylene terephthalate (PET) sheet. Graphene exposures and process emissions were investigated for three tasks - CVD growth, exfoliation, and transfer - using a multi-metric approach, which utilizes several direct reading instruments, integrated sampling, and chem. and morphol. anal. Real-time instruments included a dust monitor, condensation particle counter (CPC), nanoparticle surface area monitor, scanning mobility particle sizer, and an aethalometer. Morphol., graphenes and other nanostructures released from the work process were investigated using a transmission electron microscope (TEM). Graphenes were quantified in airborne respirable samples as elemental carbon via thermo-optical anal. The mass concns. of total suspended particulate at Workplaces A and B were very low, and elemental carbon concns. were mostly below the detection limit, indicating very low exposure to graphene or any other particles. The real-time monitoring, esp. the aethalometer, showed a good response to the released black carbon, providing a signature of the graphene released during the opening of the CVD reactor at Workplace A. The TEM observation of the samples obtained from Workplaces A and B showed graphene-like structures and aggregated/agglomerated carbon structures. Taken together, the current findings on common scenarios (exfoliation, CVD growth, and transfer), while not inclusive of all graphene manufg. processes, indicate very minimal graphene or particle exposure at facilities manufg. graphenes with good manufg. practices.
- 321Lo, L.-M.; Hammond, D.; Bartholomew, I.; Almaguer, D.; Heitbrink, W.; Topmiller, J. Engineering Controls for Nano-Scale Graphene Platelets During Manufacturing and Handling Processes. Department of Health and Human Services Centers for Disease Control and Prevention National Institute for Occupational Safety and Health, 2011.Google ScholarThere is no corresponding record for this reference.
- 322Heitbrink, W. A.; Lo, L.-M.; Dunn, K. H. Exposure Controls for Nanomaterials at Three Manufacturing Sites. J. Occup. Environ. Hyg. 2015, 12, 16– 28, DOI: 10.1080/15459624.2014.930559
- 323Rebitzer, G.; Ekvall, T.; Frischknecht, R.; Hunkeler, D.; Norris, G.; Rydberg, T.; Schmidt, W.-P.; Suh, S.; Weidema, B. P.; Pennington, D. W. Life Cycle Assessment: Part 1: Framework, Goal and Scope Definition, Inventory Analysis, and Applications. Environ. Int. 2004, 30, 701– 720, DOI: 10.1016/j.envint.2003.11.005[Crossref], [PubMed], [CAS], Google Scholar323https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BD2cXisFCgsbs%253D&md5=8135a490f5b1d9ae822a0dd868e61f2aLife cycle assessment. Part 1: Framework, goal and scope definition, inventory analysis, and applicationsRebitzer, G.; Ekvall, T.; Frischknecht, R.; Hunkeler, D.; Norris, G.; Rydberg, T.; Schmidt, W.-P.; Suh, S.; Weidema, B. P.; Pennington, D. W.Environment International (2004), 30 (5), 701-720CODEN: ENVIDV; ISSN:0160-4120. (Elsevier)A review. Sustainable development requires methods and tools to measure and compare the environmental impacts of human activities for the provision of goods and services (both of which are summarized under the term products). Environmental impacts include those from emissions into the environment and through the consumption of resources, as well as other interventions (e.g., land use) assocd. with providing products that occur when extg. resources, producing materials, manufg. the products, during consumption/use, and at the products' end-of-life (collection/sorting, reuse, recycling, waste disposal). These emissions and consumptions contribute to a wide range of impacts, such as climate change, stratospheric ozone depletion, tropospheric ozone (smog) creation, eutrophication, acidification, toxicol. stress on human health and ecosystems, the depletion of resources, water use, land use, and noise-among others. A clear need, therefore, exists to be proactive and to provide complimentary insights, apart from current regulatory practices, to help reduce such impacts. Practitioners and researchers from many domains come together in life cycle assessment (LCA) to calc. indicators of the aforementioned potential environmental impacts that are linked to products-supporting the identification of opportunities for pollution prevention and redns. in resource consumption while taking the entire product life cycle into consideration. This paper, part 1 in two, introduces the LCA framework and procedure, outlines how to define and model a product's life cycle, and provides an overview of available methods and tools for tabulating and compiling assocd. emissions and resource consumption data in a life cycle inventory (LCI). It also discusses the application of LCA in industry and policy making. The 2nd paper, by Pennington et al. (Environ. Int. 2003, in press), highlights the key features, summarizes available approaches, and outlines the key challenges of assessing the aforementioned inventory data in terms of contributions to environmental impacts (life cycle impact assessment, LCIA).
- 324Arvidsson, R.; Kushnir, D.; Molander, S.; Sandén, B. A. Energy and Resource Use Assessment of Graphene as a Substitute for Indium Tin Oxide in Transparent Electrodes. J. Cleaner Prod. 2016, 132, 289– 297, DOI: 10.1016/j.jclepro.2015.04.076[Crossref], [CAS], Google Scholar324https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2MXnsl2qt78%253D&md5=b799948ebda626fa0ef959b7eb067375Energy and resource use assessment of graphene as a substitute for indium tin oxide in transparent electrodesArvidsson, Rickard; Kushnir, Duncan; Molander, Sverker; Sanden, Bjoern A.Journal of Cleaner Production (2016), 132 (), 289-297CODEN: JCROE8; ISSN:0959-6526. (Elsevier Ltd.)One of the most promising applications of graphene is as material in transparent electrodes in applications such as liq. crystal displays (LCDs) and solar cells. In this study, we assess life cycle resource requirements of producing an electrode area of graphene by chem. vapor deposition (CVD) and compare to the prodn. of indium tin oxide (ITO). The resources considered are energy and scarce metals. The results show that graphene layers can have lower life cycle energy use than ITO layers, with 3-10 times redn. for our best case scenario. Regarding use of scarce metals, the use of indium in ITO prodn. is more problematic than the use of copper in graphene prodn., although the latter may constitute a resource constraint in the very long run. The substitution of ITO by graphene thus seems favorable from a resource point of view. Higher order effects may outweigh or enhance the energy use benefit. For example, cheaper, graphene-based electrodes may spur increased prodn. of LCDs, leading to increased abs. energy use, or spur the development of new energy technologies, such as solar cells and fuel cells. The latter could potentially lead to larger abs. redns. in resource use if these new technologies will replace fossil-based energy systems.
- 325Arvidsson, R.; Molander, S. Prospective Life Cycle Assessment of Epitaxial Graphene Production at Different Manufacturing Scales and Maturity. J. Ind. Ecol. 2017, 21, 1153– 1164, DOI: 10.1111/jiec.12526[Crossref], [CAS], Google Scholar325https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2sXhs12mtb3N&md5=a8dd6c6985efcb9150263998160c5fc8Prospective Life Cycle Assessment of Epitaxial Graphene Production at Different Manufacturing Scales and MaturityArvidsson, Rickard; Molander, SverkerJournal of Industrial Ecology (2017), 21 (5), 1153-1164CODEN: JINEFZ; ISSN:1088-1980. (Wiley-Blackwell)Epitaxial growth is a potential prodn. process for the new material graphene, where it is grown on silicon carbide (SiC) wafers at high temps. We provide first ests. of the life cycle cumulative energy demand, climate change, terrestrial acidification, and eco-toxicity of this prodn. For this purpose, we applied prospective life cycle assessment (LCA) for three prodn. scenarios (lab, pilot, and an industrial scenario), which reflect different prodn. scales and technol. maturity. The functional unit was one square centimeter of graphene. Results show that the three scenarios have similar impacts, which goes against previous studies that have suggested a decrease with larger prodn. scale and technol. maturity. The reason for this result is the dominance of electricity use in the SiC wafer prodn. for all impacts (>99% in the worst case, >76% in the best case). Only when assuming thinner SiC wafers in the industrial scenario is there a redn. in impacts by around a factor of 10. A surface-area-based comparison to the life cycle energy use of graphene produced by chem. vapor deposition showed that epitaxial graphene was considerably more energy intensive-approx. a factor of 1,000. We recommend producers of epitaxial graphene to investigate the feasibility of thinner SiC wafers and use electricity based on wind, solar, or hydropower. The main methodol. recommendation from the study is to achieve a temporal robustness of LCA studies of emerging technologies, which includes the consideration of different background systems and differences in prodn. scale and technol. maturity.
- 326Pizza, A.; Metz, R.; Hassanzadeh, M.; Bantignies, J.-L. Life Cycle Assessment of Nanocomposites Made of Thermally Conductive Graphite Nanoplatelets. Int. J. Life Cycle Assess. 2014, 19, 1226– 1237, DOI: 10.1007/s11367-014-0733-2[Crossref], [CAS], Google Scholar326https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2cXosVegtr8%253D&md5=e1e6a5b9ca461fafca0cf3995785f249Life cycle assessment of nanocomposites made of thermally conductive graphite nanoplateletsPizza, Alfredo; Metz, Renaud; Hassanzadeh, Mehrdad; Bantignies, Jean-LouisInternational Journal of Life Cycle Assessment (2014), 19 (6), 1226-1237CODEN: IJLCFF; ISSN:0948-3349. (Springer)Purpose: Polymers typically have intrinsic thermal cond. much lower than other materials. Enhancement of this property may be obtained by the addn. of conductive fillers. Nanofillers are preferred to traditional ones, due to their low percolation threshold resulting from their high aspect ratio. Beyond these considerations, it is imperative that the development of such new fillers takes place in a safe and sustainable manner. A conventional life cycle assessment (LCA) has been conducted on epoxy-based composites, filled with graphite nanoplatelets (GnP). In particular, this study focuses on energy requirements for the prodn. of such composites, in order to stress environmental hot spots and primary energy of GnP prodn. process (nano-wastes and nanoparticles emissions are not included). Methods: A cradle-to-grave approach has been employed for this assessment, in an attributional modeling perspective. The data for the LCA have been gathered from both lab. data and bibliog. refs. A tech. LCA software package, SimaPro (SimaPro 7.3), which contains Ecoinvent (2010) life cycle inventory (LCI) database, has been used for the life cycle impact assessment (LCIA), studying 13 mid-point indicators. Sensitivity and uncertainty analyses have also been performed. Results and discussion: One kilogram of GnP filler requires 1,879 MJ of primary energy while the prepn. of 1 kg of epoxy composite loaded with 0.058 kg of GnP 303 MJ. Besides energy consumption in the filler prepn., it is shown that the thermoset matrix material has also a non-negligible impact on the life cycle despite the use of GnP: the primary energy required to make epoxy resin is 187 MJ, i.e., 62 % of the total energy to make 1 kg of composite. Conclusions: Raw material extn. and filler and resin prepn. phase exhibit the highest environmental impact while the composite prodn. is negligible. Thermosetting resin remains the highest primary energy demand when used as matrix for GnP fillers. The result of the sensitivity anal. carried out on the electricity mix used during the GnP and the composite prodn. processes does not affect the conclusions.
- 327Arvidsson, R.; Kushnir, D.; Sandén, B. A.; Molander, S. Prospective Life Cycle Assessment of Graphene Production by Ultrasonication and Chemical Reduction. Environ. Sci. Technol. 2014, 48, 4529– 4536, DOI: 10.1021/es405338k[ACS Full Text
 ], [CAS], Google Scholar327https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2cXksFWitL0%253D&md5=6c8e87870f2c77c1f9e1fd2e89f2eb34Prospective Life Cycle Assessment of Graphene Production by Ultrasonication and Chemical ReductionArvidsson, Rickard; Kushnir, Duncan; Sanden, Bjoern A.; Molander, SverkerEnvironmental Science & Technology (2014), 48 (8), 4529-4536CODEN: ESTHAG; ISSN:0013-936X. (American Chemical Society)One promising future bulk application of graphene is as composite additive. Therefore, we compare two prodn. routes for in-soln. graphene using a cradle-to-gate lifecycle assessment focusing on potential differences in energy use, blue water footprint, human toxicity, and ecotoxicity. The data used for the assessment is based on information in scientific papers and patents. Considering the prospective nature of this study, environmental impacts from background systems such as energy prodn. were not included. The prodn. routes are either based on ultrasonication or chem. redn. The results show that the ultrasonication route has lower energy and water use, but higher human and ecotoxicity impacts, compared to the chem. redn. route. However, a sensitivity anal. showed that solvent recovery in the ultrasonication process gives lower impacts for all included impact categories. The sensitivity anal. also showed that solvent recovery is important to lower the blue water footprint of the chem. redn. route as well. The results demonstrate the possibility to conduct a life cycle assessment study based mainly on information from patents and scientific articles, enabling prospective life cycle assessment studies of products at early stages of technol. development.
], [CAS], Google Scholar327https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2cXksFWitL0%253D&md5=6c8e87870f2c77c1f9e1fd2e89f2eb34Prospective Life Cycle Assessment of Graphene Production by Ultrasonication and Chemical ReductionArvidsson, Rickard; Kushnir, Duncan; Sanden, Bjoern A.; Molander, SverkerEnvironmental Science & Technology (2014), 48 (8), 4529-4536CODEN: ESTHAG; ISSN:0013-936X. (American Chemical Society)One promising future bulk application of graphene is as composite additive. Therefore, we compare two prodn. routes for in-soln. graphene using a cradle-to-gate lifecycle assessment focusing on potential differences in energy use, blue water footprint, human toxicity, and ecotoxicity. The data used for the assessment is based on information in scientific papers and patents. Considering the prospective nature of this study, environmental impacts from background systems such as energy prodn. were not included. The prodn. routes are either based on ultrasonication or chem. redn. The results show that the ultrasonication route has lower energy and water use, but higher human and ecotoxicity impacts, compared to the chem. redn. route. However, a sensitivity anal. showed that solvent recovery in the ultrasonication process gives lower impacts for all included impact categories. The sensitivity anal. also showed that solvent recovery is important to lower the blue water footprint of the chem. redn. route as well. The results demonstrate the possibility to conduct a life cycle assessment study based mainly on information from patents and scientific articles, enabling prospective life cycle assessment studies of products at early stages of technol. development. - 328Rosenbaum, R. K.; Bachmann, T. M.; Gold, L. S.; Huijbregts, M. A. J.; Jolliet, O.; Juraske, R.; Koehler, A.; Larsen, H. F.; MacLeod, M.; Margni, M.; McKone, T. E.; Payet, J.; Schuhmacher, M.; van de Meent, D.; Hauschild, M. Z. USEtox—the UNEP-SETAC Toxicity Model: Recommended Characterisation Factors for Human Toxicity and Freshwater Ecotoxicity in Life Cycle Impact Assessment. Int. J. Life Cycle Assess. 2008, 13, 532– 546, DOI: 10.1007/s11367-008-0038-4[Crossref], [CAS], Google Scholar328https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BD1MXmslKl&md5=492b486f95c0b3257f363649f4341cf8USEtox- the UNEP-SETAC toxicity model: recommended characterisation factors for human toxicity and freshwater ecotoxicity in life cycle impact assessmentRosenbaum, Ralph K.; Bachmann, Till M.; Gold, Lois Swirsky; Huijbregts, Mark A. J.; Jolliet, Olivier; Juraske, Ronnie; Koehler, Annette; Larsen, Henrik F.; MacLeod, Matthew; Margni, Manuele; McKone, Thomas E.; Payet, Jerome; Schuhmacher, Marta; van de Meent, Dik; Hauschild, Michael Z.International Journal of Life Cycle Assessment (2008), 13 (7), 532-546CODEN: IJLCFF; ISSN:0948-3349. (Springer)In 2005, a comprehensive comparison of life cycle impact assessment toxicity characterization models was initiated by the United Nations Environment Program (UNEP)-Society for Environmental Toxicol. and Chem. (SETAC) Life Cycle Initiative, directly involving the model developers of CalTOX, IMPACT 2002, USES-LCA, BETR, EDIP, WATSON, and EcoSense. In this paper, we describe this model comparison process and its results-in particular the scientific consensus model developed by the model developers. The main objectives of this effort were (1) to identify specific sources of differences between the models' results and structure, (2) to detect the indispensable model components and (3) to build a scientific consensus model from them, representing recommended practice. A chem. test set of 45 orgs. covering a wide range of property combinations was selected for this purpose. All models used this set. In three workshops, the model comparison participants identified key fate, exposure and effect issues via comparison of the final characterization factors and selected intermediate outputs for fate, human exposure and toxic effects for the test set applied to all models. Through this process, we were able to reduce intermodel variation from an initial range of up to 13 orders of magnitude down to no more than two orders of magnitude for any substance. This led to the development of USEtox, a scientific consensus model that contains only the most influential model elements. These were, for example, process formulations accounting for intermittent rain, defining a closed or open system environment or nesting an urban box in a continental box. The precision of the new characterization factors (CFs) is within a factor of 100-1000 for human health and 10-100 for freshwater ecotoxicity of all other models compared to 12 orders of magnitude variation between the CFs of each model, resp. The achieved redn. of inter-model variability by up to 11 orders of magnitude is a significant improvement. USEtox provides a parsimonious and transparent tool for human health and ecosystem CF ests. Based on a referenced database, it has now been used to calc. CFs for several thousand substances and forms the basis of the recommendations from UNEP-SETAC's Life Cycle Initiative regarding characterization of toxic impacts in life cycle assessment. We provide both recommended and interim (not recommended and to be used with caution) characterization factors for human health and freshwater ecotoxicity impacts. After a process of consensus building among stakeholders on a broad scale as well as several improvements regarding a wider and easier applicability of the model, USEtox will become available to practitioners for the calcn. of further CFs.
- 329Salieri, B.; Righi, S.; Pasteris, A.; Olsen, S. I. Freshwater Ecotoxicity Characterisation Factor for Metal Oxide Nanoparticles: A Case Study on Titanium Dioxide Nanoparticle. Sci. Total Environ. 2015, 505, 494– 502, DOI: 10.1016/j.scitotenv.2014.09.107[Crossref], [PubMed], [CAS], Google Scholar329https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2cXhslersbjI&md5=351c11d05c81182f59ed1419ef65c6f9Freshwater ecotoxicity characterisation factor for metal oxide nanoparticles: A case study on titanium dioxide nanoparticleSalieri, Beatrice; Righi, Serena; Pasteris, Andrea; Olsen, Stig IrvingScience of the Total Environment (2015), 505 (), 494-502CODEN: STENDL; ISSN:0048-9697. (Elsevier B.V.)The Life Cycle Assessment (LCA) methodol. is widely applied in several industrial sectors to evaluate the environmental performance of processes, products and services. Recently, several reports and studies have emphasized the importance of LCA in the field of engineered nanomaterials. However, to date only a few LCA studies on nanotechnol. have been carried out, and fewer still have assessed aspects relating to ecotoxicity. This is mainly due to the lack of knowledge in relation on human and environmental exposure and effect of engineered nanoparticles (ENPs). This bottleneck is continued when performing Life Cycle Impact Assessment, where characterization models and consequently characterization factors (CFs) for ENPs are missing. This paper aims to provide the freshwater ecotoxicity CF for titanium dioxide nanoparticles (nano-TiO2). The USEtox model has been selected as a characterization model. An adjusted multimedia fate model has been developed which accounts for nano-specific fate process descriptors (i.e., sedimentation, aggregation with suspended particle matter, etc.) to est. the fate of nano-TiO2 in freshwater. A literature survey of toxicity tests performed on freshwater organism representative of multiple trophic levels was conducted, including algae, crustaceans and fish to collect relevant EC50 values. Then, the toxic effect of nano-TiO2 was computed on the basis of the HC50 value. Thus, following the principle of USEtox model and accounting for nano-specific descriptors a CF for the toxic impact of freshwater ecotoxicity of 0.28 PAF day M3 kg- 1 is proposed.
- 330Ettrup, K.; Kounina, A.; Hansen, S. F.; Meesters, J. A. J.; Vea, E. B.; Laurent, A. Development of Comparative Toxicity Potentials of TiO 2 Nanoparticles for Use in Life Cycle Assessment. Environ. Sci. Technol. 2017, 51, 4027– 4037, DOI: 10.1021/acs.est.6b05049
- 331Meesters, J. A. J.; Koelmans, A. A.; Quik, J. T. K.; Hendriks, A. J.; van de Meent, D. Multimedia Modeling of Engineered Nanoparticles with SimpleBox4nano: Model Definition and Evaluation. Environ. Sci. Technol. 2014, 48, 5726– 5736, DOI: 10.1021/es500548h[ACS Full Text
 ], [CAS], Google Scholar331https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2cXmvVWjt7o%253D&md5=b67c608a11c9e4fe9ed94cd8e434e55cMultimedia Modeling of Engineered Nanoparticles with SimpleBox4Nano: Model Definition and EvaluationMeesters, Johannes A. J.; Koelmans, Albert A.; Quik, Joris T. K.; Hendriks, A. Jan; van de Meent, DikEnvironmental Science & Technology (2014), 48 (10), 5726-5736CODEN: ESTHAG; ISSN:0013-936X. (American Chemical Society)Screening level models for environmental assessment of engineered nanoparticles (ENP) are not generally available. This work assessed the validity of SimpleBox4Nano (SB4N), the first model of this type, and evaluated it by comparing it with a known material flow model. SB4N expressed ENP transport and concns. in and across air, rain, surface water, soil, and sediment, accounting for nano-specific processes e.g., aggregation, attachment, and dissoln. The model solves simultaneous mass balance equations (MBE) using simple matrix algebra. MBE link all concns. and transfer processes using first-order rate consts. for all processes known to be relevant for ENP. First-order rate consts. were obtained from the literature. The SB4N output is ENP mass concns. as free dispersive species, hetero-aggregates with natural colloids, and larger natural particles in each compartment in time and at steady state. Known scenario studies for Switzerland were used to demonstrate the impact of transport processes included in SB4N on predicted environmental concns. It is argued that SB4N-predicted environmental concns. are useful as background concns. for environmental risk assessment.
], [CAS], Google Scholar331https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2cXmvVWjt7o%253D&md5=b67c608a11c9e4fe9ed94cd8e434e55cMultimedia Modeling of Engineered Nanoparticles with SimpleBox4Nano: Model Definition and EvaluationMeesters, Johannes A. J.; Koelmans, Albert A.; Quik, Joris T. K.; Hendriks, A. Jan; van de Meent, DikEnvironmental Science & Technology (2014), 48 (10), 5726-5736CODEN: ESTHAG; ISSN:0013-936X. (American Chemical Society)Screening level models for environmental assessment of engineered nanoparticles (ENP) are not generally available. This work assessed the validity of SimpleBox4Nano (SB4N), the first model of this type, and evaluated it by comparing it with a known material flow model. SB4N expressed ENP transport and concns. in and across air, rain, surface water, soil, and sediment, accounting for nano-specific processes e.g., aggregation, attachment, and dissoln. The model solves simultaneous mass balance equations (MBE) using simple matrix algebra. MBE link all concns. and transfer processes using first-order rate consts. for all processes known to be relevant for ENP. First-order rate consts. were obtained from the literature. The SB4N output is ENP mass concns. as free dispersive species, hetero-aggregates with natural colloids, and larger natural particles in each compartment in time and at steady state. Known scenario studies for Switzerland were used to demonstrate the impact of transport processes included in SB4N on predicted environmental concns. It is argued that SB4N-predicted environmental concns. are useful as background concns. for environmental risk assessment. - 332Salieri, B.; Turner, D. A.; Nowack, B.; Hischier, R. Life Cycle Assessment of Manufactured Nanomaterials: Where Are We?. NanoImpact 2018, 10, 108– 120, DOI: 10.1016/j.impact.2017.12.003
- 333Kostarelos, K. Translating Graphene and 2D Materials into Medicine. Nat. Rev. Mater. 2016, 1, 16084, DOI: 10.1038/natrevmats.2016.84[Crossref], [CAS], Google Scholar333https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2sXhtVertLc%253D&md5=fe673d8c628cc99ebd20d177b6247fcbTranslating graphene and 2D materials into medicineKostarelos, KostasNature Reviews Materials (2016), 1 (11), 16084CODEN: NRMADL; ISSN:2058-8437. (Nature Publishing Group)Adoption of graphene and other 2D crystals in biomedicine is challenging - some guidelines to facilitate this process and avoid inflated expectations should be considered.
- 334Valsami-Jones, E.; Lynch, I. How Safe Are Nanomaterials?. Science 2015, 350, 388– 389, DOI: 10.1126/science.aad0768[Crossref], [PubMed], [CAS], Google Scholar334https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2MXhslOmt7rJ&md5=b5cad7b2aa65882579d64d704d3d860fHow safe are nanomaterials?Valsami-Jones, Eugenia; Lynch, IseultScience (Washington, DC, United States) (2015), 350 (6259), 388-389CODEN: SCIEAS; ISSN:0036-8075. (American Association for the Advancement of Science)There is no expanded citation for this reference.
- 335Yang, K.; Li, Y.; Tan, X.; Peng, R.; Liu, Z. Behavior and Toxicity of Graphene and Its Functionalized Derivatives in Biological Systems. Small 2013, 9, 1492– 1503, DOI: 10.1002/smll.201201417[Crossref], [PubMed], [CAS], Google Scholar335https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC38XhtlKisb3L&md5=2e4c82579a1a53870b3911feb232d074Behavior and toxicity of graphene and its functionalized derivatives in biological systemsYang, Kai; Li, Yingjie; Tan, Xiaofang; Peng, Rui; Liu, ZhuangSmall (2013), 9 (9-10), 1492-1503CODEN: SMALBC; ISSN:1613-6810. (Wiley-VCH Verlag GmbH & Co. KGaA)A review. Graphene, as a class of 2D carbon nanomaterial, has attracted tremendous interest in different areas in recent years including biomedicine. The toxicity and behavior of graphene in biol. systems are thus important fundamental issues that require significant attention. In this article, the toxicity of graphene is reviewed by describing the behavior of graphene and its derivs. in microorganisms, cells, and animals. Despite certain inconsistencies in several detailed exptl. results and hypotheses of toxicity mechanisms, results from numerous reports all agree that the physicochem. properties such as surface functional groups, charges, coatings, sizes, and structural defects of graphene may affect its in vitro/in vivo behavior as well as its toxicity in biol. systems. It is hoped that this review article will provide an overview understanding of the impacts, behavior, and toxicol. of graphene and its derivs. in various biol. systems.
- 336Seabra, A. B.; Paula, A. J.; de Lima, R.; Alves, O. L.; Durán, N. Nanotoxicity of Graphene and Graphene Oxide. Chem. Res. Toxicol. 2014, 27, 159– 168, DOI: 10.1021/tx400385x[ACS Full Text
 ], [CAS], Google Scholar336https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2cXitFKjsA%253D%253D&md5=2cd380d9e3b577a6208e7fc694abd2c6Nanotoxicity of Graphene and Graphene OxideSeabra, Amedea B.; Paula, Amauri J.; de Lima, Renata; Alves, Oswaldo L.; Duran, NelsonChemical Research in Toxicology (2014), 27 (2), 159-168CODEN: CRTOEC; ISSN:0893-228X. (American Chemical Society)A review. Graphene and its derivs. are promising candidates for important biomedical applications because of their versatility. The prospective use of graphene-based materials in a biol. context requires a detailed comprehension of the toxicity of these materials. Moreover, due to the expanding applications of nanotechnol., human and environmental exposures to graphene-based nanomaterials are likely to increase in the future. Because of the potential risk factors assocd. with the manuf. and use of graphene-related materials, the no. of nanotoxicol. studies of these compds. has been increasing rapidly in the past decade. These studies have researched the effects of the nanostructural/biol. interactions on different organizational levels of the living system, from biomols. to animals. This review discusses recent results based on in vitro and in vivo cytotoxicity and genotoxicity studies of graphene-related materials and critically examines the methodologies employed to evaluate their toxicities. The environmental impact from the manipulation and application of graphene materials is also reported and discussed. Finally, this review presents mechanistic aspects of graphene toxicity in biol. systems. More detailed studies aiming to investigate the toxicity of graphene-based materials and to properly assoc. the biol. phenomenon with their chem., structural, and morphol. variations that result from several synthetic and processing possibilities are needed. Knowledge about graphene-based materials could ensure the safe application of this versatile material. Consequently, the focus of this review is to provide a source of inspiration for new nanotoxicol. approaches for graphene-based materials.
], [CAS], Google Scholar336https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2cXitFKjsA%253D%253D&md5=2cd380d9e3b577a6208e7fc694abd2c6Nanotoxicity of Graphene and Graphene OxideSeabra, Amedea B.; Paula, Amauri J.; de Lima, Renata; Alves, Oswaldo L.; Duran, NelsonChemical Research in Toxicology (2014), 27 (2), 159-168CODEN: CRTOEC; ISSN:0893-228X. (American Chemical Society)A review. Graphene and its derivs. are promising candidates for important biomedical applications because of their versatility. The prospective use of graphene-based materials in a biol. context requires a detailed comprehension of the toxicity of these materials. Moreover, due to the expanding applications of nanotechnol., human and environmental exposures to graphene-based nanomaterials are likely to increase in the future. Because of the potential risk factors assocd. with the manuf. and use of graphene-related materials, the no. of nanotoxicol. studies of these compds. has been increasing rapidly in the past decade. These studies have researched the effects of the nanostructural/biol. interactions on different organizational levels of the living system, from biomols. to animals. This review discusses recent results based on in vitro and in vivo cytotoxicity and genotoxicity studies of graphene-related materials and critically examines the methodologies employed to evaluate their toxicities. The environmental impact from the manipulation and application of graphene materials is also reported and discussed. Finally, this review presents mechanistic aspects of graphene toxicity in biol. systems. More detailed studies aiming to investigate the toxicity of graphene-based materials and to properly assoc. the biol. phenomenon with their chem., structural, and morphol. variations that result from several synthetic and processing possibilities are needed. Knowledge about graphene-based materials could ensure the safe application of this versatile material. Consequently, the focus of this review is to provide a source of inspiration for new nanotoxicol. approaches for graphene-based materials. - 337Costa, P. M.; Fadeel, B. Emerging Systems Biology Approaches in Nanotoxicology: Towards a Mechanism-Based Understanding of Nanomaterial Hazard and Risk. Toxicol. Appl. Pharmacol. 2016, 299, 101– 111, DOI: 10.1016/j.taap.2015.12.014[Crossref], [PubMed], [CAS], Google Scholar337https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC28Xhtlemsg%253D%253D&md5=276c63c57002fab03d0a710756898c4bEmerging systems biology approaches in nanotoxicology: Towards a mechanism-based understanding of nanomaterial hazard and riskCosta, Pedro M.; Fadeel, BengtToxicology and Applied Pharmacology (2016), 299 (), 101-111CODEN: TXAPA9; ISSN:0041-008X. (Elsevier Inc.)Engineered nanomaterials are being developed for a variety of technol. applications. However, the increasing use of nanomaterials in society has led to concerns about their potential adverse effects on human health and the environment. During the first decade of nanotoxicol. research, the realization has emerged that effective risk assessment of the multitudes of new nanomaterials would benefit from a comprehensive understanding of their toxicol. mechanisms, which is difficult to achieve with traditional, low-throughput, single end-point oriented approaches. Therefore, systems biol. approaches are being progressively applied within the nano(eco)toxicol. sciences. This novel paradigm implies that the study of biol. systems should be integrative resulting in quant. and predictive models of nanomaterial behavior in a biol. system. To this end, global 'omics' approaches with which to assess changes in genes, proteins, metabolites, etc. are deployed allowing for computational modeling of the biol. effects of nanomaterials. Here, we highlight omics and systems biol. studies in nanotoxicol., aiming towards the implementation of a systems nanotoxicol. and mechanism-based risk assessment of nanomaterials.
- 338Nel, A.; Xia, T.; Meng, H.; Wang, X.; Lin, S.; Ji, Z.; Zhang, H. Nanomaterial Toxicity Testing in the 21st Century: Use of a Predictive Toxicological Approach and High-Throughput Screening. Acc. Chem. Res. 2013, 46, 607– 621, DOI: 10.1021/ar300022h[ACS Full Text
 ], [CAS], Google Scholar338https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC38Xot1Olt78%253D&md5=d456ce272e7dcb58fc59450fb4fb991eNanomaterial Toxicity Testing in the 21st Century: Use of a Predictive Toxicological Approach and High-Throughput ScreeningNel, Andre; Xia, Tian; Meng, Huan; Wang, Xiang; Lin, Sijie; Ji, Zhaoxia; Zhang, HaiyuanAccounts of Chemical Research (2013), 46 (3), 607-621CODEN: ACHRE4; ISSN:0001-4842. (American Chemical Society)A review. The prodn. of engineered nanomaterials (ENMs) is a scientific breakthrough in material design and the development of new consumer products. While the successful implementation of nanotechnol. is important for the growth of the global economy, the authors also need to consider the possible environmental health and safety (EHS) impact as a result of the novel physicochem. properties that could generate hazardous biol. outcomes. To assess ENM hazard, reliable and reproducible screening approaches are needed to test the basic materials as well as nanoenabled products. A platform is required to investigate the potentially endless no. of biophysicochem. interactions at the nano/bio interface, in response to which the authors have developed a predictive toxicol. approach. The authors define a predictive toxicol. approach as the use of mechanisms-based high-throughput screening in vitro to make predictions about the physicochem. properties of ENMs that may lead to the generation of pathol. or disease outcomes in vivo. The in vivo results are used to validate and improve the in vitro high-throughput screening (HTS) and to establish structure-activity relationships (SARs) that allow hazard ranking and modeling by an appropriate combination of in vitro and in vivo testing. This notion is in agreement with the landmark 2007 report from the US National Academy of Sciences, "Toxicity Testing in the 21st Century: A Vision and a Strategy" (http://www.nap.edu/catalog.php?record_id=11970), which advocates increased efficiency of toxicity testing by transitioning from qual., descriptive animal testing to quant., mechanistic, and pathway-based toxicity testing in human cells or cell lines using high-throughput approaches. Accordingly, the authors have implemented HTS approaches to screen compositional and combinatorial ENM libraries to develop hazard ranking and structure-activity relationships that can be used for predicting in vivo injury outcomes. This predictive approach allows the bulk of the screening anal. and high-vol. data generation to be carried out in vitro, following which limited, but crit., validation studies are carried out in animals or whole organisms. Risk redn. in the exposed human or environmental populations can then focus on limiting or avoiding exposures that trigger these toxicol. responses as well as implementing safer design of potentially hazardous ENMs. In this Account, the authors review the tools required for establishing predictive toxicol. paradigms to assess inhalation and environmental toxicol. scenarios through the use of compositional and combinatorial ENM libraries, mechanism-based HTS assays, hazard ranking, and development of nano-SARs. The authors will discuss the major injury paradigms that have emerged based on specific ENM properties, as well as describing the safer design of ZnO nanoparticles based on characterization of dissoln. chem. as a major predictor of toxicity.
], [CAS], Google Scholar338https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC38Xot1Olt78%253D&md5=d456ce272e7dcb58fc59450fb4fb991eNanomaterial Toxicity Testing in the 21st Century: Use of a Predictive Toxicological Approach and High-Throughput ScreeningNel, Andre; Xia, Tian; Meng, Huan; Wang, Xiang; Lin, Sijie; Ji, Zhaoxia; Zhang, HaiyuanAccounts of Chemical Research (2013), 46 (3), 607-621CODEN: ACHRE4; ISSN:0001-4842. (American Chemical Society)A review. The prodn. of engineered nanomaterials (ENMs) is a scientific breakthrough in material design and the development of new consumer products. While the successful implementation of nanotechnol. is important for the growth of the global economy, the authors also need to consider the possible environmental health and safety (EHS) impact as a result of the novel physicochem. properties that could generate hazardous biol. outcomes. To assess ENM hazard, reliable and reproducible screening approaches are needed to test the basic materials as well as nanoenabled products. A platform is required to investigate the potentially endless no. of biophysicochem. interactions at the nano/bio interface, in response to which the authors have developed a predictive toxicol. approach. The authors define a predictive toxicol. approach as the use of mechanisms-based high-throughput screening in vitro to make predictions about the physicochem. properties of ENMs that may lead to the generation of pathol. or disease outcomes in vivo. The in vivo results are used to validate and improve the in vitro high-throughput screening (HTS) and to establish structure-activity relationships (SARs) that allow hazard ranking and modeling by an appropriate combination of in vitro and in vivo testing. This notion is in agreement with the landmark 2007 report from the US National Academy of Sciences, "Toxicity Testing in the 21st Century: A Vision and a Strategy" (http://www.nap.edu/catalog.php?record_id=11970), which advocates increased efficiency of toxicity testing by transitioning from qual., descriptive animal testing to quant., mechanistic, and pathway-based toxicity testing in human cells or cell lines using high-throughput approaches. Accordingly, the authors have implemented HTS approaches to screen compositional and combinatorial ENM libraries to develop hazard ranking and structure-activity relationships that can be used for predicting in vivo injury outcomes. This predictive approach allows the bulk of the screening anal. and high-vol. data generation to be carried out in vitro, following which limited, but crit., validation studies are carried out in animals or whole organisms. Risk redn. in the exposed human or environmental populations can then focus on limiting or avoiding exposures that trigger these toxicol. responses as well as implementing safer design of potentially hazardous ENMs. In this Account, the authors review the tools required for establishing predictive toxicol. paradigms to assess inhalation and environmental toxicol. scenarios through the use of compositional and combinatorial ENM libraries, mechanism-based HTS assays, hazard ranking, and development of nano-SARs. The authors will discuss the major injury paradigms that have emerged based on specific ENM properties, as well as describing the safer design of ZnO nanoparticles based on characterization of dissoln. chem. as a major predictor of toxicity. - 339Fadeel, B.; Farcal, L.; Hardy, B.; Vázquez-Campos, S.; Hristozov, D.; Marcomini, A.; Lynch, I.; Valsami-Jones, E.; Alenius, H.; Savolainen, K. Advanced Tools for the Safety Assessment of Nanomaterials. Nat. Nanotechnol. 2018, 13, 537– 543, DOI: 10.1038/s41565-018-0185-0[Crossref], [PubMed], [CAS], Google Scholar339https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC1cXhtlSjsrnP&md5=54220c1454805f6138590193f1b9e7b5Advanced tools for the safety assessment of nanomaterialsFadeel, Bengt; Farcal, Lucian; Hardy, Barry; Vazquez-Campos, Socorro; Hristozov, Danail; Marcomini, Antonio; Lynch, Iseult; Valsami-Jones, Eugenia; Alenius, Harri; Savolainen, KaiNature Nanotechnology (2018), 13 (7), 537-543CODEN: NNAABX; ISSN:1748-3387. (Nature Research)Engineered nanomaterials (ENMs) have tremendous potential to produce beneficial technol. impact in numerous sectors in society. Safety assessment is, of course, of paramount importance. However, the myriad variations of ENM properties makes the identification of specific features driving toxicity challenging. At the same time, reducing animal tests by introducing alternative and/or predictive in vitro and in silico methods has become a priority. It is important to embrace these new advances in the safety assessment of ENMs. Indeed, remarkable progress has been made in recent years with respect to mechanism-based hazard assessment of ENMs, including systems biol. approaches as well as high-throughput screening platforms, and new tools are also emerging in risk assessment and risk management for humans and the environment across the whole life-cycle of nano-enabled products. Here, we highlight some of the key advances in the hazard and risk assessment of ENMs.
- 340Brockmeier, E. K.; Hodges, G.; Hutchinson, T. H.; Butler, E.; Hecker, M.; Tollefsen, K. E.; Garcia-Reyero, N.; Kille, P.; Becker, D.; Chipman, K.; Colbourne, J.; Collette, T. W.; Cossins, A.; Cronin, M.; Graystock, P.; Gutsell, S.; Knapen, D.; Katsiadaki, I.; Lange, A.; Marshall, S. The Role of Omics in the Application of Adverse Outcome Pathways for Chemical Risk Assessment. Toxicol. Sci. 2017, 158, 252– 262, DOI: 10.1093/toxsci/kfx097[Crossref], [PubMed], [CAS], Google Scholar340https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC1cXjt1WrtLc%253D&md5=9a21c5896929bf796db4ff9dbb04fd98The role of omics in the application of adverse outcome pathways for chemical risk assessmentBrockmeier, Erica K.; Hodges, Geoff; Hutchinson, Thomas H.; Butler, Emma; Hecker, Markus; Tollefsen, Knut Erik; Garcia-Reyero, Natalia; Kille, Peter; Becker, Dorthe; Chipman, Kevin; Colbourne, John; Collette, Timothy W.; Cossins, Andrew; Cronin, Mark; Graystock, Peter; Gutsell, Steve; Knapen, Dries; Katsiadaki, Ioanna; Lange, Anke; Marshall, Stuart; Owen, Stewart F.; Perkins, Edward J.; Plaistow, Stewart; Schroeder, Anthony; Taylor, Daisy; Viant, Mark; Ankley, Gerald; Falciani, FrancescoToxicological Sciences (2017), 158 (2), 252-262CODEN: TOSCF2; ISSN:1096-0929. (Oxford University Press)A review. In conjunction with the second International Environmental Omics Symposium (iEOS) conference, held at the University of Liverpool (United Kingdom) in Sept. 2014, a workshop was held to bring together experts in toxicol. and regulatory science from academia, government and industry. The purpose of the workshop was to review the specific roles that high-content omics datasets (eg, transcriptomics, metabolomics, lipidomics, and proteomics) can hold within the adverse outcome pathway (AOP) framework for supporting ecol. and human health risk assessments. In light of the growing no. of examples of the application of omics data in the context of ecol. risk assessment, we considered how omics datasets might continue to support the AOP framework. In particular, the role of omics in identifying potential AOP mol. initiating events and providing supportive evidence of key events at different levels of biol. organization and across taxonomic groups was discussed. Areas with potential for short and medium-term breakthroughs were also discussed, such as providing mechanistic evidence to support chem. read-across, providing wt. of evidence information for mode of action assignment, understanding biol. networks, and developing robust extrapolations of species-sensitivity. Key challenges that need to be addressed were considered, including the need for a cohesive approach towards exptl. design, the lack of a mutually agreed framework to quant. link genes and pathways to key events, and the need for better interpretation of chem. induced changes at the mol. level. This article was developed to provide an overview of ecol. risk assessment process and a perspective on how high content mol.-level datasets can support the future of assessment procedures through the AOP framework.
- 341Wittwehr, C.; Aladjov, H.; Ankley, G.; Byrne, H. J.; de Knecht, J.; Heinzle, E.; Klambauer, G.; Landesmann, B.; Luijten, M.; MacKay, C.; Maxwell, G.; Meek, M. E.; Paini, A.; Perkins, E.; Sobanski, T.; Villeneuve, D.; Waters, K. M.; Whelan, M. How Adverse Outcome Pathways Can Aid the Development and Use of Computational Prediction Models for Regulatory Toxicology. Toxicol. Sci. 2017, 155, 326– 336, DOI: 10.1093/toxsci/kfw207[Crossref], [PubMed], [CAS], Google Scholar341https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC1cXhsFajsL0%253D&md5=2ee63942f5aa24b407e87aae8e917259How adverse outcome pathways can aid the development and use of computational prediction models for regulatory toxicologyWittwehr, Clemens; Aladjov, Hristo; Ankley, Gerald; Byrne, Hugh J.; de Knecht, Joop; Heinzle, Elmar; Klambauer, Gunter; Landesmann, Brigitte; Luijten, Mirjam; MacKay, Cameron; Maxwell, Gavin; Meek, M. E. Bette; Paini, Alicia; Perkins, Edward; Sobanski, Tomasz; Villeneuve, Dan; Waters, Katrina M.; Whelan, MauriceToxicological Sciences (2017), 155 (2), 326-336CODEN: TOSCF2; ISSN:1096-0929. (Oxford University Press)A review. Efforts are underway to transform regulatory toxicol. and chem. safety assessment from a largely empirical science based on direct observation of apical toxicity outcomes in whole organism toxicity tests to a predictive one in which outcomes and risk are inferred from accumulated mechanistic understanding. The adverse outcome pathway (AOP) framework provides a systematic approach for organizing knowledge that may support such inference. Likewise, computational models of biol. systems at various scales provide another means and platform to integrate current biol. understanding to facilitate inference and extrapolation. We argue that the systematic organization of knowledge into AOP frameworks can inform and help direct the design and development of computational prediction models that can further enhance the utility of mechanistic and in silico data for chem. safety assessment. This concept was explored as part of a workshop on AOP-Informed Predictive Modeling Approaches for Regulatory Toxicol. held Sept. 24-25, 2015. Examples of AOP-informed model development and its application to the assessment of chems. for skin sensitization and multiple modes of endocrine disruption are provided. The role of problem formulation, not only as a crit. phase of risk assessment, but also as guide for both AOP and complementary model development is described. Finally, a proposal for actively engaging the modeling community in AOP-informed computational model development is made. The contents serve as a vision for how AOPs can be leveraged to facilitate development of computational prediction models needed to support the next generation of chem. safety assessment.
- 342Worth, A.; Aschberger, K.; Bofill, D. A.; Bessems, J.; Gerloff, K.; Graepel, R.; Joossens, E.; Lamon, L.; Palosaari, T.; Richarz, A. Evaluation of the Availability and Applicability of Computational Approaches in the Safety Assessment of Nanomaterials Final Report of the Nanocomput Project. JRC Sci. Technol. Report. 2017, DOI: 10.2760/248139
- 343Burello, E. Review of (Q)SAR Models for Regulatory Assessment of Nanomaterials Risks. NanoImpact 2017, 8, 48– 58, DOI: 10.1016/j.impact.2017.07.002
- 344Grosse, Y.; Loomis, D.; Guyton, K. Z.; Lauby-Secretan, B.; El Ghissassi, F.; Bouvard, V.; Benbrahim-Tallaa, L.; Guha, N.; Scoccianti, C.; Mattock, H.; Straif, K. Carcinogenicity of Fluoro-Edenite, Silicon Carbide Fibres and Whiskers, and Carbon Nanotubes. Lancet Oncol. 2014, 15, 1427– 1428, DOI: 10.1016/S1470-2045(14)71109-X[Crossref], [PubMed], [CAS], Google Scholar344https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2cXhvVGks7jP&md5=e21e58269ad7cb899273cf43d860ae69Carcinogenicity of fluoro-edenite, silicon carbide fibres and whiskers, and carbon nanotubesGrosse, Yann; Loomis, Dana; Guyton, Kathryn Z.; Lauby-Secretan, Beatrice; El Ghissassi, Fatiha; Bouvard, Veronique; Benbrahim-Tallaa, Lamia; Guha, Neela; Scoccianti, Chiara; Mattock, Heidi; Straif, KurtLancet Oncology (2014), 15 (13), 1427-1428CODEN: LOANBN; ISSN:1470-2045. (Elsevier Ltd.)A review. This article focuses about the carcinogenicity of fluoro-edenite, silicon carbide fibers and whiskers, and carbon nanotubes including single-walled (SWCNTs) and multi-walled(MWCNTs) types. It also discusses about MWCNTs, SWCNTs induced genetic lesions like DNA strand breaks, oxidized DNA bases, mutations, micronucleus formation, and chromosomal aberrations in rodents and in cultured human lung or mesothelial cells. The authors concluded that fibrous silicon carbide is possibly carcinogenic to humans (Group 2B) based on limited evidence in humans that it causes lung cancer, and SWCNTs and MWCNTs excluding MWCNT-7 were categorized as not classifiable as to their carcinogenicity to humans (Group 3).
- 345Kurapati, R.; Mukherjee, S. P.; Martín, C.; Bepete, G.; Vázquez, E.; Pénicaud, A.; Fadeel, B.; Bianco, A. Degradation of Single-Layer and Few-Layer Graphene by Neutrophil Myeloperoxidase. Angew. Chem., Int. Ed. 2018, 57, 11722– 11727, DOI: 10.1002/anie.201806906[Crossref], [CAS], Google Scholar345https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC1cXhsVWhurvF&md5=e271ca63513cd7a71ffe382716bf2a53Degradation of single-layer and few-layer graphene by neutrophil myeloperoxidaseKurapati, Rajendra; Mukherjee, Sourav P.; Martin, Cristina; Bepete, George; Vazquez, Ester; Penicaud, Alain; Fadeel, Bengt; Bianco, AlbertoAngewandte Chemie, International Edition (2018), 57 (36), 11722-11727CODEN: ACIEF5; ISSN:1433-7851. (Wiley-VCH Verlag GmbH & Co. KGaA)Biodegradability of graphene is one of the fundamental parameters detg. the fate of this material in vivo. Two types of aq. dispersible graphene, corresponding to single-layer (SLG) and few-layer graphene (FLG), devoid of either chem. functionalization or stabilizing surfactants, were subjected to biodegrdn. by human myeloperoxidase (hMPO) mediated catalysis. Graphene biodegrdn. was also studied in the presence of activated, degranulating human neutrophils. The degrdn. of both FLG and SLG sheets was confirmed by Raman spectroscopy and electron microscopy analyses, leading to the conclusion that highly dispersed pristine graphene is not biopersistent.
- 346Kurapati, R.; Kostarelos, K.; Prato, M.; Bianco, A. Biomedical Uses for 2D Materials Beyond Graphene: Current Advances and Challenges Ahead. Adv. Mater. 2016, 28, 6052– 6074, DOI: 10.1002/adma.201506306[Crossref], [PubMed], [CAS], Google Scholar346https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC28Xms1KrtLY%253D&md5=00d6a23a34be14c124c3e2ad6095a815Biomedical Uses for 2D Materials Beyond Graphene: Current Advances and Challenges AheadKurapati, Rajendra; Kostarelos, Kostas; Prato, Maurizio; Bianco, AlbertoAdvanced Materials (Weinheim, Germany) (2016), 28 (29), 6052-6074CODEN: ADVMEW; ISSN:0935-9648. (Wiley-VCH Verlag GmbH & Co. KGaA)Currently, a broad interdisciplinary research effort is pursued on biomedical applications of 2D materials (2DMs) beyond graphene, due to their unique physicochem. and electronic properties. The discovery of new 2DMs is driven by the diverse chem. compns. and tuneable characteristics offered. Researchers are increasingly attracted to exploit those as drug delivery systems, highly efficient photothermal modalities, multimodal therapeutics with non-invasive diagnostic capabilities, biosensing, and tissue engineering. A crucial limitation of some of the 2DMs is their moderate colloidal stability in aq. media. In addn., the lack of suitable functionalization strategies should encourage the exploration of novel chem. methodologies with that purpose. Moreover, the clin. translation of these emerging materials will require undertaking of fundamental research on biocompatibility, toxicol. and biopersistence in the living body as well as in the environment. Here, a thorough account of the biomedical applications using 2DMs explored today is given.
- 347Guiney, L. M.; Wang, X.; Xia, T.; Nel, A. E.; Hersam, M. C. Assessing and Mitigating the Hazard Potential of Two-Dimensional Materials. ACS Nano 2018, 12, 6360– 6377, DOI: 10.1021/acsnano.8b02491[ACS Full Text
 ], [CAS], Google Scholar347https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC1cXhtFSrtLnN&md5=b7846c56dbaf5d3315e2c113ea66efabAssessing and Mitigating the Hazard Potential of Two-Dimensional MaterialsGuiney, Linda M.; Wang, Xiang; Xia, Tian; Nel, Andre E.; Hersam, Mark C.ACS Nano (2018), 12 (7), 6360-6377CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)The family of two-dimensional (2D) materials is comprised of a continually expanding palette of unique compns. and properties with potential applications in electronics, optoelectronics, energy capture and storage, catalysis, and nanomedicine. To accelerate the implementation of 2D materials in widely disseminated technologies, human health and environmental implications need to be addressed. While extensive research has focused on assessing the toxicity and environmental fate of graphene and related carbon nanomaterials, the potential hazards of other 2D materials have only recently begun to be explored. Herein, the toxicity and environmental fate of postcarbon 2D materials, such as transition metal dichalcogenides, hexagonal boron nitride, and black phosphorus, are reviewed as a function of their prepn. methods and surface functionalization. Specifically, we delineate how the hazard potential of 2D materials is directly related to structural parameters and physicochem. properties and how exptl. design is crit. to the accurate elucidation of the underlying toxicol. mechanisms. Finally, a multidisciplinary approach for streamlining the hazard assessment of emerging 2D materials is outlined, thereby providing a pathway for accelerating their safe use in a range of technol. relevant contexts.
], [CAS], Google Scholar347https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC1cXhtFSrtLnN&md5=b7846c56dbaf5d3315e2c113ea66efabAssessing and Mitigating the Hazard Potential of Two-Dimensional MaterialsGuiney, Linda M.; Wang, Xiang; Xia, Tian; Nel, Andre E.; Hersam, Mark C.ACS Nano (2018), 12 (7), 6360-6377CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)The family of two-dimensional (2D) materials is comprised of a continually expanding palette of unique compns. and properties with potential applications in electronics, optoelectronics, energy capture and storage, catalysis, and nanomedicine. To accelerate the implementation of 2D materials in widely disseminated technologies, human health and environmental implications need to be addressed. While extensive research has focused on assessing the toxicity and environmental fate of graphene and related carbon nanomaterials, the potential hazards of other 2D materials have only recently begun to be explored. Herein, the toxicity and environmental fate of postcarbon 2D materials, such as transition metal dichalcogenides, hexagonal boron nitride, and black phosphorus, are reviewed as a function of their prepn. methods and surface functionalization. Specifically, we delineate how the hazard potential of 2D materials is directly related to structural parameters and physicochem. properties and how exptl. design is crit. to the accurate elucidation of the underlying toxicol. mechanisms. Finally, a multidisciplinary approach for streamlining the hazard assessment of emerging 2D materials is outlined, thereby providing a pathway for accelerating their safe use in a range of technol. relevant contexts. - 348Faria, M.; Björnmalm, M.; Thurecht, K. J.; Kent, S. J.; Parton, R. G.; Kavallaris, M.; Johnston, A. P. R.; Gooding, J. J.; Corrie, S. R.; Boyd, B. J.; Thordarson, P.; Whittaker, A. K.; Stevens, M. M.; Prestidge, C. A.; Porter, C. J. H.; Parak, W. J.; Davis, T. P.; Crampin, E. J.; Caruso, F. Minimum Information Reporting in Bio–nano Experimental Literature. Nat. Nanotechnol. 2018, 13, 777– 785, DOI: 10.1038/s41565-018-0246-4[Crossref], [PubMed], [CAS], Google Scholar348https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC1cXhs1KnsrvP&md5=8df276a875711e35adde271273eafb1eMinimum information reporting in bio-nano experimental literatureFaria, Matthew; Bjornmalm, Mattias; Thurecht, Kristofer J.; Kent, Stephen J.; Parton, Robert G.; Kavallaris, Maria; Johnston, Angus P. R.; Gooding, J. Justin; Corrie, Simon R.; Boyd, Ben J.; Thordarson, Pall; Whittaker, Andrew K.; Stevens, Molly M.; Prestidge, Clive A.; Porter, Christopher J. H.; Parak, Wolfgang J.; Davis, Thomas P.; Crampin, Edmund J.; Caruso, FrankNature Nanotechnology (2018), 13 (9), 777-785CODEN: NNAABX; ISSN:1748-3387. (Nature Research)Studying the interactions between nanoengineered materials and biol. systems plays a vital role in the development of biol. applications of nanotechnol. and the improvement of our fundamental understanding of the bio-nano interface. A significant barrier to progress in this multidisciplinary area is the variability of published literature with regards to characterizations performed and exptl. details reported. Here, we suggest a 'min. information std.' for exptl. literature investigating bio-nano interactions. This std. consists of specific components to be reported, divided into three categories: material characterization, biol. characterization and details of exptl. protocols. Our intention is for these proposed stds. to improve reproducibility, increase quant. comparisons of bio-nano materials, and facilitate meta analyses and in silico modeling.
Cited By
Smart citations by scite.ai include citation statements extracted from the full text of the citing article. The number of the statements may be higher than the number of citations provided by ACS Publications if one paper cites another multiple times or lower if scite has not yet processed some of the citing articles.
- SupportingSupporting6
- MentioningMentioning302
- ContrastingContrasting0
This article is cited by 350 publications.
- Viviana González, Javier Frontiñan-Rubio, M. Victoria Gomez, Tiziano Montini, Mario Durán-Prado, Paolo Fornasiero, Maurizio Prato, Ester Vázquez. Easy and Versatile Synthesis of Bulk Quantities of Highly Enriched 13C-Graphene Materials for Biological and Safety Applications. ACS Nano 2023, 17 (1) , 606-620. https://doi.org/10.1021/acsnano.2c09799
- André F. Girão, María Concepcion Serrano, António Completo, Paula A. A. P. Marques. Is Graphene Shortening the Path toward Spinal Cord Regeneration?. ACS Nano 2022, 16 (9) , 13430-13467. https://doi.org/10.1021/acsnano.2c04756
- Chen-Xia Hu, Oliver Read, Yuyoung Shin, Yingxian Chen, Jingjing Wang, Matthew Boyes, Niting Zeng, Adyasha Panigrahi, Kostas Kostarelos, Igor Larrosa, Sandra Vranic, Cinzia Casiraghi. Effects of Lateral Size, Thickness, and Stabilizer Concentration on the Cytotoxicity of Defect-Free Graphene Nanosheets: Implications for Biological Applications. ACS Applied Nano Materials 2022, 5 (9) , 12626-12636. https://doi.org/10.1021/acsanm.2c02403
- Elena Briñas, Viviana Jehová González, María Antonia Herrero, Mohammed Zougagh, Ángel Ríos, Ester Vázquez. SERS-Based Methodology for the Quantification of Ultratrace Graphene Oxide in Water Samples. Environmental Science & Technology 2022, 56 (13) , 9527-9535. https://doi.org/10.1021/acs.est.2c00937
- Javier Frontiñan-Rubio, Emilio Llanos-González, Viviana Jehová González, Ester Vázquez, Mario Durán-Prado. Subchronic Graphene Exposure Reshapes Skin Cell Metabolism. Journal of Proteome Research 2022, 21 (7) , 1675-1685. https://doi.org/10.1021/acs.jproteome.2c00064
- Alagarsamy Vasanthakumar, Chandrababu Rejeeth, Raju Vivek, Thondhi Ponraj, Karunyadevi Jayaraman, Suresh Kumar Anandasadagopan, Puthamohan Vinayaga Moorthi. Design of Bio-Graphene-Based Multifunctional Nanocomposites Exhibits Intracellular Drug Delivery in Cervical Cancer Treatment. ACS Applied Bio Materials 2022, 5 (6) , 2956-2964. https://doi.org/10.1021/acsabm.2c00280
- Lin Bao, Xuejing Cui, Xiaoyu Wang, Junguang Wu, Mengyu Guo, Na Yan, Chunying Chen. Carbon Nanotubes Promote the Development of Intestinal Organoids through Regulating Extracellular Matrix Viscoelasticity and Intracellular Energy Metabolism. ACS Nano 2021, 15 (10) , 15858-15873. https://doi.org/10.1021/acsnano.1c03707
- Lan Qin, Dutao Yang, Shaoxian Yin, Yue Qian, Yanfei Cai, Jian Jin, Gang Huang, Zhaoqi Yang. Graphene Oxide Biosensors Based on Hybridization Chain Reaction Signal Amplification for Detecting Biomarkers of Radiation-Resistant Nasopharyngeal Carcinoma and Imaging in Living Cells. Langmuir 2021, 37 (32) , 9664-9672. https://doi.org/10.1021/acs.langmuir.1c00406
- Mawin J. Martinez Jimenez, Alba Avila, Anerise de Barros, Elvis Oswaldo Lopez, Fernando Alvarez, Antonio Riul, Jr, Jaime Andres Perez-Taborda. Polyethyleneimine-Functionalized Carbon Nanotube/Graphene Oxide Composite: A Novel Sensing Platform for Pb(II) Acetate in Aqueous Solution. ACS Omega 2021, 6 (28) , 18190-18199. https://doi.org/10.1021/acsomega.1c02085
- Xiaoyun He, Dan C. Sorescu, Alexander Star. Composition and Structure of Fluorescent Graphene Quantum Dots Generated by Enzymatic Degradation of Graphene Oxide. The Journal of Physical Chemistry C 2021, 125 (24) , 13361-13369. https://doi.org/10.1021/acs.jpcc.1c01564
- Ángel Serrano-Aroca, Kazuo Takayama, Alberto Tuñón-Molina, Murat Seyran, Sk. Sarif Hassan, Pabitra Pal Choudhury, Vladimir N. Uversky, Kenneth Lundstrom, Parise Adadi, Giorgio Palù, Alaa A. A. Aljabali, Gaurav Chauhan, Ramesh Kandimalla, Murtaza M. Tambuwala, Amos Lal, Tarek Mohamed Abd El-Aziz, Samendra Sherchan, Debmalya Barh, Elrashdy M. Redwan, Nicolas G. Bazan, Yogendra Kumar Mishra, Bruce D. Uhal, Adam Brufsky. Carbon-Based Nanomaterials: Promising Antiviral Agents to Combat COVID-19 in the Microbial-Resistant Era. ACS Nano 2021, 15 (5) , 8069-8086. https://doi.org/10.1021/acsnano.1c00629
- Hui Zeng, Xiangang Hu, Shaohu Ouyang, Qixing Zhou. Nanocolloids, but Not Humic Acids, Augment the Phytotoxicity of Single-Layer Molybdenum Disulfide Nanosheets. Environmental Science & Technology 2021, 55 (2) , 1122-1133. https://doi.org/10.1021/acs.est.0c05048
- Jou-Yu Lin, Pei-Xing Lai, Yuh-Chang Sun, Chih-Ching Huang, Cheng-Kuan Su. Biodistribution of Graphene Oxide Determined through Postadministration Labeling with DNA-Conjugated Gold Nanoparticles and ICPMS. Analytical Chemistry 2020, 92 (20) , 13997-14005. https://doi.org/10.1021/acs.analchem.0c02909
- Phillip Lu, Alireza Zehtab Yazdi, Xiao Xia Han, Khalsa Al Husaini, Jessica Haime, Naomi Waye, P. Chen. Mechanistic Insights into the Cytotoxicity of Graphene Oxide Derivatives in Mammalian Cells. Chemical Research in Toxicology 2020, 33 (9) , 2247-2260. https://doi.org/10.1021/acs.chemrestox.9b00391
- Anastasia Tkach, Uladzimir Fiadosenka, Aliaksandr Burko, Hanna Bandarenka, Anna Matsukovich, Nina Krekoten, Ljudmila Tabulina, Vladimir Labunov, Darya Radziuk. Poly(Vinyl Alcohol) Enhances Acetylation of Ascorbic Acid in Superparamagnetic Graphene Oxide Nanoparticles Ultrasonically Complexed with Acetylsalicylic Acid. ACS Applied Polymer Materials 2020, 2 (8) , 3663-3673. https://doi.org/10.1021/acsapm.0c00648
- Anastasia Tkach, Anna Matsukovich, Nina Krekoten, Ljudmila Tabulina, Vladimir Labunov, Darya Radziuk. Graphene-Oxide-Coated CuO Nanoparticles for Functionalization of Acetylsalicylic Acid and Diclofenac. ACS Applied Nano Materials 2020, 3 (6) , 5593-5604. https://doi.org/10.1021/acsanm.0c00852
- Carsten Weiss, Marie Carriere, Laura Fusco, Ilaria Capua, Jose Angel Regla-Nava, Matteo Pasquali, James A. Scott, Flavia Vitale, Mehmet Altay Unal, Cecilia Mattevi, Davide Bedognetti, Arben Merkoçi, Ennio Tasciotti, Açelya Yilmazer, Yury Gogotsi, Francesco Stellacci, Lucia Gemma Delogu. Toward Nanotechnology-Enabled Approaches against the COVID-19 Pandemic. ACS Nano 2020, 14 (6) , 6383-6406. https://doi.org/10.1021/acsnano.0c03697
- Giulia Cibecchini, Marina Veronesi, Tiziano Catelani, Tiziano Bandiera, Daniela Guarnieri, Pier Paolo Pompa. Antiangiogenic Effect of Graphene Oxide in Primary Human Endothelial Cells. ACS Applied Materials & Interfaces 2020, 12 (20) , 22507-22518. https://doi.org/10.1021/acsami.0c03404
- Yadong Lyu, Xiaohong Gu, Yimin Mao. Green Composite of Instant Coffee and Poly(vinyl alcohol): An Excellent Transparent UV-Shielding Material with Superior Thermal-Oxidative Stability. Industrial & Engineering Chemistry Research 2020, 59 (18) , 8640-8648. https://doi.org/10.1021/acs.iecr.0c00413
- Patrícia C. Henriques, Andreia T. Pereira, Ana L. Pires, André M. Pereira, Fernão D. Magalhães, Inês C. Gonçalves. Graphene Surfaces Interaction with Proteins, Bacteria, Mammalian Cells, and Blood Constituents: The Impact of Graphene Platelet Oxidation and Thickness. ACS Applied Materials & Interfaces 2020, 12 (18) , 21020-21035. https://doi.org/10.1021/acsami.9b21841
- Shaohu Ouyang, Qixing Zhou, Hui Zeng, Yue Wang, Xiangang Hu. Natural Nanocolloids Mediate the Phytotoxicity of Graphene Oxide. Environmental Science & Technology 2020, 54 (8) , 4865-4875. https://doi.org/10.1021/acs.est.9b07460
- Ana Domínguez-Bajo, Ankor González-Mayorga, Elisa López-Dolado, Carmen Munuera, Mar García-Hernández, María Concepción Serrano. Graphene Oxide Microfibers Promote Regenerative Responses after Chronic Implantation in the Cervical Injured Spinal Cord. ACS Biomaterials Science & Engineering 2020, 6 (4) , 2401-2414. https://doi.org/10.1021/acsbiomaterials.0c00345
- Yuchen Tong, Anqi Feng, Xuan Hou, Qixing Zhou, Xiangang Hu. Nanoholes Regulate the Phytotoxicity of Single-Layer Molybdenum Disulfide. Environmental Science & Technology 2019, 53 (23) , 13938-13948. https://doi.org/10.1021/acs.est.9b04198
- Eveline Tan, Bang Lin Li, Katsuhiko Ariga, Chwee-Teck Lim, Slaven Garaj, David Tai Leong. Toxicity of Two-Dimensional Layered Materials and Their Heterostructures. Bioconjugate Chemistry 2019, 30 (9) , 2287-2299. https://doi.org/10.1021/acs.bioconjchem.9b00502
- Lizanne Nilewski, Kimberly Mendoza, Almaz S. Jalilov, Vladimir Berka, Gang Wu, William K. A. Sikkema, Andrew Metzger, Ruquan Ye, Rui Zhang, Duy Xuan Luong, Tuo Wang, Emily McHugh, Paul J. Derry, Errol Loïc Samuel, Thomas A. Kent, Ah-Lim Tsai, James M. Tour. Highly Oxidized Graphene Quantum Dots from Coal as Efficient Antioxidants. ACS Applied Materials & Interfaces 2019, 11 (18) , 16815-16821. https://doi.org/10.1021/acsami.9b01082
- Giacomo Reina, Amalia Ruiz, Diane Murera, Yuta Nishina, Alberto Bianco. “Ultramixing”: A Simple and Effective Method To Obtain Controlled and Stable Dispersions of Graphene Oxide in Cell Culture Media. ACS Applied Materials & Interfaces 2019, 11 (8) , 7695-7702. https://doi.org/10.1021/acsami.8b18304
- Yeli Fan, Donghui Pan, Min Yang, Xinyu Wang. Radiolabelling and in vivo radionuclide imaging tracking of emerging pollutants in environmental toxicology: A review. Science of The Total Environment 2023, 866 , 161412. https://doi.org/10.1016/j.scitotenv.2023.161412
- Hao Ren, Yuanwei Pan, Jiahao Zhong, Jiayi Wang, Zhaoxiang Lu, Qian He, Shiying Zhou, Xiaoping Liao, Yahong Liu, Taicheng An, Jian Sun. An antibiotic-destructase-activated Fenton-like catalyst for synergistic removal of tetracycline residues from aquatic environment. Chemical Engineering Journal 2023, 459 , 141576. https://doi.org/10.1016/j.cej.2023.141576
- Shun Deng, Enming Zhang, Junyu Tao, Yunyang Zhao, Wenbo Huo, Hao Guo, Bingxin Zheng, Xiaoyuan Mu, Kezhu Yuan, Xuangen Deng, Hai Shen, Haibo Rong, Yanbo Ma, Wanping Bian. Graphene quantum dots (GQDs) induce thigmotactic effect in zebrafish larvae via modulating key genes and metabolites related to synaptic plasticity. Toxicology 2023, 487 , 153462. https://doi.org/10.1016/j.tox.2023.153462
- Mohd Hayrie Mohd Hatta, Juan Matmin, Nik Ahmad Nizam Nik Malek, Farah Hidayah Kamisan, Aishah Badruzzaman, Kalaivani Batumalaie, Siew Ling Lee, Roswanira Abdul Wahab. COVID‐19: Prevention, Detection, and Treatment by Using Carbon Nanotubes‐Based Materials. ChemistrySelect 2023, 8 (7) https://doi.org/10.1002/slct.202204615
- S. Sivaselvam, A. Mohankumar, R. Narmadha, R. Selvakumar, P. Sundararaj, C. Viswanathan, N. Ponpandian. Effect of gamma-ray irradiated reduced graphene oxide (rGO) on environmental health: An in-vitro and in-vivo studies. Environmental Pollution 2023, 318 , 120933. https://doi.org/10.1016/j.envpol.2022.120933
- Luigi Coppola, Tiziano Bellezze, Alberto Belli, Alessandra Bianco, Elisa Blasi, Miriam Cappello, Domenico Caputo, Mehdi Chougan, Denny Coffetti, Bartolomeo Coppola, Valeria Corinaldesi, Alberto D’Amore, Valeria Daniele, Luciano Di Maio, Luca Di Palma, Jacopo Donnini, Giuseppe Ferrara, Sara Filippi, Matteo Gastaldi, Nicola Generosi, Chiara Giosuè, Loredana Incarnato, Francesca Lamastra, Barbara Liguori, Ludovico Macera, Qaisar Maqbool, Maria Cristina Mascolo, Letterio Mavilia, Alida Mazzoli, Franco Medici, Alessandra Mobili, Giampiero Montesperelli, Giorgio Pia, Elena Redaelli, Maria Letizia Ruello, Paola Scarfato, Giuliana Taglieri, Francesca Tittarelli, Jean-Marc Tulliani, Antonino Valenza. New Materials and Technologies for Durability and Conservation of Building Heritage. Materials 2023, 16 (3) , 1190. https://doi.org/10.3390/ma16031190
- Shunyi Lu, Wen Chen, Jiayi Wang, Zilong Guo, Lan Xiao, Lingyu Wei, Jieqin Yu, Ya Yuan, Weisin Chen, Mengxuan Bian, Lei Huang, Yuanyuan Liu, Jian Zhang, Yu‐Lin Li, Li‐Bo Jiang. Polydopamine‐Decorated PLCL Conduit to Induce Synergetic Effect of Electrical Stimulation and Topological Morphology for Peripheral Nerve Regeneration. Small Methods 2023, 7 (2) , 2200883. https://doi.org/10.1002/smtd.202200883
- Artur Filipe Rodrigues, Ana P. M. Tavares, Susana Simões, Rui P. F. F. Silva, Tomás Sobrino, Bruno R. Figueiredo, Goreti Sales, Lino Ferreira. Engineering graphene-based electrodes for optical neural stimulation. Nanoscale 2023, 15 (2) , 687-706. https://doi.org/10.1039/D2NR05256C
- Davide Zanelli, Fabio Candotto Carniel, Lorenzo Fortuna, Elena Pavoni, Viviana Jehová González, Ester Vázquez, Maurizio Prato, Mauro Tretiach. Interactions of airborne graphene oxides with the sexual reproduction of a model plant: When production impurities matter. Chemosphere 2023, 312 , 137138. https://doi.org/10.1016/j.chemosphere.2022.137138
- Jingying Wu, Qing Liu, Shile Wang, Jinfang Sun, Ting Zhang. Trends and prospects in graphene and its derivatives toxicity research: A bibliometric analysis. Journal of Applied Toxicology 2023, 43 (1) , 146-166. https://doi.org/10.1002/jat.4373
- Huan Tang, Tong Yang, Lin Chen, Ying Zhang, Yinhua Zhu, Chen Wang, Dandan Liu, Qiuyan Guo, Guangqing Cheng, Fei Xia, Tianyu Zhong, Jigang Wang. Surface chemistry of graphene tailoring the activity of digestive enzymes by modulating interfacial molecular interactions. Journal of Colloid and Interface Science 2023, 630 , 179-192. https://doi.org/10.1016/j.jcis.2022.10.030
- Lauris Evariste, Florence Mouchet, Eric Pinelli, Emmanuel Flahaut, Laury Gauthier, Maialen Barret. Gut microbiota impairment following graphene oxide exposure is associated to physiological alterations in Xenopus laevis tadpoles. Science of The Total Environment 2023, 857 , 159515. https://doi.org/10.1016/j.scitotenv.2022.159515
- Xiaomeng Ding, Yuepu Pu, Meng Tang, Ting Zhang. Pulmonary hazard identifications of Graphene family nanomaterials: Adverse outcome pathways framework based on toxicity mechanisms. Science of The Total Environment 2023, 857 , 159329. https://doi.org/10.1016/j.scitotenv.2022.159329
- Qingnan Wu, Chenjie Fan, Hezhong Wang, Yanlai Han, Fuju Tai, Jiakai Wu, Hui Li, Rui He. Biphasic impacts of graphite-derived engineering carbon-based nanomaterials on plant performance: Effectiveness vs. nanotoxicity. Advanced Agrochem 2023, 56 https://doi.org/10.1016/j.aac.2023.01.001
- Guotao Peng, Hanna M. Sinkko, Harri Alenius, Neus Lozano, Kostas Kostarelos, Lars Bräutigam, Bengt Fadeel. Graphene oxide elicits microbiome-dependent type 2 immune responses via the aryl hydrocarbon receptor. Nature Nanotechnology 2023, 18 (1) , 42-48. https://doi.org/10.1038/s41565-022-01260-8
- Shashi Chawla, Prateek Rai. Current advancement and development of functionalized carbon nanomaterials for biomedical therapy. 2023, 381-413. https://doi.org/10.1016/B978-0-12-824366-4.00021-2
- Silvio Sosa, Aurelia Tubaro, Michela Carlin, Cristina Ponti, Ester Vázquez, Maurizio Prato, Marco Pelin. Assessment of skin sensitization properties of few-layer graphene and graphene oxide through the Local Lymph Node Assay (OECD TG 442B). NanoImpact 2023, 29 , 100448. https://doi.org/10.1016/j.impact.2022.100448
- Qiu-Hong Zhu, Guo-Hao Zhang, Lei Zhang, Jie Fu, Yue-Ru Zhou, Yu-Qin Xiang, Lijian Ma, Guo-Hong Tao, Ling He. Self-charge-carrying air filter by in situ polymerization to avoid charge dissipation and potential material poisoning. Chemical Engineering Journal 2022, 449 , 137788. https://doi.org/10.1016/j.cej.2022.137788
- Ritika Malhotra, Christian Eberhard Halbig, Yu Fan Sim, Chwee Teck Lim, David Tai Leong, A. H. Castro Neto, Slaven Garaj, Vinicius Rosa. Cytotoxicity survey of commercial graphene materials from worldwide. npj 2D Materials and Applications 2022, 6 (1) https://doi.org/10.1038/s41699-022-00330-8
- I. I. Kulakova, G. V. Lisichkin. Biosensors Based on Graphene Nanomaterials. Moscow University Chemistry Bulletin 2022, 77 (6) , 307-321. https://doi.org/10.3103/S0027131422060049
- Luis Augusto Visani de Luna, Thomas Loret, Alexander Fordham, Atta Arshad, Matthew Drummond, Abbie Dodd, Neus Lozano, Kostas Kostarelos, Cyrill Bussy. Lung recovery from DNA damage induced by graphene oxide is dependent on size, dose and inflammation profile. Particle and Fibre Toxicology 2022, 19 (1) https://doi.org/10.1186/s12989-022-00502-w
- Javier Frontiñan-Rubio, Viviana Jehová González, Ester Vázquez, Mario Durán-Prado. Rapid and efficient testing of the toxicity of graphene-related materials in primary human lung cells. Scientific Reports 2022, 12 (1) https://doi.org/10.1038/s41598-022-11840-2
- Kelli M. McCourt, Jarad Cochran, Sabah M. Abdelbasir, Elizabeth R. Carraway, Tzuen-Rong J. Tzeng, Olga V. Tsyusko, Diana C. Vanegas. Potential Environmental and Health Implications from the Scaled-Up Production and Disposal of Nanomaterials Used in Biosensors. Biosensors 2022, 12 (12) , 1082. https://doi.org/10.3390/bios12121082
- Jiulong Li, Graciel Diamante, In Sook Ahn, Darren Wijaya, Xiang Wang, Chong Hyun Chang, Sung-min Ha, Kavya Immadisetty, Huan Meng, André Nel, Xia Yang, Tian Xia. Determination of the nanoparticle- and cell-specific toxicological mechanisms in 3D liver spheroids using scRNAseq analysis. Nano Today 2022, 47 , 101652. https://doi.org/10.1016/j.nantod.2022.101652
- M. Connolly, G. Moles, F. Candotto Carniel, M. Tretiach, G. Caorsi, E. Flahaut, B. Soula, E. Pinelli, L. Gauthier, F. Mouchet, J.M. Navas. Applicability of OECD TG 201, 202, 203 for the aquatic toxicity testing and assessment of 2D Graphene material nanoforms to meet regulatory needs. NanoImpact 2022, 22 , 100447. https://doi.org/10.1016/j.impact.2022.100447
- Prasanta Kumar Sahoo, Gyanaprabha Nayak, Jagriti Gupta, Naresh Kumar Sahoo, Srikanta Sahu, Ankur Soam. 3D graphene‐based materials and their potential application on wastewater management. Environmental Quality Management 2022, 7 https://doi.org/10.1002/tqem.21946
- Juan Pablo González-Castillo, Esdras Alfredo Zamora-Morán, Lourdes Rodriguez-Fragoso. Advances in Graphene Platforms for Drug Delivery in Cancer and Its Biocompatibility. 2022https://doi.org/10.5772/intechopen.103688
- Shijie Yu, Longzhou Wang, Qinghai Li, Yanguo Zhang, Hui Zhou. Sustainable carbon materials from the pyrolysis of lignocellulosic biomass. Materials Today Sustainability 2022, 19 , 100209. https://doi.org/10.1016/j.mtsust.2022.100209
- Enguang Nie, Yandao Chen, Yuhui Lu, Lei Xu, Sufen Zhang, Zhiyang Yu, Qingfu Ye, Haiyan Wang. Reduced graphene oxide accelerates the dissipation of 14C-Triclosan in paddy soil via adsorption interactions. Chemosphere 2022, 307 , 136125. https://doi.org/10.1016/j.chemosphere.2022.136125
- Xin Ma, Liu Yang, Guoying Xu, Jianzhong Song. A comprehensive review of MXene-based nanofluids: Preparation, stability, physical properties, and applications. Journal of Molecular Liquids 2022, 365 , 120037. https://doi.org/10.1016/j.molliq.2022.120037
- Kabiru Haruna, Tawfik A. Saleh. The inhibition performance of diaminoalkanes functionalized GOs against carbon steel corrosion in 15% HCl environment. Chemical Engineering Journal 2022, 448 , 137402. https://doi.org/10.1016/j.cej.2022.137402
- Laura Fusco, Arianna Gazzi, Christopher E. Shuck, Marco Orecchioni, Dafne Alberti, Sènan Mickael D'Almeida, Darawan Rinchai, Eiman Ahmed, Ofer Elhanani, Martina Rauner, Barbara Zavan, Jean‐Charles Grivel, Leeat Keren, Giulia Pasqual, Davide Bedognetti, Klaus Ley, Yury Gogotsi, Lucia Gemma Delogu. Immune Profiling and Multiplexed Label‐Free Detection of 2D MXenes by Mass Cytometry and High‐Dimensional Imaging. Advanced Materials 2022, , 2205154. https://doi.org/10.1002/adma.202205154
- Rodrigo B. Capaz. Grand challenges in graphene and graphite research. Frontiers in Carbon 2022, 1 https://doi.org/10.3389/frcrb.2022.1034557
- N. Luo, X. J. Zhang, H. G. Zhang, D. Liu, H. X. Wang, J. F. Song. Graphene Oxide Influences on Bacterial Community Diversity of Larix olgensis Rhizosphere of Haplic Cambisols in Northeast China. Eurasian Soil Science 2022, 55 (10) , 1470-1481. https://doi.org/10.1134/S1064229322100106
- Daniela Iannazzo, Consuelo Celesti, Claudia Espro, Angelo Ferlazzo, Salvatore V. Giofrè, Mario Scuderi, Silvia Scalese, Bartolo Gabriele, Raffaella Mancuso, Ida Ziccarelli, Giuseppa Visalli, Angela Di Pietro. Orange-Peel-Derived Nanobiochar for Targeted Cancer Therapy. Pharmaceutics 2022, 14 (10) , 2249. https://doi.org/10.3390/pharmaceutics14102249
- Mohammad Hamidul Islam, Shaila Afroj, Mohammad Abbas Uddin, Daria V. Andreeva, Kostya S Novoselov, Nazmul Karim. Graphene and CNT‐Based Smart Fiber‐Reinforced Composites: A Review. Advanced Functional Materials 2022, 32 (40) , 2205723. https://doi.org/10.1002/adfm.202205723
- Lauris Evariste, Laura Lagier, Chloé Chary, Antoine Mottier, Stéphanie Cadarsi, Eric Pinelli, Emmanuel Flahaut, Laury Gauthier, Florence Mouchet. Exposure of Midge Larvae (Chironomus riparius) to Graphene Oxide Leads to Development Alterations. Toxics 2022, 10 (10) , 588. https://doi.org/10.3390/toxics10100588
- Daina Romeo, Chrysovalanto Louka, Berenice Gudino, Joakim Wigström, Peter Wick. Structure-activity relationship of graphene-related materials: A meta-analysis based on mammalian in vitro toxicity data. NanoImpact 2022, 28 , 100436. https://doi.org/10.1016/j.impact.2022.100436
- Sepidar Sayyar, Jo Law, Agnieszka Golda, Gregory Ryder, Gordon Wallace. Eco-friendly and mechanochemically functionalised graphene with quick and high water dispersibility. Materials Chemistry Frontiers 2022, 6 (18) , 2718-2728. https://doi.org/10.1039/D2QM00310D
- Vicente Orts Mercadillo, Kai Chio Chan, Mario Caironi, Athanassia Athanassiou, Ian A. Kinloch, Mark Bissett, Pietro Cataldi. Electrically Conductive 2D Material Coatings for Flexible and Stretchable Electronics: A Comparative Review of Graphenes and MXenes. Advanced Functional Materials 2022, 32 (38) , 2204772. https://doi.org/10.1002/adfm.202204772
- Vrushti Kansara, Sanjay Tiwari, Mitali Patel. Graphene quantum dots: A review on the effect of synthesis parameters and theranostic applications. Colloids and Surfaces B: Biointerfaces 2022, 217 , 112605. https://doi.org/10.1016/j.colsurfb.2022.112605
- Guotao Peng, Bengt Fadeel. Understanding the bidirectional interactions between two-dimensional materials, microorganisms, and the immune system. Advanced Drug Delivery Reviews 2022, 188 , 114422. https://doi.org/10.1016/j.addr.2022.114422
- Philipp Meier, Mahsa Zabara, Cordula Hirsch, Alexander Gogos, Dominic Tscherrig, Gilles Richner, Bernd Nowack, Peter Wick. Evaluation of fiber and debris release from protective COVID-19 mask textiles and in vitro acute cytotoxicity effects. Environment International 2022, 167 , 107364. https://doi.org/10.1016/j.envint.2022.107364
- Sergio Pinilla, João Coelho, Ke Li, Ji Liu, Valeria Nicolosi. Two-dimensional material inks. Nature Reviews Materials 2022, 7 (9) , 717-735. https://doi.org/10.1038/s41578-022-00448-7
- Živilė Jurgelėnė, Danguolė Montvydienė, Sergej Šemčuk, Milda Stankevičiūtė, Gintarė Sauliutė, Janina Pažusienė, Augustas Morkvėnas, Renata Butrimienė, Kęstutis Jokšas, Vidas Pakštas, Nijolė Kazlauskienė, Vitalijus Karabanovas. The impact of co-treatment with graphene oxide and metal mixture on Salmo trutta at early development stages: The sorption capacity and potential toxicity. Science of The Total Environment 2022, 838 , 156525. https://doi.org/10.1016/j.scitotenv.2022.156525
- Elena A. Chiticaru, Mariana Ionita. Graphene toxicity and future perspectives in healthcare and biomedicine. FlatChem 2022, 35 , 100417. https://doi.org/10.1016/j.flatc.2022.100417
- Eylem Asmatulu, Mohammad Nahid Andalib, Balakrishnan Subeshan, Farhana Abedin. Impact of nanomaterials on human health: a review. Environmental Chemistry Letters 2022, 20 (4) , 2509-2529. https://doi.org/10.1007/s10311-022-01430-z
- Yonghui Jin, Qiuju Du, Yanhui Li, Yang Zhang, Bing Chen, Mingzhen Wang, Kewei Chen, Yaohui Sun, Shiyong Zhao, Zhenyu Jing. Removal of Methylene Blue by Crosslinked Egg White Protein/Graphene Oxide Bionanocomposite Aerogels. Nanomaterials 2022, 12 (15) , 2659. https://doi.org/10.3390/nano12152659
- Sushma Thapa, Kshitij RB Singh, Ranjana Verma, Jay Singh, Ravindra Pratap Singh. State-of-the-Art Smart and Intelligent Nanobiosensors for SARS-CoV-2 Diagnosis. Biosensors 2022, 12 (8) , 637. https://doi.org/10.3390/bios12080637
- Hongshan San, Marianne Paresoglou, Michelle Minneboo, Ingmar A. J. van Hengel, Aytac Yilmaz, Yaiza Gonzalez-Garcia, Ad C. Fluit, Peter-Leon Hagedoorn, Lidy E. Fratila-Apachitei, Iulian Apachitei, Amir A. Zadpoor. Fighting Antibiotic-Resistant Bacterial Infections by Surface Biofunctionalization of 3D-Printed Porous Titanium Implants with Reduced Graphene Oxide and Silver Nanoparticles. International Journal of Molecular Sciences 2022, 23 (16) , 9204. https://doi.org/10.3390/ijms23169204
- Shaghayegh Kohzadi, Najmeh Najmoddin, Hadi Baharifar, Mahdi Shabani. Functionalized SPION immobilized on graphene-oxide: Anticancer and antiviral study. Diamond and Related Materials 2022, 127 , 109149. https://doi.org/10.1016/j.diamond.2022.109149
- Narsimha Mamidi, Ramiro Manuel Velasco Delgadillo, Enrique V. Barrera, Seeram Ramakrishna, Nasim Annabi. Carbonaceous nanomaterials incorporated biomaterials: The present and future of the flourishing field. Composites Part B: Engineering 2022, 243 , 110150. https://doi.org/10.1016/j.compositesb.2022.110150
- Savvina Chortarea, Ogul Can Kuru, Woranan Netkueakul, Marco Pelin, Sandeep Keshavan, Zhengmei Song, Baojin Ma, Julio Gómes, Elvira Villaro Abalos, Luis Augusto Visani de Luna, Thomas Loret, Alexander Fordham, Matthew Drummond, Nikolaos Kontis, George Anagnostopoulos, George Paterakis, Pietro Cataldi, Aurelia Tubaro, Costas Galiotis, Ian Kinloch, Bengt Fadeel, Cyrill Bussy, Kostas Kostarelos, Tina Buerki-Thurnherr, Maurizio Prato, Alberto Bianco, Peter Wick. Hazard assessment of abraded thermoplastic composites reinforced with reduced graphene oxide. Journal of Hazardous Materials 2022, 435 , 129053. https://doi.org/10.1016/j.jhazmat.2022.129053
- Arianna Dalla Colletta, Marco Pelin, Silvio Sosa, Laura Fusco, Maurizio Prato, Aurelia Tubaro. CARBON-BASED nanomaterials and SKIN: An overview. Carbon 2022, 196 , 683-698. https://doi.org/10.1016/j.carbon.2022.05.036
- Giacomo Reina, Cristian Gabellini, Maria Maranska, Fabian Grote, Shan Min Chin, Lucas Jacquemin, François Berger, Paola Posocco, Siegfried Eigler, Alberto Bianco. The importance of molecular structure and functionalization of oxo-graphene sheets for gene silencing. Carbon 2022, 195 , 69-79. https://doi.org/10.1016/j.carbon.2022.03.066
- Xudong Liu, Chao Yang, P. Chen, Lei Zhang, Yi Cao. The uses of transcriptomics and lipidomics indicated that direct contact with graphene oxide altered lipid homeostasis through ER stress in 3D human brain organoids. Science of The Total Environment 2022, , 157815. https://doi.org/10.1016/j.scitotenv.2022.157815
- Nandini Bhattacharya, David M. Cahill, Wenrong Yang, Mandira Kochar. Graphene as a nano-delivery vehicle in agriculture – current knowledge and future prospects. Critical Reviews in Biotechnology 2022, 10 , 1-19. https://doi.org/10.1080/07388551.2022.2090315
- Selsabil Rokia Laraba, Wei Luo, Amine Rezzoug, Qurat ul ain Zahra, Shihao Zhang, Bozhen Wu, Wen Chen, Lan Xiao, Yuhao Yang, Jie Wei, Yulin Li. Graphene-based composites for biomedical applications. Green Chemistry Letters and Reviews 2022, 15 (3) , 724-748. https://doi.org/10.1080/17518253.2022.2128698
- Md Raju Ahmed, Samantha Newby, Wajira Mirihanage, Prasad Potluri, Anura Fernando. Graphene in wearable textile sensor devices for healthcare. Textile Progress 2022, 54 (3) , 201-245. https://doi.org/10.1080/00405167.2022.2128015
- Woranan Netkueakul, Savvina Chortarea, Kornphimol Kulthong, Hao Li, Guangyu Qiu, Milijana Jovic, Sabyasachi Gaan, Yvette Hannig, Tina Buerki-Thurnherr, Peter Wick, Jing Wang. Airborne emissions from combustion of graphene nanoplatelet/epoxy composites and their cytotoxicity on lung cells via air-liquid interface cell exposure in vitro. NanoImpact 2022, 27 , 100414. https://doi.org/10.1016/j.impact.2022.100414
- Davide Zanelli, Fabio Candotto Carniel, Lorenzo Fortuna, Elena Pavoni, Viviana Jehová González, Ester Vázquez, Maurizio Prato, Mauro Tretiach. Is airborne graphene oxide a possible hazard for the sexual reproduction of wind-pollinated plants?. Science of The Total Environment 2022, 830 , 154625. https://doi.org/10.1016/j.scitotenv.2022.154625
- Farkad Bantun, Rajeev Singh, Mustfa F. Alkhanani, Atiah H. Almalki, Freah Alshammary, Saif Khan, Shafiul Haque, Manish Srivastava. Gut microbiome interactions with graphene based nanomaterials: Challenges and opportunities. Science of The Total Environment 2022, 830 , 154789. https://doi.org/10.1016/j.scitotenv.2022.154789
- Alessandro Silvestri, Cecilia Wetzl, Nuria Alegret, Lucia Cardo, Hui-Lei Hou, Alejandro Criado, Maurizio Prato. The era of nano-bionic: 2D materials for wearable and implantable body sensors. Advanced Drug Delivery Reviews 2022, 186 , 114315. https://doi.org/10.1016/j.addr.2022.114315
- Olha V. Rudnytska, Yuliia V. Kulish, Olena O. Khita, Dmytro O. Minchenko, Dariia O. Tsymbal, Yuliia M. Viletska, Myroslava Y. Sliusar, Dariia D. Trufanova, Oleksandr H. Minchenko. Exposure to nanographene oxide induces gene expression dysregulation in normal human astrocytes. Endocrine Regulations 2022, 56 (3) , 216-226. https://doi.org/10.2478/enr-2022-0023
- Giada Cellot, Audrey Franceschi Biagioni, Laura Ballerini. Nanomedicine and graphene-based materials: advanced technologies for potential treatments of diseases in the developing nervous system. Pediatric Research 2022, 92 (1) , 71-79. https://doi.org/10.1038/s41390-021-01681-6
- Josefa Domenech, Adriana Rodríguez-Garraus, Adela López de Cerain, Amaya Azqueta, Julia Catalán. Genotoxicity of Graphene-Based Materials. Nanomaterials 2022, 12 (11) , 1795. https://doi.org/10.3390/nano12111795
- Mohammad Mahdi Ghazimoradi, Mohammad Hossein Ghorbani, Ehsan Ebadian, Ali Hassani, Soheyl Mirzababaei, Mahshid Hodjat, Mona Navaei-Nigjeh, Mohammad Abdollahi. Epigenetic effects of graphene oxide and its derivatives: A mini-review. Mutation Research/Genetic Toxicology and Environmental Mutagenesis 2022, 878 , 503483. https://doi.org/10.1016/j.mrgentox.2022.503483
- Md Sazadul Hasan, Jingnuo Dong, Venkataramana Gadhamshetty, Mengistu Geza. Modeling graphene oxide transport and retention in biochar. Journal of Contaminant Hydrology 2022, 248 , 104014. https://doi.org/10.1016/j.jconhyd.2022.104014
- Davide Marin, Silvia Marchesan. Carbon Graphitization: Towards Greener Alternatives to Develop Nanomaterials for Targeted Drug Delivery. Biomedicines 2022, 10 (6) , 1320. https://doi.org/10.3390/biomedicines10061320
- Hana Bavorova, Tereza Svadlakova, Zdenek Fiala, Rishikaysh Pisal, Jaroslav Mokry. The Dose- and Time-Dependent Cytotoxic Effect of Graphene Nanoplatelets: In Vitro and In Vivo Study. Nanomaterials 2022, 12 (12) , 1978. https://doi.org/10.3390/nano12121978
- Haisu Ni, Shu Fang, Tanyu Wang, Yitao Liu, Hao Liu, Li Liu, Rui Wang. Flexible carbonized cotton/thermoplastic polyurethane composites with outstanding electric heating and pressure sensing performance. Textile Research Journal 2022, 92 (11-12) , 1760-1770. https://doi.org/10.1177/00405175211069888
- Santoshi U. Singh, Subhodeep Chatterjee, Shahbaz Ahmad Lone, Hsin-Hsuan Ho, Kuldeep Kaswan, Kiran Peringeth, Arshad Khan, Yun-Wei Chiang, Sangmin Lee, Zong-Hong Lin. Advanced wearable biosensors for the detection of body fluids and exhaled breath by graphene. Microchimica Acta 2022, 189 (6) https://doi.org/10.1007/s00604-022-05317-2
- Francesca Grilli, Parisa Hajimohammadi Gohari, Shan Zou. Characteristics of Graphene Oxide for Gene Transfection and Controlled Release in Breast Cancer Cells. International Journal of Molecular Sciences 2022, 23 (12) , 6802. https://doi.org/10.3390/ijms23126802
- Silvana Azevedo, Raquel Costa-Almeida, Susana G. Santos, Fernão D. Magalhães, Artur M. Pinto. Advances in carbon nanomaterials for immunotherapy. Applied Materials Today 2022, 27 , 101397. https://doi.org/10.1016/j.apmt.2022.101397
Abstrakt

Ryc. 1

Ryc. 1. Ramy klasyfikacji materiałów na bazie grafenu. Przedruk za zgodą ref (22). Prawa autorskie 2014 Wiley-VCH Verlag GmbH & Co, KGaA, Weinheim.
Ryc. 2

Ryc. 2. Biodystrybucja GO. Obrazowanie PET/CT i dystrybucja tkanek [64Cu]-f-GO-cienki, [64Cu]-f-GO-gruby, oraz [64Cu]-EDTA. (A) Obrazy PET/CT całego ciała myszy C57BL/6 wstrzykniętych dożylnie [64Cu]-f-GO-cienki (u góry) oraz [64Cu]-f-GO-gruby (na dole) w różnych punktach czasowych (1, 3.5, 24 h). (B) Krzywe czasowo-aktywne głównych narządów myszy C57BL/6, którym wstrzyknięto [64Cu]-f-GO-cienki, [64Cu]-f-GO-gruby i control [64Cu]-EDTA. (C) Obrazy PET/CT całego ciała myszy C57BL/6 wstrzykniętej dożylnie z próbką kontrolną [64Cu]-EDTA, wykazujący prawie całkowite wydalanie i brak akumulacji tkanek po 3 h. Przedruk za zgodą ref (40). Prawa autorskie 2016 Elsevier.
Ryc. 3

Figure 3. Macrophage uptake of GO. Primary human monocyte-derived macrophages readily ingest GO without ultrastructural signs of acute toxicity. Macrophages were incubated for 3 h with or without small or large GO (50 μg/mL). TEM images (scale bar: 2 μm) show (a) control cells, (b) cells exposed to GO-S, and (c) cells exposed to GO-L. Internalized GO can be seen in panels (b,c). Higher-magnification micrographs (scale bar: 1 μm) show (d) control cells, (e) cells exposed to GO-S, and (f,g) cells exposed to GO-L. The asterisk in panel (e) indicates GO sheets that are undergoing internalization. The asterisk in panel (f) shows a large aggregation of GO inside the cell, whereas the image in panel (g) shows the presence of GO sheets at the plasma membrane of the cell as well as GO internalized within the cell. The asterisk marks a mitochondrion, for comparison. Finally, at higher magnification (scale bar: 200 nm), the micrographs in panels (h,i) show internalized GO-S and GO-L, respectively. Reprinted with permission from ref (39). Copyright 2018 Wiley-VCH Verlag GmbH & Co.
Figure 4

Figure 4. Dissecting the immunological impact of graphene using single-cell mass cytometry. SPADE (spanning tree progression analysis of density-normalized events) clustering algorithm analysis of significantly secreted cytokines. The tree plots show the different immune cell subpopulations, and the size of each cluster in the tree indicates the relative frequency of cells that fall within the dimensional confines of the node boundaries. Node color is scaled to the median intensity of marker expression of the cells within each node, expressed as a percentage of the maximum value in the data set: (a) IL-6; (b) TNF-α, and (c) MIP-1β for GO (left) and GO-NH2 (right). Reprinted with permission from ref (134). Copyright 2017 Nature Publishing Group.
Figure 5

Figure 5. Carbon-based nanomaterials and the gut microbiome. Comparison of bacterial community abundance at phylum level after acute oral administration of SWCNTs, MWCNTs, and GO to mice (2.5 mg/kg for 7 days). The pie charts show the relative abundance of gut microbiota based on 16S rRNA gene sequencing. Reprinted with permission from ref (197). Copyright 2018 Wiley-VCH Verlag GmbH & Co.
Figure 6

Figure 6. Graphene interactions with neurons. Primary rat cortical neurons were exposed to FLG (here abbreviated GR) and GO flakes (1 and 10 μg/mL) for 96 h or 14 days or to equivalent volumes of the respective vehicles. SEM was used to study the interaction of flakes with neuronal cells. (e–h) Large number of flakes (white arrowheads) were found in contact with the cell membrane; however, cell morphology and network development were largely unaffected. (i–l) Cell uptake of FLG and GO and intracellular localization were studied by TEM. At 24 h, most of the flakes were found outside the cells (not shown). However, starting from 96 h, flakes were internalized into intracellular vesicles (i,j; black arrowheads) or free in the cytoplasm (l; black arrowheads). Reprinted from ref (218). Copyright 2016 American Chemical Society.
Figure 7

Figure 7. Graphene modulation of neuronal communication. (Top row) AFM topography reconstructions of glass control, single-layer graphene (SLG), multilayer graphene (MLG), and gold-plated glass surfaces. AFM documented a surface roughness of the materials that varied from 0.23 ± 0.02 nm for the control (n = 3), 1.5 ± 0.5 nm for SLG (n = 3), 20 ± 10 nm for MLG (n = 3), and 0.47 ± 0.1 nm for Au (n = 3). Scale bar, 5 μm. (Middle row) Representative SEM images depicting hippocampal neuron morphology after 10 days in vitro, supported by the different substrates. Culture substrates were not pretreated with additional adhesion molecules that might mask the effects of graphene. Scale bar, 10 μm. (Bottom row) SLG triggers changes in single-cell intrinsic excitability. Representative current-clamp recordings of hippocampal neurons in culture for 10 days. Control and SLG neurons displayed similar resting membrane potentials (−52 ± 10 mV in SLG; −50 ± 7 mV in control). When maintained at −60 mV, the spontaneous action potential firing was measured as summarized in the histograms (right). Note the significantly higher action potential frequency in SLG (2.60 ± 0.36 Hz in neurons grown on SLG, n = 21; 1.37 ± 0.26 Hz in control, n = 19; P = 0.0054). *P < 0.05, **P < 0.01. Reprinted with permission from ref (228). Copyright 2018 Nature Publishing Group.
Figure 8

Figure 8. Choosing the best dose metric. Growth inhibition in Xenopus laevis larvae after a 12 day exposure to few layer graphene, nanodiamonds, and double-walled or multiwalled carbon nanotubes. Normalized size (%) is plotted versus the base-10 logarithms of three different metrics: mass concentration (mg·L–1), number concentration (L–1), and surface area concentration (m2·L–1). Black dashed lines represent nonlinear regression model predictions, and shaded areas are 95% confidence intervals (CIs). The 95% CIs on the mean sizes are represented as vertical error bars. Reprinted from ref (298). Copyright 2016 American Chemical Society.
Figure 9

Figure 9. Life cycle analysis of graphene production. The chemical reduction route (CRR) and the ultrasonication route (USR) are two liquid phase exfoliation routes with industrial-scale potential at low costs. The figure illustrates the results of the sensitivity analysis. Reprinted from ref (218). Copyright 2016 American Chemical Society.
References
ARTICLE SECTIONSThis article references 348 other publications.
- 1Novoselov, K. S.; Fal'ko, V. I.; Colombo, L.; Gellert, P. R.; Schwab, M. G.; Kim, K. A Roadmap for Graphene. Nature 2012, 490, 192– 200, DOI: 10.1038/nature11458[Crossref], [PubMed], [CAS], Google Scholar1https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC38XhsVyrsrrO&md5=39fd29cc6d8a772bfa811f57bc142fd7A roadmap for grapheneNovoselov, K. S.; Fal'ko, V. I.; Colombo, L.; Gellert, P. R.; Schwab, M. G.; Kim, K.Nature (London, United Kingdom) (2012), 490 (7419), 192-200CODEN: NATUAS; ISSN:0028-0836. (Nature Publishing Group)A review. Recent years have witnessed many breakthroughs in research on graphene (the first 2D at. crystal) as well as a significant advance in the mass prodn. of this material. This one-atom-thick fabric of C uniquely combines extreme mech. strength, exceptionally high electronic and thermal conductivities, impermeability to gases, as well as many other supreme properties, all of which make it highly attractive for numerous applications. Here we review recent progress in graphene research and in the development of prodn. methods, and critically analyze the feasibility of various graphene applications.
- 2Ferrari, A. C.; Bonaccorso, F.; Fal’ko, V.; Novoselov, K. S.; Roche, S.; Bøggild, P.; Borini, S.; Koppens, F. H. L.; Palermo, V.; Pugno, N.; Garrido, J. A.; Sordan, R.; Bianco, A.; Ballerini, L.; Prato, M.; Lidorikis, E.; Kivioja, J.; Marinelli, C.; Ryhänen, T.; Morpurgo, A. Science and Technology Roadmap for Graphene, Related Two-Dimensional Crystals, and Hybrid Systems. Nanoscale 2015, 7, 4598– 4810, DOI: 10.1039/C4NR01600A[Crossref], [PubMed], [CAS], Google Scholar2https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2cXhsFyhu77K&md5=65926c599802eaf69f8e1b3160cc0189Science and technology roadmap for graphene, related two-dimensional crystals, and hybrid systemsFerrari, Andrea C.; Bonaccorso, Francesco; Fal'ko, Vladimir; Novoselov, Konstantin S.; Roche, Stephan; Boeggild, Peter; Borini, Stefano; Koppens, Frank H. L.; Palermo, Vincenzo; Pugno, Nicola; Garrido, Jose A.; Sordan, Roman; Bianco, Alberto; Ballerini, Laura; Prato, Maurizio; Lidorikis, Elefterios; Kivioja, Jani; Marinelli, Claudio; Ryhanen, Tapani; Morpurgo, Alberto; Coleman, Jonathan N.; Nicolosi, Valeria; Colombo, Luigi; Fert, Albert; Garcia-Hernandez, Mar; Bachtold, Adrian; Schneider, Gregory F.; Guinea, Francisco; Dekker, Cees; Barbone, Matteo; Sun, Zhipei; Galiotis, Costas; Grigorenko, Alexander N.; Konstantatos, Gerasimos; Kis, Andras; Katsnelson, Mikhail; Vandersypen, Lieven; Loiseau, Annick; Morandi, Vittorio; Neumaier, Daniel; Treossi, Emanuele; Pellegrini, Vittorio; Polini, Marco; Tredicucci, Alessandro; Williams, Gareth M.; Hee Hong, Byung; Ahn, Jong-Hyun; Min Kim, Jong; Zirath, Herbert; van Wees, Bart J.; van der Zant, Herre; Occhipinti, Luigi; Di Matteo, Andrea; Kinloch, Ian A.; Seyller, Thomas; Quesnel, Etienne; Feng, Xinliang; Teo, Ken; Rupesinghe, Nalin; Hakonen, Pertti; Neil, Simon R. T.; Tannock, Quentin; Lofwander, Tomas; Kinaret, JariNanoscale (2015), 7 (11), 4598-4810CODEN: NANOHL; ISSN:2040-3372. (Royal Society of Chemistry)A review. We present the science and technol. roadmap for graphene, related two-dimensional crystals, and hybrid systems, targeting an evolution in technol., that might lead to impacts and benefits reaching into most areas of society. This roadmap was developed within the framework of the European Graphene Flagship and outlines the main targets and research areas as best understood at the start of this ambitious project. We provide an overview of the key aspects of graphene and related materials (GRMs), ranging from fundamental research challenges to a variety of applications in a large no. of sectors, highlighting the steps necessary to take GRMs from a state of raw potential to a point where they might revolutionize multiple industries. We also define an extensive list of acronyms in an effort to standardize the nomenclature in this emerging field.
- 3Bianco, A.; Prato, M. Safety Concerns on Graphene and 2D Materials: A Flagship Perspective. 2D Mater. 2015, 2, 030201, DOI: 10.1088/2053-1583/2/3/030201
- 4Park, M. V. D. Z.; Bleeker, E. A. J.; Brand, W.; Cassee, F. R.; van Elk, M.; Gosens, I.; de Jong, W. H.; Meesters, J. A. J.; Peijnenburg, W. J. G. M.; Quik, J. T. K.; Vandebriel, R. J.; Sips, A. J. A. M. Considerations for Safe Innovation: The Case of Graphene. ACS Nano 2017, 11, 9574– 9593, DOI: 10.1021/acsnano.7b04120[ACS Full Text
 ], [CAS], Google Scholar4https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2sXhsFensLjF&md5=c4d3e30331adb4b3929e605877b64897Considerations for Safe Innovation: The Case of GraphenePark, Margriet V. D. Z.; Bleeker, Eric A. J.; Brand, Walter; Cassee, Flemming R.; van Elk, Merel; Gosens, Ilse; de Jong, Wim H.; Meesters, Johannes A. J.; Peijnenburg, Willie J. G. M.; Quik, Joris T. K.; Vandebriel, Rob J.; Sips, Adrienne J. A. M.ACS Nano (2017), 11 (10), 9574-9593CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)A review. The terms safe innovation and safe(r)-by-design are currently popular in the field of nanotechnol. These terms are used to describe approaches that advocate the consideration of safety aspects already at an early stage of the innovation process of (nano)materials and nanoenabled products. Here, we investigate the possibilities of considering safety aspects during various stages of the innovation process of graphene, outlining what information is already available for assessing potential hazard, exposure, and risks. In addn., we recommend further steps to be taken by various stakeholders to promote the safe prodn. and safe use of graphene.
], [CAS], Google Scholar4https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2sXhsFensLjF&md5=c4d3e30331adb4b3929e605877b64897Considerations for Safe Innovation: The Case of GraphenePark, Margriet V. D. Z.; Bleeker, Eric A. J.; Brand, Walter; Cassee, Flemming R.; van Elk, Merel; Gosens, Ilse; de Jong, Wim H.; Meesters, Johannes A. J.; Peijnenburg, Willie J. G. M.; Quik, Joris T. K.; Vandebriel, Rob J.; Sips, Adrienne J. A. M.ACS Nano (2017), 11 (10), 9574-9593CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)A review. The terms safe innovation and safe(r)-by-design are currently popular in the field of nanotechnol. These terms are used to describe approaches that advocate the consideration of safety aspects already at an early stage of the innovation process of (nano)materials and nanoenabled products. Here, we investigate the possibilities of considering safety aspects during various stages of the innovation process of graphene, outlining what information is already available for assessing potential hazard, exposure, and risks. In addn., we recommend further steps to be taken by various stakeholders to promote the safe prodn. and safe use of graphene. - 5Poland, C. A.; Duffin, R.; Kinloch, I.; Maynard, A.; Wallace, W. A. H.; Seaton, A.; Stone, V.; Brown, S.; MacNee, W.; Donaldson, K. Carbon Nanotubes Introduced into the Abdominal Cavity of Mice Show Asbestos-like Pathogenicity in a Pilot Study. Nat. Nanotechnol. 2008, 3, 423– 428, DOI: 10.1038/nnano.2008.111[Crossref], [PubMed], [CAS], Google Scholar5https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BD1cXotFehs7o%253D&md5=54ae8b1abbe311ade69bb8255891b407Carbon nanotubes introduced into the abdominal cavity of mice show asbestos-like pathogenicity in a pilot studyPoland, Craig A.; Duffin, Rodger; Kinloch, Ian; Maynard, Andrew; Wallace, William A. H.; Seaton, Anthony; Stone, Vicki; Brown, Simon; MacNee, William; Donaldson, KenNature Nanotechnology (2008), 3 (7), 423-428CODEN: NNAABX; ISSN:1748-3387. (Nature Publishing Group)Carbon nanotubes have distinctive characteristics, but their needle-like fiber shape has been compared to asbestos, raising concerns that widespread use of carbon nanotubes may lead to mesothelioma, cancer of the lining of the lungs caused by exposure to asbestos. Exposing the mesothelial lining of the body cavity of mice, as a surrogate for the mesothelial lining of the chest cavity, to long multiwalled carbon nanotubes results in asbestos-like, length-dependent, pathogenic behavior. This includes inflammation and the formation of lesions known as granulomas. This is of considerable importance, because research and business communities continue to invest heavily in carbon nanotubes for a wide range of products under the assumption that they are no more hazardous than graphite. The authors' results suggest the need for further research and great caution before introducing such products into the market if long-term harm is to be avoided. A pilot study in a small no. of mice shows that long multiwalled carbon nanotubes introduced into the abdominal cavity can cause asbestos-like pathogenic behavior. The results suggest the need for further research and caution before introducing nanotube products into the market.
- 6Kuempel, E. D.; Jaurand, M.-C.; Møller, P.; Morimoto, Y.; Kobayashi, N.; Pinkerton, K. E.; Sargent, L. M.; Vermeulen, R. C. H.; Fubini, B.; Kane, A. B. Evaluating the Mechanistic Evidence and Key Data Gaps in Assessing the Potential Carcinogenicity of Carbon Nanotubes and Nanofibers in Humans. Crit. Rev. Toxicol. 2017, 47, 1– 58, DOI: 10.1080/10408444.2016.1206061[Crossref], [PubMed], [CAS], Google Scholar6https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC28XhsVSlurnL&md5=ca1dc533df738b01b82cb52446fa317aEvaluating the mechanistic evidence and key data gaps in assessing the potential carcinogenicity of carbon nanotubes and nanofibers in humansKuempel, Eileen D.; Jaurand, Marie-Claude; Moeller, Peter; Morimoto, Yasuo; Kobayashi, Norihiro; Pinkerton, Kent E.; Sargent, Linda M.; Vermeulen, Roel C. H.; Fubini, Bice; Kane, Agnes B.Critical Reviews in Toxicology (2017), 47 (1), 1-58CODEN: CRTXB2; ISSN:1040-8444. (Taylor & Francis Ltd.)In an evaluation of carbon nanotubes (CNTs) for the IARC Monograph 111, the Mechanisms Subgroup was tasked with assessing the strength of evidence on the potential carcinogenicity of CNTs in humans. The mechanistic evidence was considered to be not strong enough to alter the evaluations based on the animal data. In this paper, we provide an extended, in-depth examn. of the in vivo and in vitro exptl. studies according to current hypotheses on the carcinogenicity of inhaled particles and fibers. We cite addnl. studies of CNTs that were not available at the time of the IARC meeting in Oct. 2014, and extend our evaluation to include carbon nanofibers (CNFs). Finally, we identify key data gaps and suggest research needs to reduce uncertainty. The focus of this review is on the cancer risk to workers exposed to airborne CNT or CNF during the prodn. and use of these materials. The findings of this review, in general, affirm those of the original evaluation on the inadequate or limited evidence of carcinogenicity for most types of CNTs and CNFs at this time, and possible carcinogenicity of one type of CNT (MWCNT-7). The key evidence gaps to be filled by research include: investigation of possible assocns. between in vitro and early-stage in vivo events that may be predictive of lung cancer or mesothelioma, and systematic anal. of dose-response relationships across materials, including evaluation of the influence of physico-chem. properties and exptl. factors on the observation of nonmalignant and malignant endpoints.
- 7Kostarelos, K.; Lacerda, L.; Pastorin, G.; Wu, W.; Wieckowski, S.; Luangsivilay, J.; Godefroy, S.; Pantarotto, D.; Briand, J.-P.; Muller, S.; Prato, M.; Bianco, A. Cellular Uptake of Functionalized Carbon Nanotubes Is Independent of Functional Group and Cell Type. Nat. Nanotechnol. 2007, 2, 108– 113, DOI: 10.1038/nnano.2006.209[Crossref], [PubMed], [CAS], Google Scholar7https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BD2sXit1Wrtrs%253D&md5=030c99a00e958dd35bc1a8607c882a54Cellular uptake of functionalized carbon nanotubes is independent of functional group and cell typeKostarelos, Kostas; Lacerda, Lara; Pastorin, Giorgia; Wu, Wei; Wieckowski, Sebastien; Luangsivilay, Jacqueline; Godefroy, Sylvie; Pantarotto, Davide; Briand, Jean-Paul; Muller, Sylviane; Prato, Maurizio; Bianco, AlbertoNature Nanotechnology (2007), 2 (2), 108-113CODEN: NNAABX; ISSN:1748-3387. (Nature Publishing Group)The development of nanomaterials for biomedical and biotechnol. applications is an area of research that holds great promise and intense interest, and carbon-based nanostructures in particular, such as carbon nanotubes (CNTs), are attracting an increasing level of attention. One of the key advantages that CNTs offer is the possibility of effectively crossing biol. barriers, which would allow their use in the delivery of therapeutically active mols. The authors' labs. have been investigating the use of CNTs in biomedical applications, and in particular as nanovectors for therapeutic agent delivery. The interaction between cells and CNTs is a crit. issue that will det. any future biol. application of such structures. Various types of functionalized carbon nanotubes (f-CNTs) exhibit a capacity to be taken up by a wide range of cells and can intracellularly traffic through different cellular barriers.
- 8Schipper, M. L.; Nakayama-Ratchford, N.; Davis, C. R.; Kam, N. W. S.; Chu, P.; Liu, Z.; Sun, X.; Dai, H.; Gambhir, S. S. A Pilot Toxicology Study of Single-Walled Carbon Nanotubes in a Small Sample of Mice. Nat. Nanotechnol. 2008, 3, 216– 221, DOI: 10.1038/nnano.2008.68[Crossref], [PubMed], [CAS], Google Scholar8https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BD1cXkt1Slu7w%253D&md5=814b1f01559c4f5071a5b81c4e94c64aA pilot toxicology study of single-walled carbon nanotubes in a small sample of miceSchipper, Meike L.; Nakayama-Ratchford, Nozomi; Davis, Corrine R.; Kam, Nadine Wong Shi; Chu, Pauline; Liu, Zhuang; Sun, Xiaoming; Dai, Hongjie; Gambhir, Sanjiv S.Nature Nanotechnology (2008), 3 (4), 216-221CODEN: NNAABX; ISSN:1748-3387. (Nature Publishing Group)Single-walled carbon nanotubes are currently under evaluation in biomedical applications, including in vivo delivery of drugs, proteins, peptides, and nucleic acids (for gene transfer or gene silencing), in vivo tumor imaging, and tumor targeting of single-walled carbon nanotubes as an antineoplastic treatment. However, concerns about the potential toxicity of single-walled carbon nanotubes have been raised. Here the authors examine the acute and chronic toxicity of functionalized single-walled carbon nanotubes when injected into the bloodstream of mice. Survival, clin., and lab. parameters reveal no evidence of toxicity over 4 mo. Upon killing, careful necropsy and tissue histol. show age-related changes only. Histol. and Raman microscopic mapping demonstrate that functionalized single-walled carbon nanotubes persisted within liver and spleen macrophages for 4 mo without apparent toxicity. Although this is a preliminary study with a small group of animals, the results encourage further confirmation studies with larger groups of animals.
- 9Kagan, V. E.; Konduru, N. V.; Feng, W.; Allen, B. L.; Conroy, J.; Volkov, Y.; Vlasova, I. I.; Belikova, N. A.; Yanamala, N.; Kapralov, A.; Tyurina, Y. Y.; Shi, J.; Kisin, E. R.; Murray, A. R.; Franks, J.; Stolz, D.; Gou, P.; Klein-Seetharaman, J.; Fadeel, B.; Star, A. Carbon Nanotubes Degraded by Neutrophil Myeloperoxidase Induce Less Pulmonary Inflammation. Nat. Nanotechnol. 2010, 5, 354– 359, DOI: 10.1038/nnano.2010.44[Crossref], [PubMed], [CAS], Google Scholar9https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3cXls12isb4%253D&md5=20b56ba9ecf823553930816138b3dffeCarbon nanotubes degraded by neutrophil myeloperoxidase induce less pulmonary inflammationKagan, Valerian E.; Konduru, Nagarjun V.; Feng, Weihong; Allen, Brett L.; Conroy, Jennifer; Volkov, Yuri; Vlasova, Irina I.; Belikova, Natalia A.; Yanamala, Naveena; Kapralov, Alexander; Tyurina, Yulia Y.; Shi, Jingwen; Kisin, Elena R.; Murray, Ashley R.; Franks, Jonathan; Stolz, Donna; Gou, Pingping; Klein-Seetharaman, Judith; Fadeel, Bengt; Star, Alexander; Shvedova, Anna A.Nature Nanotechnology (2010), 5 (5), 354-359CODEN: NNAABX; ISSN:1748-3387. (Nature Publishing Group)We have shown previously that single-walled carbon nanotubes can be catalytically biodegraded over several weeks by the plant-derived enzyme, horseradish peroxidase. However, whether peroxidase intermediates generated inside human cells or biofluids are involved in the biodegrdn. of carbon nanotubes has not been explored. Here, we show that hypochlorite and reactive radical intermediates of the human neutrophil enzyme myeloperoxidase catalyze the biodegrdn. of single-walled carbon nanotubes in vitro, in neutrophils and to a lesser degree in macrophages. Mol. modeling suggests that interactions of basic amino acids of the enzyme with the carboxyls on the carbon nanotubes position the nanotubes near the catalytic site. Importantly, the biodegraded nanotubes do not generate an inflammatory response when aspirated into the lungs of mice. Our findings suggest that the extent to which carbon nanotubes are biodegraded may be a major determinant of the scale and severity of the assocd. inflammatory responses in exposed individuals.
- 10Bhattacharya, K.; Mukherjee, S. P.; Gallud, A.; Burkert, S. C.; Bistarelli, S.; Bellucci, S.; Bottini, M.; Star, A.; Fadeel, B. Biological Interactions of Carbon-Based Nanomaterials: From Coronation to Degradation. Nanomedicine 2016, 12, 333– 351, DOI: 10.1016/j.nano.2015.11.011[Crossref], [PubMed], [CAS], Google Scholar10https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC28XlvVCqsA%253D%253D&md5=27801167ac52dbd5af33a2d2e1a34d4fBiological interactions of carbon-based nanomaterials: From coronation to degradationBhattacharya, Kunal; Mukherjee, Sourav P.; Gallud, Audrey; Burkert, Seth C.; Bistarelli, Silvia; Bellucci, Stefano; Bottini, Massimo; Star, Alexander; Fadeel, BengtNanomedicine (New York, NY, United States) (2016), 12 (2), 333-351CODEN: NANOBF; ISSN:1549-9634. (Elsevier)Carbon-based nanomaterials including carbon nanotubes, graphene oxide, fullerenes and nanodiamonds are potential candidates for various applications in medicine such as drug delivery and imaging. However, the successful translation of nanomaterials for biomedical applications is predicated on a detailed understanding of the biol. interactions of these materials. Indeed, the potential impact of the so-called bio-corona of proteins, lipids, and other biomols. on the fate of nanomaterials in the body should not be ignored. Enzymic degrdn. of carbon-based nanomaterials by immune-competent cells serves as a special case of bio-corona interactions with important implications for the medical use of such nanomaterials. In the present review, we highlight emerging biomedical applications of carbon-based nanomaterials. We also discuss recent studies on nanomaterial 'coronation' and how this impacts on biodistribution and targeting along with studies on the enzymic degrdn. of carbon-based nanomaterials, and the role of surface modification of nanomaterials for these biol. interactions.
- 11Shvedova, A. A.; Kagan, V. E.; Fadeel, B. Close Encounters of the Small Kind: Adverse Effects of Man-Made Materials Interfacing with the Nano-Cosmos of Biological Systems. Annu. Rev. Pharmacol. Toxicol. 2010, 50, 63– 88, DOI: 10.1146/annurev.pharmtox.010909.105819[Crossref], [PubMed], [CAS], Google Scholar11https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3cXisVeltbk%253D&md5=c4127a2971a72e3a98af19580c0ad62dClose encounters of the small kind: adverse effects of man-made materials interfacing with the nano-cosmos of biological systemsShvedova, Anna A.; Kagan, Valerian E.; Fadeel, BengtAnnual Review of Pharmacology and Toxicology (2010), 50 (), 63-88CODEN: ARPTDI; ISSN:0362-1642. (Annual Reviews Inc.)A review. Engineered nanomaterials have unique physico-chem. properties that make them promising for many technol. and biomedical applications, including tissue regeneration, drug and gene delivery, and in vivo monitoring of disease processes. However, with the burgeoning capabilities to manipulate structures at the nano-scale, intentional as well as unintentional human exposures to engineered nanomaterials are set to increase. Nanotoxicol. is an emerging discipline focused on understanding the properties of engineered nanomaterials and their interactions with biol. systems, and may be viewed as the study of the undesirable interference between man-made nanomaterials and cellular nanostructures or nanomachines. In this review, we discuss recognition of engineered nanomaterials by the immune system, our primary defense system against foreign invasion. Moreover, as oxidative stress is believed to be one of the major deleterious consequences of exposure to nanomaterials, we explore triggering of pro- and antioxidant pathways as well as biomarkers of oxidative stress. Finally, we highlight in vivo studies of the toxicol. outcomes of engineered nanomaterials, including carbon nanotubes, with an emphasis on inflammation and genotoxic responses.
- 12Donaldson, K.; Poland, C. A. Nanotoxicity: Challenging the Myth of Nano-Specific Toxicity. Curr. Opin. Biotechnol. 2013, 24, 724– 734, DOI: 10.1016/j.copbio.2013.05.003[Crossref], [PubMed], [CAS], Google Scholar12https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3sXptlGrsL0%253D&md5=dde1b497718e9aaebdc230bdcdf86598Nanotoxicity: challenging the myth of nano-specific toxicityDonaldson, Ken; Poland, Craig A.Current Opinion in Biotechnology (2013), 24 (4), 724-734CODEN: CUOBE3; ISSN:0958-1669. (Elsevier B.V.)A review. The anal. of nanoparticle (NP) hazard is currently a major research pre-occupation for particle toxicologists since there is a pressing requirement for a comprehensive understanding of nanoparticle hazard because of the wide spectrum of NP varying in compn., shape and size that require testing for risk assessment. The Biol. EDs (BEDs) of nanoparticles, the dose entity that drives toxicity include charge, soly., contaminants, shape and the ability to translocate from the site of deposition in the lungs. We point out here that all of these modes of toxicity are relevant and described for conventional pathogenic particles. There is no evidence that particles below 100 nm, the threshold definition of a NP, show any step-change in their hazard meaning that there is no evidence of novel 'nano-specific hazard'. Therefore conventional particle toxicol. data are useful and relevant to the detn. of the nanoparticle hazard. Emphasis away from 'nano-specific effects' and the availability of hazard data from conventional particles will focus limited resource towards a full understanding of the NP hazard. This will lead to improved ability to identify and test for their effects and measure their toxicokinetics and so contribute to their risk assessment.
- 13Bianco, A. Graphene: Safe or Toxic? The Two Faces of the Medal. Angew. Chem., Int. Ed. 2013, 52, 4986– 4997, DOI: 10.1002/anie.201209099[Crossref], [CAS], Google Scholar13https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3sXlsl2jtrk%253D&md5=4f293b4b7482a9468c792ae44746e9eeGraphene: Safe or Toxic? The Two Faces of the MedalBianco, AlbertoAngewandte Chemie, International Edition (2013), 52 (19), 4986-4997CODEN: ACIEF5; ISSN:1433-7851. (Wiley-VCH Verlag GmbH & Co. KGaA)A review. Graphene is considered the future revolutionary material. For its development, it is of fundamental importance to evaluate the safety profile and the impact on health. Graphene is part of a bigger family which has been identified as the graphene family nanomaterials (GFNs). Clarifying the existence of multiple graphene forms allows better understanding the differences between the components and eventually correlating their biol. effects to the physicochem. characteristics of each structure. Some in vitro and in vivo studies clearly showed no particular risks, while others have indicated that GFNs might become health hazards. This Minireview critically discusses the recent studies on the toxicity of GFNs to provide some perspective on the possible risks to their future development in materials and biomedical sciences.
- 14Krug, H. F. Nanosafety Research-Are We on the Right Track?. Angew. Chem., Int. Ed. 2014, 53, 12304– 12319, DOI: 10.1002/anie.201403367[Crossref], [CAS], Google Scholar14https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2cXhvVGksLzP&md5=47e39189d170a4b2ca2b0f34f36122caNanosafety Research-Are We on the Right Track?Krug, Harald F.Angewandte Chemie, International Edition (2014), 53 (46), 12304-12319CODEN: ACIEF5; ISSN:1433-7851. (Wiley-VCH Verlag GmbH & Co. KGaA)A review. The no. of studies that have been published on the topic of nanosafety speaks for itself. We have seen an almost exponential rise over the past 15 years or so in the no. of articles on nanotoxicol. Although only a couple of hundred papers had appeared on the topic of "Nanomaterials: environmental and health effects" before 2000, this no. has exploded to over 10 000 since 2001. Most of these studies, however, do not offer any kind of clear statement on the safety of nanomaterials. On the contrary, most of them are either self-contradictory or arrive at completely erroneous conclusions. Three years ago in this Journal we underscored the deficiencies in the way these studies were designed and pointed out the sources of error in the methods used. Now, on the basis of a comprehensive review of the literature and with the help of selected toxicol. end points, we attempt to indicate where the significant weaknesses of these studies lie and what we must improve in the future.
- 15Sanchez, V. C.; Jachak, A.; Hurt, R. H.; Kane, A. B. Biological Interactions of Graphene-Family Nanomaterials: An Interdisciplinary Review. Chem. Res. Toxicol. 2012, 25, 15– 34, DOI: 10.1021/tx200339h[ACS Full Text
 ], [CAS], Google Scholar15https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3MXhtlGjt73N&md5=331735edd40d5f955121e3d2def219adBiological Interactions of Graphene-Family Nanomaterials: An Interdisciplinary ReviewSanchez, Vanesa C.; Jachak, Ashish; Hurt, Robert H.; Kane, Agnes B.Chemical Research in Toxicology (2012), 25 (1), 15-34CODEN: CRTOEC; ISSN:0893-228X. (American Chemical Society)A review. Graphene is a single-atom thick, two-dimensional sheet of hexagonally arranged carbon atoms isolated from its three-dimensional parent material, graphite. Related materials include few-layer-graphene (FLG), ultrathin graphite, graphene oxide (GO), reduced graphene oxide (rGO), and graphene nanosheets (GNS). This review proposes a systematic nomenclature for this set of Graphene-Family Nanomaterials (GFNs) and discusses specific materials properties relevant for biomol. and cellular interactions. We discuss several unique modes of interaction between GFNs and nucleic acids, lipid bilayers, and conjugated small mol. drugs and dyes. Some GFNs are produced as dry powders using thermal exfoliation, and in these cases, inhalation is a likely route of human exposure. Some GFNs have aerodynamic sizes that can lead to inhalation and substantial deposition in the human respiratory tract, which may impair lung defense and clearance leading to the formation of granulomas and lung fibrosis. The limited literature on in vitro toxicity suggests that GFNs can be either benign or toxic to cells, and it is hypothesized that the biol. response will vary across the material family depending on layer no., lateral size, stiffness, hydrophobicity, surface functionalization, and dose. Generation of reactive oxygen species (ROS) in target cells is a potential mechanism for toxicity, although the extremely high hydrophobic surface area of some GFNs may also lead to significant interactions with membrane lipids leading to direct phys. toxicity or adsorption of biol. mols. leading to indirect toxicity. Limited in vivo studies demonstrate systemic biodistribution and biopersistence of GFNs following i.v. delivery. Similar to other smooth, continuous, biopersistent implants or foreign bodies, GFNs have the potential to induce foreign body tumors. Long-term adverse health impacts must be considered in the design of GFNs for drug delivery, tissue engineering, and fluorescence-based biomol. sensing. Future research is needed to explore fundamental biol. responses to GFNs including systematic assessment of the phys. and chem. material properties related to toxicity. Complete materials characterization and mechanistic toxicity studies are essential for safer design and manufg. of GFNs in order to optimize biol. applications with minimal risks for environmental health and safety.
], [CAS], Google Scholar15https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3MXhtlGjt73N&md5=331735edd40d5f955121e3d2def219adBiological Interactions of Graphene-Family Nanomaterials: An Interdisciplinary ReviewSanchez, Vanesa C.; Jachak, Ashish; Hurt, Robert H.; Kane, Agnes B.Chemical Research in Toxicology (2012), 25 (1), 15-34CODEN: CRTOEC; ISSN:0893-228X. (American Chemical Society)A review. Graphene is a single-atom thick, two-dimensional sheet of hexagonally arranged carbon atoms isolated from its three-dimensional parent material, graphite. Related materials include few-layer-graphene (FLG), ultrathin graphite, graphene oxide (GO), reduced graphene oxide (rGO), and graphene nanosheets (GNS). This review proposes a systematic nomenclature for this set of Graphene-Family Nanomaterials (GFNs) and discusses specific materials properties relevant for biomol. and cellular interactions. We discuss several unique modes of interaction between GFNs and nucleic acids, lipid bilayers, and conjugated small mol. drugs and dyes. Some GFNs are produced as dry powders using thermal exfoliation, and in these cases, inhalation is a likely route of human exposure. Some GFNs have aerodynamic sizes that can lead to inhalation and substantial deposition in the human respiratory tract, which may impair lung defense and clearance leading to the formation of granulomas and lung fibrosis. The limited literature on in vitro toxicity suggests that GFNs can be either benign or toxic to cells, and it is hypothesized that the biol. response will vary across the material family depending on layer no., lateral size, stiffness, hydrophobicity, surface functionalization, and dose. Generation of reactive oxygen species (ROS) in target cells is a potential mechanism for toxicity, although the extremely high hydrophobic surface area of some GFNs may also lead to significant interactions with membrane lipids leading to direct phys. toxicity or adsorption of biol. mols. leading to indirect toxicity. Limited in vivo studies demonstrate systemic biodistribution and biopersistence of GFNs following i.v. delivery. Similar to other smooth, continuous, biopersistent implants or foreign bodies, GFNs have the potential to induce foreign body tumors. Long-term adverse health impacts must be considered in the design of GFNs for drug delivery, tissue engineering, and fluorescence-based biomol. sensing. Future research is needed to explore fundamental biol. responses to GFNs including systematic assessment of the phys. and chem. material properties related to toxicity. Complete materials characterization and mechanistic toxicity studies are essential for safer design and manufg. of GFNs in order to optimize biol. applications with minimal risks for environmental health and safety. - 16Lalwani, G.; D’Agati, M.; Khan, A. M.; Sitharaman, B. Toxicology of Graphene-Based Nanomaterials. Adv. Drug Delivery Rev. 2016, 105, 109– 144, DOI: 10.1016/j.addr.2016.04.028[Crossref], [PubMed], [CAS], Google Scholar16https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC28XnsV2gsr0%253D&md5=9c78313ebe97a7f599147beeecf4ab50Toxicology of graphene-based nanomaterialsLalwani, Gaurav; D'Agati, Michael; Khan, Amit Mahmud; Sitharaman, BalajiAdvanced Drug Delivery Reviews (2016), 105 (Part_B), 109-144CODEN: ADDREP; ISSN:0169-409X. (Elsevier B.V.)Graphene based nanomaterials possess remarkable physiochem. properties suitable for diverse applications in electronics, telecommunications, energy and healthcare. The human and environmental exposure to graphene-based nanomaterials is increasing due to advancements in the synthesis, characterization and large-scale prodn. of graphene and the subsequent development of graphene based biomedical and consumer products. A large no. of in vitro and in vivo toxicol. studies have evaluated the interactions of graphene-based nanomaterials with various living systems such as microbes, mammalian cells, and animal models. A significant no. of studies have examd. the short- and long-term in vivo toxicity and biodistribution of graphene synthesized by variety of methods and starting materials. A key focus of these examns. is to properly assoc. the biol. responses with chem. and morphol. properties of graphene. Several studies also report the environmental and genotoxicity response of pristine and functionalized graphene. This review summarizes these in vitro and in vivo studies and critically examines the methodologies used to perform these evaluations. Our overarching goal is to provide a comprehensive overview of the complex interplay of biol. responses of graphene as a function of their physiochem. properties.
- 17Reina, G.; González-Domínguez, J. M.; Criado, A.; Vázquez, E.; Bianco, A.; Prato, M. Promises, Facts and Challenges for Graphene in Biomedical Applications. Chem. Soc. Rev. 2017, 46, 4400– 4416, DOI: 10.1039/C7CS00363C[Crossref], [PubMed], [CAS], Google Scholar17https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2sXhtFyqtbrP&md5=fac25dcc837c266c1740345500d8440aPromises, facts and challenges for graphene in biomedical applicationsReina, Giacomo; Gonzalez-Dominguez, Jose Miguel; Criado, Alejandro; Vazquez, Ester; Bianco, Alberto; Prato, MaurizioChemical Society Reviews (2017), 46 (15), 4400-4416CODEN: CSRVBR; ISSN:0306-0012. (Royal Society of Chemistry)The graphene family has captured the interest and the imagination of an increasing no. of scientists working in different fields, ranging from composites to flexible electronics. In the area of biomedical applications, graphene is esp. involved in drug delivery, biosensing and tissue engineering, with strong contributions to the whole nanomedicine area. Besides the interesting results obtained so far and the evident success, there are still many problems to solve, on the way to the manufg. of biomedical devices, including the lack of standardization in the prodn. of the graphene family members. Control of lateral size, aggregation state (single vs. few layers) and oxidn. state (unmodified graphene vs. oxidized graphenes) is essential for the translation of this material into clin. assays. In this Tutorial Review we critically describe the latest developments of the graphene family materials into the biomedical field. We analyze graphene-based devices starting from graphene synthetic strategies, functionalization and processibility protocols up to the final in vitro and in vivo applications. We also address the toxicol. impact and the limitations in translating graphene materials into advanced clin. tools. Finally, new trends and guidelines for future developments are presented.
- 18Ema, M.; Gamo, M.; Honda, K. A Review of Toxicity Studies on Graphene-Based Nanomaterials in Laboratory Animals. Regul. Toxicol. Pharmacol. 2017, 85, 7– 24, DOI: 10.1016/j.yrtph.2017.01.011[Crossref], [PubMed], [CAS], Google Scholar18https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2sXisVCntL4%253D&md5=6e161b89ebfb01f37de1d3a3b13115f0A review of toxicity studies on graphene-based nanomaterials in laboratory animalsEma, Makoto; Gamo, Masashi; Honda, KazumasaRegulatory Toxicology and Pharmacology (2017), 85 (), 7-24CODEN: RTOPDW; ISSN:0273-2300. (Elsevier Inc.)We summarized the findings of toxicity studies on graphene-based nanomaterials (GNMs) in lab. mammals. The inhalation of graphene (GP) and graphene oxide (GO) induced only minimal pulmonary toxicity. Bolus airway exposure to GP and GO caused acute and subacute pulmonary inflammation. Large-sized GO (L-GO) was more toxic than small-sized GO (S-GO). Intratracheally administered GP passed through the air-blood barrier into the blood and i.v. GO distributed mainly in the lungs, liver, and spleen. S-GO and L-GO mainly accumulated in the liver and lungs, resp. Limited information showed the potential behavioral, reproductive, and developmental toxicity and genotoxicity of GNMs. There are indications that oxidative stress and inflammation may be involved in the toxicity of GNMs. The surface reactivity, size, and dispersion status of GNMs play an important role in the induction of toxicity and biodistribution of GNMs. Although this review paper provides initial information on the potential toxicity of GNMs, data are still very limited, esp. when taking into account the many different types of GNMs and their potential modifications. To fill the data gap, further studies should be performed using lab. mammals exposed using the route and dose anticipated for human exposure scenarios.
- 19Fojtů, M.; Teo, W. Z.; Pumera, M. Environmental Impact and Potential Health Risks of 2D Nanomaterials. Environ. Sci.: Nano 2017, 4, 1617– 1633, DOI: 10.1039/C7EN00401J[Crossref], [CAS], Google Scholar19https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2sXhtF2rsrfJ&md5=088d986da8cac0a27ace8b7061fe7868Environmental impact and potential health risks of 2D nanomaterialsFojtu, Michaela; Teo, Wei Zhe; Pumera, MartinEnvironmental Science: Nano (2017), 4 (8), 1617-1633CODEN: ESNNA4; ISSN:2051-8161. (Royal Society of Chemistry)The prospective intensive utilization of two-dimensional (2D) nanomaterials, such as graphene, transition metal dichalcogenides, and black phosphorus, increased the requirements for thorough comprehension of their potential impact on the environment and health. The unique properties of 2D materials originate from their parent material cryst. structure composed of vertically stacked layers. This enables the redn. of their thickness on the at. layer scale while simultaneously changing their physicochem. properties. Layered nanomaterials are revealing their promising employment in a wide range of applications, from the fabrication of products for everyday use to water purifn. and applications in biomedicine. The degrdn. of such materials, their biocompatibility, and their effect on living organisms have begun to attract increased attention since their auspicious application potential is still increasing. Here, we summarize recent knowledge regarding the environmental and health risks of graphene-based materials, transition metal dichalcogenides, and black phosphorus. We have summarized the current progress and findings concerning their biocompatibility, nanotoxicity, and biodistribution, bringing awareness to the complexity of these phenomena.
- 20Volkov, Y.; McIntyre, J.; Prina-Mello, A. Graphene Toxicity as a Double-Edged Sword of Risks and Exploitable Opportunities: A Critical Analysis of the Most Recent Trends and Developments. 2D Mater. 2017, 4, 022001, DOI: 10.1088/2053-1583/aa5476
- 21Bianco, A.; Cheng, H.-M.; Enoki, T.; Gogotsi, Y.; Hurt, R. H.; Koratkar, N.; Kyotani, T.; Monthioux, M.; Park, C. R.; Tascon, J. M. D.; Zhang, J. All in the Graphene Family – A Recommended Nomenclature for Two-Dimensional Carbon Materials. Carbon 2013, 65, 1– 6, DOI: 10.1016/j.carbon.2013.08.038[Crossref], [CAS], Google Scholar21https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3sXhsVCitrbK&md5=8db9e63da674e82738226d2483d9050cAll in the graphene family - A recommended nomenclature for two-dimensional carbon materialsBianco, Alberto; Cheng, Hui-Ming; Enoki, Toshiaki; Gogotsi, Yury; Hurt, Robert H.; Koratkar, Nikhil; Kyotani, Takashi; Monthioux, Marc; Park, Chong Rae; Tascon, Juan M. D.; Zhang, JinCarbon (2013), 65 (), 1-6CODEN: CRBNAH; ISSN:0008-6223. (Elsevier Ltd.)Interest in two-dimensional, sheet-like or flake-like carbon forms has expanded beyond monolayer graphene to include related materials with significant variations in layer no., lateral dimension, rotational faulting, and chem. modification. Describing this family of "graphene materials" has been causing confusion in the Carbon journal and in the scientific literature as a whole. The international editorial team for Carbon believes that the time has come for a discussion on a rational naming system for two-dimensional carbon forms. We propose here a first nomenclature for two-dimensional carbons that could guide authors toward a more precise description of their subject materials, and could allow the field to move forward with a higher degree of common understanding.
- 22Wick, P.; Louw-Gaume, A. E.; Kucki, M.; Krug, H. F.; Kostarelos, K.; Fadeel, B.; Dawson, K. a.; Salvati, A.; Vázquez, E.; Ballerini, L.; Tretiach, M.; Benfenati, F.; Flahaut, E.; Gauthier, L.; Prato, M.; Bianco, A. Classification Framework for Graphene-Based Materials. Angew. Chem., Int. Ed. 2014, 53, 7714– 7718, DOI: 10.1002/anie.201403335[Crossref], [CAS], Google Scholar22https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2cXpsVKit74%253D&md5=bbb7a59c7a6e533514839c0de3549247Classification Framework for Graphene-Based MaterialsWick, Peter; Louw-Gaume, Anna E.; Kucki, Melanie; Krug, Harald F.; Kostarelos, Kostas; Fadeel, Bengt; Dawson, Kenneth A.; Salvati, Anna; Vazquez, Ester; Ballerini, Laura; Tretiach, Mauro; Benfenati, Fabio; Flahaut, Emmanuel; Gauthier, Laury; Prato, Maurizio; Bianco, AlbertoAngewandte Chemie, International Edition (2014), 53 (30), 7714-7718CODEN: ACIEF5; ISSN:1433-7851. (Wiley-VCH Verlag GmbH & Co. KGaA)Graphene is the enabling material of the 21st century and there are high expectations for its potential applications. A clear and consistent system describing the various derivs. of graphene promotes a precise vocabulary for the family of graphene-based materials. This will be a prerequisite, for example, to understand structure-activity relationships in the context of human health and safety and to avoid generalizations about the capabilities and limitations of graphene- based materials. Within the European Union's GRAPHENE Flagship project, three phys.-chem. descriptors specific for graphene were defined to assist in the classification of graphene-based materials.
- 23Bottari, G.; Herranz, M. Á.; Wibmer, L.; Volland, M.; Rodríguez-Pérez, L.; Guldi, D. M.; Hirsch, A.; Martín, N.; D’Souza, F.; Torres, T. Chemical Functionalization and Characterization of Graphene-Based Materials. Chem. Soc. Rev. 2017, 46, 4464– 4500, DOI: 10.1039/C7CS00229G[Crossref], [PubMed], [CAS], Google Scholar23https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2sXhtFKhtrvE&md5=1f0cfbf285c40a39a16efc02bf3409d2Chemical functionalization and characterization of graphene-based materialsBottari, Giovanni; Herranz, Ma Angeles; Wibmer, Leonie; Volland, Michel; Rodriguez-Perez, Laura; Guldi, Dirk M.; Hirsch, Andreas; Martin, Nazario; D'Souza, Francis; Torres, TomasChemical Society Reviews (2017), 46 (15), 4464-4500CODEN: CSRVBR; ISSN:0306-0012. (Royal Society of Chemistry)Graphene-based materials (GBMs), with graphene, their most known member, at the head, constitute a large family of materials which has aroused the interest of scientists working in different research fields such as chem., physics, or materials science, to mention a few, arguably as no other material before. In this review, we offer a general overview on the most relevant synthetic approaches for the covalent and non-covalent functionalization and characterization of GBMs. Moreover, some representative examples of the incorporation into GBMs of electroactive units such as porphyrins, phthalocyanines, or ferrocene, among others, affording electron donor-acceptor (D-A) hybrids are presented. For the latter systems, the photophys. characterization of their ground- and excited-state features has also been included, paying particular attention to elucidate the fundamental dynamics of the energy transfer and charge sepn. processes of these hybrids. For some of the presented architectures, their application in solar energy conversion schemes and energy prodn. has been also discussed.
- 24Dong, L.; Yang, J.; Chhowalla, M.; Loh, K. P. Synthesis and Reduction of Large Sized Graphene Oxide Sheets. Chem. Soc. Rev. 2017, 46, 7306– 7316, DOI: 10.1039/C7CS00485K[Crossref], [PubMed], [CAS], Google Scholar24https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2sXhs12lsLbF&md5=15bc5ee0cd2e8994b57887a82b889cc7Synthesis and reduction of large sized graphene oxide sheetsDong, Lei; Yang, Jieun; Chhowalla, Manish; Loh, Kian PingChemical Society Reviews (2017), 46 (23), 7306-7316CODEN: CSRVBR; ISSN:0306-0012. (Royal Society of Chemistry)Graphene oxide (GO) can be considered as one of the most visible outcomes of graphene research in terms of large scale prodn. and commercialization prospects. Although GO can be easily prepd. by oxidn.-exfoliation of graphite in agitated solns., the size of these sheets is generally limited due to fragmentation along fault lines during chem. oxidn. and exfoliation in agitated solns. In this account, we discuss recent strategies which have been developed for the prepn. of large sized graphene oxide (LGO) sheets with lateral sizes >10 μm, using chem. expanded graphite as the starting material. LGO has a much lower d. of defects than GO prepd. using the conventional Hummers' method and can be readily transformed into graphene by chem. redn. In addn., the unique advantages of using LGO sheets as a performance enhancer are discussed. Finally, this review also discusses recent advances in the chem. and electrochem. redn. of graphene oxide.
- 25Yin, P. T.; Shah, S.; Chhowalla, M.; Lee, K.-B. Design, Synthesis, and Characterization of Graphene–Nanoparticle Hybrid Materials for Bioapplications. Chem. Rev. 2015, 115, 2483– 2531, DOI: 10.1021/cr500537t[ACS Full Text
 ], [CAS], Google Scholar25https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2MXjtVSjs7s%253D&md5=043909061e1bb64f0c5d595077cb25f5Design, Synthesis, and Characterization of Graphene-Nanoparticle Hybrid Materials for BioapplicationsYin, Perry T.; Shah, Shreyas; Chhowalla, Manish; Lee, Ki-BumChemical Reviews (Washington, DC, United States) (2015), 115 (7), 2483-2531CODEN: CHREAY; ISSN:0009-2665. (American Chemical Society)A review.
], [CAS], Google Scholar25https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2MXjtVSjs7s%253D&md5=043909061e1bb64f0c5d595077cb25f5Design, Synthesis, and Characterization of Graphene-Nanoparticle Hybrid Materials for BioapplicationsYin, Perry T.; Shah, Shreyas; Chhowalla, Manish; Lee, Ki-BumChemical Reviews (Washington, DC, United States) (2015), 115 (7), 2483-2531CODEN: CHREAY; ISSN:0009-2665. (American Chemical Society)A review. - 26Mukherjee, S. P.; Lozano, N.; Kucki, M.; Del Rio-Castillo, A. E.; Newman, L.; Vázquez, E.; Kostarelos, K.; Wick, P.; Fadeel, B. Detection of Endotoxin Contamination of Graphene Based Materials Using the TNF-α Expression Test and Guidelines for Endotoxin-Free Graphene Oxide Production. PLoS One 2016, 11, e0166816, DOI: 10.1371/journal.pone.0166816[Crossref], [PubMed], [CAS], Google Scholar26https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2sXktVOltLc%253D&md5=1dd701d9306b1e3034f83e6741d5bbc4Detection of endotoxin contamination of graphene based materials using the TNF-α expression test and guidelines for endotoxin- free graphene oxide productionMukherjee, Sourav P.; Lozano, Neus; Kucki, Melanie; Del Rio-Castillo, Antonio E.; Newman, Leon; Vazquez, Ester; Kostarelos, Kostas; Wick, Peter; Fadeel, BengtPLoS One (2016), 11 (11), e0166816/1-e0166816/17CODEN: POLNCL; ISSN:1932-6203. (Public Library of Science)Nanomaterials may be contaminated with bacterial endotoxin during prodn. and handling, which may confound toxicol. testing of these materials, not least when assessing for immunotoxicity. In the present study, we evaluated the conventional Limulus amebocyte lysate (LAL) assay for endotoxin detection in graphene based material (GBM) samples, including graphene oxide (GO) and few-layered graphene (FLG). Our results showed that some GO samples interfered with various formats of the LAL assay. To overcome this problem, we developed a TNF-α expression test (TET) using primary human monocyte-derived macrophages incubated in the presence or absence of the endotoxin inhibitor, polymyxin B sulfate, and found that this assay, performed with non-cytotoxic doses of the GBM samples, enabled unequivocal detection of endotoxin with a sensitivity that is comparable to the LAL assay. FLG also triggered TNF-α prodn. in the presence of the LPS inhibitor, pointing to an intrinsic pro-inflammatory effect. Finally, we present guidelines for the prepn. of endotoxin-free GO, validated by using the TET.
- 27Cai, M.; Thorpe, D.; Adamson, D. H.; Schniepp, H. C. Methods of Graphite Exfoliation. J. Mater. Chem. 2012, 22, 24992– 25002, DOI: 10.1039/c2jm34517j[Crossref], [CAS], Google Scholar27https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC38Xhs12ls7rK&md5=574d6181655b8628d94387327410a170Methods of graphite exfoliationCai, Minzhen; Thorpe, Daniel; Adamson, Douglas H.; Schniepp, Hannes C.Journal of Materials Chemistry (2012), 22 (48), 24992-25002CODEN: JMACEP; ISSN:0959-9428. (Royal Society of Chemistry)A review. For applications of two-dimensional graphene, com. viable sources are necessary. Exfoliation from bulk, stacked graphite is the most economical way to achieve large quantities of single layer graphene. A no. of methods have been developed to achieve exfoliation of graphite, each with advantages and disadvantages. In this review, we describe current exfoliation methods and techniques used to produce single layer materials from graphite precursors.
- 28Hernández-Sánchez, D.; Scardamaglia, M.; Saucedo-Anaya, S.; Bittencourt, C.; Quintana, M. Exfoliation of Graphite and Graphite Oxide in Water by Chlorin e 6. RSC Adv. 2016, 6, 66634– 66640, DOI: 10.1039/C6RA13501C[Crossref], [CAS], Google Scholar28https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC28XhtFantLjF&md5=9bddd68531a305b6c96e4544e1db4415Exfoliation of graphite and graphite oxide in water by chlorin e6Hernandez-Sanchez, Dania; Scardamaglia, Mattia; Saucedo-Anaya, Sonia; Bittencourt, Carla; Quintana, MildredRSC Advances (2016), 6 (71), 66634-66640CODEN: RSCACL; ISSN:2046-2069. (Royal Society of Chemistry)Few layer graphene (FLG) and graphene oxide (GO) are considered important materials for the development of future technol. applications. Diverse strategies are followed for their synthesis and prodn. resulting in graphene materials with different processability, electronic, optical, mech., and chem. properties. In particular, many efforts are directed at the integration of FLG or GO with water dispersable functional mols. Recent advances in ultrasonication techniques have led to the control over the synthesis of carbon nanostructures using a versatile synthetic tool. Herein, we demonstrate the facile prepn. of two different types of chlorin e6 (Ce6) nanohybrids in biocompatible media: few-layer graphene (FLG-Ce6) and graphene oxide (GO-Ce6) in deionized water (DW) and phosphate buffered saline (PBS). The exfoliation is energetically driven by acoustic cavitation while mol. interactions are responsible for the stabilization of FLG and GO in water by Ce6. The nanohybrid materials might find applications in energy and biomedicine fields since the main photophys. features of Ce6, such as its efficient use of energy in the near IR region, its light harvesting properties, and its capacity for energy and electron transferring processes, are well preserved.
- 29Salunke, B. K.; Kim, B. S. Facile Synthesis of Graphene Using a Biological Method. RSC Adv. 2016, 6, 17158– 17162, DOI: 10.1039/C5RA25977K[Crossref], [CAS], Google Scholar29https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC28XitFeisro%253D&md5=e6e215c59b5424b18a071302cc9f0800Facile synthesis of graphene using a biological methodSalunke, Bipinchandra K.; Kim, Beom SooRSC Advances (2016), 6 (21), 17158-17162CODEN: RSCACL; ISSN:2046-2069. (Royal Society of Chemistry)A new, facile, low cost, environmentally safe process is demonstrated for the prodn. of few layer graphene by liq. phase exfoliation of graphite using exts. of medicinal plants in water. Plant exts. possibly function as bio-surfactants by creating a barrier in the aggregation by adsorbing on to the exposed surfaces of the graphite, weakening the attraction between the layers created by the van der Waals forces and allowing the graphite to slowly exfoliate in the form of undamaged flakes.
- 30Pattammattel, A.; Pande, P.; Kuttappan, D.; Puglia, M.; Basu, A. K.; Amalaradjou, M. A.; Kumar, C. V. Controlling the Graphene–Bio Interface: Dispersions in Animal Sera for Enhanced Stability and Reduced Toxicity. Langmuir 2017, 33, 14184– 14194, DOI: 10.1021/acs.langmuir.7b02854[ACS Full Text
 ], [CAS], Google Scholar30https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2sXhvVWltrrP&md5=593a8c1624784bbdcff9d9bcc030e3a9Controlling the Graphene-Bio Interface: Dispersions in Animal Sera for Enhanced Stability and Reduced ToxicityPattammattel, Ajith; Pande, Paritosh; Kuttappan, Deepa; Puglia, Megan; Basu, Ashis K.; Amalaradjou, Mary Anne; Kumar, Challa V.Langmuir (2017), 33 (49), 14184-14194CODEN: LANGD5; ISSN:0743-7463. (American Chemical Society)Liq. phase exfoliation of graphite in six different animal sera and evaluation of its toxicity are reported here. Previously, we reported the exfoliation of graphene using proteins, and here we extend this approach to complex animal fluids. A kitchen blender with a high-turbulence flow gave high quality and max. exfoliation efficiency in all sera tested, when compared to the values found with shear and ultrasonication methods. Raman spectra and electron microscopy confirmed the formation of three- or four-layer, submicrometer size graphene, independent of the serum used. Graphene prepd. in serum was directly transferred to cell culture media without post-treatments. Contrary to many reports, a nanotoxicity study of this graphene fully dispersed to human embryonic kidney cells, human lung cancer cells, and nematodes (Caenorhabditis elegans) showed no acute toxicity for up to 7 days at various doses (50-500 μg/mL), but prolonged exposure at higher doses (300-500 μg/mL, 10-15 days) showed cytotoxicity to cells (∼95% death) and reproductive toxicity to C. elegans (5-10% redn. in brood size). The origin of toxicity was found to be due to the highly fragmented smaller graphene sheets (<200 nm), while the larger sheets were nontoxic (50-300 μg/mL dose). In contrast, graphene produced with sodium cholate as the mediator has been found to be cytotoxic to these cells at these dosages. We demonstrated the toxicity of liq. phase exfoliated graphene is attributed to highly fragmented fractions or nonbiocompatible exfoliating agents. Thus, low-toxicity graphene/serum suspensions are produced by a facile method in biol. media, and this approach may accelerate the much-anticipated development of graphene for biol. applications.
], [CAS], Google Scholar30https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2sXhvVWltrrP&md5=593a8c1624784bbdcff9d9bcc030e3a9Controlling the Graphene-Bio Interface: Dispersions in Animal Sera for Enhanced Stability and Reduced ToxicityPattammattel, Ajith; Pande, Paritosh; Kuttappan, Deepa; Puglia, Megan; Basu, Ashis K.; Amalaradjou, Mary Anne; Kumar, Challa V.Langmuir (2017), 33 (49), 14184-14194CODEN: LANGD5; ISSN:0743-7463. (American Chemical Society)Liq. phase exfoliation of graphite in six different animal sera and evaluation of its toxicity are reported here. Previously, we reported the exfoliation of graphene using proteins, and here we extend this approach to complex animal fluids. A kitchen blender with a high-turbulence flow gave high quality and max. exfoliation efficiency in all sera tested, when compared to the values found with shear and ultrasonication methods. Raman spectra and electron microscopy confirmed the formation of three- or four-layer, submicrometer size graphene, independent of the serum used. Graphene prepd. in serum was directly transferred to cell culture media without post-treatments. Contrary to many reports, a nanotoxicity study of this graphene fully dispersed to human embryonic kidney cells, human lung cancer cells, and nematodes (Caenorhabditis elegans) showed no acute toxicity for up to 7 days at various doses (50-500 μg/mL), but prolonged exposure at higher doses (300-500 μg/mL, 10-15 days) showed cytotoxicity to cells (∼95% death) and reproductive toxicity to C. elegans (5-10% redn. in brood size). The origin of toxicity was found to be due to the highly fragmented smaller graphene sheets (<200 nm), while the larger sheets were nontoxic (50-300 μg/mL dose). In contrast, graphene produced with sodium cholate as the mediator has been found to be cytotoxic to these cells at these dosages. We demonstrated the toxicity of liq. phase exfoliated graphene is attributed to highly fragmented fractions or nonbiocompatible exfoliating agents. Thus, low-toxicity graphene/serum suspensions are produced by a facile method in biol. media, and this approach may accelerate the much-anticipated development of graphene for biol. applications. - 31Liu, X.; Liu, J.; Zhan, D.; Yan, J.; Wang, J.; Chao, D.; Lai, L.; Chen, M.; Yin, J.; Shen, Z. Repeated Microwave-Assisted Exfoliation of Expandable Graphite for the Preparation of Large Scale and High Quality Multi-Layer Graphene. RSC Adv. 2013, 3, 11601– 11606, DOI: 10.1039/c3ra22673e[Crossref], [CAS], Google Scholar31https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3sXhtVarurbJ&md5=5c933e6ce3e1935d62c9ba6cfaf56d2fRepeated microwave-assisted exfoliation of expandable graphite for the preparation of large scale and high quality multi-layer grapheneLiu, Xiaoxu; Liu, Jilei; Zhan, Da; Yan, Jiaxu; Wang, Jin; Chao, Dongliang; Lai, Linfei; Chen, Minghua; Yin, Jinghua; Shen, ZexiangRSC Advances (2013), 3 (29), 11601-11606CODEN: RSCACL; ISSN:2046-2069. (Royal Society of Chemistry)The increasing demand for graphene's industrial application requires a new route for its mass prodn. with high quality. Here, we report a facile, green, highly efficient and cost effective method for prepg. a large amt. of high quality graphene flakes, which is by the repeated microwave assisted exfoliation of expandable graphite (EG). The successful exfoliation of graphite is realized through the intercalation and decompn. of eco-friendly chems. with the assistance of a microwave source. The chem. morphol. and electrocatalytic performance analyses reveal that the graphene flakes are of high quality with little degrdn.
- 32León, V.; González-Domínguez, J. M.; Fierro, J. L. G.; Prato, M.; Vázquez, E. Production and Stability of Mechanochemically Exfoliated Graphene in Water and Culture Media. Nanoscale 2016, 8, 14548– 14555, DOI: 10.1039/C6NR03246J
- 33González-Domínguez, J. M.; León, V.; Lucío, M. I.; Prato, M.; Vázquez, E. Production of Ready-to-Use Few-Layer Graphene in Aqueous Suspensions. Nat. Protoc. 2018, 13, 495– 506, DOI: 10.1038/nprot.2017.142[Crossref], [PubMed], [CAS], Google Scholar33https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC1cXisl2kurc%253D&md5=e61c3385dd08691bbb536312046671b2Production of ready-to-use few-layer graphene in aqueous suspensionsGonzalez-Dominguez, Jose M.; Leon, Veronica; Lucio, Maria Isabel; Prato, Maurizio; Vazquez, EsterNature Protocols (2018), 13 (3), 495-506CODEN: NPARDW; ISSN:1750-2799. (Nature Research)A review. Graphene has promising phys. and chem. properties such as high strength and flexibility, coupled with high elec. and thermal conductivities. It is therefore being incorporated into polymer-based composites for use in electronics and photonics applications. A main constraint related to the graphene development is that, being of a strongly hydrophobic nature, almost all dispersions (usually required for its handling and processing toward the desired application) are prepd. in poisonous org. solvents such as N-Me pyrrolidone or N,N-DMF. Here, we describe how to prep. exfoliated graphite using a ball mill. The graphene produced is three to four layers thick and ~ 500 nm in diam. on av., as measured by electron microscopy and Raman spectroscopy; can be stored in the form of light solid; and is easily dispersed in aq. media. Our methodol. consists of four main steps: (i) the mechanochem. intercalation of org. mols. (melamine) into graphite, followed by suspension in water; (ii) the washing of suspended graphene to eliminate most of the melamine; (iii) the isolation of stable graphene sheets; and (iv) freeze-drying to obtain graphene powder. This process takes 6-7 or 9-10 d for aq. suspensions and dry powders, resp. The product has well-defined properties and can be used for many science and technol. applications, including toxicol. impact assessment and the prodn. of innovative medical devices.
- 34Amiri, A.; Zubir, M. N. M.; Dimiev, A. M.; Teng, K. H.; Shanbedi, M.; Kazi, S. N.; Rozali, S. B. Facile, Environmentally Friendly, Cost Effective and Scalable Production of Few-Layered Graphene. Chem. Eng. J. 2017, 326, 1105– 1115, DOI: 10.1016/j.cej.2017.06.046[Crossref], [CAS], Google Scholar34https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2sXhtVerurbN&md5=fe3292a79cf23b3c2741949d87a97251Facile, environmentally friendly, cost effective and scalable production of few-layered grapheneAmiri, Ahmad; Zubir, Mohd. Nashrul Mohd.; Dimiev, Ayrat M.; Teng, K. H.; Shanbedi, Mehdi; Kazi, S. N.; Bin Rozali, ShaifulazuarChemical Engineering Journal (Amsterdam, Netherlands) (2017), 326 (), 1105-1115CODEN: CMEJAJ; ISSN:1385-8947. (Elsevier B.V.)Commercialization of graphene is still one the biggest challenges in the carbon field despite the development of several methods for its prodn. The lack of simple, cost-effective and scalable methods for mass-prodn. of graphene hampers its promotion to the market. Here, we propose a new method for large-scale prodn. of mono- and few-layered graphene via liq. phase exfoliation with the use of wet ball milling in the presence of org. solvents at extremely low temps. The wet ball milling combined with the temp. modulated high surface energy solvents affords exfoliation of bulk graphite into graphenes in a fast, scalable, cost effective and environmentally friendly process. The thorough statistical anal. of as-prepd. graphene flakes demonstrates that more than 61% of the flakes comprise less than 5 layers, while ∼14% of the flakes were monolayer graphene. Combined with the ∼30% yield of few-layer graphene out of the graphite precursor, this method demonstrates incredible efficiency in just 45 min. In the presence of methanol, our method results in formation of predominantly bi-layer graphene, which is more difficult to obtain in scalable fashion, than mono-layer graphene. The high quality of as-obtained graphenes is fully confirmed by Raman spectroscopy, TEM, SAED, AFM and XPS.
- 35Ali-Boucetta, H.; Bitounis, D.; Raveendran-Nair, R.; Servant, A.; Van den Bossche, J.; Kostarelos, K. Purified Graphene Oxide Dispersions Lack In Vitro Cytotoxicity and In Vivo Pathogenicity. Adv. Healthcare Mater. 2013, 2, 433– 441, DOI: 10.1002/adhm.201200248[Crossref], [PubMed], [CAS], Google Scholar35https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3sXjsVKgs7s%253D&md5=3e6408260ebe6fc5dc657565da84213fPurified Graphene Oxide Dispersions Lack In Vitro Cytotoxicity and In Vivo PathogenicityAli-Boucetta, Hanene; Bitounis, Dimitrios; Raveendran-Nair, Rahul; Servant, Ania; Van den Bossche, Jeroen; Kostarelos, KostasAdvanced Healthcare Materials (2013), 2 (3), 433-441CODEN: AHMDBJ; ISSN:2192-2640. (Wiley-VCH Verlag GmbH & Co. KGaA)Prompted by the excitement from the description of single layer graphene, increased attention for potential applications in the biomedical field was recently placed on graphene oxide (GO). Detn. of the opportunities and limitations that GO offers in biomedicine are particularly prone to inaccuracies due to wide variability in the prepn. methodologies of GO material in different labs., that results in significant variation in the purity of the material and the yield of the oxidn. reactions, primarily the Hummers method used. Herein, the fabrication of highly pure, colloidally stable, and evenly dispersed GO in physiol.-relevant aq. buffers in comparison to conventional GO is investigated. The purified GO material is thoroughly characterized by a battery of techniques, and is shown to consist of single layer GO sheets of lateral dimensions below 500 nm. The cytotoxic impact of the GO in vitro and its inflammation profile in vivo is investigated. The purified GO prepd. and characterized here does not induce significant cytotoxic responses in vitro, or inflammation and granuloma formation in vivo following i.p. injection. This is one of the initial steps towards detn. of the safety risks assocd. with GO material that may be interacting with living tissue.
- 36Jasim, D. A.; Lozano, N.; Kostarelos, K. Synthesis of Few-Layered, High-Purity Graphene Oxide Sheets from Different Graphite Sources for Biology. 2D Mater. 2016, 3, 014006, DOI: 10.1088/2053-1583/3/1/014006[Crossref], [CAS], Google Scholar36https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2sXls1elsb4%253D&md5=4a6e49132ce830f1ec262f79a05a0f2cSynthesis of few-layered, high-purity graphene oxide sheets from different graphite sources for biologyJasim, Dhifaf A.; Lozano, Neus; Kostarelos, Kostas2D Materials (2016), 3 (1), 014006/1-014006/17CODEN: DMATB7; ISSN:2053-1583. (IOP Publishing Ltd.)This work aimed to interrogate the role that the starting graphitic material played on the physicochem. properties of graphene oxide (GO) sheets and their impact on mammalian cell viability following exposure to those flakes. Three different GO thin sheets were synthesized from three starting graphite material: flakes (GO-f), ground (GO-g) and powder (GO-p) using a modified Hummers' method. The synthetic yield of this methodol. was found to differ according to type of starting material, with GO-p resulting in most efficient yields. Structural and morphol. comparison of the three GO sheet types were carried out using transmission electron microscopy and at. force microscopy. Optical properties were measured using UV/visible and fluorescence spectroscopy. Surface characteristics and chem. were detd. using a battery of techniques. Exposure to human cells was studied using the human A549 lung epithelial cultures. Our results revealed that all three GO samples were composed of few-layer sheets with similar physicochem. and surface characteristics. However, significant differences were obsd. in terms of their lateral dimensions with GO-p, prepd. from graphite powder, being the largest among the GOs. No cytotoxicity was detected for any of the GO samples following exposure onto A549 cells up to 48 h. In conclusion, the form and type of the starting graphite material is shown to be an important factor that can det. the synthetic yield and the structural characteristics of the resulting GO sheets.
- 37Coleman, B. R.; Knight, T.; Gies, V.; Jakubek, Z. J.; Zou, S. Manipulation and Quantification of Graphene Oxide Flake Size: Photoluminescence and Cytotoxicity. ACS Appl. Mater. Interfaces 2017, 9, 28911– 28921, DOI: 10.1021/acsami.7b08585[ACS Full Text
 ], [CAS], Google Scholar37https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2sXht1Oht7fE&md5=27c39812226b072bee39604d18d5f046Manipulation and Quantification of Graphene Oxide Flake Size: Photoluminescence and CytotoxicityColeman, Brian R.; Knight, Timothy; Gies, Valerie; Jakubek, Zygmunt J.; Zou, ShanACS Applied Materials & Interfaces (2017), 9 (34), 28911-28921CODEN: AAMICK; ISSN:1944-8244. (American Chemical Society)Single-layered graphene oxide (GO) has exhibited great promise in the areas of sensing, membrane filtration, supercapacitors, bioimaging, and therapeutic carriers because of its biocompatibility, large surface area, and electrochem., photoluminescent, and optical properties. To elucidate how the phys. dimensions of GO affect its intrinsic properties, the authors employed sonication to produce >130 different sizes of GO in aq. dispersion and implemented new approaches to characterize various GO properties as a function of the av. flake size. New protocols were developed to det. and compare the flake size of GO dispersions sonicated with energies up to 20 MJ/g by using dynamic light scattering and at. force microscopy (AFM). The relation between the av. flake size and sonication energy per unit mass of GO was obsd. to follow a power law. AFM height measurements showed that the sonication of GO yielded monolayered flakes. Luminescence of GO was characterized as a function of the sonication energy (or the av. flake size which is the monotonic function of the sonication energy), excitation wavelength, and pH of the dispersion. The strong dependence of the luminescence intensity on pH control and the variation of the luminescence intensity with different flake sizes were obsd. An intense luminescence signal, likely related to the sepn. of the oxidative debris from the GO framework, was found at the highest sonication energies (E ⪆ 15 MJ/g) or under extremely alk. conditions (pH ⪆ 11). The cytotoxicity of GO was studied with various flake sizes. Size- and concn.-dependent cytotoxicity was obsd. for cell lines NIH 3T3 and A549. The NIH 3T3 cell line also demonstrated time-dependent cytotoxicity.
], [CAS], Google Scholar37https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2sXht1Oht7fE&md5=27c39812226b072bee39604d18d5f046Manipulation and Quantification of Graphene Oxide Flake Size: Photoluminescence and CytotoxicityColeman, Brian R.; Knight, Timothy; Gies, Valerie; Jakubek, Zygmunt J.; Zou, ShanACS Applied Materials & Interfaces (2017), 9 (34), 28911-28921CODEN: AAMICK; ISSN:1944-8244. (American Chemical Society)Single-layered graphene oxide (GO) has exhibited great promise in the areas of sensing, membrane filtration, supercapacitors, bioimaging, and therapeutic carriers because of its biocompatibility, large surface area, and electrochem., photoluminescent, and optical properties. To elucidate how the phys. dimensions of GO affect its intrinsic properties, the authors employed sonication to produce >130 different sizes of GO in aq. dispersion and implemented new approaches to characterize various GO properties as a function of the av. flake size. New protocols were developed to det. and compare the flake size of GO dispersions sonicated with energies up to 20 MJ/g by using dynamic light scattering and at. force microscopy (AFM). The relation between the av. flake size and sonication energy per unit mass of GO was obsd. to follow a power law. AFM height measurements showed that the sonication of GO yielded monolayered flakes. Luminescence of GO was characterized as a function of the sonication energy (or the av. flake size which is the monotonic function of the sonication energy), excitation wavelength, and pH of the dispersion. The strong dependence of the luminescence intensity on pH control and the variation of the luminescence intensity with different flake sizes were obsd. An intense luminescence signal, likely related to the sepn. of the oxidative debris from the GO framework, was found at the highest sonication energies (E ⪆ 15 MJ/g) or under extremely alk. conditions (pH ⪆ 11). The cytotoxicity of GO was studied with various flake sizes. Size- and concn.-dependent cytotoxicity was obsd. for cell lines NIH 3T3 and A549. The NIH 3T3 cell line also demonstrated time-dependent cytotoxicity. - 38Orecchioni, M.; Jasim, D. A.; Pescatori, M.; Manetti, R.; Fozza, C.; Sgarrella, F.; Bedognetti, D.; Bianco, A.; Kostarelos, K.; Delogu, L. G. Molecular and Genomic Impact of Large and Small Lateral Dimension Graphene Oxide Sheets on Human Immune Cells from Healthy Donors. Adv. Healthcare Mater. 2016, 5, 276– 287, DOI: 10.1002/adhm.201500606[Crossref], [PubMed], [CAS], Google Scholar38https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2MXitVCqs77N&md5=37832613234885afb65fdc90cbcc7100Molecular and Genomic Impact of Large and Small Lateral Dimension Graphene Oxide Sheets on Human Immune Cells from Healthy DonorsOrecchioni, Marco; Jasim, Dhifaf A.; Pescatori, Mario; Manetti, Roberto; Fozza, Claudio; Sgarrella, Francesco; Bedognetti, Davide; Bianco, Alberto; Kostarelos, Kostas; Delogu, Lucia GemmaAdvanced Healthcare Materials (2016), 5 (2), 276-287CODEN: AHMDBJ; ISSN:2192-2640. (Wiley-VCH Verlag GmbH & Co. KGaA)Graphene oxide (GO) is attracting great interest in biomedical sciences. The impact of GO on immune cells is one fundamental area of study that is often overlooked, but crit. in terms of clin. translation. This work investigates the effects of two types of thoroughly characterized GO sheets, different in their lateral dimension, on human peripheral immune cells provided from healthy donors using a wide range of assays. After evaluation of cell viability, the gene expression was analyzed, following GO exposure on 84 genes related to innate and adaptive immune responses. Exposure to GO small sheets was found to have a more significant impact on immune cells compared to GO large sheets, reflected in the upregulation of crit. genes implicated in immune responses and the release of cytokines IL1β and TNFα. These findings were further confirmed by whole-genome microarray anal. of the impact of small GO sheets on T cells and monocytes. Activation in both cell types was underlined by the overexpression of genes such as CXCL10 and receptor CXCR3. Significant energy-dependent pathway modulation was identified. These findings can potentially pave the foundations for further design of graphene that can be used for immune modulation applications, for example in cancer immunotherapy.
- 39Mukherjee, S. P.; Kostarelos, K.; Fadeel, B. Cytokine Profiling of Primary Human Macrophages Exposed to Endotoxin-Free Graphene Oxide: Size-Independent NLRP3 Inflammasome Activation. Adv. Healthcare Mater. 2018, 7, 1700815, DOI: 10.1002/adhm.201700815
- 40Jasim, D. A.; Boutin, H.; Fairclough, M.; Ménard-Moyon, C.; Prenant, C.; Bianco, A.; Kostarelos, K. Thickness of Functionalized Graphene Oxide Sheets Plays Critical Role in Tissue Accumulation and Urinary Excretion: A Pilot PET/CT Study. Appl. Mater. Today 2016, 4, 24– 30, DOI: 10.1016/j.apmt.2016.04.003
- 41Jasim, D. A.; Murphy, S.; Newman, L.; Mironov, A.; Prestat, E.; McCaffrey, J.; Ménard-Moyon, C.; Rodrigues, A. F.; Bianco, A.; Haigh, S.; Lennon, R.; Kostarelos, K. The Effects of Extensive Glomerular Filtration of Thin Graphene Oxide Sheets on Kidney Physiology. ACS Nano 2016, 10, 10753– 10767, DOI: 10.1021/acsnano.6b03358[ACS Full Text
 ], [CAS], Google Scholar41https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC28XhvFGgsr%252FO&md5=4a367d90400726d1685a155534147362The Effects of Extensive Glomerular Filtration of Thin Graphene Oxide Sheets on Kidney PhysiologyJasim, Dhifaf A.; Murphy, Stephanie; Newman, Leon; Mironov, Aleksandr; Prestat, Eric; McCaffrey, James; Menard-Moyon, Cecilia; Rodrigues, Artur Filipe; Bianco, Alberto; Haigh, Sarah; Lennon, Rachel; Kostarelos, KostasACS Nano (2016), 10 (12), 10753-10767CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)Understanding how two-dimensional (2D) nanomaterials interact with the biol. milieu is fundamental for their development towards biomedical applications. When thin, individualized GO sheets were administered i.v. in mice, extensive urinary excretion was obsd., to indicate rapid transit across the glomerular filtration barrier (GFB). A detailed anal. of kidney function, histopathol. and ultrastructure was performed, along with the in vitro responses of two highly specialized GFB cells (glomerular endothelial cells and podocytes) following exposure to GO. The authors investigated whether these cells preserved their unique barrier function at doses 100 times greater than the dose expected to reach the GFB in vivo. Both serum and urine analyses revealed that there was no impairment of kidney function up to one month after injection of GO at escalating doses. Histol. examn. suggested no damage to the glomerular and tubular regions of the kidneys. Ultrastructural anal. by TEM showed absence of damage, with no change in the size of podocyte slits, endothelial cell fenestra, or the glomerular basement membrane. The endothelial and podocyte cell cultures regained their full barrier function after >48 h of GO exposure and cellular uptake was significant in both cell types after 24 h. This study provided previously unreported understanding of the interaction between thin GO sheets with different components of the GFB in vitro and in vivo to highlight that the glomerular excretion of significant amts. of GO did not induce any signs of acute nephrotoxicity or glomerular barrier dysfunction.
], [CAS], Google Scholar41https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC28XhvFGgsr%252FO&md5=4a367d90400726d1685a155534147362The Effects of Extensive Glomerular Filtration of Thin Graphene Oxide Sheets on Kidney PhysiologyJasim, Dhifaf A.; Murphy, Stephanie; Newman, Leon; Mironov, Aleksandr; Prestat, Eric; McCaffrey, James; Menard-Moyon, Cecilia; Rodrigues, Artur Filipe; Bianco, Alberto; Haigh, Sarah; Lennon, Rachel; Kostarelos, KostasACS Nano (2016), 10 (12), 10753-10767CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)Understanding how two-dimensional (2D) nanomaterials interact with the biol. milieu is fundamental for their development towards biomedical applications. When thin, individualized GO sheets were administered i.v. in mice, extensive urinary excretion was obsd., to indicate rapid transit across the glomerular filtration barrier (GFB). A detailed anal. of kidney function, histopathol. and ultrastructure was performed, along with the in vitro responses of two highly specialized GFB cells (glomerular endothelial cells and podocytes) following exposure to GO. The authors investigated whether these cells preserved their unique barrier function at doses 100 times greater than the dose expected to reach the GFB in vivo. Both serum and urine analyses revealed that there was no impairment of kidney function up to one month after injection of GO at escalating doses. Histol. examn. suggested no damage to the glomerular and tubular regions of the kidneys. Ultrastructural anal. by TEM showed absence of damage, with no change in the size of podocyte slits, endothelial cell fenestra, or the glomerular basement membrane. The endothelial and podocyte cell cultures regained their full barrier function after >48 h of GO exposure and cellular uptake was significant in both cell types after 24 h. This study provided previously unreported understanding of the interaction between thin GO sheets with different components of the GFB in vitro and in vivo to highlight that the glomerular excretion of significant amts. of GO did not induce any signs of acute nephrotoxicity or glomerular barrier dysfunction. - 42Rodrigues, A. F.; Newman, L.; Lozano, N.; Mukherjee, S. P.; Fadeel, B.; Bussy, C.; Kostarelos, K. A Blueprint for the Synthesis and Characterisation of Thin Graphene Oxide with Controlled Lateral Dimensions for Biomedicine. 2D Mater. 2018, 5, 035020, DOI: 10.1088/2053-1583/aac05c[Crossref], [CAS], Google Scholar42https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC1MXlt1SjsLw%253D&md5=ffd7895f0a265119f3ae8d8b21f2978dA blueprint for the synthesis and characterisation of thin graphene oxide with controlled lateral dimensions for biomedicineRodrigues, Artur Filipe; Newman, Leon; Lozano, Neus; Mukherjee, Sourav P.; Fadeel, Bengt; Bussy, Cyrill; Kostarelos, Kostas2D Materials (2018), 5 (3), 035020/1-035020/19CODEN: DMATB7; ISSN:2053-1583. (IOP Publishing Ltd.)Graphene-based materials (GBMs) have ignited a revolution in material science and technol., with electronic, optical and mech. properties that are of relevant interest for a wide range of applications. To support the development of these enabling technologies, a global research effort has been invested to assess their hazard and biocompatibility. The aim of the present work was to produce a blueprint for the synthesis and characterization of non-pyrogenic graphene oxide (GO) flakes with three different controlled lateral dimensions, which could be further used for either hazard assessment or biomedical proof-of-concept studies. A battery of techniques used to characterize the physicochem. properties of the GO samples included at. force microscopy, transmission electron microscopy, Fourier-transformed infra-red spectroscopy, XPS and Raman spectroscopy. The combination of these different techniques confirmed that only the lateral dimension varied among the GO materials produced, without significant change in any other of their fundamental physicochem. properties, such as the thickness or surface chem. The proposed systematic approach in GO batch prodn. for biol. will hopefully contribute to a better understanding of the material properties that govern their interactions with biol. systems and offer a blueprint towards standardisation of biol. relevant 2D materials.
- 43De Silva, K. K. H.; Huang, H.-H.; Joshi, R. K.; Yoshimura, M. Chemical Reduction of Graphene Oxide Using Green Reductants. Carbon 2017, 119, 190– 199, DOI: 10.1016/j.carbon.2017.04.025[Crossref], [CAS], Google Scholar43https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2sXmsVeitro%253D&md5=0befcbbeeacb817a7bab60bb245a9983Chemical reduction of graphene oxide using green reductantsDe Silva, K. K. H.; Huang, H.-H.; Joshi, R. K.; Yoshimura, M.Carbon (2017), 119 (), 190-199CODEN: CRBNAH; ISSN:0008-6223. (Elsevier Ltd.)Graphene has exceptional phys., chem., mech., thermal and optical properties which offer huge potential for applications in various sectors. Chem. oxidn. of graphite to graphene oxide followed by the redn. process is the commonly used method for mass scale prodn. of graphene or reduced graphene oxide (RGO). Among the large no. of chem. reducing agents used to prep. RGO or graphene, the most efficient reductant is hydrazine. It is toxic in nature and harmful to the environment, thus it is in high demand to use green reductants for RGO synthesis. We understand that due to high demand of graphene/graphene oxide/reduced graphene oxide recently and which is expected to be more in future, green synthesis methods are extremely important. In this article, we have studied the synthesis methods, characterization and the possible mechanism for green redn., esp. by ascorbic acid. This article could possibly motivate the researcher worldwide to innovate new green methods for mass scale prodn. of graphene based materials.
- 44Fernández-Merino, M. J.; Guardia, L.; Paredes, J. I.; Villar-Rodil, S.; Solís-Fernández, P.; Martínez-Alonso, A.; Tascón, J. M. D. Vitamin C Is an Ideal Substitute for Hydrazine in the Reduction of Graphene Oxide Suspensions. J. Phys. Chem. C 2010, 114, 6426– 6432, DOI: 10.1021/jp100603h[ACS Full Text
 ], [CAS], Google Scholar44https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3cXislyru78%253D&md5=0ef03b756a33ff86a953803c1ab6f6abVitamin C Is an Ideal Substitute for Hydrazine in the Reduction of Graphene Oxide SuspensionsFernandez-Merino, M. J.; Guardia, L.; Paredes, J. I.; Villar-Rodil, S.; Solis-Fernandez, P.; Martinez-Alonso, A.; Tascon, J. M. D.Journal of Physical Chemistry C (2010), 114 (14), 6426-6432CODEN: JPCCCK; ISSN:1932-7447. (American Chemical Society)The prepn. of soln.-processable graphene from graphite oxide typically involves a hydrazine redn. step, but the use of such a reagent in the large-scale implementation of this approach is not desirable due to its high toxicity. Here, we compare the deoxygenation efficiency of graphene oxide suspensions by different reductants (sodium borohydride, pyrogallol, and vitamin C, in addn. to hydrazine), as well as by heating the suspensions under alk. conditions. In almost all cases, the degree of redn. attainable and the subsequent restoration of relevant properties (e.g., elec. cond.) lag significantly behind those achieved with hydrazine. Only vitamin C is found to yield highly reduced suspensions in a way comparable to those provided by hydrazine. Stable suspensions of vitamin C-reduced graphene oxide can be prepd. not only in water but also in common org. solvents, such as N,N-dimethylformamide (DMF) or N-methyl-2-pyrrolidone (NMP). These results open the perspective of replacing hydrazine in the redn. of graphene oxide suspensions by an innocuous and safe reductant of similar efficacy, thus facilitating the use of graphene-based materials for large-scale applications.
], [CAS], Google Scholar44https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3cXislyru78%253D&md5=0ef03b756a33ff86a953803c1ab6f6abVitamin C Is an Ideal Substitute for Hydrazine in the Reduction of Graphene Oxide SuspensionsFernandez-Merino, M. J.; Guardia, L.; Paredes, J. I.; Villar-Rodil, S.; Solis-Fernandez, P.; Martinez-Alonso, A.; Tascon, J. M. D.Journal of Physical Chemistry C (2010), 114 (14), 6426-6432CODEN: JPCCCK; ISSN:1932-7447. (American Chemical Society)The prepn. of soln.-processable graphene from graphite oxide typically involves a hydrazine redn. step, but the use of such a reagent in the large-scale implementation of this approach is not desirable due to its high toxicity. Here, we compare the deoxygenation efficiency of graphene oxide suspensions by different reductants (sodium borohydride, pyrogallol, and vitamin C, in addn. to hydrazine), as well as by heating the suspensions under alk. conditions. In almost all cases, the degree of redn. attainable and the subsequent restoration of relevant properties (e.g., elec. cond.) lag significantly behind those achieved with hydrazine. Only vitamin C is found to yield highly reduced suspensions in a way comparable to those provided by hydrazine. Stable suspensions of vitamin C-reduced graphene oxide can be prepd. not only in water but also in common org. solvents, such as N,N-dimethylformamide (DMF) or N-methyl-2-pyrrolidone (NMP). These results open the perspective of replacing hydrazine in the redn. of graphene oxide suspensions by an innocuous and safe reductant of similar efficacy, thus facilitating the use of graphene-based materials for large-scale applications. - 45Zhu, C.; Guo, S.; Fang, Y.; Dong, S. Reducing Sugar: New Functional Molecules for the Green Synthesis of Graphene Nanosheets. ACS Nano 2010, 4, 2429– 2437, DOI: 10.1021/nn1002387[ACS Full Text
 ], [CAS], Google Scholar45https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3cXktVyhsLc%253D&md5=987145bec0dcae1681985d0b88bfc77aReducing sugar: new functional molecules for the green synthesis of graphene nanosheetsZhu, Chengzhou; Guo, Shaojun; Fang, Youxing; Dong, ShaojunACS Nano (2010), 4 (4), 2429-2437CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)In this paper, we developed a green and facile approach to the synthesis of chem. converted graphene nanosheets (GNS) based on reducing sugars, such as glucose, fructose and sucrose using exfoliated graphite oxide (GO) as precursor. The obtained GNS is characterized with at. force microscopy, UV-visible absorption spectroscopy, transmission electron microscopy, XPS, and so on. The merit of this method is that both the reducing agents themselves and the oxidized products are environmentally friendly. It should be noted that, besides the mild redn. capability to GO, the oxidized products of reducing sugars could also play an important role as a capping reagent in stabilizing as-prepd. GNS simultaneously, which exhibited good stability in water. This approach can open up the new possibility for prepg. GNS in large-scale prodn. alternatively. Moreover, it is found that GNS-based materials could be of great value for applications in various fields, such as good electrocatalytic activity toward catecholamines (dopamine, epinephrine, and norepinephrine).
], [CAS], Google Scholar45https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3cXktVyhsLc%253D&md5=987145bec0dcae1681985d0b88bfc77aReducing sugar: new functional molecules for the green synthesis of graphene nanosheetsZhu, Chengzhou; Guo, Shaojun; Fang, Youxing; Dong, ShaojunACS Nano (2010), 4 (4), 2429-2437CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)In this paper, we developed a green and facile approach to the synthesis of chem. converted graphene nanosheets (GNS) based on reducing sugars, such as glucose, fructose and sucrose using exfoliated graphite oxide (GO) as precursor. The obtained GNS is characterized with at. force microscopy, UV-visible absorption spectroscopy, transmission electron microscopy, XPS, and so on. The merit of this method is that both the reducing agents themselves and the oxidized products are environmentally friendly. It should be noted that, besides the mild redn. capability to GO, the oxidized products of reducing sugars could also play an important role as a capping reagent in stabilizing as-prepd. GNS simultaneously, which exhibited good stability in water. This approach can open up the new possibility for prepg. GNS in large-scale prodn. alternatively. Moreover, it is found that GNS-based materials could be of great value for applications in various fields, such as good electrocatalytic activity toward catecholamines (dopamine, epinephrine, and norepinephrine). - 46Haghighi, B.; Tabrizi, M. A. Green-Synthesis of Reduced Graphene Oxide Nanosheets Using Rose Water and a Survey on Their Characteristics and Applications. RSC Adv. 2013, 3, 13365– 13371, DOI: 10.1039/c3ra40856f[Crossref], [CAS], Google Scholar46https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3sXhtFeqtr7J&md5=bf4618e21465fed2afab624ad246c943Green-synthesis of reduced graphene oxide nanosheets using rose water and a survey on their characteristics and applicationsHaghighi, Behzad; Tabrizi, Mahmoud AmouzadehRSC Advances (2013), 3 (32), 13365-13371CODEN: RSCACL; ISSN:2046-2069. (Royal Society of Chemistry)Rose water as a green reducing and stabilizing agent is introduced and used for the chem. redn. of exfoliated graphite oxide (GO) and the synthesis of reduced graphene oxide nanosheets (RGONs). The prepd. materials are characterized with UV-visible absorption spectroscopy, Fourier transform IR spectroscopy, Raman spectroscopy, at. force microscopy (AFM), SEM, transmission electron microscopy and X-ray diffraction (XRD). The results of XRD anal. show that the oxygen contg. functional groups of exfoliated GO have been removed remarkably after its redn. by rose water. AFM and Raman spectroscopy results indicate that the exfoliated GO has been reduced to monolayer RGONs. Electrochem. impedance spectroscopy measurements show that the rate of electron transfer of the redox probe on prepd. RGONs is much higher than that obsd. on exfoliated GO, indicating the capability of the proposed method for the prodn. of RGONs. Moreover, excellent electrocatalytic activity towards catechol, NAD and immobilized glucose oxidase is obsd. on a glassy carbon electrode modified with RGONs, indicating the applicability of the prepd. RGONs for the fabrication of sensors and biosensors.
- 47Akhavan, O.; Ghaderi, E. Escherichia Coli Bacteria Reduce Graphene Oxide to Bactericidal Graphene in a Self-Limiting Manner. Carbon 2012, 50, 1853– 1860, DOI: 10.1016/j.carbon.2011.12.035[Crossref], [CAS], Google Scholar47https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC38XhvFOjtbo%253D&md5=29ab29625c1dc9194813f9448af9e6d0Escherichia coli bacteria reduce graphene oxide to bactericidal graphene in a self-limiting mannerAkhavan, O.; Ghaderi, E.Carbon (2012), 50 (5), 1853-1860CODEN: CRBNAH; ISSN:0008-6223. (Elsevier Ltd.)Interactions of chem. exfoliated graphene oxide (GO) nanosheets and Escherichia coli bacteria living in mixed-acid fermn. with an anaerobic condition were investigated for different exposure times. XPS showed that as the exposure time increased (from 0 to 48 h), the oxygen-contg. functional groups of the GO decreased by ∼60%, indicating a relative chem. redn. of the sheets by interaction with the bacteria. Raman spectroscopy and current-voltage measurement confirmed the redn. of the GO exposed to the bacteria. The redn. was believed to be due to the metabolic activity of the surviving bacteria through their glycolysis process. It was found that the GO sheets could act as biocompatible sites for adsorption and proliferation of the bacteria on their surfaces, while the bacterially-reduced GO (BRGO) sheets showed an inhibition for proliferation of the bacteria on their surfaces. It was shown that the slight antibacterial property of the BRGO sheets and the detaching of the already proliferated bacteria from the surface of these sheets contributed to the growth inhibition of the bacteria on the surface of the reduced sheets.
- 48Aunkor, M. T. H.; Mahbubul, I. M.; Saidur, R.; Metselaar, H. S. C. The Green Reduction of Graphene Oxide. RSC Adv. 2016, 6, 27807– 27828, DOI: 10.1039/C6RA03189G[Crossref], [CAS], Google Scholar48https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC28XjslKiu7s%253D&md5=de3412fe2b548182d51f4c7d6c4293d6The green reduction of graphene oxideAunkor, M. T. H.; Mahbubul, I. M.; Saidur, R.; Metselaar, H. S. C.RSC Advances (2016), 6 (33), 27807-27828CODEN: RSCACL; ISSN:2046-2069. (Royal Society of Chemistry)Graphene is an ultra-thin material, which has received broad interest in many areas of science and technol. because of its unique phys., chem., mech. and thermal properties. Synthesis of high quality graphene in an inexpensive and eco-friendly manner is a big challenge. Among various methods, chem. synthesis is considered the best because it is easy, scalable, facile, and inexpensive. Different kinds of chem. reducers have been used to produce graphene sheets. However, some chems. are toxic, corrosive, and hazardous. For this reason, researchers have been using different environmentally friendly substances (termed green reducers) to produce functional graphene sheets. This paper presents an overview and discussion of the green redn. of graphene oxide (GO) to graphene. It also reviews the characterization of GO and its oxide redn. through the anal. of different spectroscopic and microscopic techniques such as Raman spectroscopy, Fourier transform IR spectroscopy, XPS, X-ray diffraction, transmission electron microscopy, SEM, and at. force microscopy.
- 49Soltani, T.; Kyu Lee, B. A Benign Ultrasonic Route to Reduced Graphene Oxide from Pristine Graphite. J. Colloid Interface Sci. 2017, 486, 337– 343, DOI: 10.1016/j.jcis.2016.09.075[Crossref], [PubMed], [CAS], Google Scholar49https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC28Xhs1CnsLbM&md5=30dd28755a4aee8b1ff8c57fb770fc72A benign ultrasonic route to reduced graphene oxide from pristine graphiteSoltani, Tayyebeh; Lee, Byeong-KyuJournal of Colloid and Interface Science (2017), 486 (), 337-343CODEN: JCISA5; ISSN:0021-9797. (Elsevier B.V.)In this study, we report the synthesis of high purity reduced graphene oxide (rGO) from pristine graphite via a fast and cost-effective one-step ultrasonic redn. method. Ultrasonic treatment was employed to avoid the harsh reaction conditions, including high temp. and use of highly toxic hydrazine, required for the conventional rGO prepn. method. The high temp. produced during the ultrasound irradn. at low temp. and short reaction time enabled the redn. of graphene oxide (GO) into rGO without the use of toxic chems. The oxygen functional groups on GO were successfully reduced by the sonochem. redn. The rGO prepd. using the ultrasonic method exhibited a curled morphol., a very thin wrinkled paper-like structure, sheet folding, minimal layers (∼4 layers), and a layer spacing of ∼1 nm. The sonochem. approach for the synthesis of rGO showed fast, high productivity, much improved safety, less energy, and time consuming characteristics as compared to other methods. More importantly, highly explosive and poisonous hydrazine is not required in this sonochem. technique, opposed to that required in conventional rGO synthesis, making it useful for many industrial applications of rGO.
- 50Wang, Z.; Xu, D.; Huang, Y.; Wu, Z.; Wang, L.; Zhang, X. Facile, Mild and Fast Thermal-Decomposition Reduction of Graphene Oxide in Air and Its Application in High-Performance Lithium Batteries. Chem. Commun. 2012, 48, 976– 978, DOI: 10.1039/C2CC16239C[Crossref], [PubMed], [CAS], Google Scholar50https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC38XhvVKhtw%253D%253D&md5=fbc59de646682a634d404e4c75d5070eFacile, mild and fast thermal-decomposition reduction of graphene oxide in air and its application in high-performance lithium batteriesWang, Zhong-li; Xu, Dan; Huang, Yun; Wu, Zhong; Wang, Li-min; Zhang, Xin-boChemical Communications (Cambridge, United Kingdom) (2012), 48 (7), 976-978CODEN: CHCOFS; ISSN:1359-7345. (Royal Society of Chemistry)The authors proposed a facile, mild and effective thermal-decompn. strategy to prep. high-quality graphene at a low temp. of 300° in only 5 min under an ambient atm. Applying the advantage of this strategy that provides an oxidizing atm., pure V2O5/graphene composite is successfully synthesized and exerts excellent Li storage properties.
- 51Yang, D.; Velamakanni, A.; Bozoklu, G.; Park, S.; Stoller, M.; Piner, R. D.; Stankovich, S.; Jung, I.; Field, D. A.; Ventrice, C. A.; Ruoff, R. S. Chemical Analysis of Graphene Oxide Films after Heat and Chemical Treatments by X-Ray Photoelectron and Micro-Raman Spectroscopy. Carbon 2009, 47, 145– 152, DOI: 10.1016/j.carbon.2008.09.045[Crossref], [CAS], Google Scholar51https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BD1cXhsVChsbbI&md5=99e301a34edd05e2c0c0a1849e8b3721Chemical analysis of graphene oxide films after heat and chemical treatments by X-ray photoelectron and Micro-Raman spectroscopyYang, Dongxing; Velamakanni, Aruna; Bozoklu, Guelay; Park, Sungjin; Stoller, Meryl; Piner, Richard D.; Stankovich, Sasha; Jung, Inhwa; Field, Daniel A.; Ventrice, Carl A. Jr.; Ruoff, Rodney S.Carbon (2009), 47 (1), 145-152CODEN: CRBNAH; ISSN:0008-6223. (Elsevier Ltd.)Several nanometer-thick graphene oxide films deposited on silicon nitride-on silicon substrates were exposed to nine different heat treatments (three in Argon, three in Argon and Hydrogen, and three in ultra-high vacuum), and also a film was held at 70 °C while being exposed to a vapor from hydrazine monohydrate. The films were characterized with at. force microscopy to obtain local thickness and variation in thickness over extended regions. XPS was used to measure significant redn. of the oxygen content of the films; heating in ultra-high vacuum was particularly effective. The overtone region of the Raman spectrum was used, for the first time, to provide a "fingerprint" of changing oxygen content.
- 52Mori, F.; Kubouchi, M.; Arao, Y. Effect of Graphite Structures on the Productivity and Quality of Few-Layer Graphene in Liquid-Phase Exfoliation. J. Mater. Sci. 2018, 53, 12807– 12815, DOI: 10.1007/s10853-018-2538-3[Crossref], [CAS], Google Scholar52https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC1cXhtFSmtrfK&md5=e3689e87a96872d6f4300dcc584200cfEffect of graphite structures on the productivity and quality of few-layer graphene in liquid-phase exfoliationMori, Fumiya; Kubouchi, Masatoshi; Arao, YoshihikoJournal of Materials Science (2018), 53 (18), 12807-12815CODEN: JMTSAS; ISSN:0022-2461. (Springer)Liq.-phase exfoliation (LPE) is a promising technique for commercializing graphene prodn. because of its simplicity and cost-effectiveness. However, the low yield of graphene in lab.-scale prodn., less than 10 g/h, necessitates modifications to the process for it to be feasible for com. applications. Natural graphite has various size distribution, crystallite sizes, and interlayer space, making the choice of initial graphite very important. Five types of natural graphite with different structures were prepd. for the expt. The structural parameters of graphite such as crystallite size and d-spacing were precisely detd. based on a std. procedure of X-ray diffraction measurements for carbon materials. The effects of graphite flake size and crystallite size on the productivity and quality of few-layer graphene (FLG) were investigated. The results showed that small graphite was easier to fragment and exfoliate. FLG productivity improvement up to 1500% was attained when graphite with smaller flakes was used instead of graphite with large flakes. The crystallite size of graphite was manipulated by plenary ball milling, and the effect of crystallite on FLG productivity in LPE process was also discussed.
- 53Ding, J.-H.; Zhao, H.-R.; Yu, H.-B. A Water-Based Green Approach to Large-Scale Production of Aqueous Compatible Graphene Nanoplatelets. Sci. Rep. 2018, 8, 5567, DOI: 10.1038/s41598-018-23859-5[Crossref], [PubMed], [CAS], Google Scholar53https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A280%3ADC%252BC1MnoslGitQ%253D%253D&md5=50c7a7701d314b612af7f0cf9158fb43A water-based green approach to large-scale production of aqueous compatible graphene nanoplateletsDing Ji-Heng; Zhao Hong-Ran; Yu Hai-BinScientific reports (2018), 8 (1), 5567 ISSN:.The unique properties of graphene are highly desired for printing electronics, coatings, energy storage, separation membranes, biomedicine, and composites. However, the high efficiency exfoliation of graphene into single- or few-layered nanoplates remains a grand challenge and becomes the bottleneck in essential studies and applications of graphene. Here, we report a scalable and green method to exfoliate graphene nanoplatelets (GNPs) from nature graphite in pure water without using any chemicals or surfactants. The essence of this strategy lies in the facile liquid exfoliation route with the assistance of vapor pretreatment for the preparation of edge hydroxylated graphene. The produced graphene consisted primarily of fewer than ten atomic layers. Such the water soluble graphene can be stored in the form of dispersion (~0.55 g L(-1)) or filter cake for more than 6 months without the risk of re-stacking. This method paves the way for the environmentally friendly and cost-effective production of graphene-based materials.
- 54Reddy, V.; Satish Babu, K. K. C.; Torati, S. R.; Eom, Y. J.; Trung, T. Q.; Lee, N.-E.; Kim, C. Scalable Production of Water-Dispersible Reduced Graphene Oxide and Its Integration in a Field Effect Transistor. J. Ind. Eng. Chem. 2018, 63, 19– 26, DOI: 10.1016/j.jiec.2018.01.033[Crossref], [CAS], Google Scholar54https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC1cXis12rurg%253D&md5=9a50ae49ad434fe70eed32bf366e5877Scalable production of water-dispersible reduced graphene oxide and its integration in a field effect transistorReddy, Venu; Satish Babu, K. K. C.; Torati, Sri Ramulu; Eom, Yun Ji; Trung, Tran Quang; Lee, Nae-Eung; Kim, Cheol-GiJournal of Industrial and Engineering Chemistry (Amsterdam, Netherlands) (2018), 63 (), 19-26CODEN: JIECFI; ISSN:1226-086X. (Elsevier B.V.)The development of environmentally benign, low-processing and low-cost approaches to the large-scale prepn. of advanced nanomaterials based on the use of biol. materials is currently attracting great interest. Here, we report the discovery that aq. honey solns. reduce graphene oxide in a low-cost and an eco-friendly manner, yielding highly water dispersive functionalized reduced graphene sheets. The roles of honey in the redn. of graphene oxide of as-prepd. graphene are demonstrated. The possible mechanism for the de-epoxidn. of graphene oxide is elucidated. The fabricated a honey-reduced graphene oxide-based field-effect transistor exhibited ambipolar transfer characteristics, thereby demonstrating that the developed material may therefore have applications in electronic devices and sensors.
- 55Balasubramanyan, S.; Sasidharan, S.; Poovathinthodiyil, R.; Ramakrishnan, R. M.; Narayanan, B. N. Sucrose-Mediated Mechanical Exfoliation of Graphite: A Green Method for the Large Scale Production of Graphene and Its Application in Catalytic Reduction of 4-Nitrophenol. New J. Chem. 2017, 41, 11969– 11978, DOI: 10.1039/C7NJ01900A[Crossref], [CAS], Google Scholar55https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2sXhsVGktbrE&md5=da8694efbb17023786c260f70c049b26Sucrose-mediated mechanical exfoliation of graphite: a green method for the large scale production of graphene and its application in catalytic reduction of 4-nitrophenolBalasubramanyan, Sowmya; Sasidharan, Sreenikesh; Poovathinthodiyil, Raveendran; Ramakrishnan, Resmi M.; Narayanan, Binitha N.New Journal of Chemistry (2017), 41 (20), 11969-11978CODEN: NJCHE5; ISSN:1144-0546. (Royal Society of Chemistry)We report an incredibly simple and green method for the large scale prodn. of graphene by the ball-milling of graphite with sucrose as an auxiliary milling agent, plausibly assisted by the interaction of the sucrose mols. with the graphitic surface layers by virtue of non-conventional CH/π or OH/π interactions. Upon calcination, the graphene-sucrose mixt. directly yields mono- and few-layer graphene nanosheets. The graphene thus produced forms stable suspensions in various org. solvents, enabling its further processing and fabrication. It is also demonstrated that the graphene produced can be used successfully for heterogeneous catalytic redn. of 4-nitrophenol.
- 56González, V. J.; Rodríguez, A. M.; León, V.; Frontiñán-Rubio, J.; Fierro, J. L. G.; Durán-Prado, M.; Muñoz-García, A. B.; Pavone, M.; Vázquez, E. Sweet Graphene: Exfoliation of Graphite and Preparation of Glucose-Graphene Cocrystals through Mechanochemical Treatments. Green Chem. 2018, 20, 3581– 3592, DOI: 10.1039/C8GC01162A[Crossref], [CAS], Google Scholar56https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC1cXht1ersLjO&md5=14fe258165f902d27a77116fa1785564Sweet graphene: exfoliation of graphite and preparation of glucose-graphene cocrystals through mechanochemical treatmentsGonzalez, Viviana Jehova; Rodriguez, Antonio M.; Leon, Veronica; Frontinan-Rubio, Javier; Fierro, Jose Luis G.; Duran-Prado, Mario; Munoz-Garcia, Ana B.; Pavone, Michele; Vazquez, EsterGreen Chemistry (2018), 20 (15), 3581-3592CODEN: GRCHFJ; ISSN:1463-9262. (Royal Society of Chemistry)Mechanochem. treatment with carbohydrates leads to the successful exfoliation of graphite and this can be considered as a green approach to the prepn. of graphene. Glucose, fructose, and saccharose were used and the former showed the best exfoliation behavior to generate graphene materials with a relatively low no. of defects, as evidenced by Raman spectroscopy. The addn. of small amts. of water to the ball milling treatment led to the formation of glucose-graphene co-crystals, which exhibited superior properties in terms of colloidal stability and minimization of cell toxicity.
- 57Zhang, X.; Wang, L.; Lu, Q.; Kaplan, D. L. Mass Production of Biocompatible Graphene Using Silk Nanofibers. ACS Appl. Mater. Interfaces 2018, 10, 22924– 22931, DOI: 10.1021/acsami.8b04777[ACS Full Text
 ], [CAS], Google Scholar57https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC1cXhtFKhtrjN&md5=5e48af036ecad2ecda31f1e76f98fb05Mass Production of Biocompatible Graphene Using Silk NanofibersZhang, Xiaoyi; Wang, Ling; Lu, Qiang; Kaplan, David L.ACS Applied Materials & Interfaces (2018), 10 (27), 22924-22931CODEN: AAMICK; ISSN:1944-8244. (American Chemical Society)Mass prodn. of high-quality graphene dispersions under mild conditions impacts the utility of the material for biomedical applications. Various proteins have been used to prep. graphene dispersions, rare sources, and expensive prices for these proteins restrict their large-scale utility for the prodn. of graphene. Here, inexpensive silk proteins as an abundant resource in nature were used for graphene exfoliation. The silk proteins were assembled into hydrophobic nanofibers with neg. charge, and then optimized for the prodn. of graphene. Significantly higher concns. (>8 mg mL-1) and yields (>30%) of graphene dispersions under ambient aq. conditions were achieved compared with previous protein-assisted exfoliation systems. The exfoliated graphene exhibited excellent stability in water and fetal bovine serum soln., cytocompatibility, and cond., suggesting a promising future in biomedical and bioengineering applications.
], [CAS], Google Scholar57https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC1cXhtFKhtrjN&md5=5e48af036ecad2ecda31f1e76f98fb05Mass Production of Biocompatible Graphene Using Silk NanofibersZhang, Xiaoyi; Wang, Ling; Lu, Qiang; Kaplan, David L.ACS Applied Materials & Interfaces (2018), 10 (27), 22924-22931CODEN: AAMICK; ISSN:1944-8244. (American Chemical Society)Mass prodn. of high-quality graphene dispersions under mild conditions impacts the utility of the material for biomedical applications. Various proteins have been used to prep. graphene dispersions, rare sources, and expensive prices for these proteins restrict their large-scale utility for the prodn. of graphene. Here, inexpensive silk proteins as an abundant resource in nature were used for graphene exfoliation. The silk proteins were assembled into hydrophobic nanofibers with neg. charge, and then optimized for the prodn. of graphene. Significantly higher concns. (>8 mg mL-1) and yields (>30%) of graphene dispersions under ambient aq. conditions were achieved compared with previous protein-assisted exfoliation systems. The exfoliated graphene exhibited excellent stability in water and fetal bovine serum soln., cytocompatibility, and cond., suggesting a promising future in biomedical and bioengineering applications. - 58Kim, H.-R.; Lee, S.-H.; Lee, K.-H. Scalable Production of Large Single-Layered Graphenes by Microwave Exfoliation ‘in Deionized Water. Carbon 2018, 134, 431– 438, DOI: 10.1016/j.carbon.2018.04.014[Crossref], [CAS], Google Scholar58https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC1cXnvVSmt78%253D&md5=5acab8f3fa6578f873ad46f20d3e8664Scalable production of large single-layered graphenes by microwave exfoliation 'in deionized water'Kim, Hye-Rim; Lee, Sung-Hyun; Lee, Kun-HongCarbon (2018), 134 (), 431-438CODEN: CRBNAH; ISSN:0008-6223. (Elsevier Ltd.)Single-layered graphenes with large sizes were produced by inserting solvent mols. between the graphene layers in graphite intercalation compds. (GICs) followed by direct microwave exfoliation 'in a solvent' to prevent re-aggregation. During the microwave exfoliation of GICs in deionized (DI) water, single-layered graphenes were produced, and their lateral sizes ranged from several micrometers to several tens of micrometers. The entire process time was less than 2 h, and toxic compds. were not used. In the case of microwave exfoliation in acetone or ethanol, graphenes with a thickness of 3-6 nm were mainly produced rather than single-layered graphenes. In addn., when the produced graphenes were directly dispersed in DI water, the dispersed state was maintained for 2 days. This method is very advantageous for industrial scale-up.
- 59George, G.; Sisupal, S. B.; Tomy, T.; Kumaran, A.; Vadivelu, P.; Suvekbala, V.; Sivaram, S.; Ragupathy, L. Facile, Environmentally Benign and Scalable Approach to Produce Pristine Few Layers Graphene Suitable for Preparing Biocompatible Polymer Nanocomposites. Sci. Rep. 2018, 8, 11228, DOI: 10.1038/s41598-018-28560-1[Crossref], [PubMed], [CAS], Google Scholar59https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A280%3ADC%252BB3c7hvFOhsw%253D%253D&md5=68ae0e7e0a13e0a0f64f20614a96802bFacile, environmentally benign and scalable approach to produce pristine few layers graphene suitable for preparing biocompatible polymer nanocompositesGeorge Gejo; Sisupal Suja Bhargavan; Tomy Teenu; Kumaran Alaganandam; Suvekbala Vemparthan; Ragupathy Lakshminarayanan; Vadivelu Prabha; Sivaram SwaminathanScientific reports (2018), 8 (1), 11228 ISSN:.The success of developing graphene based biomaterials depends on its ease of synthesis, use of environmentally benign methods and low toxicity of the chemicals involved as well as biocompatibility of the final products/devices. We report, herein, a simple, scalable and safe method to produce defect free few layers graphene using naturally available phenolics i.e. curcumin/tetrahydrocurcumin/quercetin, as solid-phase exfoliating agents with a productivity of ∼45 g/batch (D/G ≤ 0.54 and D/D' ≤ 1.23). The production method can also be employed in liquid-phase using a ball mill (20 g/batch, D/G ≤ 0.23 and D/D' ≤ 1.12) and a sand grinder (10 g/batch, D/G ≤ 0.11 and D/D∼ ≤ 0.78). The combined effect of π-π interaction and charge transfer (from curcumin to graphene) is postulated to be the driving force for efficient exfoliation of graphite. The yielded graphene was mixed with the natural rubber (NR) latex to produce thin film nanocomposites, which show superior tensile strength with low modulus and no loss of % elongation at break. In-vitro and in-vivo investigations demonstrate that the prepared nanocomposite is biocompatible. This approach could be useful for the production of materials suitable in products (gloves/condoms/catheters), which come in contact with body parts/body fluids.
- 60González-Domínguez, J. M.; León, V.; Lucío, M. I.; Prato, M.; Vázquez, E. Production of Ready-to-Use Few-Layer Graphene in Aqueous Suspensions. Nat. Protoc. 2018, 13, 495– 506, DOI: 10.1038/nprot.2017.142[Crossref], [PubMed], [CAS], Google Scholar60https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC1cXisl2kurc%253D&md5=e61c3385dd08691bbb536312046671b2Production of ready-to-use few-layer graphene in aqueous suspensionsGonzalez-Dominguez, Jose M.; Leon, Veronica; Lucio, Maria Isabel; Prato, Maurizio; Vazquez, EsterNature Protocols (2018), 13 (3), 495-506CODEN: NPARDW; ISSN:1750-2799. (Nature Research)A review. Graphene has promising phys. and chem. properties such as high strength and flexibility, coupled with high elec. and thermal conductivities. It is therefore being incorporated into polymer-based composites for use in electronics and photonics applications. A main constraint related to the graphene development is that, being of a strongly hydrophobic nature, almost all dispersions (usually required for its handling and processing toward the desired application) are prepd. in poisonous org. solvents such as N-Me pyrrolidone or N,N-DMF. Here, we describe how to prep. exfoliated graphite using a ball mill. The graphene produced is three to four layers thick and ~ 500 nm in diam. on av., as measured by electron microscopy and Raman spectroscopy; can be stored in the form of light solid; and is easily dispersed in aq. media. Our methodol. consists of four main steps: (i) the mechanochem. intercalation of org. mols. (melamine) into graphite, followed by suspension in water; (ii) the washing of suspended graphene to eliminate most of the melamine; (iii) the isolation of stable graphene sheets; and (iv) freeze-drying to obtain graphene powder. This process takes 6-7 or 9-10 d for aq. suspensions and dry powders, resp. The product has well-defined properties and can be used for many science and technol. applications, including toxicol. impact assessment and the prodn. of innovative medical devices.
- 61Yang, S.; Lohe, M. R.; Müllen, K.; Feng, X. New-Generation Graphene from Electrochemical Approaches: Production and Applications. Adv. Mater. 2016, 28, 6213– 6221, DOI: 10.1002/adma.201505326[Crossref], [PubMed], [CAS], Google Scholar61https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC28XhvVSitbk%253D&md5=bcc93390e8971a15c363364ddbf89006New-Generation Graphene from Electrochemical Approaches: Production and ApplicationsYang, Sheng; Lohe, Martin R.; Muellen, Klaus; Feng, XinliangAdvanced Materials (Weinheim, Germany) (2016), 28 (29), 6213-6221CODEN: ADVMEW; ISSN:0935-9648. (Wiley-VCH Verlag GmbH & Co. KGaA)A review. Extensive research suggests a bright future for the graphene market. However, for a long time there was a huge gap between lab.-scale research and com. application due to the challenging task of reproducible bulk prodn. of high-quality graphene at low cost. Electrochem. exfoliation of graphite has emerged as a promising wet chem. method with advantages such as upscalability, soln. processability and eco-friendliness. Recent progress in the electrochem. exfoliation of graphite and prospects for the application of exfoliated graphene, mainly in the fields of composites, electronics, energy storage and conversion are discussed.
- 62Gao, X.; Lowry, G. V. Progress towards Standardized and Validated Characterizations for Measuring Physicochemical Properties of Manufactured Nanomaterials Relevant to Nano Health and Safety Risks. NanoImpact 2018, 9, 14– 30, DOI: 10.1016/j.impact.2017.09.002
- 63Bourdo, S. E.; Al Faouri, R.; Sleezer, R.; Nima, Z. A.; Lafont, A.; Chhetri, B. P.; Benamara, M.; Martin, B.; Salamo, G. J.; Biris, A. S. Physicochemical Characteristics of Pristine and Functionalized Graphene. J. Appl. Toxicol. 2017, 37, 1288– 1296, DOI: 10.1002/jat.3493[Crossref], [PubMed], [CAS], Google Scholar63https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2sXhtFSmu7%252FM&md5=b92964e5275459e9b5189c85a79a910bPhysicochemical characteristics of pristine and functionalized grapheneBourdo, Shawn E.; Al Faouri, Radwan; Sleezer, Robert; Nima, Zeid A.; Lafont, Andersen; Chhetri, Bijay P.; Benamara, Mourad; Martin, Betty; Salamo, Gregory J.; Biris, Alexandru S.Journal of Applied Toxicology (2017), 37 (11), 1288-1296CODEN: JJATDK; ISSN:0260-437X. (John Wiley & Sons Ltd.)Graphene-based nanomaterials have received significant attention in the last decade due to their interesting properties. Its elec. and thermal cond. and strength make graphene well suited for a variety of applications, particularly for use as a composite material in plastics. Furthermore, much work is taking place to utilize graphene as a biomaterial for uses such as drug delivery and tissue regeneration scaffolds. Owing to the rapid progress of graphene and its potential in many marketplaces, the potential toxicity of these materials has garnered attention. Graphene, while simple in its purest form, can have many different chem. and phys. properties. In this paper, we describe our toxicity evaluation of pristine graphene and a functionalized graphene sample that has been oxidized for enhanced hydrophilicity, which was synthesized from the pristine sample. The samples were characterized by XPS, Raman spectroscopy, IR spectroscopy, thermogravimetric anal., zeta-potential, at. force microscopy and electron microscopy. We discuss the disagreement between the size of imaged samples analyzed by at. force microscopy and by transmission electron microscopy. Furthermore, the samples each exhibit quite different surface chem. and structure, which directly affects their interaction with aq. environments and is important to consider when evaluating the toxicity of materials both in vitro and in vivo.
- 64Li, Y.; Fujita, M.; Boraschi, D. Endotoxin Contamination in Nanomaterials Leads to the Misinterpretation of Immunosafety Results. Front. Immunol. 2017, 8, 472, DOI: 10.3389/fimmu.2017.00472[Crossref], [PubMed], [CAS], Google Scholar64https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC1cXhvFemsL7N&md5=fe86b38a30c32264e67f7a34c0dd9a32Endotoxin contamination in nanomaterials leads to the misinterpretation of immunosafety resultsLi, Yang; Fujita, Mayumi; Boraschi, DianaFrontiers in Immunology (2017), 8 (), 00472/1-00472/7CODEN: FIRMCW; ISSN:1664-3224. (Frontiers Media S.A.)Given the presence of engineered nanomaterials in consumers' products and their application in nanomedicine, nanosafety assessment is becoming increasingly import-ant. In particular, immunosafety aspects are being actively investigated. In nanomaterial immunosafety testing strategies, it is important to consider that nanomaterials and nanoparticles are very easy to become contaminated with endotoxin, which is a wide-spread contaminant coming from the Gram-neg. bacterial cell membrane. Because of the potent inflammatory activity of endotoxin, contaminated nanomaterials can show inflammatory/toxic effects due to endotoxin, which may mask or misidentify the real bio-logical effects (or lack thereof) of nanomaterials. Therefore, before running immunosafety assays, either in vitro or in vivo, the presence of endotoxin in nanomaterials must be evaluated. This calls for using appropriate assays with proper controls, because many nanomaterials interfere at various levels with the com. available endotoxin detec-tion methods. This also underlines the need to develop robust and bespoke strategies for endotoxin evaluation in nanomaterials.
- 65Pumera, M.; Ambrosi, A.; Chng, E. L. K. Impurities in Graphenes and Carbon Nanotubes and Their Influence on the Redox Properties. Chem. Sci. 2012, 3, 3347– 3355, DOI: 10.1039/c2sc21374e[Crossref], [CAS], Google Scholar65https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC38XhsF2rtrvI&md5=5ecd5ddd14bc435d50644e29e11751acImpurities in graphenes and carbon nanotubes and their influence on the redox propertiesPumera, Martin; Ambrosi, Adriano; Chng, Elaine Lay KhimChemical Science (2012), 3 (12), 3347-3355CODEN: CSHCCN; ISSN:2041-6520. (Royal Society of Chemistry)A review. Carbon nanomaterials, such as carbon nanotubes and graphene-related materials are currently being heavily researched and widely proposed for numerous applications. It is often underestimated that these carbon nanomaterials are of complex nature, consisting of different components and often contg. impurities. These impurities can dramatically influence, or even dominate various properties of carbon nanotubes and graphenes. Herein, we will show that impurities in such carbon nanomaterials are capable of exhibiting a striking effect on their redox properties. The impurities being discussed include metallic, nanographitic and amorphous carbon-based impurities commonly found in carbon nanotube samples; and metallic, nanographitic, and carbonaceous debris-based impurities in graphenes. We emphasize that the effects brought about by these impurities on the properties of the carbon nanomaterials can, in many cases be rather significant. As such, one needs to be cautious by clearly accounting for these effects obsd. for the nanomaterials before assigning any properties to the material itself.
- 66Liao, K.-H.; Lin, Y.-S.; Macosko, C. W.; Haynes, C. L. Cytotoxicity of Graphene Oxide and Graphene in Human Erythrocytes and Skin Fibroblasts. ACS Appl. Mater. Interfaces 2011, 3, 2607– 2615, DOI: 10.1021/am200428v[ACS Full Text
 ], [CAS], Google Scholar66https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3MXotlGhsL8%253D&md5=c85d96f60388c108e3d665be8a304c60Cytotoxicity of Graphene Oxide and Graphene in Human Erythrocytes and Skin FibroblastsLiao, Ken-Hsuan; Lin, Yu-Shen; Macosko, Christopher W.; Haynes, Christy L.ACS Applied Materials & Interfaces (2011), 3 (7), 2607-2615CODEN: AAMICK; ISSN:1944-8244. (American Chemical Society)Two-dimensional carbon-based nanomaterials, including graphene oxide and graphene, are potential candidates for biomedical applications such as sensors, cell labeling, bacterial inhibition, and drug delivery. Herein, the authors explore the biocompatibility of graphene-related materials with controlled phys. and chem. properties. The size and extent of exfoliation of graphene oxide sheets was varied by sonication intensity and time. Graphene sheets were obtained from graphene oxide by a simple (hydrazine-free) hydrothermal route. The particle size, morphol., exfoliation extent, oxygen content, and surface charge of graphene oxide and graphene were characterized by wide-angle powder X-ray diffraction, at. force microscopy, XPS, dynamic light scattering, and zeta-potential. One method of toxicity assessment was based on measurement of the efflux of Hb from suspended red blood cells. At the smallest size, graphene oxide showed the greatest hemolytic activity, whereas aggregated graphene sheets exhibited the lowest hemolytic activity. Coating graphene oxide with chitosan nearly eliminated hemolytic activity. Together, these results demonstrate that particle size, particulate state, and oxygen content/surface charge of graphene have a strong impact on biol./toxicol. responses to red blood cells. In addn., the cytotoxicity of graphene oxide and graphene sheets was investigated by measuring mitochondrial activity in adherent human skin fibroblasts using two assays. The methylthiazolyldiphenyl-tetrazolium bromide (MTT) assay, a typical nanotoxicity assay, fails to predict the toxicity of graphene oxide and graphene toxicity because of the spontaneous redn. of MTT by graphene and graphene oxide, resulting in a false pos. signal. However, appropriate alternate assessments, using the water-sol. tetrazolium salt (WST-8), trypan blue exclusion, and reactive oxygen species assay reveal that the compacted graphene sheets are more damaging to mammalian fibroblasts than the less densely packed graphene oxide. Clearly, the toxicity of graphene and graphene oxide depends on the exposure environment (i.e., whether or not aggregation occurs) and mode of interaction with cells (i.e., suspension vs. adherent cell types).
], [CAS], Google Scholar66https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3MXotlGhsL8%253D&md5=c85d96f60388c108e3d665be8a304c60Cytotoxicity of Graphene Oxide and Graphene in Human Erythrocytes and Skin FibroblastsLiao, Ken-Hsuan; Lin, Yu-Shen; Macosko, Christopher W.; Haynes, Christy L.ACS Applied Materials & Interfaces (2011), 3 (7), 2607-2615CODEN: AAMICK; ISSN:1944-8244. (American Chemical Society)Two-dimensional carbon-based nanomaterials, including graphene oxide and graphene, are potential candidates for biomedical applications such as sensors, cell labeling, bacterial inhibition, and drug delivery. Herein, the authors explore the biocompatibility of graphene-related materials with controlled phys. and chem. properties. The size and extent of exfoliation of graphene oxide sheets was varied by sonication intensity and time. Graphene sheets were obtained from graphene oxide by a simple (hydrazine-free) hydrothermal route. The particle size, morphol., exfoliation extent, oxygen content, and surface charge of graphene oxide and graphene were characterized by wide-angle powder X-ray diffraction, at. force microscopy, XPS, dynamic light scattering, and zeta-potential. One method of toxicity assessment was based on measurement of the efflux of Hb from suspended red blood cells. At the smallest size, graphene oxide showed the greatest hemolytic activity, whereas aggregated graphene sheets exhibited the lowest hemolytic activity. Coating graphene oxide with chitosan nearly eliminated hemolytic activity. Together, these results demonstrate that particle size, particulate state, and oxygen content/surface charge of graphene have a strong impact on biol./toxicol. responses to red blood cells. In addn., the cytotoxicity of graphene oxide and graphene sheets was investigated by measuring mitochondrial activity in adherent human skin fibroblasts using two assays. The methylthiazolyldiphenyl-tetrazolium bromide (MTT) assay, a typical nanotoxicity assay, fails to predict the toxicity of graphene oxide and graphene toxicity because of the spontaneous redn. of MTT by graphene and graphene oxide, resulting in a false pos. signal. However, appropriate alternate assessments, using the water-sol. tetrazolium salt (WST-8), trypan blue exclusion, and reactive oxygen species assay reveal that the compacted graphene sheets are more damaging to mammalian fibroblasts than the less densely packed graphene oxide. Clearly, the toxicity of graphene and graphene oxide depends on the exposure environment (i.e., whether or not aggregation occurs) and mode of interaction with cells (i.e., suspension vs. adherent cell types). - 67Yang, K.; Wan, J.; Zhang, S.; Zhang, Y.; Lee, S.-T.; Liu, Z. In Vivo Pharmacokinetics, Long-Term Biodistribution, and Toxicology of PEGylated Graphene in Mice. ACS Nano 2011, 5, 516– 522, DOI: 10.1021/nn1024303[ACS Full Text
 ], [CAS], Google Scholar67https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3cXhsFKqu7%252FL&md5=5b9b425a918f0092a66b9e7d804753eeIn Vivo Pharmacokinetics, Long-Term Biodistribution, and Toxicology of PEGylated Graphene in MiceYang, Kai; Wan, Jian-Mei; Zhang, Shuai; Zhang, You-Jiu; Lee, Shuit-Tong; Liu, ZhuangACS Nano (2011), 5 (1), 516-522CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)Graphene has emerged as interesting nanomaterials with promising applications in a range of fields including biomedicine. In this work, for the first time we study the long-term in vivo biodistribution of 125I-labeled nanographene sheets (NGS) functionalized with polyethylene glycol (PEG) and systematically examine the potential toxicity of graphene over time. Our results show that PEGylated NGS mainly accumulate in the reticuloendothelial system (RES) including liver and spleen after i.v. administration and can be gradually cleared, likely by both renal and fecal excretion. PEGylated NGS do not cause appreciable toxicity at our tested dose (20 mg/kg) to the treated mice in a period of 3 mo as evidenced by blood biochem., hematol. anal., and histol. examns. Our work greatly encourages further studies of graphene for biomedical applications.
], [CAS], Google Scholar67https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3cXhsFKqu7%252FL&md5=5b9b425a918f0092a66b9e7d804753eeIn Vivo Pharmacokinetics, Long-Term Biodistribution, and Toxicology of PEGylated Graphene in MiceYang, Kai; Wan, Jian-Mei; Zhang, Shuai; Zhang, You-Jiu; Lee, Shuit-Tong; Liu, ZhuangACS Nano (2011), 5 (1), 516-522CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)Graphene has emerged as interesting nanomaterials with promising applications in a range of fields including biomedicine. In this work, for the first time we study the long-term in vivo biodistribution of 125I-labeled nanographene sheets (NGS) functionalized with polyethylene glycol (PEG) and systematically examine the potential toxicity of graphene over time. Our results show that PEGylated NGS mainly accumulate in the reticuloendothelial system (RES) including liver and spleen after i.v. administration and can be gradually cleared, likely by both renal and fecal excretion. PEGylated NGS do not cause appreciable toxicity at our tested dose (20 mg/kg) to the treated mice in a period of 3 mo as evidenced by blood biochem., hematol. anal., and histol. examns. Our work greatly encourages further studies of graphene for biomedical applications. - 68Duch, M. C.; Budinger, G. R. S.; Liang, Y. T.; Soberanes, S.; Urich, D.; Chiarella, S. E.; Campochiaro, L. A.; Gonzalez, A.; Chandel, N. S.; Hersam, M. C.; Mutlu, G. M. Minimizing Oxidation and Stable Nanoscale Dispersion Improves the Biocompatibility of Graphene in the Lung. Nano Lett. 2011, 11, 5201– 5207, DOI: 10.1021/nl202515a[ACS Full Text
 ], [CAS], Google Scholar68https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A280%3ADC%252BC38%252Fmt1ersw%253D%253D&md5=2901611a7f1af578ef7f0160bd2ee63dMinimizing oxidation and stable nanoscale dispersion improves the biocompatibility of graphene in the lungDuch Matthew C; Budinger G R Scott; Liang Yu Teng; Soberanes Saul; Urich Daniela; Chiarella Sergio E; Campochiaro Laura A; Gonzalez Angel; Chandel Navdeep S; Hersam Mark C; Mutlu Gokhan MNano letters (2011), 11 (12), 5201-7 ISSN:.To facilitate the proposed use of graphene and its derivative graphene oxide (GO) in widespread applications, we explored strategies that improve the biocompatibility of graphene nanomaterials in the lung. In particular, solutions of aggregated graphene, Pluronic dispersed graphene, and GO were administered directly into the lungs of mice. The introduction of GO resulted in severe and persistent lung injury. Furthermore, in cells GO increased the rate of mitochondrial respiration and the generation of reactive oxygen species, activating inflammatory and apoptotic pathways. In contrast, this toxicity was significantly reduced in the case of pristine graphene after liquid phase exfoliation and was further minimized when the unoxidized graphene was well-dispersed with the block copolymer Pluronic. Our results demonstrate that the covalent oxidation of graphene is a major contributor to its pulmonary toxicity and suggest that dispersion of pristine graphene in Pluronic provides a pathway for the safe handling and potential biomedical application of two-dimensional carbon nanomaterials.
], [CAS], Google Scholar68https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A280%3ADC%252BC38%252Fmt1ersw%253D%253D&md5=2901611a7f1af578ef7f0160bd2ee63dMinimizing oxidation and stable nanoscale dispersion improves the biocompatibility of graphene in the lungDuch Matthew C; Budinger G R Scott; Liang Yu Teng; Soberanes Saul; Urich Daniela; Chiarella Sergio E; Campochiaro Laura A; Gonzalez Angel; Chandel Navdeep S; Hersam Mark C; Mutlu Gokhan MNano letters (2011), 11 (12), 5201-7 ISSN:.To facilitate the proposed use of graphene and its derivative graphene oxide (GO) in widespread applications, we explored strategies that improve the biocompatibility of graphene nanomaterials in the lung. In particular, solutions of aggregated graphene, Pluronic dispersed graphene, and GO were administered directly into the lungs of mice. The introduction of GO resulted in severe and persistent lung injury. Furthermore, in cells GO increased the rate of mitochondrial respiration and the generation of reactive oxygen species, activating inflammatory and apoptotic pathways. In contrast, this toxicity was significantly reduced in the case of pristine graphene after liquid phase exfoliation and was further minimized when the unoxidized graphene was well-dispersed with the block copolymer Pluronic. Our results demonstrate that the covalent oxidation of graphene is a major contributor to its pulmonary toxicity and suggest that dispersion of pristine graphene in Pluronic provides a pathway for the safe handling and potential biomedical application of two-dimensional carbon nanomaterials. - 69Pinto, A. M.; Moreira, J. A.; Magalhães, F. D.; Gonçalves, I. C. Polymer Surface Adsorption as a Strategy to Improve the Biocompatibility of Graphene Nanoplatelets. Colloids Surf., B 2016, 146, 818– 824, DOI: 10.1016/j.colsurfb.2016.07.031[Crossref], [PubMed], [CAS], Google Scholar69https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC28Xht1ClurfO&md5=9d76975141ae4b55444923801248cdacPolymer surface adsorption as a strategy to improve the biocompatibility of graphene nanoplateletsPinto, Artur M.; Moreira, J. Agostinho; Magalhaes, Fernao D.; Goncalves, Ines C.Colloids and Surfaces, B: Biointerfaces (2016), 146 (), 818-824CODEN: CSBBEQ; ISSN:0927-7765. (Elsevier B.V.)The biointeractions of graphene-based materials depend on their physico-chem. properties. These properties can be manipulated by polymer adsorption. Graphene nanoplatelets (GNP-C) were modified with PVA, HEC, PEG, PVP, chondroitin, glucosamine, and hyaluronic acid. These materials were characterized by SEM, DLS, XPS, Raman spectroscopy, and TGA. Surface adsorption was confirmed for all polymers. Biocompatibility evaluation showed that all of these materials induced low hemolysis (<1.7%) at concns. up to 500 μg mL-1. GNP-C-PVA and GNP-C-HEC presented the lowest haemolysis percentages and were therefore more thoroughly studied. The morphol. of HFF-1 cells was investigated by microscopy (optical, fluorescence, TEM) in order to evaluate interactions with GNP materials. Small GNP-C nanoplatelets were obsd. to enter cells independently of the surface treatment. For pristine GNP-C at a concn. of 50 μg mL-1, ROS prodn. increased 4.4-fold. This effect is lower for GNP-C-PVA (3.3-fold) and higher for GNP-C-HEC (5.1-fold). Resazurin assays showed that GNP-C caused toxicity in HFF-1 cells at concns. above 20 μg mL-1 at 24 h, which decreased at 48 and 72 h. PVA surface adsorption rendered GNP-C non-toxic at concns. up to 50 μg mL-1. LIVE/DEAD assays showed that at 20 and 50 μg mL-1 cell death is significantly lower for GNP-C-PVA compared to pristine GNP-C. Modification of nanoplatelets with HEC resulted in no benefit in terms of biocompatibility, whereas PVA considerably improved the biocompatibility.
- 70Meng, H.; Xia, T.; George, S.; Nel, A. E. A Predictive Toxicological Paradigm for the Safety Assessment of Nanomaterials. ACS Nano 2009, 3, 1620– 1627, DOI: 10.1021/nn9005973[ACS Full Text
 ], [CAS], Google Scholar70https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BD1MXovVOjsrw%253D&md5=69dfff2a92731684b22b146e706ef284A Predictive Toxicological Paradigm for the Safety Assessment of NanomaterialsMeng, Huan; Xia, Tian; George, Saji; Nel, Andre E.ACS Nano (2009), 3 (7), 1620-1627CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)A review. The rate of expansion of nanomaterials calls for the consideration of appropriate toxicol. paradigms in the safety assessment of nanomaterials. We advocate a predictive toxicol. paradigm for the assessment of nanomaterial hazards. The predictive toxicol. approach is defined as establishing and using mechanisms and pathways of injury at a cellular and mol. level to prioritize screening for adverse biol. effects and health outcomes in vivo. Specifically as it relates to nanomaterials, a predictive approach has to consider the physicochem. properties of the material that leads to mol. or cellular injury and also has to be valid in terms of disease pathogenesis in whole organisms.
], [CAS], Google Scholar70https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BD1MXovVOjsrw%253D&md5=69dfff2a92731684b22b146e706ef284A Predictive Toxicological Paradigm for the Safety Assessment of NanomaterialsMeng, Huan; Xia, Tian; George, Saji; Nel, Andre E.ACS Nano (2009), 3 (7), 1620-1627CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)A review. The rate of expansion of nanomaterials calls for the consideration of appropriate toxicol. paradigms in the safety assessment of nanomaterials. We advocate a predictive toxicol. paradigm for the assessment of nanomaterial hazards. The predictive toxicol. approach is defined as establishing and using mechanisms and pathways of injury at a cellular and mol. level to prioritize screening for adverse biol. effects and health outcomes in vivo. Specifically as it relates to nanomaterials, a predictive approach has to consider the physicochem. properties of the material that leads to mol. or cellular injury and also has to be valid in terms of disease pathogenesis in whole organisms. - 71Pokhrel, S.; Nel, A. E.; Mädler, L. Custom-Designed Nanomaterial Libraries for Testing Metal Oxide Toxicity. Acc. Chem. Res. 2013, 46 (3), 632– 641, DOI: 10.1021/ar300032q[ACS Full Text
 ], [CAS], Google Scholar71https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC38XhslKhsb3L&md5=0f6e46b17d211dd5ec58ff7f4dbec346Custom-Designed Nanomaterial Libraries for Testing Metal Oxide ToxicityPokhrel, Suman; Nel, Andre E.; Maedler, LutzAccounts of Chemical Research (2013), 46 (3), 632-641CODEN: ACHRE4; ISSN:0001-4842. (American Chemical Society)Advances in aerosol technol. over the past 10 years have enabled the generation and design of ultrafine nanoscale materials for many applications. A key new method is flame spray pyrolysis (FSP), which produces particles by pyrolyzing a precursor soln. in the gas phase. FSP is a highly versatile technique for fast, single-step, scalable synthesis of nanoscale materials. New innovations in particle synthesis using FSP technol., including variations in precursor chem., have enabled flexible, dry synthesis of loosely agglomerated, highly cryst. ultrafine powders (porosity ≥90%) of binary, ternary, and mixed-binary-and-ternary oxides. FSP can fulfill much of the increasing demand, esp. in biol. applications, for particles with specific material compn., high purity, and high crystallinity. In this Account, the authors describe a strategy for creating nanoparticle libraries (pure or Fedoped ZnO or TiO2) utilizing FSP and using these libraries to test hypotheses related to the particles' toxicity. The authors' innovation lies in the overall integration of the knowledge the authors have developed in the last 5 years in synthesizing nanomaterials to address specific hypotheses, demonstrating the electronic properties that cause the material toxicity, understanding the reaction mechanisms causing the toxicity, and extg. from in vitro testing and in vivo testing in terrestrial and marine organisms the essential properties of safe nanomaterials. On the basis of this acquired knowledge, the authors further describe how the dissolved metal ion from these materials (Zn2+ in this Account) can effectively bind with different cell constituents, causing toxicity. The authors use Fe-S protein clusters as an example of the complex chem. reactions taking place after free metal ions migrate into the cells. As a second example, TiO2 is an active material in the UV range that exhibits photocatalytic behavior. The induction of electron-hole (e-/H+) pairs followed by free radical prodn. is a key mechanism for biol. injury. The authors show that decreasing the bandgap energy increases the phototoxicity in the presence of near-visible light. The authors present in detail the mechanism of electron transfer in biotic and abiotic systems during light exposure. Through this example FSP is a versatile technique for efficiently designing a homologous library, meaning a library based on a parent oxide doped with different amts. of dopant, and investigating the properties of the resulting compds. Finally, the authors describe the future outlook and state-of-the-art of an innovative two-flame system. A double-flame reactor enables independent control over each flame, the nozzle distances and the flame angles for efficient mixing of the particle streams. In addn., it allows for different flame compns., flame sizes, and multicomponent mixing (a grain-grain heterojunction) during the reaction process.
], [CAS], Google Scholar71https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC38XhslKhsb3L&md5=0f6e46b17d211dd5ec58ff7f4dbec346Custom-Designed Nanomaterial Libraries for Testing Metal Oxide ToxicityPokhrel, Suman; Nel, Andre E.; Maedler, LutzAccounts of Chemical Research (2013), 46 (3), 632-641CODEN: ACHRE4; ISSN:0001-4842. (American Chemical Society)Advances in aerosol technol. over the past 10 years have enabled the generation and design of ultrafine nanoscale materials for many applications. A key new method is flame spray pyrolysis (FSP), which produces particles by pyrolyzing a precursor soln. in the gas phase. FSP is a highly versatile technique for fast, single-step, scalable synthesis of nanoscale materials. New innovations in particle synthesis using FSP technol., including variations in precursor chem., have enabled flexible, dry synthesis of loosely agglomerated, highly cryst. ultrafine powders (porosity ≥90%) of binary, ternary, and mixed-binary-and-ternary oxides. FSP can fulfill much of the increasing demand, esp. in biol. applications, for particles with specific material compn., high purity, and high crystallinity. In this Account, the authors describe a strategy for creating nanoparticle libraries (pure or Fedoped ZnO or TiO2) utilizing FSP and using these libraries to test hypotheses related to the particles' toxicity. The authors' innovation lies in the overall integration of the knowledge the authors have developed in the last 5 years in synthesizing nanomaterials to address specific hypotheses, demonstrating the electronic properties that cause the material toxicity, understanding the reaction mechanisms causing the toxicity, and extg. from in vitro testing and in vivo testing in terrestrial and marine organisms the essential properties of safe nanomaterials. On the basis of this acquired knowledge, the authors further describe how the dissolved metal ion from these materials (Zn2+ in this Account) can effectively bind with different cell constituents, causing toxicity. The authors use Fe-S protein clusters as an example of the complex chem. reactions taking place after free metal ions migrate into the cells. As a second example, TiO2 is an active material in the UV range that exhibits photocatalytic behavior. The induction of electron-hole (e-/H+) pairs followed by free radical prodn. is a key mechanism for biol. injury. The authors show that decreasing the bandgap energy increases the phototoxicity in the presence of near-visible light. The authors present in detail the mechanism of electron transfer in biotic and abiotic systems during light exposure. Through this example FSP is a versatile technique for efficiently designing a homologous library, meaning a library based on a parent oxide doped with different amts. of dopant, and investigating the properties of the resulting compds. Finally, the authors describe the future outlook and state-of-the-art of an innovative two-flame system. A double-flame reactor enables independent control over each flame, the nozzle distances and the flame angles for efficient mixing of the particle streams. In addn., it allows for different flame compns., flame sizes, and multicomponent mixing (a grain-grain heterojunction) during the reaction process. - 72Walkey, C. D.; Olsen, J. B.; Song, F.; Liu, R.; Guo, H.; Olsen, D. W. H.; Cohen, Y.; Emili, A.; Chan, W. C. W. Protein Corona Fingerprinting Predicts the Cellular Interaction of Gold and Silver Nanoparticles. ACS Nano 2014, 8, 2439– 2455, DOI: 10.1021/nn406018q[ACS Full Text
 ], [CAS], Google Scholar72https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2cXisVWitLk%253D&md5=6d25fd4ea571d7e9344bd853adf8dbeaProtein Corona Fingerprinting Predicts the Cellular Interaction of Gold and Silver NanoparticlesWalkey, Carl D.; Olsen, Jonathan B.; Song, Fayi; Liu, Rong; Guo, Hongbo; Olsen, D. Wesley H.; Cohen, Yoram; Emili, Andrew; Chan, Warren C. W.ACS Nano (2014), 8 (3), 2439-2455CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)Using quant. models to predict the biol. interactions of nanoparticles will accelerate the translation of nanotechnol. Here, we characterized the serum protein corona 'fingerprint' formed around a library of 105 surface-modified gold nanoparticles. Applying a bioinformatics-inspired approach, we developed a multivariate model that uses the protein corona fingerprint to predict cell assocn. 50% more accurately than a model that uses parameters describing nanoparticle size, aggregation state, and surface charge. Our model implicates a set of hyaluronan-binding proteins as mediators of nanoparticle-cell interactions. This study establishes a framework for developing a comprehensive database of protein corona fingerprints and biol. responses for multiple nanoparticle types. Such a database can be used to develop quant. relationships that predict the biol. responses to nanoparticles and will aid in uncovering the fundamental mechanisms of nano-bio interactions.
], [CAS], Google Scholar72https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2cXisVWitLk%253D&md5=6d25fd4ea571d7e9344bd853adf8dbeaProtein Corona Fingerprinting Predicts the Cellular Interaction of Gold and Silver NanoparticlesWalkey, Carl D.; Olsen, Jonathan B.; Song, Fayi; Liu, Rong; Guo, Hongbo; Olsen, D. Wesley H.; Cohen, Yoram; Emili, Andrew; Chan, Warren C. W.ACS Nano (2014), 8 (3), 2439-2455CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)Using quant. models to predict the biol. interactions of nanoparticles will accelerate the translation of nanotechnol. Here, we characterized the serum protein corona 'fingerprint' formed around a library of 105 surface-modified gold nanoparticles. Applying a bioinformatics-inspired approach, we developed a multivariate model that uses the protein corona fingerprint to predict cell assocn. 50% more accurately than a model that uses parameters describing nanoparticle size, aggregation state, and surface charge. Our model implicates a set of hyaluronan-binding proteins as mediators of nanoparticle-cell interactions. This study establishes a framework for developing a comprehensive database of protein corona fingerprints and biol. responses for multiple nanoparticle types. Such a database can be used to develop quant. relationships that predict the biol. responses to nanoparticles and will aid in uncovering the fundamental mechanisms of nano-bio interactions. - 73Zhou, H.; Mu, Q.; Gao, N.; Liu, A.; Xing, Y.; Gao, S.; Zhang, Q.; Qu, G.; Chen, Y.; Liu, G.; Zhang, B.; Yan, B. A Nano-Combinatorial Library Strategy for the Discovery of Nanotubes with Reduced Protein-Binding, Cytotoxicity, and Immune Response. Nano Lett. 2008, 8, 859– 865, DOI: 10.1021/nl0730155[ACS Full Text
 ], [CAS], Google Scholar73https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BD1cXitleis7s%253D&md5=1a831465872c69ebd489a5841567a502A Nano-Combinatorial Library Strategy for the Discovery of Nanotubes with Reduced Protein-Binding, Cytotoxicity, and Immune ResponseZhou, Hongyu; Mu, Qingxin; Gao, Ningning; Liu, Aifeng; Xing, Yuehan; Gao, Sulian; Zhang, Qiu; Qu, Guangbo; Chen, Yuyan; Liu, Gang; Zhang, Bin; Yan, BingNano Letters (2008), 8 (3), 859-865CODEN: NALEFD; ISSN:1530-6984. (American Chemical Society)The authors have discovered functionalized multiwalled carbon nanotubes with reduced protein-binding, cytotoxicity, and immune response and the assocd. structure-activity relationships using in silico surface mol. diversity design, combinatorial library synthesis, and multiple biol. screenings. The authors' results demonstrated the general utility of the nanocombinatorial library approach in nanomedicine and nanotoxicity research.
], [CAS], Google Scholar73https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BD1cXitleis7s%253D&md5=1a831465872c69ebd489a5841567a502A Nano-Combinatorial Library Strategy for the Discovery of Nanotubes with Reduced Protein-Binding, Cytotoxicity, and Immune ResponseZhou, Hongyu; Mu, Qingxin; Gao, Ningning; Liu, Aifeng; Xing, Yuehan; Gao, Sulian; Zhang, Qiu; Qu, Guangbo; Chen, Yuyan; Liu, Gang; Zhang, Bin; Yan, BingNano Letters (2008), 8 (3), 859-865CODEN: NALEFD; ISSN:1530-6984. (American Chemical Society)The authors have discovered functionalized multiwalled carbon nanotubes with reduced protein-binding, cytotoxicity, and immune response and the assocd. structure-activity relationships using in silico surface mol. diversity design, combinatorial library synthesis, and multiple biol. screenings. The authors' results demonstrated the general utility of the nanocombinatorial library approach in nanomedicine and nanotoxicity research. - 74Li, Y.; Wang, J.; Zhao, F.; Bai, B.; Nie, G.; Nel, A. E.; Zhao, Y. Nanomaterial Libraries and Model Organisms for Rapid High-Content Analysis of Nanosafety. Natl. Sci. Rev. 2018, 5, 365– 388, DOI: 10.1093/nsr/nwx120
- 75Docter, D.; Westmeier, D.; Markiewicz, M.; Stolte, S.; Knauer, S. K.; Stauber, R. H. The Nanoparticle Biomolecule Corona: Lessons Learned – Challenge Accepted?. Chem. Soc. Rev. 2015, 44, 6094– 6121, DOI: 10.1039/C5CS00217F[Crossref], [PubMed], [CAS], Google Scholar75https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2MXhtVSgsLvN&md5=3d9164867a4a20b6f9cf3c3a0dc287b8The nanoparticle biomolecule corona: lessons learned - challenge accepted?Docter, D.; Westmeier, D.; Markiewicz, M.; Stolte, S.; Knauer, S. K.; Stauber, R. H.Chemical Society Reviews (2015), 44 (17), 6094-6121CODEN: CSRVBR; ISSN:0306-0012. (Royal Society of Chemistry)Besides the wide use of engineered nanomaterials (NMs) in tech. products, their applications are not only increasing in biotechnol. and biomedicine, but also in the environmental field. While the physico-chem. properties and behavior of NMs can be characterized accurately under idealized conditions, this is no longer the case in complex physiol. or natural environments. Herein, proteins and other biomols. rapidly bind to NMs, forming a protein/biomol. corona that critically affects the NMs' (patho)biol. and tech. identities. As the corona impacts the in vitro and/or in vivo NM applications in humans and ecosystems, a mechanistic understanding of its relevance and of the biophys. forces regulating corona formation is mandatory. Based on recent insights, we here critically review and present an updated concept of corona formation and evolution. We comment on how corona signatures may be linked to effects at the nano-bio interface in physiol. and environmental systems. In order to comprehensively analyze corona profiles and to mechanistically understand the coronas' biol./ecol. impact, we present a tiered multidisciplinary approach. To stimulate progress in this field, we introduce the potential impact of the corona for NM-microbiome-(human)host interactions and the novel concept of 'nanologicals', i.e., the nanomaterial-specific targeting of mol. machines. We conclude by discussing the relevant challenges that still need to be resolved in this field.
- 76Bussy, C.; Kostarelos, K. Culture Media Critically Influence Graphene Oxide Effects on Plasma Membranes. Chem. 2017, 2, 322– 323, DOI: 10.1016/j.chempr.2017.01.015
- 77Chen, R.; Riviere, J. E. Biological Surface Adsorption Index of Nanomaterials: Modelling Surface Interactions of Nanomaterials with Biomolecules. Adv. Exp. Med. Biol. 2017, 947, 207– 253, DOI: 10.1007/978-3-319-47754-1_8[Crossref], [PubMed], [CAS], Google Scholar77https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC1cXhtVOhsL%252FK&md5=8873de2885127bfde51f89af2178c2c4Biological surface adsorption index of nanomaterials: modelling surface interactions of nanomaterials with biomoleculesChen, Ran; Riviere, Jim E.Advances in Experimental Medicine and Biology (2017), 947 (Modelling the Toxicity of Nanoparticles), 207-253CODEN: AEMBAP; ISSN:2214-8019. (Springer)A review. Quant. anal. of the interactions between nanomaterials and their surrounding environment is crucial for safety evaluation in the application of nanotechnol. as well as its development and standardization. In this chapter, we demonstrate the importance of the adsorption of surrounding mols. onto the surface of nanomaterials by forming biocorona and thus impact the bio-identity and fate of those materials. We illustrate the key factors including various phys. forces in detg. the interaction happening at bio-nano interfaces. We further discuss the math. endeavors in explaining and predicting the adsorption phenomena, and propose a new statistics-based surface adsorption model, the Biol. Surface Adsorption Index (BSAI), to quant. analyze the interaction profile of surface adsorption of a large group of small org. mols. onto nanomaterials with varying surface physicochem. properties, first employing five descriptors representing the surface energy profile of the nanomaterials, then further incorporating traditional semi-empirical adsorption models to address concn. effects of solutes. These Advancements in surface adsorption modeling showed a promising development in the application of quant. predictive models in biol. applications, nanomedicine, and environmental safety assessment of nanomaterials.
- 78Graham, U. M.; Jacobs, G.; Yokel, R. A.; Davis, B. H.; Dozier, A. K.; Birch, M. E.; Tseng, M. T.; Oberdörster, G.; Elder, A.; DeLouise, L. From Dose to Response: In Vivo Nanoparticle Processing and Potential Toxicity. Adv. Exp. Med. Biol. 2017, 947, 71– 100, DOI: 10.1007/978-3-319-47754-1_4
- 79Zhang, D.; Zhang, Z.; Liu, Y.; Chu, M.; Yang, C.; Li, W.; Shao, Y.; Yue, Y.; Xu, R. The Short- and Long-Term Effects of Orally Administered High-Dose Reduced Graphene Oxide Nanosheets on Mouse Behaviors. Biomaterials 2015, 68, 100– 113, DOI: 10.1016/j.biomaterials.2015.07.060[Crossref], [PubMed], [CAS], Google Scholar79https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2MXht1OgsLvP&md5=57e7bd3d4ece2d88765fea35ec291779The short- and long-term effects of orally administered high-dose reduced graphene oxide nanosheets on mouse behaviorsZhang, Ding; Zhang, Zheyu; Liu, Yayun; Chu, Maoquan; Yang, Chengyu; Li, Wenhao; Shao, Yuxiang; Yue, Yan; Xu, RujiaoBiomaterials (2015), 68 (), 100-113CODEN: BIMADU; ISSN:0142-9612. (Elsevier Ltd.)Reduced graphene oxide (rGO), a carbon-based nanomaterial, has enormous potential in biomedical research, including in vivo cancer therapeutics. Concerns over the toxicity remain outstanding and must be investigated before clin. application. The effect of rGO exposure on animal behaviors, such as learning and memory abilities, has not been clarified. Herein, we explored the short- and long-term effects of orally administered rGO on mouse behaviors, including general locomotor activity level, balance and neuromuscular coordination, exploratory and anxiety behaviors, and learning and memory abilities using open-field, rotarod, and Morris water maze tests. Compared with mice administered buffer-dispersed mouse chow or buffer alone, mice receiving a high dose of small or large rGO nanosheets showed little change in exploratory, anxiety-like, or learning and memory behaviors, although general locomotor activity, balance, and neuromuscular coordination were initially affected, which the mechanisms (e.g. the influence of rGO exposure on the activity of superoxide dismutase in mouse serum) were discussed. The results presented in this work look to provide a deep understanding of the in vivo toxicity of rGO to animals, esp. its effect on learning and memory and other behaviors.
- 80Yang, K.; Gong, H.; Shi, X.; Wan, J.; Zhang, Y.; Liu, Z. In Vivo Biodistribution and Toxicology of Functionalized Nano-Graphene Oxide in Mice after Oral and Intraperitoneal Administration. Biomaterials 2013, 34, 2787– 2795, DOI: 10.1016/j.biomaterials.2013.01.001[Crossref], [PubMed], [CAS], Google Scholar80https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3sXhtFahsbo%253D&md5=ee7c44c58878fbbf97db7e99e7101c02In vivo biodistribution and toxicology of functionalized nano-graphene oxide in mice after oral and intraperitoneal administrationYang, Kai; Gong, Hua; Shi, Xiaoze; Wan, Jianmei; Zhang, Youjiu; Liu, ZhuangBiomaterials (2013), 34 (11), 2787-2795CODEN: BIMADU; ISSN:0142-9612. (Elsevier Ltd.)Graphene oxide (GO) and its functionalized derivs. have attracted great attention in biomedicine in recent years. A no. of groups including ours have studied the in vivo behaviors of functionalized nano-graphene after i.v. injection or inhalation, and uncovered the surface coating & size dependent biodistribution and toxicol. profiles for this type of nanomaterials. However, the fate of GO derivs. in animals after oral feeding and i.p. injection, which are two other major drug administration routes, remain unclear. Therefore, in this work, we sought to systematically investigate in vivo biodistribution and potential toxicity of as-made GO and a no. of polyethylene glycol (PEG) functionalized GO derivs. with different sizes and surface coatings, after oral and i.p. administration at high doses. It is found that 125I labeled PEGylated GO derivs. show no obvious tissue uptake via oral administration, indicating the rather limited intestinal adsorption of those nanomaterials. In contrast, high accumulation of PEGylated GO derivs., but not as-made GO, in the reticuloendothelial (RES) system including liver and spleen is obsd. after i.p. injection. Further investigations based on histol. examn. of organ slices and hematol. anal. discover that although GO and PEGylated GO derivs. would retain in the mouse body over a long period of time after i.p. injection, their toxicity to the treated animals is insignificant. Our work is an important fundamental study that offers a deeper understanding of in vivo behaviors and toxicol. of functionalized nano-graphene in animals, depending on their different administration routes.
- 81Kucki, M.; Diener, L.; Bohmer, N.; Hirsch, C.; Krug, H. F.; Palermo, V.; Wick, P. Uptake of Label-Free Graphene Oxide by Caco-2 Cells Is Dependent on the Cell Differentiation Status. J. Nanobiotechnol. 2017, 15, 46, DOI: 10.1186/s12951-017-0280-7[Crossref], [PubMed], [CAS], Google Scholar81https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC1cXitVOru7jF&md5=8e2b097965d22dc299189ff1a127c22fUptake of label-free graphene oxide by Caco-2 cells is dependent on the cell diferentiation statusKucki, Melanie; Diener, Liliane; Bohmer, Nils; Hirsch, Cordula; Krug, Harald F.; Palermo, Vincenzo; Wick, PeterJournal of Nanobiotechnology (2017), 15 (), 46/1-46/18CODEN: JNOAAO; ISSN:1477-3155. (BioMed Central Ltd.)Background: Understanding the interaction of graphene-related materials (GRM) with human cells is a key to the assessment of their potential risks for human health. There is a knowledge gap regarding the potential uptake of GRM by human intestinal cells after unintended ingestion. Therefore the aim of our study was to investigate the interaction of label-free graphene oxide (GO) with the intestinal cell line Caco-2 in vitro and to shed light on the influence of the cell phenotype given by the differentiation status on cellular uptake behavior. Results: Internalisation of two label-free GOs with different lateral size and thickness by undifferentiated and differentiated Caco-2 cells was analyzed by SEM and transmission electron microscopy. Semiquantification of cells assocd. with GRM was performed by flow cytometry. Undifferentiated Caco-2 cells showed significant amts. of cell-assocd. GRM, whereas differentiated Caco-2 cells exhibited low adhesion of GO sheets. Transmission electron microscopy anal. revealed internalisation of both applied GO (small and large) by undifferentiated Caco-2 cells. Even large GO sheets with lateral dimensions up to 10 ´i.m., were found internalised by undifferentiated cells, presumably by macropinocytosis. In contrast, no GO uptake could be found for differentiated Caco-2 cells exhibiting an enterocyte-like morphol. with apical brush border. Conclusions: Our results show that the internalisation of GO is highly dependent on the cell differentiation status of human intestinal cells. During differentiation Caco-2 cells undergo intense phenotypic changes which lead to a dramatic decrease in GRM internalisation. The results support the hypothesis that the cell surface topog. of differentiated Caco-2 cells given by the brush border leads to low adhesion of GO sheets and sterical hindrance for material uptake. In addn., the mech. properties of GRM, esp. flexibility of the sheets, seem to be an important factor for internalisation of large GO sheets by epithelial cells. Our results highlight the importance of the choice of the in vitro model to enable better in vitro-in vivo translation.
- 82Li, B.; Yang, J.; Huang, Q.; Zhang, Y.; Peng, C.; Zhang, Y.; He, Y.; Shi, J.; Li, W.; Hu, J.; Fan, C. Biodistribution and Pulmonary Toxicity of Intratracheally Instilled Graphene Oxide in Mice. NPG Asia Mater. 2013, 5, e44– e44, DOI: 10.1038/am.2013.7[Crossref], [CAS], Google Scholar82https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3sXhtVyrsb%252FP&md5=24168dadf3cf1482ef58502f49c789c2Biodistribution and pulmonary toxicity of intratracheally instilled graphene oxide in miceLi, Bo; Yang, Jianzhong; Huang, Qing; Zhang, Yi; Peng, Cheng; Zhang, Yujie; He, Yao; Shi, Jiye; Li, Wenxin; Hu, Jun; Fan, ChunhaiNPG Asia Materials (2013), 5 (April), e44CODEN: NAMPCE; ISSN:1884-4057. (Nature Publishing Group)Graphene and its derivs. (for example, nanoscale graphene oxide (NGO)) have emerged as extremely attractive nanomaterials for a wide range of applications, including diagnostics and therapeutics. In this work, we present a systematic study on the in vivo distribution and pulmonary toxicity of NGO for up to 3 mo after exposure. Radioisotope tracing and morphol. observation demonstrated that intratracheally instilled NGO was mainly retained in the lung. NGO could result in acute lung injury (ALI) and chronic pulmonary fibrosis. Such NGO-induced ALI was related to oxidative stress and could effectively be relieved with dexamethasone treatment. In addn., we found that the biodistribution of 125I-NGO varied greatly from that of 125I ions, hence it is possible that nanoparticulates could deliver radioactive isotopes deep into the lung, which might settle in numerous hot spots' that could result in mutations and cancers, raising environmental concerns about the large-scale prodn. of graphene oxide.
- 83Mao, L.; Hu, M.; Pan, B.; Xie, Y.; Petersen, E. J. Biodistribution and Toxicity of Radio-Labeled Few Layer Graphene in Mice after Intratracheal Instillation. Part. Fibre Toxicol. 2015, 13, 7, DOI: 10.1186/s12989-016-0120-1
- 84Czarny, B.; Georgin, D.; Berthon, F.; Plastow, G.; Pinault, M.; Patriarche, G.; Thuleau, A.; L’Hermite, M. M.; Taran, F.; Dive, V. Carbon Nanotube Translocation to Distant Organs after Pulmonary Exposure: Insights from in Situ 14 C-Radiolabeling and Tissue Radioimaging. ACS Nano 2014, 8, 5715– 5724, DOI: 10.1021/nn500475u
- 85Sydlik, S. A.; Jhunjhunwala, S.; Webber, M. J.; Anderson, D. G.; Langer, R. In Vivo Compatibility of Graphene Oxide with Differing Oxidation States. ACS Nano 2015, 9, 3866– 3874, DOI: 10.1021/acsnano.5b01290[ACS Full Text
 ], [CAS], Google Scholar85https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2MXmtF2nsrg%253D&md5=66ccf832b46e17cb958425211b79e48cIn Vivo Compatibility of Graphene Oxide with Differing Oxidation StatesSydlik, Stefanie A.; Jhunjhunwala, Siddharth; Webber, Matthew J.; Anderson, Daniel G.; Langer, RobertACS Nano (2015), 9 (4), 3866-3874CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)Graphene oxide (GO) is suggested to have great potential as a component of biomedical devices. Although this nanomaterial has been demonstrated to be cytocompatible in vitro, its compatibility in vivo in tissue sites relevant for biomedical device application is yet to be fully understood. Here, we evaluate the compatibility of GO with two different oxidn. levels following implantation in s.c. and i.p. tissue sites, which are of broad relevance for application to medical devices. We demonstrate GO to be moderately compatible in vivo in both tissue sites, with the inflammatory reaction in response to implantation consistent with a typical foreign body reaction. A redn. in the degree of GO oxidn. results in faster immune cell infiltration, uptake, and clearance following both s.c. and peritoneal implantation. Future work toward surface modification or coating strategies could be useful to reduce the inflammatory response and improve compatibility of GO as a component of medical devices.
], [CAS], Google Scholar85https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2MXmtF2nsrg%253D&md5=66ccf832b46e17cb958425211b79e48cIn Vivo Compatibility of Graphene Oxide with Differing Oxidation StatesSydlik, Stefanie A.; Jhunjhunwala, Siddharth; Webber, Matthew J.; Anderson, Daniel G.; Langer, RobertACS Nano (2015), 9 (4), 3866-3874CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)Graphene oxide (GO) is suggested to have great potential as a component of biomedical devices. Although this nanomaterial has been demonstrated to be cytocompatible in vitro, its compatibility in vivo in tissue sites relevant for biomedical device application is yet to be fully understood. Here, we evaluate the compatibility of GO with two different oxidn. levels following implantation in s.c. and i.p. tissue sites, which are of broad relevance for application to medical devices. We demonstrate GO to be moderately compatible in vivo in both tissue sites, with the inflammatory reaction in response to implantation consistent with a typical foreign body reaction. A redn. in the degree of GO oxidn. results in faster immune cell infiltration, uptake, and clearance following both s.c. and peritoneal implantation. Future work toward surface modification or coating strategies could be useful to reduce the inflammatory response and improve compatibility of GO as a component of medical devices. - 86Kurantowicz, N.; Strojny, B.; Sawosz, E.; Jaworski, S.; Kutwin, M.; Grodzik, M.; Wierzbicki, M.; Lipińska, L.; Mitura, K.; Chwalibog, A. Biodistribution of a High Dose of Diamond, Graphite, and Graphene Oxide Nanoparticles After Multiple Intraperitoneal Injections in Rats. Nanoscale Res. Lett. 2015, 10, 398, DOI: 10.1186/s11671-015-1107-9[Crossref], [PubMed], [CAS], Google Scholar86https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A280%3ADC%252BC28zitlOnuw%253D%253D&md5=88b3d9a5d16b91e9bb2c2a7c353743d0Biodistribution of a High Dose of Diamond, Graphite, and Graphene Oxide Nanoparticles After Multiple Intraperitoneal Injections in RatsKurantowicz Natalia; Strojny Barbara; Sawosz Ewa; Jaworski Slawomir; Kutwin Marta; Grodzik Marta; Wierzbicki Mateusz; Lipinska Ludwika; Mitura Katarzyna; Chwalibog AndreNanoscale research letters (2015), 10 (1), 398 ISSN:1931-7573.Carbon nanoparticles have recently drawn intense attention in biomedical applications. Hence, there is a need for further in vivo investigations of their biocompatibility and biodistribution via various exposure routes. We hypothesized that intraperitoneally injected diamond, graphite, and graphene oxide nanoparticles may have different biodistribution and exert different effects on the intact organism. Forty Wistar rats were divided into four groups: the control and treated with nanoparticles by intraperitoneal injection (4 mg of nanoparticles/kg body weight) eight times during the 4-week period. Blood was collected for evaluation of blood morphology and biochemistry parameters. Photographs of the general appearance of each rat's interior were taken immediately after sacrifice. The organs were excised and their macroscopic structure was visualized using a stereomicroscope. The nanoparticles were retained in the body, mostly as agglomerates. The largest agglomerates (up to 10 mm in diameter) were seen in the proximity of the injection place in the stomach serous membrane, between the connective tissues of the abdominal skin, muscles, and peritoneum. Numerous smaller, spherical-shaped aggregates (diameter around 2 mm) were lodged among the mesentery. Moreover, in the connective and lipid tissue in the proximity of the liver and spleen serosa, small aggregates of graphite and graphene oxide nanoparticles were observed. However, all tested nanoparticles did not affect health and growth of rats. The nanoparticles had no toxic effects on blood parameters and growth of rats, suggesting their potential applicability as remedies or in drug delivery systems.
- 87Syama, S.; Paul, W.; Sabareeswaran, A.; Mohanan, P. V. Raman Spectroscopy for the Detection of Organ Distribution and Clearance of PEGylated Reduced Graphene Oxide and Biological Consequences. Biomaterials 2017, 131, 121– 130, DOI: 10.1016/j.biomaterials.2017.03.043[Crossref], [PubMed], [CAS], Google Scholar87https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2sXls1Wgtbg%253D&md5=110ca6a79f472cf6396180c1d29f9309Raman spectroscopy for the detection of organ distribution and clearance of PEGylated reduced graphene oxide and biological consequencesSyama, Santhakumar; Paul, Willi; Sabareeswaran, Arumugam; Mohanan, Parayanthala ValappilBiomaterials (2017), 131 (), 121-130CODEN: BIMADU; ISSN:0142-9612. (Elsevier Ltd.)Graphene, a 2D carbon material has found vast application in biomedical field because of its exciting physico-chem. properties. The large planar sheet like structure helps graphene to act as an effective carrier of drug or biomols. in enormous amt. However, limited data available on the biocompatibility of graphene upon interaction with the biol. system prompts us to evaluate their toxicity in animal model. In this study organ distribution, clearance and toxicity of PEGylated reduced nanographene (PrGO) on Swiss Albino mice was investigated after i.p. and i.v. administration. Biodistribution and blood clearance was monitored using confocal Raman mapping and indicated that PrGO was distributed on major organs such as brain, liver, kidney, spleen and bone marrow. Presence of PrGO in brain tissue suggests that it has the potential to cross blood brain barrier. Small amt. of injected PrGO was found to excrete via urine. Repeated administration of PrGO induced acute liver injury, congestion in kidney and increased splenocytes proliferation in days following exposure. Hence the result of the study recommended that PrGO should undergo intensive safety assessment before clin. application or validated to be safe for medical use.
- 88Blanco, E.; Shen, H.; Ferrari, M. Principles of Nanoparticle Design for Overcoming Biological Barriers to Drug Delivery. Nat. Biotechnol. 2015, 33, 941– 951, DOI: 10.1038/nbt.3330[Crossref], [PubMed], [CAS], Google Scholar88https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2MXhsVymt73I&md5=d693b4429d7ad4cc8b3898f7a0fb6235Principles of nanoparticle design for overcoming biological barriers to drug deliveryBlanco, Elvin; Shen, Haifa; Ferrari, MauroNature Biotechnology (2015), 33 (9), 941-951CODEN: NABIF9; ISSN:1087-0156. (Nature Publishing Group)Biol. barriers to drug transport prevent successful accumulation of nanotherapeutics specifically at diseased sites, limiting efficacious responses in disease processes ranging from cancer to inflammation. Although substantial research efforts have aimed to incorporate multiple functionalities and moieties within the overall nanoparticle design, many of these strategies fail to adequately address these barriers. Obstacles, such as nonspecific distribution and inadequate accumulation of therapeutics, remain formidable challenges to drug developers. A reimagining of conventional nanoparticles is needed to successfully negotiate these impediments to drug delivery. Site-specific delivery of therapeutics will remain a distant reality unless nanocarrier design takes into account the majority, if not all, of the biol. barriers that a particle encounters upon i.v. administration. By successively addressing each of these barriers, innovative design features can be rationally incorporated that will create a new generation of nanotherapeutics, realizing a paradigmatic shift in nanoparticle-based drug delivery.
- 89Qu, G.; Wang, X.; Liu, Q.; Liu, R.; Yin, N.; Ma, J.; Chen, L.; He, J.; Liu, S.; Jiang, G. The Ex Vivo and in Vivo Biological Performances of Graphene Oxide and the Impact of Surfactant on Graphene Oxide’s Biocompatibility. J. Environ. Sci. 2013, 25, 873– 881, DOI: 10.1016/S1001-0742(12)60252-6[Crossref], [CAS], Google Scholar89https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3sXhs1ShtbvN&md5=95cd74b73324e4b4dcf4755321c98eaaThe ex vivo and in vivo biological performances of graphene oxide and the impact of surfactant on graphene oxide's biocompatibilityQu, Guangbo; Wang, Xiaoyan; Liu, Qian; Liu, Rui; Yin, Nuoya; Ma, Juan; Chen, Liqun; He, Jiuyang; Liu, Sijin; Jiang, GuibinJournal of Environmental Sciences (Beijing, China) (2013), 25 (5), 873-881CODEN: JENSEE; ISSN:1001-0742. (Science Press)Graphene oxide (GO) displays promising properties for biomedical applications including drug delivery and cancer therapeutics. However, GO exposure also raises safety concerns such as potential side effects on health. Here, the biol. effects of GO suspended in phosphate buffered saline (PBS) with or without 1% nonionic surfactant Tween 80 were investigated. Based on the ex vivo expts., Tween 80 significantly affected the interaction between GO and peripheral blood from mice. GO suspension in PBS tended to provoke the aggregation of dild. blood cells, which could be prevented by the addn. of Tween 80. After i.v. administration, GO suspension with or without 1% Tween 80 was quickly eliminated by the mononuclear phagocyte system. Nevertheless, GO suspension without Tween 80 showed greater accumulation in lungs than that contg. 1% Tween 80. In contrast, less GO was found in livers for GO suspension compared to Tween 80 assisted GO suspension. Organs including hearts, livers, lungs, spleens, kidneys, brains, and testes did not reveal histol. alterations. The indexes of peripheral blood showed no change upon GO exposure. Our results together demonstrated that Tween 80 could greatly alter GO'S biol. performance and det. the pattern of its biodistribution in mice.
- 90Wen, K.-P.; Chen, Y.-C.; Chuang, C.-H.; Chang, H.-Y.; Lee, C.-Y.; Tai, N.-H. Accumulation and Toxicity of Intravenously-Injected Functionalized Graphene Oxide in Mice. J. Appl. Toxicol. 2015, 35, 1211– 1218, DOI: 10.1002/jat.3187[Crossref], [PubMed], [CAS], Google Scholar90https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2MXhtVent7bM&md5=3571ba97d3767ef165bffb20f68c8169Accumulation and toxicity of intravenously-injected functionalized graphene oxide in miceWen, Kai-Ping; Chen, Ying-Chieh; Chuang, Chia-Hui; Chang, Hwan-You; Lee, Chi-Young; Tai, Nyan-HwaJournal of Applied Toxicology (2015), 35 (10), 1211-1218CODEN: JJATDK; ISSN:0260-437X. (John Wiley & Sons Ltd.)Graphene and its functionalized derivs. have recently emerged as interesting nanomaterials with promising applications in biomedicine. In this study, the long-term in vivo biodistribution of i.v. injected nanographene oxide (NGO) functionalized with poly sodium 4-styrenesulfonate (PSS) was systematically examd. and the potential toxicity over 6 mo of NGO-PSS nanoparticles was investigated. Our results showed that the nanoparticles mainly accumulate in the lung, liver and spleen, where they persist for at least 6 mo. These nanoparticles result in acute liver injury and chronic inflammation of the lung, liver and spleen, as evidenced by blood biochem. results and histol. examns.
- 91Girish, C. M.; Sasidharan, A.; Gowd, G. S.; Nair, S.; Koyakutty, M. Confocal Raman Imaging Study Showing Macrophage Mediated Biodegradation of Graphene In Vivo. Adv. Healthcare Mater. 2013, 2, 1489– 1500, DOI: 10.1002/adhm.201200489[Crossref], [PubMed], [CAS], Google Scholar91https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3sXhslarsLnP&md5=02148db2759142ca2f697b6a933c2d73Confocal Raman Imaging Study Showing Macrophage Mediated Biodegradation of Graphene In VivoGirish, Chundayil Madathil; Sasidharan, Abhilash; Gowd, G. Siddaramana; Nair, Shantikumar; Koyakutty, ManzoorAdvanced Healthcare Materials (2013), 2 (11), 1489-1500CODEN: AHMDBJ; ISSN:2192-2640. (Wiley-VCH Verlag GmbH & Co. KGaA)This study is focused on the crucial issue of biodegradability of graphene under in vivo conditions. Characteristic Raman signatures of graphene are used to three dimensionally (3D) image its localization in lung, liver, kidney and spleen of mouse and identified gradual development of structural disorder, happening over a period of 3 mo, as indicated by the formation of defect-related D'band, line broadening of D and G bands, increase in ID/IG ratio and overall intensity redn. Prior to injection, the carboxyl functionalized graphene of lateral size ∼200 nm is well dispersed in aq. medium, but 24 h post injection, larger aggregates of size up to 10 μm are detected in various organs. Using Raman cluster imaging method, temporal development of disorder is detected from day 8 onwards, which begins from the edges and grows inwards over a period of 3 mo. The biodegrdn. is found prominent in graphene phagocytosed by tissue-bound macrophages and the gene expression studies of pro-inflammatory cytokines indicated the possibility of phagocytic immune response. In addn., in vitro studies conducted on macrophage cell lines also show development of structural disorder in the engulfed graphene, reiterating the role of macrophages in biodegrdn. This is the first report providing clear evidence of in vivo biodegrdn. of graphene and these results may radically change the perspective on potential biomedical applications of graphene.
- 92Li, B.; Zhang, X.; Yang, J.; Zhang, Y.; Li, W.; Fan, C.; Huang, Q. Influence of Polyethylene Glycol Coating On Biodistribution and Toxicity of Nanoscale Graphene Oxide in Mice after Intravenous Injection. Int. J. Nanomed. 2014, 9, 4697– 4707, DOI: 10.2147/IJN.S66591[Crossref], [PubMed], [CAS], Google Scholar92https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2cXitFOiurbO&md5=76596057fd5233b9202930785f305df9Influence of polyethylene glycol coating on biodistribution and toxicity of nanoscale graphene oxide in mice after intravenous injectionLi, Bo; Zhang, Xiao-Yong; Yang, Jian-Zhong; Zhang, Yu-Jie; Li, Wen-Xin; Fan, Chun-Hai; Huang, QingInternational Journal of Nanomedicine (2014), 9 (), 4697-4707, 11 pp.CODEN: IJNNHQ; ISSN:1178-2013. (Dove Medical Press Ltd.)In this study, we assessed the in vivo behavior and toxicol. of nanoscale graphene oxide (NGO) in mice after i.v. injection. The influence of a polyethylene glycol (PEG) coating on the distribution and toxicity of the NGO was also investigated. The results show that NGO is mainly retained in the liver, lung, and spleen. Retention in the lung is partially due to NGO aggregation. The PEG coating reduces the retention of NGO in the liver, lung, and spleen and promotes the clearance of NGO from these organs, but NGO and NGO-PEG are still present after 3 mo. The PEG coating effectively reduces the early wt. loss caused by NGO and alleviates NGO-induced acute tissue injuries, which can include damage to the liver, lung, and kidney, and chronic hepatic and lung fibrosis.
- 93Sasidharan, A.; Swaroop, S.; Koduri, C. K.; Girish, C. M.; Chandran, P.; Panchakarla, L. S.; Somasundaram, V. H.; Gowd, G. S.; Nair, S.; Koyakutty, M. Comparative in Vivo Toxicity, Organ Biodistribution and Immune Response of Pristine, Carboxylated and PEGylated Few-Layer Graphene Sheets in Swiss Albino Mice: A Three Month Study. Carbon 2015, 95, 511– 524, DOI: 10.1016/j.carbon.2015.08.074[Crossref], [CAS], Google Scholar93https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2MXhsVCrur7E&md5=eee2edf1ced60eeeb6b50b8486677d45Comparative in vivo toxicity, organ biodistribution and immune response of pristine, carboxylated and PEGylated few-layer graphene sheets in Swiss albino mice: A three month studySasidharan, Abhilash; Swaroop, Siddharth; Koduri, Chaitanya K.; Girish, Chundayil Madathil; Chandran, Parwathy; Panchakarla, L. S.; Somasundaram, Vijay H.; Gowd, Genekehal S.; Nair, Shantikumar; Koyakutty, ManzoorCarbon (2015), 95 (), 511-524CODEN: CRBNAH; ISSN:0008-6223. (Elsevier Ltd.)The authors present a comprehensive 3 mo report on the acute and chronic toxicity of i.v. administered (20 mg kg-1) few-layer graphene (FLG) and, its carboxylated (FLG-COOH) and PEGylated (FLG-PEG) derivs. in Swiss albino mice. Whole-animal in vivo tracking studies revealed that irresp. of surface modifications, graphene predominantly accumulated in lungs over a period of 24 h. Histol. assessment and ex vivo confocal Raman spectral mapping revealed highest uptake and retention in lung tissue, followed by spleen, liver and kidney, with no accumulation in brain, heart or testis. FLG and FLG-COOH accumulated within organs induced significant cellular and structural damages to lungs, liver, spleen, and kidney, ranging from mild congestion to necrosis, fibrosis and glomerular filtration dysfunction, without appreciable clearance. Serum biochem. anal. revealed that both FLG and FLG-COOH induced elevated levels of hepatic and renal injury markers. Quant. RT-PCR studies conducted on 23 crit. inflammation and immune response markers showed major alterations in gene expression profile by FLG, FLG-COOH and FLG-PEG treated animals. FLG-PEG in spite of its persistence within liver and spleen tissue for 3 mo, did not induce any noticeable toxicity or organ damage, and displayed significant changes in Raman spectra, indicative of their biodegrdn. potential.
- 94Liu, J.-H.; Yang, S.-T.; Wang, H.; Chang, Y.; Cao, A.; Liu, Y. Effect of Size and Dose on the Biodistribution of Graphene Oxide in Mice. Nanomedicine 2012, 7, 1801– 1812, DOI: 10.2217/nnm.12.60
- 95Jasim, D. A.; Ménard-Moyon, C.; Bégin, D.; Bianco, A.; Kostarelos, K. Tissue Distribution and Urinary Excretion of Intravenously Administered Chemically Functionalized Graphene Oxide Sheets. Chem. Sci. 2015, 6, 3952– 3964, DOI: 10.1039/C5SC00114E[Crossref], [PubMed], [CAS], Google Scholar95https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2MXmsVCgtr4%253D&md5=b9d7b7b9bceea89fee6ef461083bf8f4Tissue distribution and urinary excretion of intravenously administered chemically functionalized graphene oxide sheetsJasim, Dhifaf A.; Menard-Moyon, Cecilia; Begin, Dominique; Bianco, Alberto; Kostarelos, KostasChemical Science (2015), 6 (7), 3952-3964CODEN: CSHCCN; ISSN:2041-6520. (Royal Society of Chemistry)The design of graphene-based materials for biomedical purposes is of great interest. Graphene oxide (GO) sheets represent the most widespread type of graphene materials in biol. investigations. In this work, thin GO sheets were synthesized and further chem. functionalized with DOTA (1,4,7,10-tetraazacyclododecane-1,4,7,10-tetraacetic acid), a stable radiometal chelating agent, by an epoxide opening reaction. We report the tissue distribution of the functionalized GO sheets labeled with radioactive indium (111In) after i.v. administration in mice. Whole body single photon emission computed tomog. (SPECT/CT) imaging, gamma counting studies, Raman microscopy and histol. investigations indicated extensive urinary excretion and predominantly spleen accumulation. Intact GO sheets were detected in the urine of injected mice by Raman spectroscopy, high resoln. transmission electron microscopy (HR-TEM) and electron diffraction. These results offer a previously unavailable pharmacol. understanding on how chem. functionalized GO sheets transport in the blood stream and interact with physiol. barriers that will det. their body excretion and tissue accumulation.
- 96Oberdörster, G.; Oberdörster, E.; Oberdörster, J. Nanotoxicology: An Emerging Discipline Evolving from Studies of Ultrafine Particles. Environ. Health Perspect. 2005, 113, 823– 839, DOI: 10.1289/ehp.7339[Crossref], [PubMed], [CAS], Google Scholar96https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BD2MXntVyls7Y%253D&md5=a2fbd85436eb30794567d91103088042Nanotoxicology: an emerging discipline evolving from studies of ultrafine particlesOberdorster, Gunter; Oberdorster, Eva; Oberdorster, JanEnvironmental Health Perspectives (2005), 113 (7), 823-839CODEN: EVHPAZ; ISSN:0091-6765. (U. S. Department of Health and Human Services, Public Health Services)A review. Although humans have been exposed to airborne nanosized particles (NSPs; <100 nm) throughout their evolutionary stages, such exposure has increased dramatically over the last century due to anthropogenic sources. The rapidly developing field of nanotechnol. is likely to become yet another source through inhalation, ingestion, skin uptake, and injection of engineered nanomaterials. Information about safety and potential hazards is urgently needed. Results of older biokinetic studies with NSPs and newer epidemiol. and toxicol. studies with airborne ultrafine particles can be viewed as the basis for the expanding field of nanotoxicol., which can be defined as safety evaluation of engineered nanostructures and nanodevices. Collectively, some emerging concepts of nanotoxicol. can be identified from the results of these studies. When inhaled, specific sizes of NSPs are efficiently deposited by diffusional mechanisms in all regions of the respiratory tract. The small size facilitates uptake into cells and transcytosis across epithelial and endothelial cells into the blood and lymph circulation to reach potentially sensitive target sites such as bone marrow, lymph nodes, spleen, and heart. Access to the central nervous system and ganglia via translocation along axons and dendrites of neurons has also been obsd. NSPs penetrating the skin distribute via uptake into lymphatic channels. Endocytosis and biokinetics are largely dependent on NSP surface chem. (coating) and in vivo surface modifications. The greater surface area per mass compared with larger-sized particles of the same chem. renders NSPs more active biol. This activity includes a potential for inflammatory and pro-oxidant, but also antioxidant, activity, which can explain early findings showing mixed results in terms of toxicity of NSPs to environmentally relevant species. Evidence of mitochondrial distribution and oxidative stress response after NSP endocytosis points to a need for basic research on their interactions with subcellular structures. Addnl. considerations for assessing the safety of engineered NSPs include careful selections of appropriate and relevant doses/concns., the likelihood of increased effects in a compromised organism, and also the benefits of possible desirable effects. An interdisciplinary team approach (e.g., toxicol., materials science, medicine, mol. biol., and bioinformatics, to name a few) is mandatory for nanotoxicol. research to arrive at an appropriate risk assessment.
- 97Stone, V.; Miller, M. R.; Clift, M. J. D.; Elder, A.; Mills, N. L.; Møller, P.; Schins, R. P. F.; Vogel, U.; Kreyling, W. G.; Alstrup Jensen, K.; Kuhlbusch, T. A. J.; Schwarze, P. E.; Hoet, P.; Pietroiusti, A.; De Vizcaya-Ruiz, A.; Baeza-Squiban, A.; Teixeira, J. P.; Tran, C. L.; Cassee, F. R. Nanomaterials Versus Ambient Ultrafine Particles: An Opportunity to Exchange Toxicology Knowledge. Environ. Health Perspect. 2017, 125, 106002, DOI: 10.1289/EHP424[Crossref], [PubMed], [CAS], Google Scholar97https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC1MXlsFGnsLY%253D&md5=0098ead3159f7ce97b5a8aa64a7b083eNanomaterials versus ambient ultrafine particles: an opportunity to exchange toxicology knowledgeStone, Vicki; Miller, Mark R.; Clift, Martin J. D.; Elder, Alison; Mills, Nicholas L.; ller, Peter M.; Schins, Roel P. F.; Vogel, Ulla; Kreyling, Wolfgang G.; Jensen, Keld Alstrup; Kuhlbusch, Thomas A. J.; Schwarze, Per E.; Hoet, Peter; Pietroiusti, Antonio; De Vizcaya-Ruiz, Andrea; Baeza-Squiban, Armelle; Teixeira, Joao Paulo; Tran, C. Lang; Cassee, Flemming R.Environmental Health Perspectives (2017), 125 (10), 106002/1-106002/17CODEN: EVHPAZ; ISSN:1552-9924. (U. S. Department of Health and Human Services, National Institutes of Health)BACKGROUND: A rich body of literature exists that has demonstrated adverse human health effects following exposure to ambient air particulate matter (PM), and there is strong support for an important role of ultrafine (nanosized) particles. At present, relatively few human health or epidemiol. data exist for engineered nanomaterials (NMs) despite clear parallels in their physicochem. properties and biol. actions in in vitro models. OBJECTIVES: NMs are available with a range of physicochem. characteristics, which allows a more systematic toxicol. anal. Therefore, the study of ultrafine particles (UFP, <100 nm in diam.) provides an opportunity to identify plausible health effects for NMs, and the study of NMs provides an opportunity to facilitate the understanding of the mechanism of toxicity of UFP. METHODS: A workshop of experts systematically analyzed the available information and identified 19 key lessons that can facilitate knowledge exchange between these discipline areas. DISCUSSION: Key lessons range from the availability of specific techniques and std. protocols for physicochem. characterization and toxicol. assessment to understanding and defining dose and the mol. mechanisms of toxicity. This review identifies a no. of key areas in which addnl. research prioritization would facilitate both research fields simultaneously. CONCLUSION: There is now an opportunity to apply knowledge from NM toxicol. and use it to better inform PM health risk research and vice versa.
- 98Schreiver, I.; Hesse, B.; Seim, C.; Castillo-Michel, H.; Villanova, J.; Laux, P.; Dreiack, N.; Penning, R.; Tucoulou, R.; Cotte, M.; Luch, A. Synchrotron-Based ν-XRF Mapping and μ-FTIR Microscopy Enable to Look into the Fate and Effects of Tattoo Pigments in Human Skin. Sci. Rep. 2017, 7, 11395, DOI: 10.1038/s41598-017-11721-z[Crossref], [PubMed], [CAS], Google Scholar98https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A280%3ADC%252BC1cbnsFeisw%253D%253D&md5=dda48f7ae006494a5e5d13ea439f6cddSynchrotron-based ν-XRF mapping and μ-FTIR microscopy enable to look into the fate and effects of tattoo pigments in human skinSchreiver Ines; Laux Peter; Dreiack Nadine; Luch Andreas; Hesse Bernhard; Castillo-Michel Hiram; Villanova Julie; Tucoulou Remi; Cotte Marine; Seim Christian; Seim Christian; Penning RandolfScientific reports (2017), 7 (1), 11395 ISSN:.The increasing prevalence of tattoos provoked safety concerns with respect to particle distribution and effects inside the human body. We used skin and lymphatic tissues from human corpses to address local biokinetics by means of synchrotron X-ray fluorescence (XRF) techniques at both the micro (μ) and nano (ν) scale. Additional advanced mass spectrometry-based methodology enabled to demonstrate simultaneous transport of organic pigments, heavy metals and titanium dioxide from skin to regional lymph nodes. Among these compounds, organic pigments displayed the broadest size range with smallest species preferentially reaching the lymph nodes. Using synchrotron μ-FTIR analysis we were also able to detect ultrastructural changes of the tissue adjacent to tattoo particles through altered amide I α-helix to β-sheet protein ratios and elevated lipid contents. Altogether we report strong evidence for both migration and long-term deposition of toxic elements and tattoo pigments as well as for conformational alterations of biomolecules that likely contribute to cutaneous inflammation and other adversities upon tattooing.
- 99Fadeel, B.; Pietroiusti, A.; Shvedova, A. A. Adverse Effects of Engineered Nanomaterials : Exposure, Toxicology, and Impact on Human Health; 2nd ed. Elsevier, Amsterdam, The Netherlands, 2017.Google ScholarThere is no corresponding record for this reference.
- 100Bhattacharya, K.; Andón, F. T.; El-Sayed, R.; Fadeel, B. Mechanisms of Carbon Nanotube-Induced Toxicity: Focus on Pulmonary Inflammation. Adv. Drug Delivery Rev. 2013, 65, 2087– 2097, DOI: 10.1016/j.addr.2013.05.012
- 101Orecchioni, M.; Ménard-Moyon, C.; Delogu, L. G.; Bianco, A. Graphene and the Immune System: Challenges and Potentiality. Adv. Drug Delivery Rev. 2016, 105, 163– 175, DOI: 10.1016/j.addr.2016.05.014[Crossref], [PubMed], [CAS], Google Scholar101https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC28Xoslags7o%253D&md5=1757715ed14fb416a77d77c3373842e2Graphene and the immune system: Challenges and potentialityOrecchioni, Marco; Menard-Moyon, Cecilia; Delogu, Lucia Gemma; Bianco, AlbertoAdvanced Drug Delivery Reviews (2016), 105 (Part_B), 163-175CODEN: ADDREP; ISSN:0169-409X. (Elsevier B.V.)In the growing area of nanomedicine, graphene-based materials (GBMs) are some of the most recent explored nanomaterials. For the majority of GBM applications in nanomedicine, the immune system plays a fundamental role. It is necessary to well understand the complexity of the interactions between GBMs, the immune cells, and the immune components and how they could be of advantage for novel effective diagnostic and therapeutic approaches. In this review, we aimed at painting the current picture of GBMs in the background of the immune system. The picture we have drawn looks like a cubist image, a sort of Picasso-like portrait looking at the topic from all perspectives: the challenges (due to the potential toxicity) and the potentiality like the conjugation of GBMs to biomols. to develop advanced nanomedicine tools. In this context, we have described and discussed i) the impact of graphene on immune cells, ii) graphene as immunobiosensor, and iii) antibodies conjugated to graphene for tumor targeting.Thanks to the huge advances on graphene research, it seems realistic to hypothesize in the near future that some graphene immunoconjugates, endowed of defined immune properties, can go through preclin. test and be successfully used in nanomedicine.
- 102Russier, J.; Treossi, E.; Scarsi, A.; Perrozzi, F.; Dumortier, H.; Ottaviano, L.; Meneghetti, M.; Palermo, V.; Bianco, A. Evidencing the Mask Effect of Graphene Oxide: A Comparative Study on Primary Human and Murine Phagocytic Cells. Nanoscale 2013, 5, 11234– 11247, DOI: 10.1039/c3nr03543c
- 103Yue, H.; Wei, W.; Yue, Z.; Wang, B.; Luo, N.; Gao, Y.; Ma, D.; Ma, G.; Su, Z. The Role of the Lateral Dimension of Graphene Oxide in the Regulation of Cellular Responses. Biomaterials 2012, 33, 4013– 4021, DOI: 10.1016/j.biomaterials.2012.02.021[Crossref], [PubMed], [CAS], Google Scholar103https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC38XjtFyqtb0%253D&md5=c5e55ec5710597ed3468624407684a47The role of the lateral dimension of graphene oxide in the regulation of cellular responsesYue, Hua; Wei, Wei; Yue, Zhanguo; Wang, Bin; Luo, Nana; Gao, Yongjun; Ma, Ding; Ma, Guanghui; Su, ZhiguoBiomaterials (2012), 33 (16), 4013-4021CODEN: BIMADU; ISSN:0142-9612. (Elsevier Ltd.)The nanomaterial graphene oxide (GO) has attracted explosive interests in various areas. However, its performance in biol. environments is still largely unknown, particularly with regard to cellular response to GO. Here we sepd. the GO sheets in different size and systematically investigated size effect of the GO in response to different types of cells. In terms of abilities to internalize GO, enormous discrepancies were obsd. in the six cell types, with only two phagocytes were found to be capable of internalizing GO. The 2 μm and 350 nm GO greatly differed in lateral dimensions, but equally contributed to the uptake amt. in macrophages. Similar amts. of antibody opsonization and active Fcγ receptor-mediated phagocytosis were demonstrated the cause of this behavior. In comparison with the nanosized GO, the GO in micro-size showed divergent intracellular locations and induced much stronger inflammation responses. Present study provided insight into selective internalization, size-independent uptake, and several other biol. behaviors undergone by GO. These findings might help build necessary knowledge for potential incorporation of the unique two-dimensional nanomaterial as a biomedical tool, and for avoiding potential hazards.
- 104Ma, J.; Liu, R.; Wang, X.; Liu, Q.; Chen, Y.; Valle, R. P.; Zuo, Y. Y.; Xia, T.; Liu, S. Crucial Role of Lateral Size for Graphene Oxide in Activating Macrophages and Stimulating Pro-Inflammatory Responses in Cells and Animals. ACS Nano 2015, 9, 10498– 10515, DOI: 10.1021/acsnano.5b04751[ACS Full Text
 ], [CAS], Google Scholar104https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2MXhsFagtLvJ&md5=4b7ebfeefff79a9352bc0d9d7e0753d1Crucial Role of Lateral Size for Graphene Oxide in Activating Macrophages and Stimulating Pro-inflammatory Responses in Cells and AnimalsMa, Juan; Liu, Rui; Wang, Xiang; Liu, Qian; Chen, Yunan; Valle, Russell P.; Zuo, Yi Y.; Xia, Tian; Liu, SijinACS Nano (2015), 9 (10), 10498-10515CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)Graphene oxide (GO) is increasingly used in biomedical applications because it possesses not only the unique properties of graphene including large surface area and flexibility but also hydrophilicity and dispersibility in aq. solns. However, there are conflicting results on its biocompatibility and biosafety partially due to large variations in physicochem. properties of GO, and the role of these properties including lateral size in the biol. or toxicol. effects of GO is still unclear. In this study, the authors focused on the role of lateral size by prepg. a panel of GO samples with differential lateral sizes using the same starting material. The authors found that, in comparison to its smaller counterpart, larger GO showed a stronger adsorption onto the plasma membrane with less phagocytosis, which elicited more robust interaction with toll-like receptors and more potent activation of NF-κB pathways. By contrast, smaller GO sheets were more likely taken up by cells. As a result, larger GO promoted greater M1 polarization, assocd. with enhanced prodn. of inflammatory cytokines and recruitment of immune cells. The in vitro results correlated well with local and systemic inflammatory responses after GO administration into the abdominal cavity, lung, or bloodstream through the tail vein. Together, this study delineated the size-dependent M1 induction of macrophages and pro-inflammatory responses of GO in vitro and in vivo. The data also unearthed the detailed mechanism underlying these effects: a size-dependent interaction between GO and the plasma membrane.
], [CAS], Google Scholar104https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2MXhsFagtLvJ&md5=4b7ebfeefff79a9352bc0d9d7e0753d1Crucial Role of Lateral Size for Graphene Oxide in Activating Macrophages and Stimulating Pro-inflammatory Responses in Cells and AnimalsMa, Juan; Liu, Rui; Wang, Xiang; Liu, Qian; Chen, Yunan; Valle, Russell P.; Zuo, Yi Y.; Xia, Tian; Liu, SijinACS Nano (2015), 9 (10), 10498-10515CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)Graphene oxide (GO) is increasingly used in biomedical applications because it possesses not only the unique properties of graphene including large surface area and flexibility but also hydrophilicity and dispersibility in aq. solns. However, there are conflicting results on its biocompatibility and biosafety partially due to large variations in physicochem. properties of GO, and the role of these properties including lateral size in the biol. or toxicol. effects of GO is still unclear. In this study, the authors focused on the role of lateral size by prepg. a panel of GO samples with differential lateral sizes using the same starting material. The authors found that, in comparison to its smaller counterpart, larger GO showed a stronger adsorption onto the plasma membrane with less phagocytosis, which elicited more robust interaction with toll-like receptors and more potent activation of NF-κB pathways. By contrast, smaller GO sheets were more likely taken up by cells. As a result, larger GO promoted greater M1 polarization, assocd. with enhanced prodn. of inflammatory cytokines and recruitment of immune cells. The in vitro results correlated well with local and systemic inflammatory responses after GO administration into the abdominal cavity, lung, or bloodstream through the tail vein. Together, this study delineated the size-dependent M1 induction of macrophages and pro-inflammatory responses of GO in vitro and in vivo. The data also unearthed the detailed mechanism underlying these effects: a size-dependent interaction between GO and the plasma membrane. - 105Palomäki, J.; Välimäki, E.; Sund, J.; Vippola, M.; Clausen, P. A.; Jensen, K. A.; Savolainen, K.; Matikainen, S.; Alenius, H. Long, Needle-like Carbon Nanotubes and Asbestos Activate the NLRP3 Inflammasome through a Similar Mechanism. ACS Nano 2011, 5, 6861– 6870, DOI: 10.1021/nn200595c[ACS Full Text
 ], [CAS], Google Scholar105https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3MXpslWrs7k%253D&md5=9b5835cbbc35658df3bf4e6a7b37c176Long, Needle-like Carbon Nanotubes and Asbestos Activate the NLRP3 Inflammasome through a Similar MechanismPalomaki, Jaana; Valimaki, Elina; Sund, Jukka; Vippola, Minnamari; Clausen, Per Axel; Jensen, Keld Alstrup; Savolainen, Kai; Matikainen, Sampsa; Alenius, HarriACS Nano (2011), 5 (9), 6861-6870CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)Carbon nanomaterials (CNM) are targets of great interest because they have multiple applications in industry but also because of the fear of possible harmful health effects of certain types of CNM. The high aspect ratio of carbon nanotubes (CNT), a feature they share with asbestos, is likely the key factor for reported toxicity of certain CNT. However, the mechanism to explain this toxicity is unclear. Here the authors investigated whether different CNM induce a pro-inflammatory response in human primary macrophages. Carbon black, short CNT, long, tangled CNT, long, needle-like CNT, and crocidolite asbestos were used to compare the effect of size and shape on the potency of the materials to induce secretion of interleukin (IL) 1-family cytokines. The authors' results demonstrated that long, needle-like CNT and asbestos activated secretion of IL-1β from LPS-primed macrophages but only long, needle-like CNT induced IL-1α secretion. SiRNA expts. demonstrated that the NLRP3 inflammasome was essential for long, needle-like CNT and asbestos-induced IL-1β secretion. Moreover, it was noted that CNT-induced NLRP3 inflammasome activation depended on reactive oxygen species (ROS) prodn., cathepsin B activity, P2X7 receptor, and Src and Syk tyrosine kinases. These results provide new information about the mechanisms by which long, needle-like materials may cause their harmful health effects. Furthermore, the techniques used here may be of use in future risk assessments of nanomaterials.
], [CAS], Google Scholar105https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3MXpslWrs7k%253D&md5=9b5835cbbc35658df3bf4e6a7b37c176Long, Needle-like Carbon Nanotubes and Asbestos Activate the NLRP3 Inflammasome through a Similar MechanismPalomaki, Jaana; Valimaki, Elina; Sund, Jukka; Vippola, Minnamari; Clausen, Per Axel; Jensen, Keld Alstrup; Savolainen, Kai; Matikainen, Sampsa; Alenius, HarriACS Nano (2011), 5 (9), 6861-6870CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)Carbon nanomaterials (CNM) are targets of great interest because they have multiple applications in industry but also because of the fear of possible harmful health effects of certain types of CNM. The high aspect ratio of carbon nanotubes (CNT), a feature they share with asbestos, is likely the key factor for reported toxicity of certain CNT. However, the mechanism to explain this toxicity is unclear. Here the authors investigated whether different CNM induce a pro-inflammatory response in human primary macrophages. Carbon black, short CNT, long, tangled CNT, long, needle-like CNT, and crocidolite asbestos were used to compare the effect of size and shape on the potency of the materials to induce secretion of interleukin (IL) 1-family cytokines. The authors' results demonstrated that long, needle-like CNT and asbestos activated secretion of IL-1β from LPS-primed macrophages but only long, needle-like CNT induced IL-1α secretion. SiRNA expts. demonstrated that the NLRP3 inflammasome was essential for long, needle-like CNT and asbestos-induced IL-1β secretion. Moreover, it was noted that CNT-induced NLRP3 inflammasome activation depended on reactive oxygen species (ROS) prodn., cathepsin B activity, P2X7 receptor, and Src and Syk tyrosine kinases. These results provide new information about the mechanisms by which long, needle-like materials may cause their harmful health effects. Furthermore, the techniques used here may be of use in future risk assessments of nanomaterials. - 106Wang, X.; Duch, M. C.; Mansukhani, N.; Ji, Z.; Liao, Y.-P.; Wang, M.; Zhang, H.; Sun, B.; Chang, C. H.; Li, R.; Lin, S.; Meng, H.; Xia, T.; Hersam, M. C.; Nel, A. E. Use of a Pro-Fibrogenic Mechanism-Based Predictive Toxicological Approach for Tiered Testing and Decision Analysis of Carbonaceous Nanomaterials. ACS Nano 2015, 9, 3032– 3043, DOI: 10.1021/nn507243w[ACS Full Text
 ], [CAS], Google Scholar106https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2MXitVers70%253D&md5=78c49c31d11bebfd86429a189471b242Use of a Pro-Fibrogenic Mechanism-Based Predictive Toxicological Approach for Tiered Testing and Decision Analysis of Carbonaceous NanomaterialsWang, Xiang; Duch, Matthew C.; Mansukhani, Nikhita; Ji, Zhaoxia; Liao, Yu-Pei; Wang, Meiying; Zhang, Haiyuan; Sun, Bingbing; Chang, Chong Hyun; Li, Ruibin; Lin, Sijie; Meng, Huan; Xia, Tian; Hersam, Mark C.; Nel, Andre E.ACS Nano (2015), 9 (3), 3032-3043CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)Engineered carbonaceous nanomaterials (ECNs), including single-wall carbon nanotubes (SWCNTs), multiwall carbon nanotubes (MWCNTs), graphene, and graphene oxide (GO), are potentially hazardous to the lung. With incremental experience in the use of predictive toxicol. approaches, seeking to relate ECN physicochem. properties to adverse outcome pathways (AOPs), it is logical to explore the existence of a common AOP that allows comparative anal. of broad ECN categories. The authors established an ECN library comprising three different types of SWCNTs, graphene, and graphene oxide (two sizes) for comparative anal. according to a cell-based AOP that also plays a role in the pathogenesis of pulmonary fibrosis. SWCNTs synthesized by Hipco, arc discharge and Co-Mo catalyst (CoMoCAT) methods were obtained in their as-prepd. (AP) state, following which they were further purified (PD) or coated with Pluronic F108 (PF108) or bovine serum albumin (BSA) to improve dispersal and colloidal stability. GO was prepd. as two sizes, GO-small (S) and GO-large (L), while the graphene samples were coated with BSA and PF108 to enable dispersion in aq. soln. In vitro screening showed that AP- and PD-SWCNTs, irresp. of the method of synthesis, as well as graphene (BSA) and GO (S and L) could trigger interleukin-1β (IL-1β) and transforming growth factor-β1 (TGF-β1) prodn. in myeloid (THP-1) and epithelial (BEAS-2B) cell lines, resp. Oropharyngeal aspiration in mice confirmed that AP-Hipco tubes, graphene (BSA-dispersed), GO-S and GO-L could induce IL-1β and TGF-β1 prodn. in the lung in parallel with lung fibrosis. Notably, GO-L was the most pro-fibrogenic material based on rapid kinetics of pulmonary injury. In contrast, PF108-dispersed SWCNTs and -graphene failed to exert fibrogenic effects. Collectively, these data indicate that the dispersal state and surface reactivity of ECNs play key roles in triggering a pro-fibrogenic AOP, which could prove helpful for hazard ranking and a proposed tiered testing approach for large ECN categories.
], [CAS], Google Scholar106https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2MXitVers70%253D&md5=78c49c31d11bebfd86429a189471b242Use of a Pro-Fibrogenic Mechanism-Based Predictive Toxicological Approach for Tiered Testing and Decision Analysis of Carbonaceous NanomaterialsWang, Xiang; Duch, Matthew C.; Mansukhani, Nikhita; Ji, Zhaoxia; Liao, Yu-Pei; Wang, Meiying; Zhang, Haiyuan; Sun, Bingbing; Chang, Chong Hyun; Li, Ruibin; Lin, Sijie; Meng, Huan; Xia, Tian; Hersam, Mark C.; Nel, Andre E.ACS Nano (2015), 9 (3), 3032-3043CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)Engineered carbonaceous nanomaterials (ECNs), including single-wall carbon nanotubes (SWCNTs), multiwall carbon nanotubes (MWCNTs), graphene, and graphene oxide (GO), are potentially hazardous to the lung. With incremental experience in the use of predictive toxicol. approaches, seeking to relate ECN physicochem. properties to adverse outcome pathways (AOPs), it is logical to explore the existence of a common AOP that allows comparative anal. of broad ECN categories. The authors established an ECN library comprising three different types of SWCNTs, graphene, and graphene oxide (two sizes) for comparative anal. according to a cell-based AOP that also plays a role in the pathogenesis of pulmonary fibrosis. SWCNTs synthesized by Hipco, arc discharge and Co-Mo catalyst (CoMoCAT) methods were obtained in their as-prepd. (AP) state, following which they were further purified (PD) or coated with Pluronic F108 (PF108) or bovine serum albumin (BSA) to improve dispersal and colloidal stability. GO was prepd. as two sizes, GO-small (S) and GO-large (L), while the graphene samples were coated with BSA and PF108 to enable dispersion in aq. soln. In vitro screening showed that AP- and PD-SWCNTs, irresp. of the method of synthesis, as well as graphene (BSA) and GO (S and L) could trigger interleukin-1β (IL-1β) and transforming growth factor-β1 (TGF-β1) prodn. in myeloid (THP-1) and epithelial (BEAS-2B) cell lines, resp. Oropharyngeal aspiration in mice confirmed that AP-Hipco tubes, graphene (BSA-dispersed), GO-S and GO-L could induce IL-1β and TGF-β1 prodn. in the lung in parallel with lung fibrosis. Notably, GO-L was the most pro-fibrogenic material based on rapid kinetics of pulmonary injury. In contrast, PF108-dispersed SWCNTs and -graphene failed to exert fibrogenic effects. Collectively, these data indicate that the dispersal state and surface reactivity of ECNs play key roles in triggering a pro-fibrogenic AOP, which could prove helpful for hazard ranking and a proposed tiered testing approach for large ECN categories. - 107Sun, B.; Wang, X.; Ji, Z.; Wang, M.; Liao, Y.-P.; Chang, C. H.; Li, R.; Zhang, H.; Nel, A. E.; Xia, T. NADPH Oxidase-Dependent NLRP3 Inflammasome Activation and Its Important Role in Lung Fibrosis by Multiwalled Carbon Nanotubes. Small 2015, 11, 2087– 2097, DOI: 10.1002/smll.201402859[Crossref], [PubMed], [CAS], Google Scholar107https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2MXosFCjsg%253D%253D&md5=2d83cac43ece9da7c980d87d7c07d803NADPH oxidase-dependent NLRP3 inflammasome activation and its important role in lung fibrosis by multiwalled carbon nanotubesSun, Bingbing; Wang, Xiang; Ji, Zhaoxia; Wang, Meiying; Liao, Yu-Pei; Chang, Chong Hyun; Li, Ruibin; Zhang, Haiyuan; Nel, Andre E.; Xia, TianSmall (2015), 11 (17), 2087-2097CODEN: SMALBC; ISSN:1613-6810. (Wiley-VCH Verlag GmbH & Co. KGaA)The purpose of this paper is to elucidate the key role of NADPH oxidase in NLRP3 inflammasome activation and generation of pulmonary fibrosis by multi-walled carbon nanotubes (MWCNTs). Although it is known that oxidative stress plays a role in pulmonary fibrosis by single-walled CNTs, the role of specific sources of reactive oxygen species, including NADPH oxidase, in inflammasome activation remains to be clarified. In this study, three long aspect ratio (LAR) materials (MWCNTs, single-walled carbon nanotubes, and silver nanowires) are used to compare with spherical carbon black and silver nanoparticles for their ability to trigger oxygen burst activity and NLRP3 assembly. All LAR materials but not spherical nanoparticles induce robust NADPH oxidase activation and respiratory burst activity in THP-1 cells, which are blunted in p22phox-deficient cells. The NADPH oxidase is directly involved in lysosomal damage by LAR materials, as demonstrated by decreased cathepsin B release and IL-1β prodn. in p22phox-deficient cells. Reduced respiratory burst activity and inflammasome activation are also obsd. in bone marrow-derived macrophages from p47phox-deficient mice. Moreover, p47phox-deficient mice have reduced IL-1β prodn. and lung collagen deposition in response to MWCNTs. Lung fibrosis is also suppressed by N-acetyl-cysteine in wild-type animals exposed to MWCNTs.
- 108Yang, M.; Flavin, K.; Kopf, I.; Radics, G.; Hearnden, C. H. A.; McManus, G. J.; Moran, B.; Villalta-Cerdas, A.; Echegoyen, L. A.; Giordani, S.; Lavelle, E. C. Functionalization of Carbon Nanoparticles Modulates Inflammatory Cell Recruitment and NLRP3 Inflammasome Activation. Small 2013, 9, 4194– 4206, DOI: 10.1002/smll.201300481[Crossref], [PubMed], [CAS], Google Scholar108https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3sXhtVOisrrN&md5=0d02d1a9a6ae3ed1ee2562899a6bc14bFunctionalization of Carbon Nanoparticles Modulates Inflammatory Cell Recruitment and NLRP3 Inflammasome ActivationYang, Marie; Flavin, Kevin; Kopf, Ilona; Radics, Gabor; Hearnden, Claire H. A.; McManus, Gavin J.; Moran, Barry; Villalta-Cerdas, Adrian; Echegoyen, Luis A.; Giordani, Silvia; Lavelle, Ed C.Small (2013), 9 (24), 4194-4206CODEN: SMALBC; ISSN:1613-6810. (Wiley-VCH Verlag GmbH & Co. KGaA)The inflammatory effects of carbon nanoparticles (NPs) are highly disputed. Here it is demonstrated that endotoxin-free prepns. of raw carbon nanotubes (CNTs) are very limited in their capacity to promote inflammatory responses in vitro, as well as in vivo. Upon purifn. and selective oxidn. of raw CNTs, a higher dispersibility is achieved in physiol. solns., but this process also enhances their inflammatory activity. In synergy with toll-like receptor (TLR) ligands, CNTs promote NLRP3 inflammasome activation and it is shown for the first time that this property extends to spherical carbon nano-onions (CNOs) of 6 nm in size. In contrast, the benzoic acid functionalization of purified CNTs and CNOs leads to significantly attenuated inflammatory properties. This is evidenced by a reduced secretion of the inflammatory cytokine IL-1β, and a pronounced decrease in the recruitment of neutrophils and monocytes following injection into mice. Collectively, these results reveal that the inflammatory properties of carbon NPs are highly dependent on their physicochem. characteristics and crucially, that chem. surface functionalization allows significant moderation of these properties.
- 109Andón, F. T.; Mukherjee, S. P.; Gessner, I.; Wortmann, L.; Xiao, L.; Hultenby, K.; Shvedova, A. A.; Mathur, S.; Fadeel, B. Hollow Carbon Spheres Trigger Inflammasome-Dependent IL-1β Secretion in Macrophages. Carbon 2017, 113, 243– 251, DOI: 10.1016/j.carbon.2016.11.049[Crossref], [CAS], Google Scholar109https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC28XitFeiurvO&md5=d0dde4e9cf5c110ef44c9e74f9888feaHollow carbon spheres trigger inflammasome-dependent IL-1β secretion in macrophagesAndon, Fernando T.; Mukherjee, Sourav P.; Gessner, Isabel; Wortmann, Laura; Xiao, Lisong; Hultenby, Kjell; Shvedova, Anna A.; Mathur, Sanjay; Fadeel, BengtCarbon (2017), 113 (), 243-251CODEN: CRBNAH; ISSN:0008-6223. (Elsevier Ltd.)It is disputed whether inflammasome activation leading to secretion of pro-inflammatory interleukin (IL)-1β in macrophages transpires independently of cell death or whether the two processes are linked. Here, the authors synthesized hollow carbon spheres (HCS) and investigated their effects on primary human monocyte-derived macrophages (HMDM); short (500 nm) non-functionalized single-walled carbon nanotubes (SWCNT) were included for comparison. HCS (250 nm) were readily taken up by HMDM and induced ROS prodn., but did not trigger a loss of cell viability. However, a dose- and time-dependent release of IL-1β was detected in lipopolysaccharide (LPS)-primed macrophages upon exposure to HCS, while SWCNT-induced secretion of IL-1β was less pronounced. HCS-triggered IL-1β secretion was cathepsin B- and caspase-1-dependent, and was accompanied by a redn. in intracellular K+. Furthermore, cytokine secretion was reduced following treatment with the antioxidant, N-acetylcysteine, and cytochalasin D, an inhibitor of actin polymn. HCS also triggered IL-1β release in LPS-primed THP.1 cells, but not in THP.1 cells with silencing of ASC, NLRP3, or caspase-1 expression, providing evidence that IL-1β was elicited through NLRP3 inflammasome activation. These studies shed light on the effects of HCS on primary macrophages, and show that spherical carbon-based nanoparticles are potent inflammasome activators.
- 110De Gregorio, E.; Tritto, E.; Rappuoli, R. Alum Adjuvanticity: Unraveling a Century Old Mystery. Eur. J. Immunol. 2008, 38, 2068– 2071, DOI: 10.1002/eji.200838648[Crossref], [PubMed], [CAS], Google Scholar110https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BD1cXhtVCltrrL&md5=44aeba5749c4efa6e7bb53ce2102bd96Alum adjuvanticity: unraveling a century old mysteryDe Gregorio, Ennio; Tritto, Elaine; Rappuoli, RinoEuropean Journal of Immunology (2008), 38 (8), 2068-2071CODEN: EJIMAF; ISSN:0014-2980. (Wiley-VCH Verlag GmbH & Co. KGaA)The development of vaccine adjuvants for human use has been one of the slowest processes in the history of medicine. For almost one century, aluminum hydroxide (alum) has been the only vaccine adjuvant approved worldwide. Only in the past decade have two oil-in-water emulsions and one TLR agonist been approved by the European authorities as new vaccine adjuvants. Despite the fact that alum has been injected into billions of people, its mechanism of action is not fully understood. Recently, several reports have greatly increased our knowledge of the mol. and cellular events triggered by alum; however, the contribution of each of these processes to alum adjuvanticity is still unclear. A study published in this issue of the European Journal of Immunol. (vol.38, 2008), together with two recent publications, have demonstrated that the NOD-like receptor, pyrin domain contg. 3(Nlrp3)-inflammasome is the mol. target of alum immunostimulatory activity in vitro. Surprisingly, these three studies reported conflicting results on the requirement of the Nlrp3 inflammasome complex for alum adjuvant effects in vivo. This commentary attempts to resolve some of these discrepancies.
- 111Mukherjee, S. P.; Bottini, M.; Fadeel, B. Graphene and the Immune System: A Romance of Many Dimensions. Front. Immunol. 2017, 8, 673, DOI: 10.3389/fimmu.2017.00673[Crossref], [PubMed], [CAS], Google Scholar111https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC1cXitVWntrvE&md5=48341e765fbdbeb7988a7252e35048b4Graphene and the immune system: a romance of many dimensionsMukherjee, Sourav P.; Bottini, Massimo; Fadeel, BengtFrontiers in Immunology (2017), 8 (), 673/1-673/11CODEN: FIRMCW; ISSN:1664-3224. (Frontiers Media S.A.)A review. Graphene-based materials (GBMs) are emerging as attractive materials for biomedical applications. Understanding how these materials are perceived by and interact with the immune system is of fundamental importance. Phagocytosis is a major mechanism deployed by the immune system to remove pathogens, particles, and cellular debris. Here, we discuss recent studies on the interactions of GBMs with different phagocytic cells, including macrophages, neutrophils, and dendritic cells. The importance of assessing GBMs for endotoxin contamination is discussed as this may skew results. We also explore the role of the bio-corona for interactions of GBMs with immune cells. Finally, we highlight recent evidence for direct plasma membrane interactions of GBMs.
- 112Li, R.; Guiney, L. M.; Chang, C. H.; Mansukhani, N. D.; Ji, Z.; Wang, X.; Liao, Y.-P.; Jiang, W.; Sun, B.; Hersam, M. C.; Nel, A. E.; Xia, T. Surface Oxidation of Graphene Oxide Determines Membrane Damage, Lipid Peroxidation, and Cytotoxicity in Macrophages in a Pulmonary Toxicity Model. ACS Nano 2018, 12, 1390– 1402, DOI: 10.1021/acsnano.7b07737[ACS Full Text
 ], [CAS], Google Scholar112https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC1cXnvVCktw%253D%253D&md5=250124aed2894ca31da55bcaa2d3ce57Surface Oxidation of Graphene Oxide Determines Membrane Damage, Lipid Peroxidation, and Cytotoxicity in Macrophages in a Pulmonary Toxicity ModelLi, Ruibin; Guiney, Linda M.; Chang, Chong Hyun; Mansukhani, Nikhita D.; Ji, Zhaoxia; Wang, Xiang; Liao, Yu-Pei; Jiang, Wen; Sun, Bingbing; Hersam, Mark C.; Nel, Andre E.; Xia, TianACS Nano (2018), 12 (2), 1390-1402CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)While two-dimensional graphene oxide (GO) is used increasingly in biomedical applications, there is uncertainty on how specific physicochem. properties relate to biocompatibility in mammalian systems. Although properties such as lateral size and the colloidal properties of the nanosheets are important, the specific material properties that we address here is the oxidn. state and reactive surface groups on the planar surface. In this study, we used a GO library, comprising pristine, reduced (rGO), and hydrated GO (hGO), in which quant. assessment of the hydroxyl, carboxyl, epoxy, and carbon radical contents was used to study the impact on epithelial cells and macrophages, as well as in the murine lung. Strikingly, we obsd. that hGO, which exhibits the highest carbon radical d., was responsible for the generation of cell death in THP-1 and BEAS-2B cells as a consequence of lipid peroxidn. of the surface membrane, membrane lysis, and cell death. In contrast, pristine GO had lesser effects, while rGO showed extensive cellular uptake with minimal effects on viability. In order to see how these in vitro effects relate to adverse outcomes in the lung, mice were exposed to GOs by oropharyngeal aspiration. Animal sacrifice after 40 h demonstrated that hGO was more prone than other materials to generate acute lung inflammation, accompanied by the highest lipid peroxidn. in alveolar macrophages, cytokine prodn. (LIX, MCP-1), and LDH release in bronchoalveolar lavage fluid. Pristine GO showed less toxicity, whereas rGO had minimal effects. We demonstrate that the surface oxidn. state and carbon radical content play major roles in the induction of toxicity by GO in mammalian cells and the lung.
], [CAS], Google Scholar112https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC1cXnvVCktw%253D%253D&md5=250124aed2894ca31da55bcaa2d3ce57Surface Oxidation of Graphene Oxide Determines Membrane Damage, Lipid Peroxidation, and Cytotoxicity in Macrophages in a Pulmonary Toxicity ModelLi, Ruibin; Guiney, Linda M.; Chang, Chong Hyun; Mansukhani, Nikhita D.; Ji, Zhaoxia; Wang, Xiang; Liao, Yu-Pei; Jiang, Wen; Sun, Bingbing; Hersam, Mark C.; Nel, Andre E.; Xia, TianACS Nano (2018), 12 (2), 1390-1402CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)While two-dimensional graphene oxide (GO) is used increasingly in biomedical applications, there is uncertainty on how specific physicochem. properties relate to biocompatibility in mammalian systems. Although properties such as lateral size and the colloidal properties of the nanosheets are important, the specific material properties that we address here is the oxidn. state and reactive surface groups on the planar surface. In this study, we used a GO library, comprising pristine, reduced (rGO), and hydrated GO (hGO), in which quant. assessment of the hydroxyl, carboxyl, epoxy, and carbon radical contents was used to study the impact on epithelial cells and macrophages, as well as in the murine lung. Strikingly, we obsd. that hGO, which exhibits the highest carbon radical d., was responsible for the generation of cell death in THP-1 and BEAS-2B cells as a consequence of lipid peroxidn. of the surface membrane, membrane lysis, and cell death. In contrast, pristine GO had lesser effects, while rGO showed extensive cellular uptake with minimal effects on viability. In order to see how these in vitro effects relate to adverse outcomes in the lung, mice were exposed to GOs by oropharyngeal aspiration. Animal sacrifice after 40 h demonstrated that hGO was more prone than other materials to generate acute lung inflammation, accompanied by the highest lipid peroxidn. in alveolar macrophages, cytokine prodn. (LIX, MCP-1), and LDH release in bronchoalveolar lavage fluid. Pristine GO showed less toxicity, whereas rGO had minimal effects. We demonstrate that the surface oxidn. state and carbon radical content play major roles in the induction of toxicity by GO in mammalian cells and the lung. - 113Chen, G.-Y.; Yang, H.-J.; Lu, C.-H.; Chao, Y.-C.; Hwang, S.-M.; Chen, C.-L.; Lo, K.-W.; Sung, L.-Y.; Luo, W.-Y.; Tuan, H.-Y.; Hu, Y. C. Simultaneous Induction of Autophagy and Toll-like Receptor Signaling Pathways by Graphene Oxide. Biomaterials 2012, 33, 6559– 6569, DOI: 10.1016/j.biomaterials.2012.05.064[Crossref], [PubMed], [CAS], Google Scholar113https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC38Xos1ehtLc%253D&md5=3ca05540c6257a8c8e2486c1b1665331Simultaneous induction of autophagy and toll-like receptor signaling pathways by graphene oxideChen, Guan-Yu; Yang, Hong-Jie; Lu, Chia-Hsin; Chao, Yu-Chan; Hwang, Shiaw-Min; Chen, Chiu-Ling; Lo, Kai-Wei; Sung, Li-Yu; Luo, Wen-Yi; Tuan, Hsing-Yu; Hu, Yu-ChenBiomaterials (2012), 33 (27), 6559-6569CODEN: BIMADU; ISSN:0142-9612. (Elsevier Ltd.)Graphene oxide (GO) nanosheets have sparked growing interests in biol. and medical applications. This study examd. how macrophage, the primary immune cell type engaging microbes, responded to GO treatment. We uncovered that incubation of macrophage cell RAW264.7 with GO elicited autophagy in a concn.-dependent manner, as evidenced by the appearance of autophagic vacuoles and activation of autophagic marker proteins. Such GO-induced autophagy was obsd. in various cell lines and in macrophage treated with GO of different sizes. Strikingly, GO treatment of macrophage provoked the toll-like receptor (TLR) signaling cascades and triggered ensuing cytokine responses. Mol. anal. identified that TLR4 and TLR9 and their downstream signaling mediators MyD88, TRAF6 and NF-κB played pivotal roles in the GO-induced inflammatory responses. By silencing individual genes in the signaling pathway, we further unveiled that the GO-induced autophagy was modulated by TLR4, TLR9 and was dependent on downstream adaptor proteins MyD88, TRIF and TRAF6. Altogether, we demonstrated that GO treatment of cells simultaneously triggers autophagy and TLR4/TLR9-regulated inflammatory responses, and the autophagy was at least partly regulated by the TLRs pathway. This study thus suggests a mechanism by which cells respond to nanomaterials and underscores the importance of future safety evaluation of nanomaterials.
- 114Qu, G.; Liu, S.; Zhang, S.; Wang, L.; Wang, X.; Sun, B.; Yin, N.; Gao, X.; Xia, T.; Chen, J.-J.; Jiang, G.-B. Graphene Oxide Induces Toll-like Receptor 4 (TLR4)-Dependent Necrosis in Macrophages. ACS Nano 2013, 7, 5732– 5745, DOI: 10.1021/nn402330b[ACS Full Text
 ], [CAS], Google Scholar114https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3sXovFWktrk%253D&md5=c001d526308f33e5ae4054a91fdefad1Graphene Oxide Induces Toll-like Receptor 4 (TLR4)-Dependent Necrosis in MacrophagesQu, Guangbo; Liu, Sijin; Zhang, Shuping; Wang, Lei; Wang, Xiaoyan; Sun, Bingbing; Yin, Nuoya; Gao, Xiang; Xia, Tian; Chen, Jane-Jane; Jiang, Gui-BinACS Nano (2013), 7 (7), 5732-5745CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)Graphene and graphene-based nanomaterials display novel and beneficial chem., elec., mech., and optical characteristics, which endow these nanomaterials with promising applications in a wide spectrum of areas such as electronics and biomedicine. However, its toxicity on health remains unknown and is of great concern. In the present study, the authors demonstrated that graphene oxide (GO) induced necrotic cell death to macrophages. This toxicity is mediated by activation of toll-like receptor 4 (TLR4) signaling and subsequently in part via autocrine TNF-α prodn. Inhibition of TLR4 signaling with a selective inhibitor prevented cell death nearly completely. Furthermore, TLR4-deficient bone marrow-derived macrophages were resistant to GO-triggered necrosis. Similarly, GO did not induce necrosis of HEK293T/TLR4-null cells. Macrophagic cell death upon GO treatment was partially attributed to RIP1-RIP3 complex-mediated programmed necrosis downstream of TNF-α induction. Addnl., upon uptake into macrophages, GO accumulated primarily in cytoplasm causing dramatic morphol. alterations and a significant redn. of the macrophagic ability in phagocytosis. However, macrophagic uptake of GO may not be required for induction of necrosis. GO exposure also caused a large increase of intracellular reactive oxygen species (ROS), which contributed to the cause of cell death. The combined data reveal that interaction of GO with TLR4 is the predominant mol. mechanism underlying GO-induced macrophagic necrosis; also, cytoskeletal damage and oxidative stress contribute to decreased viability and function of macrophages upon GO treatment.
], [CAS], Google Scholar114https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3sXovFWktrk%253D&md5=c001d526308f33e5ae4054a91fdefad1Graphene Oxide Induces Toll-like Receptor 4 (TLR4)-Dependent Necrosis in MacrophagesQu, Guangbo; Liu, Sijin; Zhang, Shuping; Wang, Lei; Wang, Xiaoyan; Sun, Bingbing; Yin, Nuoya; Gao, Xiang; Xia, Tian; Chen, Jane-Jane; Jiang, Gui-BinACS Nano (2013), 7 (7), 5732-5745CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)Graphene and graphene-based nanomaterials display novel and beneficial chem., elec., mech., and optical characteristics, which endow these nanomaterials with promising applications in a wide spectrum of areas such as electronics and biomedicine. However, its toxicity on health remains unknown and is of great concern. In the present study, the authors demonstrated that graphene oxide (GO) induced necrotic cell death to macrophages. This toxicity is mediated by activation of toll-like receptor 4 (TLR4) signaling and subsequently in part via autocrine TNF-α prodn. Inhibition of TLR4 signaling with a selective inhibitor prevented cell death nearly completely. Furthermore, TLR4-deficient bone marrow-derived macrophages were resistant to GO-triggered necrosis. Similarly, GO did not induce necrosis of HEK293T/TLR4-null cells. Macrophagic cell death upon GO treatment was partially attributed to RIP1-RIP3 complex-mediated programmed necrosis downstream of TNF-α induction. Addnl., upon uptake into macrophages, GO accumulated primarily in cytoplasm causing dramatic morphol. alterations and a significant redn. of the macrophagic ability in phagocytosis. However, macrophagic uptake of GO may not be required for induction of necrosis. GO exposure also caused a large increase of intracellular reactive oxygen species (ROS), which contributed to the cause of cell death. The combined data reveal that interaction of GO with TLR4 is the predominant mol. mechanism underlying GO-induced macrophagic necrosis; also, cytoskeletal damage and oxidative stress contribute to decreased viability and function of macrophages upon GO treatment. - 115Mukherjee, S. P.; Bondarenko, O.; Kohonen, P.; Andón, F. T.; Brzicová, T.; Gessner, I.; Mathur, S.; Bottini, M.; Calligari, P.; Stella, L.; Kisin, E.; Shvedova, A.; Autio, R.; Salminen-Mankonen, H.; Lahesmaa, R.; Fadeel, B. Macrophage Sensing of Single-Walled Carbon Nanotubes via Toll-like Receptors. Sci. Rep. 2018, 8, 1115, DOI: 10.1038/s41598-018-19521-9[Crossref], [PubMed], [CAS], Google Scholar115https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A280%3ADC%252BC1MvitFKlug%253D%253D&md5=6acae7a5af7ea6a7e54fec7fd6c6eaf6Macrophage sensing of single-walled carbon nanotubes via Toll-like receptorsMukherjee Sourav P; Bondarenko Olesja; Kohonen Pekka; Andon Fernando T; Brzicova Tana; Fadeel Bengt; Bondarenko Olesja; Andon Fernando T; Brzicova Tana; Gessner Isabel; Mathur Sanjay; Bottini Massimo; Bottini Massimo; Calligari Paolo; Stella Lorenzo; Kisin Elena; Shvedova Anna; Shvedova Anna; Autio Reija; Salminen-Mankonen Heli; Lahesmaa RiittaScientific reports (2018), 8 (1), 1115 ISSN:.Carbon-based nanomaterials including carbon nanotubes (CNTs) have been shown to trigger inflammation. However, how these materials are 'sensed' by immune cells is not known. Here we compared the effects of two carbon-based nanomaterials, single-walled CNTs (SWCNTs) and graphene oxide (GO), on primary human monocyte-derived macrophages. Genome-wide transcriptomics assessment was performed at sub-cytotoxic doses. Pathway analysis of the microarray data revealed pronounced effects on chemokine-encoding genes in macrophages exposed to SWCNTs, but not in response to GO, and these results were validated by multiplex array-based cytokine and chemokine profiling. Conditioned medium from SWCNT-exposed cells acted as a chemoattractant for dendritic cells. Chemokine secretion was reduced upon inhibition of NF-κB, as predicted by upstream regulator analysis of the transcriptomics data, and Toll-like receptors (TLRs) and their adaptor molecule, MyD88 were shown to be important for CCL5 secretion. Moreover, a specific role for TLR2/4 was confirmed by using reporter cell lines. Computational studies to elucidate how SWCNTs may interact with TLR4 in the absence of a protein corona suggested that binding is guided mainly by hydrophobic interactions. Taken together, these results imply that CNTs may be 'sensed' as pathogens by immune cells.
- 116Barth, N. D.; Marwick, J. A.; Vendrell, M.; Rossi, A. G.; Dransfield, I. The ″Phagocytic Synapse″ and Clearance of Apoptotic Cells. Front. Immunol. 2017, 8, 1708, DOI: 10.3389/fimmu.2017.01708[Crossref], [PubMed], [CAS], Google Scholar116https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC1cXitFOgs77L&md5=c768bfb6be93df0a3fdd22cb9ca548fcThe "phagocytic synapse" and clearance of apoptotic cellsBarth, Nicole D.; Marwick, John A.; Vendrell, Marc; Rossi, Adriano G.; Dransfield, IanFrontiers in Immunology (2017), 8 (), 1708/1-1708/9CODEN: FIRMCW; ISSN:1664-3224. (Frontiers Media S.A.)Apoptosis and subsequent phagocytic clearance of apoptotic cells is important for embryonic development, maintenance of tissues that require regular cellular renewal and innate immunity. The timely removal of apoptotic cells prevents progression to secondary necrosis and release of cellular contents, preventing cellular stress and inflammation. In addn., altered phagocyte behavior following apoptotic cell contact and phagocytosis engages an anti-inflammatory phenotype, which impacts upon development and progression of inflammatory and immune responses. Defective apoptotic cell clearance underlies the development of various inflammatory and autoimmune diseases. There is considerable functional redundancy in the receptors that mediate apoptotic cell clearance, highlighting the importance of this process in diverse physiol. processes. A single phagocyte may utilize multiple receptor pathways for the efficient capture of apoptotic cells by phagocytes (tethering) and the subsequent initiation of signaling events necessary for internalization. In this review, we will consider the surface alterations and mol. opsonization events assocd. with apoptosis that may represent a tunable signal that confers distinct intracellular signaling events and hence specific phagocyte responses in a context-dependent manner. Efficient mol. communication between phagocytes and apoptotic targets may require cooperative receptor utilization and the establishment of efferocytic synapse, which acts to stabilize adhesive interactions and facilitate the organization of signaling platforms that are necessary for controlling phagocyte responses.
- 117Sosale, N. G.; Spinler, K. R.; Alvey, C.; Discher, D. E. Macrophage Engulfment of a Cell or Nanoparticle Is Regulated by Unavoidable Opsonization, a Species-Specific ‘Marker of Self’ CD47, and Target Physical Properties. Curr. Opin. Immunol. 2015, 35, 107– 112, DOI: 10.1016/j.coi.2015.06.013[Crossref], [PubMed], [CAS], Google Scholar117https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2MXhtFWnt7vM&md5=c080aea9ac5c3d2ef515b1eb003811c4Macrophage engulfment of a cell or nanoparticle is regulated by unavoidable opsonization, a species-specific 'Marker of Self' CD47, and target physical propertiesSosale, Nisha G.; Spinler, Kyle R.; Alvey, Cory; Discher, Dennis E.Current Opinion in Immunology (2015), 35 (), 107-112CODEN: COPIEL; ISSN:0952-7915. (Elsevier Ltd.)Professional phagocytes of the mononuclear phagocyte system (MPS), esp. ubiquitous macrophages, are commonly thought to engulf or not a target based strictly on 'eat me' mols. such as Antibodies. The target might be a viable 'self' cell or a drug-delivering nanoparticle, or it might be a cancer cell or a microbe. 'Marker of Self' CD47 signals into a macrophage to inhibit the acto-myosin cytoskeleton that makes engulfment efficient. In adhesion of any cell, the same machinery is generally activated by rigidity of target surfaces, and recent results confirm phagocytosis is likewise driven by the rigidity typical of microbes and many synthetics. Basic insights are already being applied in order to make macrophages eat cancer or to delay nanoparticle clearance for better drug delivery and imaging.
- 118Hu, W.; Peng, C.; Lv, M.; Li, X.; Zhang, Y.; Chen, N.; Fan, C.; Huang, Q. Protein Corona-Mediated Mitigation of Cytotoxicity of Graphene Oxide. ACS Nano 2011, 5, 3693– 3700, DOI: 10.1021/nn200021j[ACS Full Text
 ], [CAS], Google Scholar118https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3MXkvFGjtro%253D&md5=e91ed9e3981f6b0ca57ac3447ee76d25Protein Corona-Mediated Mitigation of Cytotoxicity of Graphene OxideHu, Wenbing; Peng, Cheng; Lv, Min; Li, Xiaoming; Zhang, Yujie; Chen, Nan; Fan, Chunhai; Huang, QingACS Nano (2011), 5 (5), 3693-3700CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)Graphene is a single layer of sp2-bonded C that has unique and highly attractive electronic, mech., and thermal properties. Consequently, the potential impact of graphene and its derivs. (e.g., graphene oxide, GO) on human and environmental health has raised considerable concerns. In this study, we have carried out a systematic investigation on cellular effects of GO nanosheets and identified the effect of fetal bovine serum (FBS), an often-employed component in cell culture medium, on the cytotoxicity of GO. At low concns. of FBS (1%), human cells were sensitive to the presence of GO and showed concn.-dependent cytotoxicity. Interestingly, the cytotoxicity of GO was greatly mitigated at 10% FBS, the concn. usually employed in cell medium. Our studies have demonstrated that the cytotoxicity of GO nanosheets arises from direct interactions between the cell membrane and GO nanosheets that result in phys. damage to the cell membrane. This effect is largely attenuated when GO is incubated with FBS due to the extremely high protein adsorption ability of GO. The observation of this FBS-mitigated GO cytotoxicity effect may provide an alternative and convenient route to engineer nanomaterials for safe biomedical and environmental applications.
], [CAS], Google Scholar118https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3MXkvFGjtro%253D&md5=e91ed9e3981f6b0ca57ac3447ee76d25Protein Corona-Mediated Mitigation of Cytotoxicity of Graphene OxideHu, Wenbing; Peng, Cheng; Lv, Min; Li, Xiaoming; Zhang, Yujie; Chen, Nan; Fan, Chunhai; Huang, QingACS Nano (2011), 5 (5), 3693-3700CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)Graphene is a single layer of sp2-bonded C that has unique and highly attractive electronic, mech., and thermal properties. Consequently, the potential impact of graphene and its derivs. (e.g., graphene oxide, GO) on human and environmental health has raised considerable concerns. In this study, we have carried out a systematic investigation on cellular effects of GO nanosheets and identified the effect of fetal bovine serum (FBS), an often-employed component in cell culture medium, on the cytotoxicity of GO. At low concns. of FBS (1%), human cells were sensitive to the presence of GO and showed concn.-dependent cytotoxicity. Interestingly, the cytotoxicity of GO was greatly mitigated at 10% FBS, the concn. usually employed in cell medium. Our studies have demonstrated that the cytotoxicity of GO nanosheets arises from direct interactions between the cell membrane and GO nanosheets that result in phys. damage to the cell membrane. This effect is largely attenuated when GO is incubated with FBS due to the extremely high protein adsorption ability of GO. The observation of this FBS-mitigated GO cytotoxicity effect may provide an alternative and convenient route to engineer nanomaterials for safe biomedical and environmental applications. - 119Chong, Y.; Ge, C.; Yang, Z.; Garate, J. A.; Gu, Z.; Weber, J. K.; Liu, J.; Zhou, R. Reduced Cytotoxicity of Graphene Nanosheets Mediated by Blood-Protein Coating. ACS Nano 2015, 9, 5713– 5724, DOI: 10.1021/nn5066606[ACS Full Text
 ], [CAS], Google Scholar119https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2MXpsFOntrY%253D&md5=3cb76dac50ba63b0bcba2f8c49da01cbReduced Cytotoxicity of Graphene Nanosheets Mediated by Blood-Protein CoatingChong, Yu; Ge, Cuicui; Yang, Zaixing; Garate, Jose Antonio; Gu, Zonglin; Weber, Jeffrey K.; Liu, Jiajia; Zhou, RuhongACS Nano (2015), 9 (6), 5713-5724CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)The advent and pending wide use of nanoscale materials urges a biosafety assessment and safe design of nanomaterials that demonstrate applicability to human medicine. In biol. microenvironment, biomols. will bind onto nanoparticles forming corona and endow nanoparticles new biol. identity. Since blood-circulatory system will most likely be the first interaction organ exposed to these nanomaterials, a deep understanding of the basic interaction mechanisms between serum proteins and foreign nanoparticles may help to better clarify the potential risks of nanomaterials and provide guidance on safe design of nanomaterials. In this study, the adsorption of four high-abundance blood proteins onto the carbon-based nanomaterial graphene oxide (GO) and reduced GO (rGO) were investigated via exptl. (AFM, florescence spectroscopy, SPR) and simulation-based (mol. dynamics) approaches. Among the proteins in question, we observe competitive binding to the GO surface that features a m´elange of distinct packing modes. Our MD simulations reveal that the protein adsorption is mainly enthalpically driven through strong π-π stacking interactions between GO and arom. protein residues, in addn. to hydrophobic interactions. Overall, these results were in line with previous findings related to adsorption of serum proteins onto single-walled carbon nanotubes (SWCNTs), but GO exhibits a dramatic enhancement of adsorption capacity compared to this one-dimensional carbon form. Encouragingly, protein-coated GO resulted in a markedly less cytotoxicity than pristine and protein-coated SWCNTs, suggesting a useful role for this planar nanomaterial in biomedical applications.
], [CAS], Google Scholar119https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2MXpsFOntrY%253D&md5=3cb76dac50ba63b0bcba2f8c49da01cbReduced Cytotoxicity of Graphene Nanosheets Mediated by Blood-Protein CoatingChong, Yu; Ge, Cuicui; Yang, Zaixing; Garate, Jose Antonio; Gu, Zonglin; Weber, Jeffrey K.; Liu, Jiajia; Zhou, RuhongACS Nano (2015), 9 (6), 5713-5724CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)The advent and pending wide use of nanoscale materials urges a biosafety assessment and safe design of nanomaterials that demonstrate applicability to human medicine. In biol. microenvironment, biomols. will bind onto nanoparticles forming corona and endow nanoparticles new biol. identity. Since blood-circulatory system will most likely be the first interaction organ exposed to these nanomaterials, a deep understanding of the basic interaction mechanisms between serum proteins and foreign nanoparticles may help to better clarify the potential risks of nanomaterials and provide guidance on safe design of nanomaterials. In this study, the adsorption of four high-abundance blood proteins onto the carbon-based nanomaterial graphene oxide (GO) and reduced GO (rGO) were investigated via exptl. (AFM, florescence spectroscopy, SPR) and simulation-based (mol. dynamics) approaches. Among the proteins in question, we observe competitive binding to the GO surface that features a m´elange of distinct packing modes. Our MD simulations reveal that the protein adsorption is mainly enthalpically driven through strong π-π stacking interactions between GO and arom. protein residues, in addn. to hydrophobic interactions. Overall, these results were in line with previous findings related to adsorption of serum proteins onto single-walled carbon nanotubes (SWCNTs), but GO exhibits a dramatic enhancement of adsorption capacity compared to this one-dimensional carbon form. Encouragingly, protein-coated GO resulted in a markedly less cytotoxicity than pristine and protein-coated SWCNTs, suggesting a useful role for this planar nanomaterial in biomedical applications. - 120Xu, M.; Zhu, J.; Wang, F.; Xiong, Y.; Wu, Y.; Wang, Q.; Weng, J.; Zhang, Z.; Chen, W.; Liu, S. Improved In Vitro and In Vivo Biocompatibility of Graphene Oxide through Surface Modification: Poly(Acrylic Acid)-Functionalization Is Superior to PEGylation. ACS Nano 2016, 10, 3267– 3281, DOI: 10.1021/acsnano.6b00539[ACS Full Text
 ], [CAS], Google Scholar120https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC28XitFeqsLg%253D&md5=11b9041f461cbac026bff16cbddcc5ccImproved In Vitro and In Vivo Biocompatibility of Graphene Oxide through Surface Modification: Poly(Acrylic Acid)-Functionalization is Superior to PEGylationXu, Ming; Zhu, Jianqiang; Wang, Fanfan; Xiong, Yunjing; Wu, Yakun; Wang, Qiuquan; Weng, Jian; Zhang, Zhihong; Chen, Wei; Liu, SijinACS Nano (2016), 10 (3), 3267-3281CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)The unique physicochem. properties of two-dimensional (2D) graphene oxide (GO) could greatly benefit the biomedical field; however, recent research demonstrated that GO could induce in vitro and in vivo toxicity. We detd. the mechanism of GO induced toxicity, and our in vitro expts. revealed that pristine GO could impair cell membrane integrity and functions including regulation of membrane- and cytoskeleton-assocd. genes, membrane permeability, fluidity and ion channels. Furthermore, GO induced platelet depletion, pro-inflammatory response and pathol. changes of lung and liver in mice. To improve the biocompatibility of pristine GO, we prepd. a series of GO derivs. including aminated GO (GO-NH2), poly(acrylamide)-functionalized GO (GO-PAM), poly(acrylic acid)-functionalized GO (GO-PAA) and poly(ethylene glycol)-functionalized GO (GO-PEG), and compared their toxicity with pristine GO in vitro and in vivo. Among these GO derivs., GO-PEG and GO-PAA induced less toxicity than pristine GO, and GO-PAA was the most biocompatible one in vitro and in vivo. The differences in biocompatibility were due to the differential compns. of protein corona, esp. IgG, formed on their surfaces that det. their cell membrane interaction and cellular uptake, the extent of platelet depletion in blood, thrombus formation under short-term exposure and the pro-inflammatory effects under long-term exposure. Overall, our combined data delineated the key mol. mechanisms underlying the in vivo and in vitro biol. behaviors and toxicity of pristine GO, and identified a safer GO deriv. that could be used for future applications.
], [CAS], Google Scholar120https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC28XitFeqsLg%253D&md5=11b9041f461cbac026bff16cbddcc5ccImproved In Vitro and In Vivo Biocompatibility of Graphene Oxide through Surface Modification: Poly(Acrylic Acid)-Functionalization is Superior to PEGylationXu, Ming; Zhu, Jianqiang; Wang, Fanfan; Xiong, Yunjing; Wu, Yakun; Wang, Qiuquan; Weng, Jian; Zhang, Zhihong; Chen, Wei; Liu, SijinACS Nano (2016), 10 (3), 3267-3281CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)The unique physicochem. properties of two-dimensional (2D) graphene oxide (GO) could greatly benefit the biomedical field; however, recent research demonstrated that GO could induce in vitro and in vivo toxicity. We detd. the mechanism of GO induced toxicity, and our in vitro expts. revealed that pristine GO could impair cell membrane integrity and functions including regulation of membrane- and cytoskeleton-assocd. genes, membrane permeability, fluidity and ion channels. Furthermore, GO induced platelet depletion, pro-inflammatory response and pathol. changes of lung and liver in mice. To improve the biocompatibility of pristine GO, we prepd. a series of GO derivs. including aminated GO (GO-NH2), poly(acrylamide)-functionalized GO (GO-PAM), poly(acrylic acid)-functionalized GO (GO-PAA) and poly(ethylene glycol)-functionalized GO (GO-PEG), and compared their toxicity with pristine GO in vitro and in vivo. Among these GO derivs., GO-PEG and GO-PAA induced less toxicity than pristine GO, and GO-PAA was the most biocompatible one in vitro and in vivo. The differences in biocompatibility were due to the differential compns. of protein corona, esp. IgG, formed on their surfaces that det. their cell membrane interaction and cellular uptake, the extent of platelet depletion in blood, thrombus formation under short-term exposure and the pro-inflammatory effects under long-term exposure. Overall, our combined data delineated the key mol. mechanisms underlying the in vivo and in vitro biol. behaviors and toxicity of pristine GO, and identified a safer GO deriv. that could be used for future applications. - 121Belling, J. N.; Jackman, J. A.; Yorulmaz Avsar, S.; Park, J. H.; Wang, Y.; Potroz, M. G.; Ferhan, A. R.; Weiss, P. S.; Cho, N.-J. Stealth Immune Properties of Graphene Oxide Enabled by Surface-Bound Complement Factor H. ACS Nano 2016, 10, 10161– 10172, DOI: 10.1021/acsnano.6b05409[ACS Full Text
 ], [CAS], Google Scholar121https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC28XhslGhtbnE&md5=969b214b6704b9863f3174eab4d1ddd1Stealth Immune Properties of Graphene Oxide Enabled by Surface-Bound Complement Factor HBelling, Jason N.; Jackman, Joshua A.; Yorulmaz Avsar, Saziye; Park, Jae Hyeon; Wang, Yan; Potroz, Michael G.; Ferhan, Abdul Rahim; Weiss, Paul S.; Cho, Nam-JoonACS Nano (2016), 10 (11), 10161-10172CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)With mounting evidence that nanomaterials can trigger adverse innate immune responses such as complement activation, there is increasing attention to the development of strategies that mask the complement-activating properties of nanomaterials. The current gold std. to reduce complement activation of nanomaterials is the covalent attachment of polymer coatings on nanomaterial surfaces, even though this strategy provides only moderate protection against complement activation. Akin to protein coronas that form on nanomaterial surfaces in physiol. fluids, noncovalent strategies based on protein adsorption would offer a simplified, biomimetic approach to mitigate complement activation. Herein, we demonstrate that precoating graphene-based nanomaterials with purified, natural proteins enables regulatory control of nanomaterial-triggered complement activation. When the graphene-based nanomaterials were coated with complement factor H, nearly complete protection (>90% redn.) against complement activation (a "stealth effect") was achieved. By contrast, coating the nanomaterials with a passivating layer of bovine or human serum albumins achieved moderate protection (∼40% redn.), whereas IgG amplified complement activation by several-fold. Taken together, our results demonstrate that surface-bound factor H, as well as serum albumins, can prevent graphene oxide-triggered complement activation, thereby offering a facile approach to inhibit complement activation completely down to naturally occurring levels.
], [CAS], Google Scholar121https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC28XhslGhtbnE&md5=969b214b6704b9863f3174eab4d1ddd1Stealth Immune Properties of Graphene Oxide Enabled by Surface-Bound Complement Factor HBelling, Jason N.; Jackman, Joshua A.; Yorulmaz Avsar, Saziye; Park, Jae Hyeon; Wang, Yan; Potroz, Michael G.; Ferhan, Abdul Rahim; Weiss, Paul S.; Cho, Nam-JoonACS Nano (2016), 10 (11), 10161-10172CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)With mounting evidence that nanomaterials can trigger adverse innate immune responses such as complement activation, there is increasing attention to the development of strategies that mask the complement-activating properties of nanomaterials. The current gold std. to reduce complement activation of nanomaterials is the covalent attachment of polymer coatings on nanomaterial surfaces, even though this strategy provides only moderate protection against complement activation. Akin to protein coronas that form on nanomaterial surfaces in physiol. fluids, noncovalent strategies based on protein adsorption would offer a simplified, biomimetic approach to mitigate complement activation. Herein, we demonstrate that precoating graphene-based nanomaterials with purified, natural proteins enables regulatory control of nanomaterial-triggered complement activation. When the graphene-based nanomaterials were coated with complement factor H, nearly complete protection (>90% redn.) against complement activation (a "stealth effect") was achieved. By contrast, coating the nanomaterials with a passivating layer of bovine or human serum albumins achieved moderate protection (∼40% redn.), whereas IgG amplified complement activation by several-fold. Taken together, our results demonstrate that surface-bound factor H, as well as serum albumins, can prevent graphene oxide-triggered complement activation, thereby offering a facile approach to inhibit complement activation completely down to naturally occurring levels. - 122Matesanz, M.-C.; Vila, M.; Feito, M.-J.; Linares, J.; Gonçalves, G.; Vallet-Regi, M.; Marques, P.-A. A. P.; Portolés, M.-T. The Effects of Graphene Oxide Nanosheets Localized on F-Actin Filaments on Cell-Cycle Alterations. Biomaterials 2013, 34, 1562– 1569, DOI: 10.1016/j.biomaterials.2012.11.001[Crossref], [PubMed], [CAS], Google Scholar122https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC38XhslWrsLfI&md5=fa540857176e69072203a4dd7f9c01c5The effects of graphene oxide nanosheets localized on F-actin filaments on cell-cycle alterationsMatesanz, Maria-Concepcion; Vila, Mercedes; Feito, Maria-Jose; Linares, Javier; Goncalves, Gil; Vallet-Regi, Maria; Marques, Paula-Alexandrina A. P.; Portoles, Maria-TeresaBiomaterials (2013), 34 (5), 1562-1569CODEN: BIMADU; ISSN:0142-9612. (Elsevier Ltd.)Graphene oxide (GO) is considered to be a promising nanomaterial for biomedical applications due to its small two-dimensional shape besides its elec. and mech. properties. However, only a few data concerning the cell responses to this material have been described and the GO biocompatibility has not been yet fully assessed. In the present study, graphene oxide nanosheets (GOs) decorated with 1-arm (1-GOs) and 6-arm (6-GOs) poly(ethylene glycol-amine) (PEG) have been incubated with cultured Saos-2 osteoblasts, MC3T3-E1 preosteoblasts and RAW-264.7 macrophages to analyze several key cell markers for in vitro biocompatibility evaluation. The results demonstrate that, after internalization, GO nanosheets are localized on F-actin filaments inducing cell-cycle alterations, apoptosis and oxidative stress in these cell types. The obsd. GOs effects must be considered in further studies focused on photothermal cancer therapy as a synergistic factor.
- 123Feito, M. J.; Vila, M.; Matesanz, M. C.; Linares, J.; Gonçalves, G.; Marques, P. A. A. P.; Vallet-Regí, M.; Rojo, J. M.; Portolés, M. T. In Vitro Evaluation of Graphene Oxide Nanosheets on Immune Function. J. Colloid Interface Sci. 2014, 432, 221– 228, DOI: 10.1016/j.jcis.2014.07.004[Crossref], [PubMed], [CAS], Google Scholar123https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2cXht1GmsrrE&md5=40c342878ecea2e2f2efbb5e5d23b66eIn vitro evaluation of graphene oxide nanosheets on immune functionFeito, M. J.; Vila, M.; Matesanz, M. C.; Linares, J.; Goncalves, G.; Marques, P. A. A. P.; Vallet-Regi, M.; Rojo, J. M.; Portoles, M. T.Journal of Colloid and Interface Science (2014), 432 (), 221-228CODEN: JCISA5; ISSN:0021-9797. (Elsevier B.V.)Graphene oxide (GO) has attracted the scientific community attention due to its novel properties and wide range of potential applications including hyperthermia cancer therapy. However, little is known about the GO effects on the immune function which involves both innate and adaptive defense mechanisms through the activation of different cell populations and secretion of several cytokines. The effect of different GO nanosheets designed for hyperthermia cancer therapy on macrophage and lymphocyte function should be detd. before using GO for this application. The effects of GO nanosheets with 1 (1-GOs) and 6 arms (6-GOs) of polyethylene glycol on RAW-264.7 macrophages and primary splenocytes (as approxn. to the in vivo situation) were evaluated through the proinflammatory cytokine secretion and the modulation of cell proliferation in the presence of specific stimuli for either T-lymphocytes (Con A, anti-CD3 antibody) or B-lymphocytes/macrophages (lipopolysaccharide). 6-GOs significantly increased the secretion of TNF-α by RAW-264.7 macrophages without alteration of IL-6 and IL-1β levels. The treatment of primary splenocytes with 1-GOs and 6-GOs in the presence of Con A, anti-CD3 antibody and lipopolysaccharide, produced significant dose-dependent decreases of cell proliferation and IL-6 levels, revealing weak inflammatory properties of GOs which are favorable for hyperthermia cancer therapy.
- 124Luo, N.; Ni, D.; Yue, H.; Wei, W.; Ma, G. Surface-Engineered Graphene Navigate Divergent Biological Outcomes toward Macrophages. ACS Appl. Mater. Interfaces 2015, 7, 5239– 5247, DOI: 10.1021/am5084607
- 125Luo, N.; Weber, J. K.; Wang, S.; Luan, B.; Yue, H.; Xi, X.; Du, J.; Yang, Z.; Wei, W.; Zhou, R.; Ma, G. PEGylated Graphene Oxide Elicits Strong Immunological Responses despite Surface Passivation. Nat. Commun. 2017, 8, 14537, DOI: 10.1038/ncomms14537[Crossref], [PubMed], [CAS], Google Scholar125https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2sXjsVGisLg%253D&md5=7151a492f80e7a3b3ea7fab18b520c73PEGylated graphene oxide elicits strong immunological responses despite surface passivationLuo, Nana; Weber, Jeffrey K.; Wang, Shuang; Luan, Binquan; Yue, Hua; Xi, Xiaobo; Du, Jing; Yang, Zaixing; Wei, Wei; Zhou, Ruhong; Ma, GuanghuiNature Communications (2017), 8 (), 14537CODEN: NCAOBW; ISSN:2041-1723. (Nature Publishing Group)Engineered nanomaterials promise to transform medicine at the bio-nano interface. However, it is important to elucidate how synthetic nanomaterials interact with crit. biol. systems before such products can be safely utilized in humans. Past evidence suggests that polyethylene glycol-functionalized (PEGylated) nanomaterials are largely biocompatible and elicit less dramatic immune responses than their pristine counterparts. We here report results that contradict these findings. We find that PEGylated graphene oxide nanosheets (nGO-PEGs) stimulate potent cytokine responses in peritoneal macrophages, despite not being internalized. Atomistic mol. dynamics simulations support a mechanism by which nGO-PEGs preferentially adsorb onto and/or partially insert into cell membranes, thereby amplifying interactions with stimulatory surface receptors. Further expts. demonstrate that nGO-PEG indeed provokes cytokine secretion by enhancing integrin β8-related signalling pathways. The present results inform that surface passivation does not always prevent immunol. reactions to 2D nanomaterials but also suggest applications for PEGylated nanomaterials wherein immune stimulation is desired.
- 126Wiemann, M.; Vennemann, A.; Sauer, U. G.; Wiench, K.; Ma-Hock, L.; Landsiedel, R. An in Vitro Alveolar Macrophage Assay for Predicting the Short-Term Inhalation Toxicity of Nanomaterials. J. Nanobiotechnol. 2016, 14, 16, DOI: 10.1186/s12951-016-0164-2[Crossref], [PubMed], [CAS], Google Scholar126https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2sXis1eisLo%253D&md5=9853e6afcb20521bdd16383b353d9fbbAn in vitro alveolar macrophage assay for predicting the short-term inhalation toxicity of nanomaterialsWiemann, Martin; Vennemann, Antje; Sauer, Ursula G.; Wiench, Karin; Ma-Hock, Lan; Landsiedel, RobertJournal of Nanobiotechnology (2016), 14 (), 16/1-16/27CODEN: JNOAAO; ISSN:1477-3155. (BioMed Central Ltd.)Background: Most in vitro studies investigating nanomaterial pulmonary toxicity poorly correlate to in vivo inhalation studies. Alveolar macrophages (AMs) play an outstanding role during inhalation exposure since they effectively clear the alveoli from particles. This study addresses the applicability of an in vitro alveolar macrophage assay to distinguish biol. active from passive nanomaterials. Methods: Rat NR8383 alveolar macrophages were exposed to 18 inorg. nanomaterials, covering AlOOH, BaSO2, CeO2, Fe2O3, TiO2, ZrO2, and ZnO NMs, amorphous SiO2 and graphite nanoplatelets, and two nanosized org. pigments. ZrO2 and amorphous SiO2 were tested without and with surface functionalization. Non-nanosized quartz DQ12 and corundum were used as pos. and neg. controls, resp. The test materials were incubated with the cells in protein-free culture medium. Lactate dehydrogenase, glucuronidase, and tumor necrosis factor alpha were assessed after 16 h. In parallel, H2O2 was assessed after 1.5 h. Using the no-obsd.-adverse-effect concns. (NOAECs) from available rat short-term inhalation studies (STIS), the test materials were categorized as active (NOAEC < 10 mg/m3) or passive. Results:In vitro data reflected the STIS categorization if a particle surface area-based threshold of <6000 mm2/mL was used to det. the biol. relevance of the lowest obsd. significant in vitro effects. Significant effects that were recorded above this threshold were assessed as resulting from test material-unspecific cellular 'overload'. Test materials were assessed as active if ≥2 of the 4 in vitro parameters undercut this threshold. They were assessed as passive if 0 or 1 parameter was altered. An overall assay accuracy of 95 % was achieved. Conclusions: The in vitro NR8383 alveolar macrophage assay allows distinguishing active from passive nanomaterials. Thereby, it allows detg. whether in vivo short-term inhalation testing is necessary for hazard assessment. Results may also be used to group nanomaterials by biol. activity. Further work should aim at validating the assay.
- 127Mukherjee, S. P.; Lazzaretto, B.; Hultenby, K.; Newman, L.; Rodrigues, A. F.; Lozano, N.; Kostarelos, K.; Malmberg, P.; Fadeel, B. Graphene Oxide Elicits Membrane Lipid Changes and Neutrophil Extracellular Trap Formation. Chem. 2018, 4, 334– 358, DOI: 10.1016/j.chempr.2017.12.017[Crossref], [CAS], Google Scholar127https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC1cXis1Shurc%253D&md5=e2529b3f746685f12a38aeed2bac7065Graphene Oxide Elicits Membrane Lipid Changes and Neutrophil Extracellular Trap FormationMukherjee, Sourav P.; Lazzaretto, Beatrice; Hultenby, Kjell; Newman, Leon; Rodrigues, Artur F.; Lozano, Neus; Kostarelos, Kostas; Malmberg, Per; Fadeel, BengtChem (2018), 4 (2), 334-358CODEN: CHEMVE; ISSN:2451-9294. (Cell Press)Understanding the biol. interactions of graphene-based materials is important for the safe use of these materials. Previous studies have explored the interaction between graphene oxide (GO) and macrophages but not the impact of GO on neutrophils, key cells of the immune system. Here, we synthesized GO sheets with differing lateral dimensions and showed by using an array of anal. and imaging techniques, including transmission and SEM, confocal microscopy, and time-of-flight secondary ion mass spectroscopy (ToF-SIMS), that GO elicited the formation of neutrophil extracellular traps (NETs). ToF-SIMS revealed pronounced perturbations of plasma membrane lipids, including a decrease in cholesterol and increased levels of oxidized cholesterol species. The induction of NETs was size dependent and assocd. with the prodn. of mitochondrial reactive oxygen species and calcium influx. Importantly, antioxidant treatment reduced the prodn. of NETs. These studies provide evidence that a previously undescribed biol. effect of GO manifests through direct effects on membrane lipids.
- 128Russier, J.; León, V.; Orecchioni, M.; Hirata, E.; Virdis, P.; Fozza, C.; Sgarrella, F.; Cuniberti, G.; Prato, M.; Vázquez, E.; Bianco, A.; Delogu, L. G. Few-Layer Graphene Kills Selectively Tumor Cells from Myelomonocytic Leukemia Patients. Angew. Chem., Int. Ed. 2017, 56, 3014– 3019, DOI: 10.1002/anie.201700078[Crossref], [CAS], Google Scholar128https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2sXitVKnurc%253D&md5=e1e10e74bce00a2663cff7f18c732ea5Few-Layer Graphene Kills Selectively Tumor Cells from Myelomonocytic Leukemia PatientsRussier, Julie; Leon, Veronica; Orecchioni, Marco; Hirata, Eri; Virdis, Patrizia; Fozza, Claudio; Sgarrella, Francesco; Cuniberti, Gianaurelio; Prato, Maurizio; Vazquez, Ester; Bianco, Alberto; Delogu, Lucia G.Angewandte Chemie, International Edition (2017), 56 (11), 3014-3019CODEN: ACIEF5; ISSN:1433-7851. (Wiley-VCH Verlag GmbH & Co. KGaA)In the cure of cancer, a major cause of today's mortality, chemotherapy is the most common treatment, though serious frequent challenges are encountered by current anticancer drugs. We discovered that few-layer graphene (FLG) dispersions have a specific killer action on monocytes, showing neither toxic nor activation effects on other immune cells. We confirmed the therapeutic application of graphene on an aggressive type of cancer that is myelomonocytic leukemia, where the monocytes are in their malignant form. We demonstrated that graphene has the unique ability to target and boost specifically the necrosis of monocytic cancer cells. Moreover, the comparison between FLG and a common chemotherapeutic drug, etoposide, confirmed the higher specificity and toxicity of FLG. Since current chemotherapy treatments of leukemia still cause serious problems, these findings open the way to new and safer therapeutic approaches.
- 129Zhou, H.; Zhao, K.; Li, W.; Yang, N.; Liu, Y.; Chen, C.; Wei, T. The Interactions between Pristine Graphene and Macrophages and the Production of Cytokines/Chemokines via TLR- and NF-ΚB-Related Signaling Pathways. Biomaterials 2012, 33, 6933– 6942, DOI: 10.1016/j.biomaterials.2012.06.064[Crossref], [PubMed], [CAS], Google Scholar129https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC38XhtVaktrnL&md5=f8ebe6d7225d8dacea9c6501486ae425The interactions between pristine graphene and macrophages and the production of cytokines/chemokines via TLR- and NF-κB-related signaling pathwaysZhou, Hejiang; Zhao, Kai; Li, Wei; Yang, Na; Liu, Ying; Chen, Chunying; Wei, TaotaoBiomaterials (2012), 33 (29), 6933-6942CODEN: BIMADU; ISSN:0142-9612. (Elsevier Ltd.)Graphene may have attractive properties for some biomedical applications, but its potential adverse biol. effects, in particular, possible modulation of immune responses, require further investigation. Macrophages are one of the most important effector cells of the innate immune system, and play pivotal roles in the response to graphene exposure. We have previously reported that exposure of macrophages to high concns. of graphene triggers cell death via MAPK- and TGF-related pathways. However, little is known about the influence of exposure to low concns. of graphene on the function of macrophages. In the present investigation, we demonstrate the biol. effects of sub-cytotoxic concns. of com. pristine graphene on both primary murine macrophages and immortalized macrophages. Graphene significantly stimulates the secretion of Th1/Th2 cytokines including IL-1α, IL-6, IL-10, TNF-α and GM-CSF as well as chemokines such as MCP-1, MIP-1α, MIP-1β and RANTES, probably by activating TLR-mediated and NF-κB-dependent transcription. Furthermore, these graphene-induced factors alter the morphol. of naive macrophages by remodeling their actin assembly, decreasing their ability to adhere to the extracellular matrix, and attenuating their phagocytosis. This neg. feedback of the immune response of macrophages by graphene-induced factors may play an important role in the prevention of their over-activation after graphene exposure. These findings shed light on the interaction of graphene and macrophages in vitro. Further research is needed to systematically assess the biol. responses of graphene, both to improve its safety and to contribute to the design of new biol. applications.
- 130Li, Y.; Liu, Y.; Fu, Y.; Wei, T.; Le Guyader, L.; Gao, G.; Liu, R.-S.; Chang, Y.-Z.; Chen, C. The Triggering of Apoptosis in Macrophages by Pristine Graphene through the MAPK and TGF-Beta Signaling Pathways. Biomaterials 2012, 33, 402– 411, DOI: 10.1016/j.biomaterials.2011.09.091[Crossref], [PubMed], [CAS], Google Scholar130https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3MXhsVWkt7vM&md5=d043f49c7a23e66a4460069054b64f1cThe triggering of apoptosis in macrophages by pristine graphene through the MAPK and TGF-beta signaling pathwaysLi, Yang; Liu, Ying; Fu, Yujian; Wei, Taotao; Le Guyader, Laurent; Gao, Ge; Liu, Ru-Shi; Chang, Yan-Zhong; Chen, ChunyingBiomaterials (2012), 33 (2), 402-411CODEN: BIMADU; ISSN:0142-9612. (Elsevier Ltd.)With the development of nanotechnol. and the wide use of graphene, it has become necessary to assess the potential biol. adverse effects of graphene. However, most of the recent publications are focused on various modified graphenes. We demonstrated biol. effects of com. pristine graphene in murine RAW 264.7 macrophages, which is an important effector cells of the innate immune system. We found that the pristine graphene can induce cytotoxicity through the depletion of the mitochondrial membrane potential (MMP) and the increase of intracellular reactive oxygen species (ROS), then trigger apoptosis by activation of the mitochondrial pathway. The MAPKs (JNK, ERK and p38) as well as the TGF-beta-related signaling pathways were found to be activated in the pristine grapheme-treated cells, which activated Bim and Bax, two pro-apoptotic member of Bcl-2 protein family. Consequently, the caspase 3 and its downstream effector proteins such as PARP were activated and the execution of apoptosis was initiated. This study provides an insight for the suppression of the apoptosis induced by the graphene through the mitochondrial pathways, the MAPKs- and TGF-beta-related signaling pathways.
- 131Sasidharan, A.; Panchakarla, L. S.; Sadanandan, A. R.; Ashokan, A.; Chandran, P.; Girish, C. M.; Menon, D.; Nair, S. V.; Rao, C. N. R.; Koyakutty, M. Hemocompatibility and Macrophage Response of Pristine and Functionalized Graphene. Small 2012, 8, 1251– 1263, DOI: 10.1002/smll.201102393[Crossref], [PubMed], [CAS], Google Scholar131https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC38Xitlyguro%253D&md5=d81709c5605f862dc9c9068d8b351df8Hemocompatibility and Macrophage Response of Pristine and Functionalized GrapheneSasidharan, Abhilash; Panchakarla, Leela S.; Sadanandan, Aparna R.; Ashokan, Anusha; Chandran, Parwathy; Girish, Chundayil Madathil; Menon, Deepthy; Nair, Shantikumar V.; Rao, C. N. R.; Koyakutty, ManzoorSmall (2012), 8 (8), 1251-1263CODEN: SMALBC; ISSN:1613-6810. (Wiley-VCH Verlag GmbH & Co. KGaA)Graphene and its derivs. are being proposed for several important biomedical applications including drug delivery, gene delivery, contrast imaging, and anticancer therapy. Most of these applications demand i.v. injection of graphene and hence evaluation of its hemocompatibility is an essential prerequisite. Herein, both pristine and functionalized graphene are extensively characterized for their interactions with murine macrophage RAW 264.7 cells and human primary blood components. Detailed analyses of the potential uptake by macrophages, effects on its metabolic activity, membrane integrity, induction of reactive oxygen stress, hemolysis, platelet activation, platelet aggregation, coagulation cascade, cytokine induction, immune cell activation, and immune cell suppression are performed using optimized protocols for nanotoxicity evaluation. Electron microscopy, confocal Raman spectral mapping, and confocal fluorescence imaging studies show active interaction of both the graphene systems with macrophage cells, and the reactive oxygen species mediated toxicity effects of hydrophobic pristine samples are significantly reduced by surface functionalization. In the case of hemocompatibility, both types of graphene show excellent compatibility with red blood cells, platelets, and plasma coagulation pathways, and minimal alteration in the cytokine expression by human peripheral blood mononuclear cells. Further, both samples do not cause any premature immune cell activation or suppression up to a relatively high concn. of 75 μg mL-1 after 72 h of incubation under in vitro conditions. This study clearly suggests that the obsd. toxicity effects of pristine graphene towards macrophage cells can be easily averted by surface functionalization and both the systems show excellent hemocompatibility.
- 132Figarol, A.; Pourchez, J.; Boudard, D.; Forest, V.; Akono, C.; Tulliani, J.-M.; Lecompte, J.-P.; Cottier, M.; Bernache-Assollant, D.; Grosseau, P. In Vitro Toxicity of Carbon Nanotubes, Nano-Graphite and Carbon Black, Similar Impacts of Acid Functionalization. Toxicol. In Vitro 2015, 30, 476– 485, DOI: 10.1016/j.tiv.2015.09.014
- 133Li, Y.; Yuan, H.; von dem Bussche, A.; Creighton, M.; Hurt, R. H.; Kane, A. B.; Gao, H. Graphene Microsheets Enter Cells through Spontaneous Membrane Penetration at Edge Asperities and Corner Sites. Proc. Natl. Acad. Sci. U. S. A. 2013, 110, 12295– 12300, DOI: 10.1073/pnas.1222276110[Crossref], [PubMed], [CAS], Google Scholar133https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3sXht1emu7vL&md5=6857eb72d9a20857dfd8b5f6f6c491a7Graphene microsheets enter cells through spontaneous membrane penetration at edge asperities and corner sitesLi, Yinfeng; Yuan, Hongyan; von dem Bussche, Annette; Creighton, Megan; Hurt, Robert H.; Kane, Agnes B.; Gao, HuajianProceedings of the National Academy of Sciences of the United States of America (2013), 110 (30), 12295-12300,S12295/1-S12295/11CODEN: PNASA6; ISSN:0027-8424. (National Academy of Sciences)Understanding and controlling the interaction of graphene-based materials with cell membranes is key to the development of graphene-enabled biomedical technologies and to the management of graphene health and safety issues. Very little is known about the fundamental behavior of cell membranes exposed to ultrathin 2D synthetic materials. Here we investigate the interactions of graphene and few-layer graphene (FLG) microsheets with three cell types and with model lipid bilayers by combining coarse-grained mol. dynamics (MD), all-atom MD, anal. modeling, confocal fluorescence imaging, and electron microscopic imaging. The imaging expts. show edge-first uptake and complete internalization for a range of FLG samples of 0.5- to 10-μm lateral dimension. In contrast, the simulations show large energy barriers relative to kBT for membrane penetration by model graphene or FLG microsheets of similar size. More detailed simulations resolve this paradox by showing that entry is initiated at corners or asperities that are abundant along the irregular edges of fabricated graphene materials. Local piercing by these sharp protrusions initiates membrane propagation along the extended graphene edge and thus avoids the high energy barrier calcd. in simple idealized MD simulations. We propose that this mechanism allows cellular uptake of even large multilayer sheets of micrometer-scale lateral dimension, which is consistent with our multimodal bioimaging results for primary human keratinocytes, human lung epithelial cells, and murine macrophages.
- 134Orecchioni, M.; Bedognetti, D.; Newman, L.; Fuoco, C.; Spada, F.; Hendrickx, W.; Marincola, F. M.; Sgarrella, F.; Rodrigues, A. F.; Ménard-Moyon, C.; Cesareni, G.; Kostarelos, K.; Bianco, A.; Delogu, L. G. Single-Cell Mass Cytometry and Transcriptome Profiling Reveal the Impact of Graphene on Human Immune Cells. Nat. Commun. 2017, 8, 1109, DOI: 10.1038/s41467-017-01015-3[Crossref], [PubMed], [CAS], Google Scholar134https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A280%3ADC%252BC1M7js1ymtw%253D%253D&md5=299377d4ed810826c0596ffeb3a5a8ffSingle-cell mass cytometry and transcriptome profiling reveal the impact of graphene on human immune cellsOrecchioni Marco; Sgarrella Francesco; Delogu Lucia G; Bedognetti Davide; Hendrickx Wouter; Newman Leon; Rodrigues Artur Filipe; Kostarelos Kostas; Fuoco Claudia; Spada Filomena; Cesareni Gianni; Marincola Francesco M; Marincola Francesco M; Menard-Moyon Cecilia; Bianco Alberto; Delogu Lucia GNature communications (2017), 8 (1), 1109 ISSN:.Understanding the biomolecular interactions between graphene and human immune cells is a prerequisite for its utilization as a diagnostic or therapeutic tool. To characterize the complex interactions between graphene and immune cells, we propose an integrative analytical pipeline encompassing the evaluation of molecular and cellular parameters. Herein, we use single-cell mass cytometry to dissect the effects of graphene oxide (GO) and GO functionalized with amino groups (GONH2) on 15 immune cell populations, interrogating 30 markers at the single-cell level. Next, the integration of single-cell mass cytometry with genome-wide transcriptome analysis shows that the amine groups reduce the perturbations caused by GO on cell metabolism and increase biocompatibility. Moreover, GONH2 polarizes T-cell and monocyte activation toward a T helper-1/M1 immune response. This study describes an innovative approach for the analysis of the effects of nanomaterials on distinct immune cells, laying the foundation for the incorporation of single-cell mass cytometry on the experimental pipeline.
- 135Kotchey, G. P.; Allen, B. L.; Vedala, H.; Yanamala, N.; Kapralov, A. A.; Tyurina, Y. Y.; Klein-Seetharaman, J.; Kagan, V. E.; Star, A. The Enzymatic Oxidation of Graphene Oxide. ACS Nano 2011, 5, 2098– 2108, DOI: 10.1021/nn103265h[ACS Full Text
 ], [CAS], Google Scholar135https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3MXisVWlt7Y%253D&md5=99e0e84eec84028f107b63619527e1ebThe Enzymatic Oxidation of Graphene OxideKotchey, Gregg P.; Allen, Brett L.; Vedala, Harindra; Yanamala, Naveena; Kapralov, Alexander A.; Tyurina, Yulia Y.; Klein-Seetharaman, Judith; Kagan, Valerian E.; Star, AlexanderACS Nano (2011), 5 (3), 2098-2108CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)Two-dimensional graphitic carbon is a new material with many emerging applications, and studying its chem. properties is an important goal. Here, the authors reported a new phenomenon - the enzymic oxidn. of a single layer of graphitic carbon by horseradish peroxidase (HRP). In the presence of low concns. of hydrogen peroxide (∼40 μM), HRP catalyzed the oxidn. of graphene oxide, which resulted in the formation of holes on its basal plane. During the same period of anal., HRP failed to oxidize chem. reduced graphene oxide (RGO). The enzymic oxidn. was characterized by Raman, UV-visible, ESR, Fourier transform IR spectroscopy, TEM, at. force microscopy, SDS-PAGE, and gas chromatog.-mass spectrometry. Computational docking studies indicated that HRP was preferentially bound to the basal plane rather than the edge for both graphene oxide and RGO. Owing to the more dynamic nature of HRP on graphene oxide, the heme active site of HRP was in closer proximity to graphene oxide compared to RGO, thereby facilitating the oxidn. of the basal plane of graphene oxide. The authors also studied the electronic properties of the reduced intermediate product, holey reduced graphene oxide (hRGO), using field-effect transistor (FET) measurements. While RGO exhibited a V-shaped transfer characteristic similar to a single layer of graphene that was attributed to its zero band gap, hRGO demonstrated a p-type semiconducting behavior with a pos. shift in the Dirac points. This p-type behavior rendered hRGO, which can be conceptualized as interconnected graphene nanoribbons, as a potentially attractive material for FET sensors.
], [CAS], Google Scholar135https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3MXisVWlt7Y%253D&md5=99e0e84eec84028f107b63619527e1ebThe Enzymatic Oxidation of Graphene OxideKotchey, Gregg P.; Allen, Brett L.; Vedala, Harindra; Yanamala, Naveena; Kapralov, Alexander A.; Tyurina, Yulia Y.; Klein-Seetharaman, Judith; Kagan, Valerian E.; Star, AlexanderACS Nano (2011), 5 (3), 2098-2108CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)Two-dimensional graphitic carbon is a new material with many emerging applications, and studying its chem. properties is an important goal. Here, the authors reported a new phenomenon - the enzymic oxidn. of a single layer of graphitic carbon by horseradish peroxidase (HRP). In the presence of low concns. of hydrogen peroxide (∼40 μM), HRP catalyzed the oxidn. of graphene oxide, which resulted in the formation of holes on its basal plane. During the same period of anal., HRP failed to oxidize chem. reduced graphene oxide (RGO). The enzymic oxidn. was characterized by Raman, UV-visible, ESR, Fourier transform IR spectroscopy, TEM, at. force microscopy, SDS-PAGE, and gas chromatog.-mass spectrometry. Computational docking studies indicated that HRP was preferentially bound to the basal plane rather than the edge for both graphene oxide and RGO. Owing to the more dynamic nature of HRP on graphene oxide, the heme active site of HRP was in closer proximity to graphene oxide compared to RGO, thereby facilitating the oxidn. of the basal plane of graphene oxide. The authors also studied the electronic properties of the reduced intermediate product, holey reduced graphene oxide (hRGO), using field-effect transistor (FET) measurements. While RGO exhibited a V-shaped transfer characteristic similar to a single layer of graphene that was attributed to its zero band gap, hRGO demonstrated a p-type semiconducting behavior with a pos. shift in the Dirac points. This p-type behavior rendered hRGO, which can be conceptualized as interconnected graphene nanoribbons, as a potentially attractive material for FET sensors. - 136Zhang, C.; Chen, S.; Alvarez, P. J. J.; Chen, W. Reduced Graphene Oxide Enhances Horseradish Peroxidase Stability by Serving as Radical Scavenger and Redox Mediator. Carbon 2015, 94, 531– 538, DOI: 10.1016/j.carbon.2015.07.036[Crossref], [CAS], Google Scholar136https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2MXhtFyltLfM&md5=c5ecfa8a3062270d83a1fd3a38772336Reduced graphene oxide enhances horseradish peroxidase stability by serving as radical scavenger and redox mediatorZhang, Chengdong; Chen, Silong; Alvarez, Pedro J. J.; Chen, WeiCarbon (2015), 94 (), 531-538CODEN: CRBNAH; ISSN:0008-6223. (Elsevier Ltd.)Graphene-based nanomaterials have been widely studied as high-performance matrixes for enzyme immobilization and in the development of biosensors. Surface O-functionalities of graphene induce changes in chem. reactivity and electronic cond. of nanomaterials and may interfere with enzymic processes; however, the mechanisms are not fully understood. We compare the effects of three com. available graphene-based nanomaterials, namely a graphene, a graphene oxide (GO), and a reduced graphene oxide (RGO), on the activity/stability of horseradish peroxidase (HRP). Both graphene and GO significantly reduced enzyme stability by altering enzyme conformation, which was evidenced by CD spectroscopy. However, RGO improved enzyme stability up to 7-fold. This increased stability was attributed to the capability of RGO to quench superoxide radicals, which were primarily responsible for the enzyme deactivation. The basal plane of RGO, mainly through quinone moieties, may act as a redox mediator to facilitate enzymic turnover. Overall, the radical scavenging plus redox mediating capabilities of RGO suggest the potential for graphene-based nanomaterials to enhance enzyme engineering and enzyme-based sensors.
- 137Li, Y.; Feng, L.; Shi, X.; Wang, X.; Yang, Y.; Yang, K.; Liu, T.; Yang, G.; Liu, Z. Surface Coating-Dependent Cytotoxicity and Degradation of Graphene Derivatives: Towards the Design of Non-Toxic, Degradable Nano-Graphene. Small 2014, 10, 1544– 1554, DOI: 10.1002/smll.201303234[Crossref], [PubMed], [CAS], Google Scholar137https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3sXhvFOltLnN&md5=7d957ec738cb14bc2ed86811109ec653Surface Coating-Dependent Cytotoxicity and Degradation of Graphene Derivatives: Towards the Design of Non-Toxic, Degradable Nano-GrapheneLi, Yingjie; Feng, Liangzhu; Shi, Xiaoze; Wang, Xiaojing; Yang, Yinlong; Yang, Kai; Liu, Teng; Yang, Guangbao; Liu, ZhuangSmall (2014), 10 (8), 1544-1554CODEN: SMALBC; ISSN:1613-6810. (Wiley-VCH Verlag GmbH & Co. KGaA)With the increasing interests of using graphene and its derivs. in the area of biomedicine, the systematic evaluation of their potential risks and impacts to biol. systems is becoming critically important. In this work, we carefully study how surface coatings affect the cytotoxicity and extracellular biodegrdn. behaviors of graphene oxide (GO) and its derivs. Although naked GO could induce significant toxicity to macrophages, coating those two-dimensional nanomaterials with biocompatible macromols. such as polyethylene glycol (PEG) or bovine serum albumin (BSA) could greatly attenuate their toxicity, as independently evidenced by several different assay approaches. On the other hand, although GO can be gradually degraded through enzyme induced oxidization by horseradish peroxidase (HRP), both PEG and BSA coated GO or reduced GO (RGO) are rather resistant to HRP-induced biodegrdn. In order to obtain biocompatible functionalized GO that can still undergo enzymic degrdn., we conjugate PEG to GO via a cleavable disulfide bond, obtaining GO-SS-PEG with negligible toxicity and considerable degradability, promising for further biomedical applications.
- 138Kurapati, R.; Bonachera, F.; Russier, J.; Sureshbabu, A. R.; Ménard-Moyon, C.; Kostarelos, K.; Bianco, A. Covalent Chemical Functionalization Enhances the Biodegradation of Graphene Oxide. 2D Mater. 2018, 5, 015020, DOI: 10.1088/2053-1583/aa8f0a[Crossref], [CAS], Google Scholar138https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC1cXitlWkt7%252FM&md5=e499146a8790edc41f74dc075063f871Covalent chemical functionalization enhances the biodegradation of graphene oxideKurapati, Rajendra; Bonachera, Fanny; Russier, Julie; Sureshbabu, Adukamparai Rajukrishnan; Menard-Moyon, Cecilia; Kostarelos, Kostas; Bianco, Alberto2D Materials (2018), 5 (1), 015020/1-015020/11CODEN: DMATB7; ISSN:2053-1583. (IOP Publishing Ltd.)Biodegrdn. of the graphene-based materials is an emerging issue due to their estd. widespread usage in different industries. Indeed, a few concerns have been raised about their biopersistence. Here, we propose the design of surface-functionalized graphene oxide (GO) with the capacity to degrade more effectively compared to unmodified GO using horseradish peroxidase (HRP). For this purpose, we have functionalized the surface of GO with two well-known substrates of HRP namely coumarin and catechol. The biodegrdn. of all conjugates has been followed by Raman, dynamic light scattering and electron microscopy. Mol. docking and gel electrophoresis have been carried out to gain more insights into the interaction between GO conjugates and HRP. Our studies have revealed better binding when GO is functionalized with coumarin or catechol compared to control GOs. All results prove that GO functionalized with coumarin and catechol moieties display a faster and more efficient biodegrdn. over GO.
- 139Kurapati, R.; Russier, J.; Squillaci, M. A.; Treossi, E.; Ménard-Moyon, C.; Del Rio-Castillo, A. E.; Vazquez, E.; Samorì, P.; Palermo, V.; Bianco, A. Dispersibility-Dependent Biodegradation of Graphene Oxide by Myeloperoxidase. Small 2015, 11, 3985– 3994, DOI: 10.1002/smll.201500038[Crossref], [PubMed], [CAS], Google Scholar139https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2MXotVClu7o%253D&md5=6b1d363a023e256809fe95e39f42a2c8Dispersibility-dependent biodegradation of graphene oxide by myeloperoxidaseKurapati, Rajendra; Russier, Julie; Squillaci, Marco A.; Treossi, Emanuele; Menard-Moyon, Cecilia; Del Rio-Castillo, Antonio Esau; Vazquez, Ester; Samori, Paolo; Palermo, Vincenzo; Bianco, AlbertoSmall (2015), 11 (32), 3985-3994CODEN: SMALBC; ISSN:1613-6810. (Wiley-VCH Verlag GmbH & Co. KGaA)Understanding human health risks assocd. with the rapidly emerging graphene-based nanomaterials represents a great challenge because of the diversity of applications and the wide range of possible ways of exposure to this type of materials. Here, the biodegrdn. of graphene oxide (GO) sheets is reported by using myeloperoxidase (hMPO) derived from human neutrophils in the presence of a low concn. of H2O2. The degrdn. capability of the enzyme on 3 different GO samples contg. different degrees of oxidn. on their graphenic lattice, leading to a variable dispersibility in aq. media was compared; hMPO failed in degrading the most aggregated GO, but succeeded to completely metabolize highly dispersed GO samples. Spectroscopic and microscopic analyses provided unambiguous evidence for key roles played by hydrophilicity, neg. surface charge, and colloidal stability of the aq. GO in their biodegrdn. by hMPO.
- 140Mukherjee, S. P.; Gliga, A. R.; Lazzaretto, B.; Brandner, B.; Fielden, M.; Vogt, C.; Newman, L.; Rodrigues, A. F.; Shao, W.; Fournier, P. M.; Toprak, M. S.; Star, A.; Kostarelos, K.; Bhattacharya, K.; Fadeel, B. Graphene Oxide Is Degraded by Neutrophils and the Degradation Products Are Non-Genotoxic. Nanoscale 2018, 10, 1180– 1188, DOI: 10.1039/C7NR03552G[Crossref], [PubMed], [CAS], Google Scholar140https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2sXhvFyrs7nO&md5=c737f5199827451234cf2e958d6d7232Graphene oxide is degraded by neutrophils and the degradation products are non-genotoxicMukherjee, Sourav P.; Gliga, Anda R.; Lazzaretto, Beatrice; Brandner, Birgit; Fielden, Matthew; Vogt, Carmen; Newman, Leon; Rodrigues, Artur F.; Shao, Wenting; Fournier, Philip M.; Toprak, Muhammet S.; Star, Alexander; Kostarelos, Kostas; Bhattacharya, Kunal; Fadeel, BengtNanoscale (2018), 10 (3), 1180-1188CODEN: NANOHL; ISSN:2040-3372. (Royal Society of Chemistry)Neutrophils were previously shown to digest oxidized carbon nanotubes through a myeloperoxidase (MPO)-dependent mechanism, and graphene oxide (GO) was found to undergo degrdn. when incubated with purified MPO, but there are no studies to date showing degrdn. of GO by neutrophils. Here we produced endotoxin-free GO by a modified Hummers' method and asked whether primary human neutrophils stimulated to produce neutrophil extracellular traps or activated to undergo degranulation are capable of digesting GO. Biodegrdn. was assessed using a range of techniques including Raman spectroscopy, transmission electron microscopy, at. force microscopy, and mass spectrometry. GO sheets of differing lateral dimensions were effectively degraded by neutrophils. As the degrdn. products could have toxicol. implications, we also evaluated the impact of degraded GO on the bronchial epithelial cell line BEAS-2B. MPO-degraded GO was found to be non-cytotoxic and did not elicit any DNA damage. Taken together, these studies have shown that neutrophils can digest GO and that the biodegraded GO is non-toxic for human lung cells.
- 141Shvedova, A. A.; Kapralov, A. A.; Feng, W. H.; Kisin, E. R.; Murray, A. R.; Mercer, R. R.; St. Croix, C. M.; Lang, M. A.; Watkins, S. C.; Konduru, N. V.; Allen, B. L.; Conroy, J.; Kotchey, G. P.; Mohamed, B. M.; Meade, A. D.; Volkov, Y.; Star, A.; Fadeel, B.; Kagan, V. E. Impaired Clearance and Enhanced Pulmonary Inflammatory/Fibrotic Response to Carbon Nanotubes in Myeloperoxidase-Deficient Mice. PLoS One 2012, 7, e30923, DOI: 10.1371/journal.pone.0030923
- 142Kagan, V. E.; Kapralov, A. A.; St. Croix, C. M.; Watkins, S. C.; Kisin, E. R.; Kotchey, G. P.; Balasubramanian, K.; Vlasova, I. I.; Yu, J.; Kim, K.; Seo, W.; Mallampalli, R. K.; Star, A.; Shvedova, A. A. Lung Macrophages “Digest” Carbon Nanotubes Using a Superoxide/Peroxynitrite Oxidative Pathway. ACS Nano 2014, 8, 5610– 5621, DOI: 10.1021/nn406484b[ACS Full Text
 ], [CAS], Google Scholar142https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2cXosl2qs7Y%253D&md5=f943617b9d6ca76eb4c627b5764a3381Lung Macrophages "Digest" Carbon Nanotubes Using a Superoxide/Peroxynitrite Oxidative PathwayKagan, Valerian E.; Kapralov, Alexandr A.; St. Croix, Claudette M.; Watkins, Simon C.; Kisin, Elena R.; Kotchey, Gregg P.; Balasubramanian, Krishnakumar; Vlasova, Irina I.; Yu, Jaesok; Kim, Kang; Seo, Wanji; Mallampalli, Rama K.; Star, Alexander; Shvedova, Anna A.ACS Nano (2014), 8 (6), 5610-5621CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)In contrast to short-lived neutrophils, macrophages display persistent presence in the lung of animals after pulmonary exposure to carbon nanotubes. While effective in the clearance of bacterial pathogens and injured host cells, the ability of macrophages to "digest" carbonaceous nanoparticles has not been documented. Here, the authors used chem., biochem., and cell and animal models and demonstrated oxidative biodegrdn. of oxidatively functionalized single-walled carbon nanotubes via superoxide/NO* → peroxynitrite-driven oxidative pathways of activated macrophages facilitating clearance of nanoparticles from the lung.
], [CAS], Google Scholar142https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2cXosl2qs7Y%253D&md5=f943617b9d6ca76eb4c627b5764a3381Lung Macrophages "Digest" Carbon Nanotubes Using a Superoxide/Peroxynitrite Oxidative PathwayKagan, Valerian E.; Kapralov, Alexandr A.; St. Croix, Claudette M.; Watkins, Simon C.; Kisin, Elena R.; Kotchey, Gregg P.; Balasubramanian, Krishnakumar; Vlasova, Irina I.; Yu, Jaesok; Kim, Kang; Seo, Wanji; Mallampalli, Rama K.; Star, Alexander; Shvedova, Anna A.ACS Nano (2014), 8 (6), 5610-5621CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)In contrast to short-lived neutrophils, macrophages display persistent presence in the lung of animals after pulmonary exposure to carbon nanotubes. While effective in the clearance of bacterial pathogens and injured host cells, the ability of macrophages to "digest" carbonaceous nanoparticles has not been documented. Here, the authors used chem., biochem., and cell and animal models and demonstrated oxidative biodegrdn. of oxidatively functionalized single-walled carbon nanotubes via superoxide/NO* → peroxynitrite-driven oxidative pathways of activated macrophages facilitating clearance of nanoparticles from the lung. - 143Elgrabli, D.; Dachraoui, W.; Ménard-Moyon, C.; Liu, X. J.; Bégin, D.; Bégin-Colin, S.; Bianco, A.; Gazeau, F.; Alloyeau, D. Carbon Nanotube Degradation in Macrophages: Live Nanoscale Monitoring and Understanding of Biological Pathway. ACS Nano 2015, 9, 10113– 10124, DOI: 10.1021/acsnano.5b03708[ACS Full Text
 ], [CAS], Google Scholar143https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2MXhsVeqtr3J&md5=67ee157e24a3b4316d8058fbbb344c8eCarbon Nanotube Degradation in Macrophages: Live Nanoscale Monitoring and Understanding of Biological PathwayElgrabli, Dan; Dachraoui, Walid; Menard-Moyon, Cecilia; Liu, Xiao Jie; Begin, Dominique; Begin-Colin, Sylvie; Bianco, Alberto; Gazeau, Florence; Alloyeau, DamienACS Nano (2015), 9 (10), 10113-10124CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)Despite numerous applications, the cellular-clearance mechanism of multiwalled carbon nanotubes (MWCNTs) has not been clearly established yet. Previous in vitro studies showed the ability of oxidative enzymes to induce nanotube degrdn. Interestingly, these enzymes have the common capacity to produce reactive oxygen species (ROS). Here, we combined material and life science approaches for revealing an intracellular way taken by macrophages to degrade carbon nanotubes. We report the in situ monitoring of ROS-mediated MWCNT degrdn. by liq.-cell transmission electron microscopy. Two degrdn. mechanisms induced by hydroxyl radicals were extd. from these unseen dynamic nanoscale investigations: a non-site-specific thinning process of the walls and a site-specific transversal drilling process on pre-existing defects of nanotubes. Remarkably, similar ROS-induced structural injuries were obsd. on MWCNTs after aging into macrophages from 1 to 7 days. Beside unraveling oxidative transformations of MWCNT structure, we elucidated an important, albeit not exclusive, biol. pathway for MWCNT degrdn. in macrophages, involving NOX2 complex activation, superoxide prodn., and hydroxyl radical attack, which highlights the crit. role of oxidative stress in cellular processing of MWCNTs.
], [CAS], Google Scholar143https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2MXhsVeqtr3J&md5=67ee157e24a3b4316d8058fbbb344c8eCarbon Nanotube Degradation in Macrophages: Live Nanoscale Monitoring and Understanding of Biological PathwayElgrabli, Dan; Dachraoui, Walid; Menard-Moyon, Cecilia; Liu, Xiao Jie; Begin, Dominique; Begin-Colin, Sylvie; Bianco, Alberto; Gazeau, Florence; Alloyeau, DamienACS Nano (2015), 9 (10), 10113-10124CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)Despite numerous applications, the cellular-clearance mechanism of multiwalled carbon nanotubes (MWCNTs) has not been clearly established yet. Previous in vitro studies showed the ability of oxidative enzymes to induce nanotube degrdn. Interestingly, these enzymes have the common capacity to produce reactive oxygen species (ROS). Here, we combined material and life science approaches for revealing an intracellular way taken by macrophages to degrade carbon nanotubes. We report the in situ monitoring of ROS-mediated MWCNT degrdn. by liq.-cell transmission electron microscopy. Two degrdn. mechanisms induced by hydroxyl radicals were extd. from these unseen dynamic nanoscale investigations: a non-site-specific thinning process of the walls and a site-specific transversal drilling process on pre-existing defects of nanotubes. Remarkably, similar ROS-induced structural injuries were obsd. on MWCNTs after aging into macrophages from 1 to 7 days. Beside unraveling oxidative transformations of MWCNT structure, we elucidated an important, albeit not exclusive, biol. pathway for MWCNT degrdn. in macrophages, involving NOX2 complex activation, superoxide prodn., and hydroxyl radical attack, which highlights the crit. role of oxidative stress in cellular processing of MWCNTs. - 144Bai, H.; Jiang, W.; Kotchey, G. P.; Saidi, W. A.; Bythell, B. J.; Jarvis, J. M.; Marshall, A. G.; Robinson, R. A. S.; Star, A. Insight into the Mechanism of Graphene Oxide Degradation via the Photo-Fenton Reaction. J. Phys. Chem. C 2014, 118, 10519– 10529, DOI: 10.1021/jp503413s[ACS Full Text
 ], [CAS], Google Scholar144https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2cXmtVOnurs%253D&md5=98f13a2dbe6bc472a9910b159ef2560bInsight into the Mechanism of Graphene Oxide Degradation via the Photo-Fenton ReactionBai, Hao; Jiang, Wentao; Kotchey, Gregg P.; Saidi, Wissam A.; Bythell, Benjamin J.; Jarvis, Jacqueline M.; Marshall, Alan G.; Robinson, Rena A. S.; Star, AlexanderJournal of Physical Chemistry C (2014), 118 (19), 10519-10529CODEN: JPCCCK; ISSN:1932-7447. (American Chemical Society)Graphene is an attractive 2-dimensional C-based nanomaterial with great promise for applications including electronics, batteries, sensors, and composite materials. Recent work demonstrated C-based nanomaterials are degradable/biodegradable, but little work has been done to identify products formed during the degrdn. process. Since these products may have toxicol. implications and could leach into the environment or the human body, insights into mechanisms and structural elucidation remain important as C-based nanomaterials become commercialized. This work provided insight into a potential graphene oxide degrdn. mechanism via the photo-Fenton reaction. After 1 day of treatment, intermediate oxidn. products (150-1000 Da mol. wt.) were generated. Upon longer reaction times (i.e., days 2 and 3), these products were no longer present in high abundance, and the system was dominated by graphene quantum dots. Based on Fourier transform IR and mass spectrometry and NMR data, potential structures for these oxidn. products, which consist of oxidized polycyclic arom. hydrocarbons, are proposed.
], [CAS], Google Scholar144https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2cXmtVOnurs%253D&md5=98f13a2dbe6bc472a9910b159ef2560bInsight into the Mechanism of Graphene Oxide Degradation via the Photo-Fenton ReactionBai, Hao; Jiang, Wentao; Kotchey, Gregg P.; Saidi, Wissam A.; Bythell, Benjamin J.; Jarvis, Jacqueline M.; Marshall, Alan G.; Robinson, Rena A. S.; Star, AlexanderJournal of Physical Chemistry C (2014), 118 (19), 10519-10529CODEN: JPCCCK; ISSN:1932-7447. (American Chemical Society)Graphene is an attractive 2-dimensional C-based nanomaterial with great promise for applications including electronics, batteries, sensors, and composite materials. Recent work demonstrated C-based nanomaterials are degradable/biodegradable, but little work has been done to identify products formed during the degrdn. process. Since these products may have toxicol. implications and could leach into the environment or the human body, insights into mechanisms and structural elucidation remain important as C-based nanomaterials become commercialized. This work provided insight into a potential graphene oxide degrdn. mechanism via the photo-Fenton reaction. After 1 day of treatment, intermediate oxidn. products (150-1000 Da mol. wt.) were generated. Upon longer reaction times (i.e., days 2 and 3), these products were no longer present in high abundance, and the system was dominated by graphene quantum dots. Based on Fourier transform IR and mass spectrometry and NMR data, potential structures for these oxidn. products, which consist of oxidized polycyclic arom. hydrocarbons, are proposed. - 145Newman, L.; Lozano, N.; Zhang, M.; Iijima, S.; Yudasaka, M.; Bussy, C.; Kostarelos, K. Hypochlorite Degrades 2D Graphene Oxide Sheets Faster than 1D Oxidised Carbon Nanotubes and Nanohorns. npj 2D Mater Appl. 2017, 1, 39, DOI: 10.1038/s41699-017-0041-3
- 146Lalwani, G.; Xing, W.; Sitharaman, B. Enzymatic Degradation of Oxidized and Reduced Graphene Nanoribbons by Lignin Peroxidase. J. Mater. Chem. B 2014, 2, 6354– 6362, DOI: 10.1039/C4TB00976B[Crossref], [PubMed], [CAS], Google Scholar146https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2cXhtFyrs77I&md5=6111edbe822d119e291abad2aa2f99cfEnzymatic degradation of oxidized and reduced graphene nanoribbons by lignin peroxidaseLalwani, Gaurav; Xing, Weiliang; Sitharaman, BalajiJournal of Materials Chemistry B: Materials for Biology and Medicine (2014), 2 (37), 6354-6362CODEN: JMCBDV; ISSN:2050-7518. (Royal Society of Chemistry)The widespread use of graphene for various industrial and biomedical applications requires efficient remediation strategies during its disposal into waste streams. In addn., the interactions of graphene with the biota need thorough evaluation. In this study, we investigated the interactions of oxidized and reduced graphene oxide nanoribbons (GONRs and rGONRs) with lignin peroxidase (LiP), a ligninolytic enzyme released from white rot fungus. GONRs and rGONRs were treated with LiP in the presence and absence of veratryl alc. (VA; an electron transfer mediator and secondary metabolite of white rot fungi). Transmission electron microscopy showed the formation of large defects (holes) in the graphene sheet, which increased in diam. with increased degrdn. time. Raman spectroscopic anal. indicated that, within 96 h, in the presence of hydrogen peroxide and VA, the GONRs and rGONRs were completely and partially degraded by LiP, resp. Comparisons between groups with or without VA showed that degrdn. of GONRs was accelerated in the presence of VA. These results indicated that LiP could efficiently degrade GONRs and rGONRs in the presence of VA, suggesting that VA may be an essential factor needed to degrade rGONRs via LiP treatment. Thus, the wide presence of white rot fungi, and thereby LiP, in nature, could lead to efficient degrdn. of graphene present in the environment. Addnl., LiP, which has a higher theor. redox potential compared to horseradish peroxidases and myeloperoxidases, could be a better candidate for the environmental remediation of graphene.
- 147Liu, L.; Zhu, C.; Fan, M.; Chen, C.; Huang, Y.; Hao, Q.; Yang, J.; Wang, H.; Sun, D. Oxidation and Degradation of Graphitic Materials by Naphthalene-Degrading Bacteria. Nanoscale 2015, 7, 13619– 13628, DOI: 10.1039/C5NR02502H[Crossref], [PubMed], [CAS], Google Scholar147https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2MXhtFKisbnI&md5=d6a4b30177a9d6511df8c2f433a8ce49Oxidation and degradation of graphitic materials by naphthalene-degrading bacteriaLiu, Lin; Zhu, Chunlin; Fan, Mengmeng; Chen, Chuntao; Huang, Yang; Hao, Qingli; Yang, Jiazhi; Wang, Haiyan; Sun, DongpingNanoscale (2015), 7 (32), 13619-13628CODEN: NANOHL; ISSN:2040-3372. (Royal Society of Chemistry)Nowadays, biol. oxidizing graphitic materials is of great importance for practical applications as an eco-friendly and low-cost method. In this work, a bacterial strain is isolated from the contaminated soil in a graphite mine and its ability to oxidize graphite, graphene oxide (GO) and reduced graphene oxide (RGO) is confirmed. After being cultivated with bacteria, graphite is inhomogeneously oxidized, and moreover oxidized sheets exfoliated from graphite are detected in the medium. RGO shows a higher degree of oxidn. compared to graphite owing to more original defects, while GO breaks into small pieces and becomes full of holes. Both the holes in GO and the exfoliated sheets from graphite caused by bacteria have a size of below 1 μm, in agreement with the size of bacterial cells. Besides, the preliminary mechanism of the bacterial oxidn. is explored, suggesting that the contact between bacterial cells and materials promotes the oxidn. of graphitic materials. The ability of naphthalene-degrading bacteria to oxidize and degrade the graphitic materials shows the potential for producing GO in an eco-friendly way and degrading carbon nanomaterials in the environment.
- 148Zhang, Y.; Bai, Y.; Jia, J.; Gao, N.; Li, Y.; Zhang, R.; Jiang, G.; Yan, B. Perturbation of Physiological Systems by Nanoparticles. Chem. Soc. Rev. 2014, 43, 3762– 3809, DOI: 10.1039/C3CS60338E[Crossref], [PubMed], [CAS], Google Scholar148https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2cXmvFGhsbs%253D&md5=c4b0cd1141e0e945bda5e9e75c06a9cfPerturbation of physiological systems by nanoparticlesZhang, Yi; Bai, Yuhong; Jia, Jianbo; Gao, Ningning; Li, Yang; Zhang, Ruinan; Jiang, Guibin; Yan, BingChemical Society Reviews (2014), 43 (10), 3762-3809CODEN: CSRVBR; ISSN:0306-0012. (Royal Society of Chemistry)A review. Nanotechnol. is having a tremendous impact on our society. However, societal concerns about human safety under nanoparticle exposure may derail the broad application of this promising technol. Nanoparticles may enter the human body via various routes, including respiratory pathways, the digestive tract, skin contact, i.v. injection, and implantation. After absorption, nanoparticles are carried to distal organs by the bloodstream and the lymphatic system. During this process, they interact with biol. mols. and perturb physiol. systems. Although some ingested or absorbed nanoparticles are eliminated, others remain in the body for a long time. The human body is composed of multiple systems that work together to maintain physiol. homeostasis. The unexpected invasion of these systems by nanoparticles disturbs normal cell signaling, impairs cell and organ functions, and may even cause pathol. disorders. This review examines the comprehensive health risks of exposure to nanoparticles by discussing how nanoparticles perturb various physiol. systems as revealed by animal studies. The potential toxicity of nanoparticles to each physiol. system and the implications of disrupting the balance among systems are emphasized.
- 149Pelin, M.; Sosa, S.; Prato, M.; Tubaro, A. Occupational Exposure to Graphene Based Nanomaterials: Risk Assessment. Nanoscale 2018, 10, 15894– 15903, DOI: 10.1039/C8NR04950E[Crossref], [PubMed], [CAS], Google Scholar149https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC1cXhsFGlsbrL&md5=8668ab0056194ca6f5d304f622734bdfOccupational exposure to graphene based nanomaterials: risk assessmentPelin, Marco; Sosa, Silvio; Prato, Maurizio; Tubaro, AureliaNanoscale (2018), 10 (34), 15894-15903CODEN: NANOHL; ISSN:2040-3372. (Royal Society of Chemistry)Graphene-based materials (GBMs) are a family of novel materials including graphene, few layer graphene (FLG), graphene oxide (GO), reduced graphene oxide (rGO) and graphene nanoplatelets (GNP). Currently, the risk posed by them to human health is assocd. mainly with the occupational exposure during their industrial and small-scale prodn. or waste discharge. The most significant occupational exposure routes are inhalation, oral, cutaneous and ocular, inhalation being the majorly involved and most studied one. This manuscript presents a crit. up-to-date review of the available in vivo toxicity data of the most significant GBMs, after using these exposure routes. The few in vivo inhalation toxicity studies (limited to 5-days of repeated exposure and only one to 5 days per wk for 4 wk) indicate inflammatory/fibrotic effects at the pulmonary level, not always reversible after 14/90 days. More limited in vivo data are available for the oral and ocular exposure routes, whereas the studies on cutaneous toxicity are at the initial stage. A long persistence of GBMs in rodents is recorded, while contradictory genotoxic data are reported. Data gap identification is also provided. Based on the available data, the occupational exposure limit cannot be detd. More exptl. toxicity studies according to specific guidelines (tentatively validated for nanomaterials) and more information on the actual occupational exposure level to GBMs are needed. Furthermore, ADME (Absorption, Distribution, Metab., Excretion), genotoxicity, developmental and reproductive toxicity data related to the occupational exposure to GBMs have to be implemented. In addn., sub-chronic and/or chronic studies are still needed to completely exclude other toxic effects and/or carcinogenicity.
- 150Kenry, K.; Loh, K. P.; Lim, C. T. Molecular Interactions of Graphene Oxide with Human Blood Plasma Proteins. Nanoscale 2016, 8, 9425– 9441, DOI: 10.1039/C6NR01697A[Crossref], [PubMed], [CAS], Google Scholar150https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC28XltFGrt7s%253D&md5=77c10834b8e0a8277dac39f6c317a2b4Molecular interactions of graphene oxide with human blood plasma proteinsKenry; Loh, Kian Ping; Lim, Chwee TeckNanoscale (2016), 8 (17), 9425-9441CODEN: NANOHL; ISSN:2040-3372. (Royal Society of Chemistry)We investigate the mol. interactions between graphene oxide (GO) and human blood plasma proteins. To gain an insight into the bio-physico-chem. activity of GO in biol. and biomedical applications, we performed a series of biophys. assays to quantify the mol. interactions between GO with different lateral size distributions and the three essential human blood plasma proteins. We elucidate the various aspects of the GO-protein interactions, particularly, the adsorption, binding kinetics and equil., and conformational stability, through detn. of quant. parameters, such as GO-protein assocn. consts., binding cooperativity, and the binding-driven protein structural changes. We demonstrate that the mol. interactions between GO and plasma proteins are significantly dependent on the lateral size distribution and mean lateral sizes of the GO nanosheets and their subtle variations may markedly influence the GO-protein interactions. Consequently, we propose the existence of size-dependent mol. interactions between GO nanosheets and plasma proteins, and importantly, the presence of specific crit. mean lateral sizes of GO nanosheets in achieving very high assocn. and fluorescence quenching efficiency of the plasma proteins. We anticipate that this work will provide a basis for the design of graphene-based and other related nanomaterials for a plethora of biol. and biomedical applications.
- 151Mondal, S.; Thirupathi, R.; Rao, L. P.; Atreya, H. S. Unraveling the Dynamic Nature of Protein–graphene Oxide Interactions. RSC Adv. 2016, 6, 52539– 52548, DOI: 10.1039/C6RA03759C[Crossref], [CAS], Google Scholar151https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC28Xoslajsb0%253D&md5=67b77fd9e7b7d0c08ba5c3f321b4813dUnraveling the dynamic nature of protein-graphene oxide interactionsMondal, Somnath; Thirupathi, Ravula; Rao, Lokeswara P.; Atreya, Hanudatta S.RSC Advances (2016), 6 (58), 52539-52548CODEN: RSCACL; ISSN:2046-2069. (Royal Society of Chemistry)In recent years, Graphene Oxide (GO) and its derivs. have attracted significant attention owing to their unique physicochem., optical and conductive properties and have been used in a diverse range of applications. One of the properties of GO, which is important for its applications in biol. systems, is the nature of its interactions with biomols. such as proteins. We present here the dynamic aspects of the interaction of GO with human ubiquitin (8.6 kDa) unraveled using NMR (NMR) spectroscopy. This study, for the first time, reveals an interaction involving fast and reversible assocn.-dissocn. of the protein mols. from the surface of the GO sheet. The conformation of the protein is not affected due to the interactions. The interactions were found to be electrostatic in nature and are attributed to the polar functional groups present on the protein and GO sheets, which was verified by titrn. of GO with ubiquitin at different pH. Taken together, the study provides new insights into protein-GO interactions, and the NMR methods described will be of utility for probing such interactions in general while designing new chem. and biol. applications involving functionalized graphene oxide.
- 152Eedy, D. J. Carbon-Fibre-Induced Airborne Irritant Contact Dermatitis. Contact Dermatitis 1996, 35, 362– 363, DOI: 10.1111/j.1600-0536.1996.tb02418.x
- 153Shvedova, A.; Castranova, V.; Kisin, E.; Schwegler-Berry, D.; Murray, A.; Gandelsman, V.; Maynard, A.; Baron, P. Exposure to Carbon Nanotube Material: Assessment of Nanotube Cytotoxicity Using Human Keratinocyte Cells. J. Toxicol. Environ. Health, Part A 2003, 66, 1909– 1926, DOI: 10.1080/713853956[Crossref], [PubMed], [CAS], Google Scholar153https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BD3sXns1Gqsb0%253D&md5=e648e99fdcbaf6779d6ae2d29255e7f1Exposure to Carbon Nanotube Material: Assessment of Nanotube Cytotoxicity using Human Keratinocyte CellsShvedova, Anna; Castranova, Vincent; Kisin, Elena; Schwegler-Berry, Diane; Murray, Ashley; Gandelsman, Vadim; Maynard, Andrew; Baron, PaulJournal of Toxicology and Environmental Health, Part A (2003), 66 (20), 1909-1926CODEN: JTEHF8; ISSN:1528-7394. (Taylor & Francis, Inc.)Carbon nanotubes are new members of carbon allotropes similar to fullerenes and graphite. Because of their unique elec., mech., and thermal properties, carbon nanotubes are important for novel applications in the electronics, aerospace, and computer industries. Exposure to graphite and carbon materials has been assocd. with increased incidence of skin diseases, such as carbon fiber dermatitis, hyperkeratosis, and naevi. The authors investigated adverse effects of single-wall carbon nanotubes (SWCNT) using a cell culture of immortalized human epidermal keratinocytes (HaCaT). After 18 h of exposure of HaCaT to SWCNT, oxidative stress and cellular toxicity were indicated by formation of free radicals, accumulation of peroxidative products, antioxidant depletion, and loss of cell viability. Exposure to SWCNT also resulted in ultrastructural and morphol. changes in cultured skin cells. These data indicate that dermal exposure to unrefined SWCNT may lead to dermal toxicity due to accelerated oxidative stress in the skin of exposed workers.
- 154Pelin, M.; Fusco, L.; León, V.; Martín, C.; Criado, A.; Sosa, S.; Vázquez, E.; Tubaro, A.; Prato, M. Differential Cytotoxic Effects of Graphene and Graphene Oxide on Skin Keratinocytes. Sci. Rep. 2017, 7, 40572, DOI: 10.1038/srep40572[Crossref], [PubMed], [CAS], Google Scholar154https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2sXpslansA%253D%253D&md5=6d5cf887a80894cbc4c4802c837ee475Differential cytotoxic effects of graphene and graphene oxide on skin keratinocytesPelin, Marco; Fusco, Laura; Leon, Veronica; Martin, Cristina; Criado, Alejandro; Sosa, Silvio; Vazquez, Ester; Tubaro, Aurelia; Prato, MaurizioScientific Reports (2017), 7 (), 40572CODEN: SRCEC3; ISSN:2045-2322. (Nature Publishing Group)Impressive properties make graphene-based materials (GBMs) promising tools for nanoelectronics and biomedicine. However, safety concerns need to be cleared before mass prodn. of GBMs starts. As skin, together with lungs, displays the highest exposure to GBMs, it is of fundamental importance to understand what happens when GBMs get in contact with skin cells. The present study was carried out on HaCaT keratinocytes, an in vitro model of skin toxicity, on which the effects of four GBMs were evaluated: a few layer graphene, prepd. by ball-milling treatment (FLG), and three samples of graphene oxide (GOs, a research-grade GO1, and two com. GOs, GO2 and GO3). Even though no significant effects were obsd. after 24 h, after 72 h the less oxidized compd. (FLG) was the less cytotoxic, inducing mitochondrial and plasma-membrane damages with EC50s of 62.8μg/mL (WST-8 assay) and 45.5μg/mL (propidium iodide uptake), resp. By contrast, the largest and most oxidized compd., GO3, was the most cytotoxic, inducing mitochondrial and plasma-membrane damages with EC50s of 5.4 and 2.9μg/mL, resp. These results suggest that only high concns. and long exposure times to FLG and GOs could impair mitochondrial activity assocd. with plasma membrane damage, suggesting low cytotoxic effects at the skin level.
- 155Pelin, M.; Fusco, L.; Martín, C.; Sosa, S.; Frontiñán-Rubio, J.; González-Domínguez, J. M.; Durán-Prado, M.; Vázquez, E.; Prato, M.; Tubaro, A. Graphene and Graphene Oxide Induce ROS Production in Human HaCaT Skin Keratinocytes: The Role of Xanthine Oxidase and NADH Dehydrogenase. Nanoscale 2018, 10, 11820– 11830, DOI: 10.1039/C8NR02933D[Crossref], [PubMed], [CAS], Google Scholar155https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC1cXhtFSgtbnM&md5=41822560b94fae2258a1a3a11155f3b7Graphene and graphene oxide induce ROS production in human HaCaT skin keratinocytes: the role of xanthine oxidase and NADH dehydrogenasePelin, Marco; Fusco, Laura; Martin, Cristina; Sosa, Silvio; Frontinan-Rubio, Javier; Gonzalez-Dominguez, Jose Miguel; Duran-Prado, Mario; Vazquez, Ester; Prato, Maurizio; Tubaro, AureliaNanoscale (2018), 10 (25), 11820-11830CODEN: NANOHL; ISSN:2040-3372. (Royal Society of Chemistry)The extraordinary physicochem. properties of graphene-based nanomaterials (GBNs) make them promising tools in nanotechnol. and biomedicine. Considering the skin contact as one of the most feasible exposure routes to GBNs, the mechanism of toxicity of two GBNs (few-layer-graphene, FLG, and graphene oxide, GO) towards human HaCaT skin keratinocytes was investigated. Both materials induced a significant mitochondrial membrane depolarization: 72 h cell exposure to 100μg mL-1 FLG or GO increased mitochondrial depolarization by 44% and 56%, resp., while the pos. control valinomycin (0.1μg mL-1) increased mitochondrial depolarization by 48%. Since the effect was not prevented by cyclosporine-A, it appears to be unrelated to mitochondrial transition pore opening. By contrast, it seems to be mediated by reactive oxygen species (ROS) prodn.: FLG and GO induced time- and concn.-dependent cellular ROS prodn., significant already at the concn. of 0.4μg mL-1 after 24 h exposure. Among a panel of specific inhibitors of the major ROS-producing enzymes, diphenyliodonium, rotenone and allopurinol significantly reverted or even abolished FLG- or GO-induced ROS prodn. Intriguingly, the same inhibitors also significantly reduced FLG- or GO-induced mitochondrial depolarization and cytotoxicity. This study shows that FLG and GO induce a cytotoxic effect due to a sustained mitochondrial depolarization. This seems to be mediated by a significant cellular ROS prodn., caused by the activation of flavoprotein-based oxidative enzymes, such as NADH dehydrogenase and xanthine oxidase.
- 156Erf, G. F.; Falcon, D. M.; Sullivan, K. S.; Bourdo, S. E. T Lymphocytes Dominate Local Leukocyte Infiltration in Response to Intradermal Injection of Functionalized Graphene-Based Nanomaterial. J. Appl. Toxicol. 2017, 37, 1317– 1324, DOI: 10.1002/jat.3492[Crossref], [PubMed], [CAS], Google Scholar156https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2sXpvFymtLk%253D&md5=842901f9e05b9164d06023d5aea32306T lymphocytes dominate local leukocyte infiltration in response to intradermal injection of functionalized graphene-based nanomaterialErf, G. F.; Falcon, D. M.; Sullivan, K. S.; Bourdo, S. E.Journal of Applied Toxicology (2017), 37 (11), 1317-1324CODEN: JJATDK; ISSN:0260-437X. (John Wiley & Sons Ltd.)Graphene-based nanomaterials (GBN) have many potential biomedical applications. However, information regarding their biol. properties and interactions with cells and/or sol. factors within a complex tissue is limited. The objective of this study was to use the growing feather (GF) of chickens as a minimally invasive cutaneous test-site to assess and monitor leukocyte recruitment in response to intradermal GBN injection. Specifically, the dermis of 20 GFs per chicken was injected with 10 μl of phosphate-buffered saline (PBS)-vehicle or 10 μl of 300 μg ml-1 oxygen-functionalized (f) GBN (6 chickens/treatment). GFs were collected before- (0) and at 0.25, 1, 2, 3, 4, 5, and 7 days post-injection and used for leukocyte-population anal. of immunofluorescently stained pulp cell suspensions or histol. examn. Based on flow-cytometric cell population anal., lymphocytes and macrophages were the major leukocyte-populations infiltrating GFs in response to f-GBN presence. Compared with PBS-controls, levels of T cells (γδ-, αβ-, CD4- and CD8-T cells) were greatly elevated in f-GBN-injected GFs within 6 h and remained elevated throughout the 7-day examn. period. f-GBN's effects on local tissue leukocyte recruitment were not reflected in the blood, except for a higher percentage of lymphocytes on 7 days. These observations together with a visual examn. of f-GBN-injected GF tissue-sections suggest a delayed-type hypersensitivity-like, inflammatory cell-mediated response to the non-biodegradable f-GBN. The GF 'in vivo test-tube'system together with blood sampling provided unique insight into the time-course, qual., and quant. aspects of immune system activities initiated by the presence of f-GBN in a complex tissue of a living animal. Copyright © 2017 John Wiley & Sons, Ltd. StartCopTextCopyright © 2017 John Wiley & Sons, Ltd.
- 157Ou, L.; Song, B.; Liang, H.; Liu, J.; Feng, X.; Deng, B.; Sun, T.; Shao, L. Toxicity of Graphene-Family Nanoparticles: A General Review of the Origins and Mechanisms. Part. Part. Fibre Toxicol. 2016, 13, 57, DOI: 10.1186/s12989-016-0168-y[Crossref], [PubMed], [CAS], Google Scholar157https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2sXitVWqs7%252FJ&md5=e740c5bc6c7cbc7818df85fb2212af27Toxicity of graphene-family nanoparticles: a general review of the origins and mechanismsOu, Lingling; Song, Bin; Liang, Huimin; Liu, Jia; Feng, Xiaoli; Deng, Bin; Sun, Ting; Shao, LongquanParticle and Fibre Toxicology (2016), 13 (), 57/1-57/24CODEN: PFTABQ; ISSN:1743-8977. (BioMed Central Ltd.)Due to their unique physicochem. properties, graphene-family nanomaterials (GFNs) are widely used in many fields, esp. in biomedical applications. Currently, many studies have investigated the biocompatibility and toxicity of GFNs in vivo and in intro. Generally, GFNs may exert different degrees of toxicity in animals or cell models by following with different administration routes and penetrating through physiol. barriers, subsequently being distributed in tissues or located in cells, eventually being excreted out of the bodies. This review collects studies on the toxic effects of GFNs in several organs and cell models. We also point out that various factors det. the toxicity of GFNs including the lateral size, surface structure, functionalization, charge, impurities, aggregations, and corona effect ect. In addn., several typical mechanisms underlying GFN toxicity have been revealed, for instance, phys. destruction, oxidative stress, DNA damage, inflammatory response, apoptosis, autophagy, and necrosis. In these mechanisms, (toll-like receptors-) TLR-, transforming growth factor β- (TGF-β-) and tumor necrosis factor-alpha (TNF-α) dependent-pathways are involved in the signalling pathway network, and oxidative stress plays a crucial role in these pathways. In this review, we summarize the available information on regulating factors and the mechanisms of GFNs toxicity, and propose some challenges and suggestions for further investigations of GFNs, with the aim of completing the toxicol. mechanisms, and providing suggestions to improve the biol. safety of GFNs and facilitate their wide application.
- 158Roberts, J. R.; Mercer, R. R.; Stefaniak, A. B.; Seehra, M. S.; Geddam, U. K.; Chaudhuri, I. S.; Kyrlidis, A.; Kodali, V. K.; Sager, T.; Kenyon, A.; Bilgesu, S. A.; Eye, T.; Scabilloni, J. F.; Leonard, S. S.; Fix, N. R.; Schwegler-Berry, D.; Farris, B. Y.; Wolfarth, M. G.; Porter, D. W.; Castranova, V. Evaluation of Pulmonary and Systemic Toxicity Following Lung Exposure to Graphite Nanoplates: A Member of the Graphene-Based Nanomaterial Family. Part. Part. Fibre Toxicol. 2015, 13, 34, DOI: 10.1186/s12989-016-0145-5
- 159Schinwald, A.; Murphy, F. A.; Jones, A.; MacNee, W.; Donaldson, K. Graphene-Based Nanoplatelets: A New Risk to the Respiratory System as a Consequence of Their Unusual Aerodynamic Properties. ACS Nano 2012, 6, 736– 746, DOI: 10.1021/nn204229f[ACS Full Text
 ], [CAS], Google Scholar159https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3MXhs1GrurnP&md5=d6893da59ca929cc9cd61bad2a6a5d24Graphene-Based Nanoplatelets: A New Risk to the Respiratory System as a Consequence of Their Unusual Aerodynamic PropertiesSchinwald, Anja; Murphy, Fiona A.; Jones, Alan; MacNee, William; Donaldson, KenACS Nano (2012), 6 (1), 736-746CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)Graphene is a new nanomaterial with unusual and useful phys. and chem. properties. However, in the form of nanoplatelets this new, emerging material could pose unusual risks to the respiratory system after inhalation exposure. The graphene-based nanoplatelets used in this study are com. available and consist of several sheets of graphene (few-layer graphene). We first derived the respirability of graphene nanoplatelets (GP) from the basic principles of the aerodynamic behavior of plate-shaped particles which allowed us to calc. their aerodynamic diam. This showed that the nanoplatelets, which were up to 25 μm in diam., were respirable and so would deposit beyond the ciliated airways following inhalation. We therefore utilized models of pharyngeal aspiration and direct intrapleural installation of GP, as well as an in vitro model, to assess their inflammatory potential. These large but respirable GP were inflammogenic in both the lung and the pleural space. MIP-1α, MCP-1, MIP-2, IL-8, and IL-1β expression in the BAL, the pleural lavage, and cell culture supernatant from THP-1 macrophages were increased with GP exposure compared to controls but not with nanoparticulate carbon black (CB). In vitro, macrophages exposed to GP showed expression of IL-1β. This study highlights the importance of nanoplatelet form as a driver for in vivo and in vitro inflammogenicity by virtue of their respirable aerodynamic diam., despite a considerable 2-dimensional size which leads to frustrated phagocytosis when they deposit in the distal lungs and macrophages attempt to phagocytose them. Our data suggest that nanoplatelets pose a novel nanohazard and structure-toxicity relationship in nanoparticle toxicol.
], [CAS], Google Scholar159https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3MXhs1GrurnP&md5=d6893da59ca929cc9cd61bad2a6a5d24Graphene-Based Nanoplatelets: A New Risk to the Respiratory System as a Consequence of Their Unusual Aerodynamic PropertiesSchinwald, Anja; Murphy, Fiona A.; Jones, Alan; MacNee, William; Donaldson, KenACS Nano (2012), 6 (1), 736-746CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)Graphene is a new nanomaterial with unusual and useful phys. and chem. properties. However, in the form of nanoplatelets this new, emerging material could pose unusual risks to the respiratory system after inhalation exposure. The graphene-based nanoplatelets used in this study are com. available and consist of several sheets of graphene (few-layer graphene). We first derived the respirability of graphene nanoplatelets (GP) from the basic principles of the aerodynamic behavior of plate-shaped particles which allowed us to calc. their aerodynamic diam. This showed that the nanoplatelets, which were up to 25 μm in diam., were respirable and so would deposit beyond the ciliated airways following inhalation. We therefore utilized models of pharyngeal aspiration and direct intrapleural installation of GP, as well as an in vitro model, to assess their inflammatory potential. These large but respirable GP were inflammogenic in both the lung and the pleural space. MIP-1α, MCP-1, MIP-2, IL-8, and IL-1β expression in the BAL, the pleural lavage, and cell culture supernatant from THP-1 macrophages were increased with GP exposure compared to controls but not with nanoparticulate carbon black (CB). In vitro, macrophages exposed to GP showed expression of IL-1β. This study highlights the importance of nanoplatelet form as a driver for in vivo and in vitro inflammogenicity by virtue of their respirable aerodynamic diam., despite a considerable 2-dimensional size which leads to frustrated phagocytosis when they deposit in the distal lungs and macrophages attempt to phagocytose them. Our data suggest that nanoplatelets pose a novel nanohazard and structure-toxicity relationship in nanoparticle toxicol. - 160Schinwald, A.; Murphy, F.; Askounis, A.; Koutsos, V.; Sefiane, K.; Donaldson, K.; Campbell, C. J. Minimal Oxidation and Inflammogenicity of Pristine Graphene with Residence in the Lung. Nanotoxicology 2014, 8, 824– 832, DOI: 10.3109/17435390.2013.831502
- 161Park, E.-J.; Lee, G.-H.; Han, B. S.; Lee, B.-S.; Lee, S.; Cho, M.-H.; Kim, J.-H.; Kim, D.-W. Toxic Response of Graphene Nanoplatelets in Vivo and in Vitro. Arch. Toxicol. 2015, 89, 1557– 1568, DOI: 10.1007/s00204-014-1303-x[Crossref], [PubMed], [CAS], Google Scholar161https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2cXhtVOns7jE&md5=6d48dfebf8a4527c2c11e8ad49b82ecdToxic response of graphene nanoplatelets in vivo and in vitroPark, Eun-Jung; Lee, Gwang-Hee; Han, Beom Seok; Lee, Byoung-Seok; Lee, Somin; Cho, Myung-Haing; Kim, Jae-Ho; Kim, Dong-WanArchives of Toxicology (2015), 89 (9), 1557-1568CODEN: ARTODN; ISSN:0340-5761. (Springer)With the development of nanotechnol., myriad types of novel materials have been discovered at the nanoscale, among which the most interesting material is graphene. However, the toxicity data available on graphene are extremely limited. In this study, we explored toxic response of com. available graphene nanoplatelets (GNPs) in vivo and in vitro. The GNPs used in this study had a high surface area and feature considerably few defects. In mice, GNPs (2.5 and 5 mg/kg) remained in the lung until 28 days after a single instillation, and the secretion of inflammatory cytokines reached the maximal level at Day 14 and then decreased over time. In vitro study using BEAS-2B cells, a human bronchial epithelial cell line, GNPs located within autophagosome-like vacuoles 24 h after exposure. The GNPs (2.5, 5, 10, and 20 μg/mL) also dose-dependently reduced cell viability, which was accompanied by an increase in the portion of cells in the subG1 and S phases. Moreover, the GNPs down-regulated the generation of reactive oxygen species, suppressed ATP prodn., caused mitochondria damage, and elevated the levels of autophagy-related proteins. Based on these results, we suggest that GNPs provoked a subchronic inflammatory response in mice and that GNPs induced autophagy accompanying apoptosis via mitochondria damage in vitro.
- 162Park, E.-J.; Lee, S. J.; Lee, K.; Choi, Y. C.; Lee, B.-S.; Lee, G.-H.; Kim, D.-W. Pulmonary Persistence of Graphene Nanoplatelets May Disturb Physiological and Immunological Homeostasis. J. Appl. Toxicol. 2017, 37, 296– 309, DOI: 10.1002/jat.3361[Crossref], [PubMed], [CAS], Google Scholar162https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC28XhtF2mt77L&md5=288939a39b10dd9f495d94dfa8cd2729Pulmonary persistence of graphene nanoplatelets may disturb physiological and immunological homeostasisPark, Eun-Jung; Lee, Sang Jin; Lee, Kyuhong; Choi, Young Chul; Lee, Byoung-Seok; Lee, Gwang-Hee; Kim, Dong-WanJournal of Applied Toxicology (2017), 37 (3), 296-309CODEN: JJATDK; ISSN:0260-437X. (John Wiley & Sons Ltd.)Accumulated evidence suggests that chronic pulmonary accumulation of harmful particles cause adverse pulmonary and systemic health effects. In our previous study, most of the graphene nanoplatelet (GNP) remained in the lung until 28 days after a single instillation. In this study, we sought to evaluate the local and systemic health effect after a long pulmonary persistence of GNP. As expected, GNP remained in the lung on day 90 after a single intratracheal instillation (1.25, 2.5 and 5 mg kg-1). In the lung exposed at the highest dose, the total no. of cells and the percentage of lymphocytes significantly increased in the BAL fluid with an increase in both the no. of GNP-engulfed macrophages and the percentage of apoptotic cells. A Th1-shifted immune response, the elevated chemokine secretion and the enhanced expression of cytoskeletal-related genes were obsd. Addnl., the expression of natriuretic-related genes was noteworthy altered in the lungs. Moreover, the no. of white blood cells (WBC) and the percentage of macrophages and neutrophils clearly increased in the blood of mice exposed to a 5-mg kg-1 dose, whereas total protein, BUN and potassium levels significantly decreased. In conclusion, we suggest that the long persistence of GNP in the lung may cause adverse health effects by disturbing immunol.- and physiol.-homeostasis of our body. Copyright © 2016 John Wiley & Sons, Ltd.
- 163Shin, J. H.; Han, S. G.; Kim, J. K.; Kim, B. W.; Hwang, J. H.; Lee, J. S.; Lee, J. H.; Baek, J. E.; Kim, T. G.; Kim, K. S.; Lee, H. S.; Song, N. W.; Ahn, K.; Yu, I. J. 5-Day Repeated Inhalation and 28-Day Post-Exposure Study of Graphene. Nanotoxicology 2015, 9, 1023– 1031, DOI: 10.3109/17435390.2014.998306
- 164Kim, J. K.; Shin, J. H.; Lee, J. S.; Hwang, J. H.; Lee, J. H.; Baek, J. E.; Kim, T. G.; Kim, B. W.; Kim, J. S.; Lee, G. H.; Ahn, K.; Han, S. G.; Bello, D.; Yu, I. J. 28-Day Inhalation Toxicity of Graphene Nanoplatelets in Sprague-Dawley Rats. Nanotoxicology 2016, 10, 891– 901, DOI: 10.3109/17435390.2015.1133865
- 165Lee, J. K.; Jeong, A. Y.; Bae, J.; Seok, J. H.; Yang, J.-Y.; Roh, H. S.; Jeong, J.; Han, Y.; Jeong, J.; Cho, W.-S. The Role of Surface Functionalization on the Pulmonary Inflammogenicity and Translocation into Mediastinal Lymph Nodes of Graphene Nanoplatelets in Rats. Arch. Toxicol. 2017, 91, 667– 676, DOI: 10.1007/s00204-016-1706-y[Crossref], [PubMed], [CAS], Google Scholar165https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC28XntVOntro%253D&md5=dac00e3294aca9af5747b071c232ea07The role of surface functionalization on the pulmonary inflammogenicity and translocation into mediastinal lymph nodes of graphene nanoplatelets in ratsLee, Jong Kwon; Jeong, A. Young; Bae, Jiyeong; Seok, Ji Hyun; Yang, Jun-Young; Roh, Hang Sik; Jeong, Jiyoung; Han, Youngju; Jeong, Jayoung; Cho, Wan-SeobArchives of Toxicology (2017), 91 (2), 667-676CODEN: ARTODN; ISSN:0340-5761. (Springer)Graphene, a two-dimensional monocryst. layer of carbon atoms, has potential in many applications not only in material sciences, but also in the biomedical fields, but there is little information about the role of surface modification on the toxicity of graphene-based nanomaterials. Here, we evaluated the role of surface functionalization of the graphene nanoplatelets (GNPs) on the pulmonary inflammogenicity and translocation into mediastinal lymph nodes using a rat intratracheal instillation model. Six types of GNPs were used: All types of GNPs were based on the pristine GNPs (GNPdot), and different functional groups were conjugated onto them including a COOH (GNPCOOH), COH (GNPO2), N-H (GNPN2), Fx (GNPF), and N=H (GNPNH2). All types of GNPs showed very high potential for the generation of reactive oxygen species (ROS) in a dose-dependent manner when measured by a 2'7'-dichlorofluorescin diacetate assay. GNPs were instilled into the lungs of rats at 0.3 and 1 mg/rat for the evaluation of acute (24 h) inflammation and at 3 mg/rat for chronic (1 and 4 wk) inflammation. At 24 h after instillation, all types of GNPs showed good dose-dependent increases in polymorphonuclear leukocytes with a clear dose-dependency although significant increases compared to vehicle control were found only in pos. charged GNPs (GNPN2andGNPNH2). While the acute inflammation in all treatment groups was returned to control levels at 1 and 4 wk after instillation, GNPs showed similar patterns of translocation into the mediastinal lymph nodes with a higher degree over time. This study implies that the main factors of GNPs for producing lung inflammation are the potential for ROS generation and surface charge. In addn., functional groups on the GNPs might not play an important role in the extrapulmonary translocation into the mediastinal lymph nodes.
- 166Bengtson, S.; Knudsen, K. B.; Kyjovska, Z. O.; Berthing, T.; Skaug, V.; Levin, M.; Koponen, I. K.; Shivayogimath, A.; Booth, T. J.; Alonso, B.; Pesquera, A.; Zurutuza, A.; Thomsen, B. L.; Troelsen, J. T.; Jacobsen, N. R.; Vogel, U. Differences in Inflammation and Acute Phase Response but Similar Genotoxicity in Mice Following Pulmonary Exposure to Graphene Oxide and Reduced Graphene Oxide. PLoS One 2017, 12, e0178355, DOI: 10.1371/journal.pone.0178355[Crossref], [PubMed], [CAS], Google Scholar166https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2sXhslWhsr3M&md5=585e5fa50e54869664f3b270cb1c60cbDifferences in inflammation and acute phase response but similar genotoxicity in mice following pulmonary exposure to graphene oxide and reduced graphene oxideBengtson, Stefan; Knudsen, Kristina B.; Kyjovska, Zdenka O.; Berthing, Trine; Skaug, Vidar; Levin, Marcus; Koponen, Ismo K.; Shivayogimath, Abhay; Booth, Timothy J.; Alonso, Beatriz; Pesquera, Amaia; Zurutuza, Amaia; Thomsen, Birthe L.; Troelsen, Jesper T.; Jacobsen, Nicklas R.; Vogel, UllaPLoS One (2017), 12 (6), e0178355/1-e0178355/25CODEN: POLNCL; ISSN:1932-6203. (Public Library of Science)We investigated toxicity of 2-3 layered >1 μm sized graphene oxide (GO) and reduced graphene oxide (rGO) in mice following single intratracheal exposure with respect to pulmonary inflammation, acute phase response (biomarker for risk of cardiovascular disease) and genotoxicity. In addn., we assessed exposure levels of particulate matter emitted during prodn. of graphene in a clean room and in a normal industrial environment using chem. vapor deposition. Toxicity was evaluated at day 1, 3, 28 and 90 days (18, 54 and 162 μg/mouse), except for GO exposed mice at day 28 and 90 where only the lowest dose was evaluated. GO induced a strong acute inflammatory response together with a pulmonary (Serum-Amyloid A, Saa3) and hepatic (Saa1) acute phase response. rGO induced less acute, but a const. and prolonged inflammation up to day 90. Lung histopathol. showed particle agglomerates at day 90 without signs of fibrosis. In addn., DNA damage in BAL cells was obsd. across time points and doses for both GO and rGO. In conclusion, pulmonary exposure to GO and rGO induced inflammation, acute phase response and genotoxicity but no fibrosis.
- 167Bengtson, S.; Kling, K.; Madsen, A. M.; Noergaard, A. W.; Jacobsen, N. R.; Clausen, P. A.; Alonso, B.; Pesquera, A.; Zurutuza, A.; Ramos, R.; Okuno, H.; Dijon, J.; Wallin, H.; Vogel, U. No Cytotoxicity or Genotoxicity of Graphene and Graphene Oxide in Murine Lung Epithelial FE1 Cells in Vitro. Environ. Mol. Mutagen. 2016, 57, 469– 482, DOI: 10.1002/em.22017[Crossref], [PubMed], [CAS], Google Scholar167https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC28XotVWlt7c%253D&md5=676a69ea8ddf67b314ccd35ba7724e91No cytotoxicity or genotoxicity of graphene and graphene oxide in murine lung epithelial FE1 cells in vitroBengtson, Stefan; Kling, Kirsten; Madsen, Anne Mette; Noergaard, Asger W.; Jacobsen, Nicklas Raun; Clausen, Per Axel; Alonso, Beatriz; Pesquera, Amaia; Zurutuza, Amaia; Ramos, Raphael; Okuno, Hanako; Dijon, Jean; Wallin, Hakan; Vogel, UllaEnvironmental and Molecular Mutagenesis (2016), 57 (6), 469-482CODEN: EMMUEG; ISSN:1098-2280. (Wiley-Blackwell)Graphene and graphene oxide receive much attention these years, because they add attractive properties to a wide range of applications and products. Several studies have shown toxicol. effects of other carbon-based nanomaterials such as carbon black nanoparticles and carbon nanotubes in vitro and in vivo. Here, we report in-depth physicochem. characterization of three com. graphene materials, one graphene oxide (GO) and two reduced graphene oxides (rGO) and assess cytotoxicity and genotoxicity in the murine lung epithelial cell line FE1. The studied GO and rGO mainly consisted of 2-3 graphene layers with lateral sizes of 1-2 μm. GO had almost equimolar content of C, O, and H while the two rGO materials had lower contents of oxygen with C/O and C/H ratios of 8 and 12.8, resp. All materials had low levels of endotoxin and low levels of inorg. impurities, which were mainly sulfur, manganese, and silicon. GO generated more ROS than the two rGO materials, but none of the graphene materials influenced cytotoxicity in terms of cell viability and cell proliferation after 24 h. Furthermore, no genotoxicity was obsd. using the alk. comet assay following 3 or 24 h of exposure. We demonstrate that CP, few-layered GO and rGO with comparable lateral size (> 1 μm) do not induce significant cytotoxicity or genotoxicity in FE1 cells at relatively high doses (5-200 μg/mL).
- 168Poulsen, S. S.; Jackson, P.; Kling, K.; Knudsen, K. B.; Skaug, V.; Kyjovska, Z. O.; Thomsen, B. L.; Clausen, P. A.; Atluri, R.; Berthing, T.; Bengtson, S.; Wolff, H.; Jensen, K. A.; Wallin, H.; Vogel, U. Multi-Walled Carbon Nanotube Physicochemical Properties Predict Pulmonary Inflammation and Genotoxicity. Nanotoxicology 2016, 10, 1263– 1275, DOI: 10.1080/17435390.2016.1202351[Crossref], [PubMed], [CAS], Google Scholar168https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC28XhtFOhurfN&md5=c393d4fe14558d3a07e66f5867a1176cMulti-walled carbon nanotube physicochemical properties predict pulmonary inflammation and genotoxicityPoulsen, Sarah S.; Jackson, Petra; Kling, Kirsten; Knudsen, Kristina B.; Skaug, Vidar; Kyjovska, Zdenka O.; Thomsen, Birthe L.; Clausen, Per Axel; Atluri, Rambabu; Berthing, Trine; Bengtson, Stefan; Wolff, Henrik; Jensen, Keld A.; Wallin, Haakan; Vogel, UllaNanotoxicology (2016), 10 (9), 1263-1275CODEN: NANOGK; ISSN:1743-5404. (Taylor & Francis Ltd.)Lung deposition of multi-walled carbon nanotubes (MWCNT) induces pulmonary toxicity. Com. MWCNT vary greatly in physicochem. properties and consequently in biol. effects. To identify determinants of MWCNT-induced toxicity, we analyzed the effects of pulmonary exposure to 10 com. MWCNT (supplied in three groups of different dimensions, with one pristine and two/three surface modified in each group). We characterized morphol., chem. compn., surface area and functionalization levels. MWCNT were deposited in lungs of female C57BL/6J mice by intratracheal instillation of 0, 6, 18 or 54 μg/mouse. Pulmonary inflammation (neutrophil influx in bronchoalveolar lavage (BAL)) and genotoxicity were detd. on day 1, 28 or 92. Histopathol. of the lungs was performed on day 28 and 92. All MWCNT induced similar histol. changes. Lymphocytic aggregates were detected for all MWCNT on day 28 and 92. Using adjusted, multiple regression analyses, inflammation and genotoxicity were related to dose, time and physicochem. properties. The sp. surface area (BET) was identified as a pos. predictor of pulmonary inflammation on all post-exposure days. In addn., length significantly predicted pulmonary inflammation, whereas surface oxidn. (-OH and -COOH) was predictor of lowered inflammation on day 28. BET surface area, and therefore diam., significantly predicted genotoxicity in BAL fluid cells and lung tissue such that lower BET surface area or correspondingly larger diam. was assocd. with increased genotoxicity. This study provides information on possible toxicity-driving physicochem. properties of MWCNT. The results may contribute to safe-by-design manufg. of MWCNT, thereby minimizing adverse effects.
- 169Poulsen, S. S.; Saber, A. T.; Williams, A.; Andersen, O.; Købler, C.; Atluri, R.; Pozzebon, M. E.; Mucelli, S. P.; Simion, M.; Rickerby, D.; Mortensen, A.; Jackson, P.; Kyjovska, Z. O.; Mølhave, K.; Jacobsen, N. R.; Jensen, K. A.; Yauk, C. L.; Wallin, H.; Halappanavar, S.; Vogel, U. MWCNTs of Different Physicochemical Properties Cause Similar Inflammatory Responses, but Differences in Transcriptional and Histological Markers of Fibrosis in Mouse Lungs. Toxicol. Appl. Pharmacol. 2015, 284, 16– 32, DOI: 10.1016/j.taap.2014.12.011[Crossref], [PubMed], [CAS], Google Scholar169https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2MXmtlSisQ%253D%253D&md5=ad98017672f4322af10db305a1de672dMWCNTs of different physicochemical properties cause similar inflammatory responses, but differences in transcriptional and histological markers of fibrosis in mouse lungsPoulsen, Sarah S.; Saber, Anne T.; Williams, Andrew; Andersen, Ole; Koebler, Carsten; Atluri, Rambabu; Pozzebon, Maria E.; Mucelli, Stefano P.; Simion, Monica; Rickerby, David; Mortensen, Alicja; Jackson, Petra; Kyjovska, Zdenka O.; Moelhave, Kristian; Jacobsen, Nicklas R.; Jensen, Keld A.; Yauk, Carole L.; Wallin, Haakan; Halappanavar, Sabina; Vogel, UllaToxicology and Applied Pharmacology (2015), 284 (1), 16-32CODEN: TXAPA9; ISSN:0041-008X. (Elsevier Inc.)Multi-walled carbon nanotubes (MWCNTs) are an inhomogeneous group of nanomaterials that vary in lengths, shapes and types of metal contamination, which makes hazard evaluation difficult. Here we present a toxicogenomic anal. of female C57BL/6 mouse lungs following a single intratracheal instillation of 0, 18, 54 or 162 μg/mouse of a small, curled (CNTSmall, 0.8 ± 0.1 μm in length) or large, thick MWCNT (CNTLarge, 4 ± 0.4 μm in length). The two MWCNTs were extensively characterized by SEM and TEM imaging, thermogravimetric anal., and Brunauer-Emmett-Teller surface area anal. Lung tissues were harvested 24 h, 3 days and 28 days post-exposure. DNA microarrays were used to analyze gene expression, in parallel with anal. of bronchoalveolar lavage fluid, lung histol., DNA damage (comet assay) and the presence of reactive oxygen species (dichlorodihydrofluorescein assay), to profile and characterize related pulmonary endpoints. Overall changes in global transcription following exposure to CNTSmall or CNTLarge were similar. Both MWCNTs elicited strong acute phase and inflammatory responses that peaked at day 3, persisted up to 28 days, and were characterized by increased cellular influx in bronchoalveolar lavage fluid, interstitial pneumonia and gene expression changes. However, CNTLarge elicited an earlier onset of inflammation and DNA damage, and induced more fibrosis and a unique fibrotic gene expression signature at day 28, compared to CNTSmall. The results indicate that the extent of change at the mol. level during early response phases following an acute exposure is greater in mice exposed to CNTLarge, which may eventually lead to the different responses obsd. at day 28.
- 170Vranic, S.; Rodrigues, A. F.; Buggio, M.; Newman, L.; White, M. R. H.; Spiller, D. G.; Bussy, C.; Kostarelos, K. Live Imaging of Label-Free Graphene Oxide Reveals Critical Factors Causing Oxidative-Stress-Mediated Cellular Responses. ACS Nano 2018, 12, 1373– 1389, DOI: 10.1021/acsnano.7b07734[ACS Full Text
 ], [CAS], Google Scholar170https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC1cXhsFOisw%253D%253D&md5=2d227a016212a189d46e9b6055d2d48dLive Imaging of Label-Free Graphene Oxide Reveals Critical Factors Causing Oxidative-Stress-Mediated Cellular ResponsesVranic, Sandra; Rodrigues, Artur Filipe; Buggio, Maurizio; Newman, Leon; White, Michael R. H.; Spiller, David G.; Bussy, Cyrill; Kostarelos, KostasACS Nano (2018), 12 (2), 1373-1389CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)The interest in graphene and its translation into com. products have been expanding at high pace. In regard to previously described pulmonary safety concerns for carbon nanomaterials, there is a great need to define parameters guiding interactions between graphene-based materials and pulmonary system. The aim of present study was to det. the importance of two crit. parameters: lateral dimensions of the material and coating with proteins in relation to each other and their pulmonary impact. Endotoxin-free materials with distinct lateral dimensions - s-GO (50 - 200 nm) and l-GO (5 - 15 μm) were produced and thoroughly characterized. Exploiting intrinsic fluorescence of GO and using confocal live-cell imaging, we visualized the behavior of the cells in response to the material in real time. Although BEAS-2B cells internalized GO efficiently, l-GO was linked to higher plasma membrane interactions correlated with elevated ROS levels, pro-inflammatory response and greater cytotoxicity, in agreement with the oxidative stress paradigm. For both GO types, the presence of serum alleviated lipid peroxidn. of plasma membrane and decreased intracellular ROS levels. However, protein coating was not enough to entirely mitigate toxicity and inflammatory response induced by l-GO. In vitro results were validated in vivo, as l-GO was more prone to induce pulmonary granulomatous response in mice compared to s-GO. In conclusion, lateral dimension of GO played more important role than serum protein coating in detg. biol. responses to the material. It was also demonstrated that time-lapse imaging of live cells interacting with label-free GO sheets can be used as a tool to assess GO induced cytotoxicity.
], [CAS], Google Scholar170https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC1cXhsFOisw%253D%253D&md5=2d227a016212a189d46e9b6055d2d48dLive Imaging of Label-Free Graphene Oxide Reveals Critical Factors Causing Oxidative-Stress-Mediated Cellular ResponsesVranic, Sandra; Rodrigues, Artur Filipe; Buggio, Maurizio; Newman, Leon; White, Michael R. H.; Spiller, David G.; Bussy, Cyrill; Kostarelos, KostasACS Nano (2018), 12 (2), 1373-1389CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)The interest in graphene and its translation into com. products have been expanding at high pace. In regard to previously described pulmonary safety concerns for carbon nanomaterials, there is a great need to define parameters guiding interactions between graphene-based materials and pulmonary system. The aim of present study was to det. the importance of two crit. parameters: lateral dimensions of the material and coating with proteins in relation to each other and their pulmonary impact. Endotoxin-free materials with distinct lateral dimensions - s-GO (50 - 200 nm) and l-GO (5 - 15 μm) were produced and thoroughly characterized. Exploiting intrinsic fluorescence of GO and using confocal live-cell imaging, we visualized the behavior of the cells in response to the material in real time. Although BEAS-2B cells internalized GO efficiently, l-GO was linked to higher plasma membrane interactions correlated with elevated ROS levels, pro-inflammatory response and greater cytotoxicity, in agreement with the oxidative stress paradigm. For both GO types, the presence of serum alleviated lipid peroxidn. of plasma membrane and decreased intracellular ROS levels. However, protein coating was not enough to entirely mitigate toxicity and inflammatory response induced by l-GO. In vitro results were validated in vivo, as l-GO was more prone to induce pulmonary granulomatous response in mice compared to s-GO. In conclusion, lateral dimension of GO played more important role than serum protein coating in detg. biol. responses to the material. It was also demonstrated that time-lapse imaging of live cells interacting with label-free GO sheets can be used as a tool to assess GO induced cytotoxicity. - 171Drasler, B.; Kucki, M.; Delhaes, F.; Buerki-Thurnherr, T.; Vanhecke, D.; Korejwo, D.; Chortarea, S.; Barosova, H.; Hirsch, C.; Petri-Fink, A.; Rothen-Rutishauser, B.; Wick, P. Single Exposure to Aerosolized Graphene Oxide and Graphene Nanoplatelets Did Not Initiate an Acute Biological Response in a 3D Human Lung Model. Carbon 2018, 137, 125– 135, DOI: 10.1016/j.carbon.2018.05.012[Crossref], [CAS], Google Scholar171https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC1cXpvVKmsbw%253D&md5=4730c8f6e613eeab7c74e29c239e1330Single exposure to aerosolized graphene oxide and graphene nanoplatelets did not initiate an acute biological response in a 3D human lung modelDrasler, Barbara; Kucki, Melanie; Delhaes, Flavien; Buerki-Thurnherr, Tina; Vanhecke, Dimitri; Korejwo, Daria; Chortarea, Savvina; Barosova, Hana; Hirsch, Cordula; Petri-Fink, Alke; Rothen-Rutishauser, Barbara; Wick, PeterCarbon (2018), 137 (), 125-135CODEN: CRBNAH; ISSN:0008-6223. (Elsevier Ltd.)The increased mass prodn. of graphene related materials (GRM), intended for a broad spectrum of applications, demands a thorough assessment of their potential hazard to humans and the environment. Particularly, the paramount concern has been expressed in regard to their interaction with the respiratory system in occupational exposure settings. It has been shown that GRM are easily respirable and can interact with lung cells resulting in the induction of oxidative stress or pulmonary inflammation. However, a comprehensive assessment of potential biol. effects induced by GRM is currently hardly feasible to accomplish due to the lack of well-defined GRM materials and realistic exposure data. Herein, a 3D human lung model was combined with a com. aerosolization system to study potential side effects of GRM. Two representative types of GRM were aerosolized onto the lung epithelial tissue surface. After 24 h post exposure, selected biol. endpoints were evaluated, such as cell viability, morphol., barrier integrity, induction of (pro-)inflammation and oxidative stress reactions and compared with the ref. carbon black. Single exposure to all tested GRM at the two different exposure concns. (∼300 and 1000 ng/Cm2) did not initiate an observable adverse effect to the 3D lung model under acute exposure scenarios.
- 172Shurin, M. R.; Yanamala, N.; Kisin, E. R.; Tkach, A. V.; Shurin, G. V.; Murray, A. R.; Leonard, H. D.; Reynolds, J. S.; Gutkin, D. W.; Star, A.; Fadeel, B.; Savolainen, K.; Kagan, V. E.; Shvedova, A. A. Graphene Oxide Attenuates Th2-Type Immune Responses, but Augments Airway Remodeling and Hyperresponsiveness in a Murine Model of Asthma. ACS Nano 2014, 8, 5585– 5599, DOI: 10.1021/nn406454u[ACS Full Text
 ], [CAS], Google Scholar172https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2cXotlWgt7k%253D&md5=ad985867d575b425c42b0094bda74268Graphene Oxide Attenuates Th2-Type Immune Responses, but Augments Airway Remodeling and Hyperresponsiveness in a Murine Model of AsthmaShurin, Michael R.; Yanamala, Naveena; Kisin, Elena R.; Tkach, Alexey V.; Shurin, Galina V.; Murray, Ashley R.; Leonard, Howard D.; Reynolds, Jeffrey S.; Gutkin, Dmirtiy W.; Star, Alexander; Fadeel, Bengt; Savolainen, Kai; Kagan, Valerian E.; Shvedova, Anna A.ACS Nano (2014), 8 (6), 5585-5599CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)Several lines of evidence indicate that exposure to nanoparticles (NPs) is able to modify airway immune responses, thus facilitating the development of respiratory diseases. Graphene oxide (GO) is a promising carbonaceous nanomaterial with unique physicochem. properties, envisioned for a multitude of medical and industrial applications. In this paper, the authors detd. how exposure to GO modulates the allergic pulmonary response. Using a murine model of ovalbumin (OVA)-induced asthma, the authors revealed that GO, given at the sensitization stage, augmented airway hyperresponsiveness and airway remodeling in the form of goblet cell hyperplasia and smooth muscle hypertrophy. At the same time, the levels of the cytokines IL-4, IL-5, and IL-13 were reduced in broncho-alveolar lavage (BAL) fluid in GO-exposed mice. Exposure to GO during sensitization with OVA decreased eosinophil accumulation and increased recruitment of macrophages in BAL fluid. In line with the cytokine profiles, sensitization with OVA in the presence of GO stimulated the prodn. of OVA-specific IgG2a and down-regulated the levels of IgE and IgG1. Moreover, exposure to GO increased the macrophage prodn. of the mammalian chitinases, CHI3L1 and AMCase, whose expression is assocd. with asthma. Finally, mol. modeling has suggested that GO may directly interact with chitinase, affecting AMCase activity, which has been directly proven in the authors' studies. Thus, these data show that GO exposure attenuates Th2 immune response in a model of OVA-induced asthma, but leads to potentiation of airway remodeling and hyperresponsiveness, with the induction of mammalian chitinases.
], [CAS], Google Scholar172https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2cXotlWgt7k%253D&md5=ad985867d575b425c42b0094bda74268Graphene Oxide Attenuates Th2-Type Immune Responses, but Augments Airway Remodeling and Hyperresponsiveness in a Murine Model of AsthmaShurin, Michael R.; Yanamala, Naveena; Kisin, Elena R.; Tkach, Alexey V.; Shurin, Galina V.; Murray, Ashley R.; Leonard, Howard D.; Reynolds, Jeffrey S.; Gutkin, Dmirtiy W.; Star, Alexander; Fadeel, Bengt; Savolainen, Kai; Kagan, Valerian E.; Shvedova, Anna A.ACS Nano (2014), 8 (6), 5585-5599CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)Several lines of evidence indicate that exposure to nanoparticles (NPs) is able to modify airway immune responses, thus facilitating the development of respiratory diseases. Graphene oxide (GO) is a promising carbonaceous nanomaterial with unique physicochem. properties, envisioned for a multitude of medical and industrial applications. In this paper, the authors detd. how exposure to GO modulates the allergic pulmonary response. Using a murine model of ovalbumin (OVA)-induced asthma, the authors revealed that GO, given at the sensitization stage, augmented airway hyperresponsiveness and airway remodeling in the form of goblet cell hyperplasia and smooth muscle hypertrophy. At the same time, the levels of the cytokines IL-4, IL-5, and IL-13 were reduced in broncho-alveolar lavage (BAL) fluid in GO-exposed mice. Exposure to GO during sensitization with OVA decreased eosinophil accumulation and increased recruitment of macrophages in BAL fluid. In line with the cytokine profiles, sensitization with OVA in the presence of GO stimulated the prodn. of OVA-specific IgG2a and down-regulated the levels of IgE and IgG1. Moreover, exposure to GO increased the macrophage prodn. of the mammalian chitinases, CHI3L1 and AMCase, whose expression is assocd. with asthma. Finally, mol. modeling has suggested that GO may directly interact with chitinase, affecting AMCase activity, which has been directly proven in the authors' studies. Thus, these data show that GO exposure attenuates Th2 immune response in a model of OVA-induced asthma, but leads to potentiation of airway remodeling and hyperresponsiveness, with the induction of mammalian chitinases. - 173Lee, B.-J.; Kim, B.; Lee, K. Air Pollution Exposure and Cardiovascular Disease. Toxicol. Res. 2014, 30, 71– 75, DOI: 10.5487/TR.2014.30.2.071[Crossref], [PubMed], [CAS], Google Scholar173https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2cXhsFKnt7fK&md5=f22d9e6d8907ce022bfa4e94d13ea597Air pollution exposure and cardiovascular diseaseLee, Byeong-Jae; Kim, Bumseok; Lee, KyuhongToxicological Research (Seoul, Republic of Korea) (2014), 30 (2), 71-75CODEN: TROED7; ISSN:1976-8257. (Korean Society of Toxicology)A review. Ambient air pollution (AAP) and particulate matters (PM) have been closely assocd. with adverse health effects such as respiratory disease and cardiovascular diseases. Previous studies have examd. the adverse health effects assocd. with short- and long-term exposure to AAP and outdoor PM on respiratory disease. However, the effect of PM size (PM2.5 and PM10) on cardiovascular disease has not been well studied. Thus, it remains unclear how the size of the inhalable particles (coarse, fine, or ultrafine) affects mortality and morbidity. Airborne PM concns. are commonly used for ambient air quality management worldwide, owing to the known effects on cardiorespiratory health. In this article, we assess the relationship between cardiovascular diseases and PM, with a particular focus on PM size. We discuss the assocn. of PM2.5 and PM10, nitrogen dioxide (NO2), and elemental carbon with mortality and morbidity due to cardiovascular diseases, stroke, and altered blood pressure, based on epidemiol. studies. In addn., we provide evidence that the adverse health effects of AAP and PM are more pronounced among the elderly, children, and people with preexisting cardiovascular and respiratory conditions. Finally, we critically summarize the literature pertaining to cardiovascular diseases, including atherosclerosis and stroke, and introduce potential studies to better understand the health significance of AAP and PM on cardiovascular disease.
- 174Du, Y.; Xu, X.; Chu, M.; Guo, Y.; Wang, J. Air Particulate Matter and Cardiovascular Disease: The Epidemiological, Biomedical and Clinical Evidence. J. Thorac. Dis. 2016, 8, E8– E19, DOI: 10.3978/j.issn.2072-1439.2015.11.37
- 175Donaldson, K.; Duffin, R.; Langrish, J. P.; Miller, M. R.; Mills, N. L.; Poland, C. A.; Raftis, J.; Shah, A.; Shaw, C. A.; Newby, D. E. Nanoparticles and the Cardiovascular System: A Critical Review. Nanomedicine 2013, 8, 403– 423, DOI: 10.2217/nnm.13.16
- 176Contreras-Torres, F. F.; Rodríguez-Galván, A.; Guerrero-Beltrán, C. E.; Martínez-Lorán, E.; Vázquez-Garza, E.; Ornelas-Soto, N.; García-Rivas, G. Differential Cytotoxicity and Internalization of Graphene Family Nanomaterials in Myocardial Cells. Mater. Sci. Eng., C 2017, 73, 633– 642, DOI: 10.1016/j.msec.2016.12.080[Crossref], [PubMed], [CAS], Google Scholar176https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2sXislKluw%253D%253D&md5=d30d69ca06eed799b5c340ab67e31e4fDifferential cytotoxicity and internalization of graphene family nanomaterials in myocardial cellsContreras-Torres, Flavio F.; Rodriguez-Galvan, Andres; Guerrero-Beltran, Carlos E.; Martinez-Loran, Erick; Vazquez-Garza, Eduardo; Ornelas-Soto, Nancy; Garcia-Rivas, GerardoMaterials Science & Engineering, C: Materials for Biological Applications (2017), 73 (), 633-642CODEN: MSCEEE; ISSN:0928-4931. (Elsevier B.V.)Given the well-known phys. properties of graphene oxide (GO), numerous applications for this novel nanomaterial have been recently envisioned to improve the performance of biomedical devices. However, the toxicol. assessment of GO, which strongly depends on the used material and the studied cell line, is a fundamental task that needs to be performed prior to its use in biomedical applications. Therefore, the toxicol. characterization of GO is still ongoing. This study contributes to this, aiming to synthesize and characterize GO particles and thus investigate their toxic effects in myocardial cells. Herein, GO particles were produced from graphite using the Tour method and subsequent mild redn. was carried out to obtain low-reduced GO (LRGO) particles. A qual. anal. of the viability, cellular uptake, and internalization of particles was carried out using GO (∼ 54% content of oxygen) and LRGO (∼ 37% content of oxygen) and graphite. GO and LRGO reduce the viability of cardiac cells at IC50 of 652.1 ± 1.2 and 129.4 ± 1.2μg/mL, resp. This shows that LRGO particles produce a five-fold increase in cytotoxicity when compared to GO. The cell uptake pattern of GO and LRGO particles demonstrated that cardiac cells retain a similar complexity to control cells. Morphol. alterations examd. with electron microscopy showed that internalization by GO and LRGO-treated cells (100μg/mL) occurred affecting the cell structure. These results suggest that the viability of H9c2 cells can be assocd. with the surface chem. of GO and LRGO, as defined by the amt. of oxygen functionalities, the no. of graphitic domains, and the size of particles. High angle annular dark-field scanning transmission electron microscopy, dynamic light-scattering, Fourier-transform IR, Raman, and X-ray photoelectron spectroscopies were used to characterize the as-prepd. materials.
- 177Singh, S. K.; Singh, M. K.; Nayak, M. K.; Kumari, S.; Shrivastava, S.; Grácio, J. J. A.; Dash, D. Thrombus Inducing Property of Atomically Thin Graphene Oxide Sheets. ACS Nano 2011, 5, 4987– 4996, DOI: 10.1021/nn201092p[ACS Full Text
 ], [CAS], Google Scholar177https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3MXmtlynu7s%253D&md5=e1df0fce48e100362b8fcc35cfcb7b57Thrombus Inducing Property of Atomically Thin Graphene Oxide SheetsSingh, Sunil K.; Singh, Manoj K.; Nayak, Manasa K.; Kumari, Sharda; Shrivastava, Siddhartha; Gracio, Jose J. A.; Dash, DebabrataACS Nano (2011), 5 (6), 4987-4996CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)Graphene oxide (GO), the new two-dimensional carbon nanomaterial, is extensively investigated for potential biomedical applications. Thus, it is pertinent to critically evaluate its untoward effects on physiol. of tissue systems including blood platelets, the cells responsible for maintenance of hemostasis and thrombus formation. Here we report for the first time that atomically thin GO sheets elicited strong aggregatory response in platelets through activation of Src kinases and release of calcium from intracellular stores. Compounding this, i.v. administration of GO was found to induce extensive pulmonary thromboembolism in mice. Prothrombotic character of GO was dependent on surface charge distribution as reduced GO (RGO) was significantly less effective in aggregating platelets. Our findings raise a concern on putative biomedical applications of GO in the form of diagnostic and therapeutic tools where its prothrombotic property should be carefully investigated.
], [CAS], Google Scholar177https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3MXmtlynu7s%253D&md5=e1df0fce48e100362b8fcc35cfcb7b57Thrombus Inducing Property of Atomically Thin Graphene Oxide SheetsSingh, Sunil K.; Singh, Manoj K.; Nayak, Manasa K.; Kumari, Sharda; Shrivastava, Siddhartha; Gracio, Jose J. A.; Dash, DebabrataACS Nano (2011), 5 (6), 4987-4996CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)Graphene oxide (GO), the new two-dimensional carbon nanomaterial, is extensively investigated for potential biomedical applications. Thus, it is pertinent to critically evaluate its untoward effects on physiol. of tissue systems including blood platelets, the cells responsible for maintenance of hemostasis and thrombus formation. Here we report for the first time that atomically thin GO sheets elicited strong aggregatory response in platelets through activation of Src kinases and release of calcium from intracellular stores. Compounding this, i.v. administration of GO was found to induce extensive pulmonary thromboembolism in mice. Prothrombotic character of GO was dependent on surface charge distribution as reduced GO (RGO) was significantly less effective in aggregating platelets. Our findings raise a concern on putative biomedical applications of GO in the form of diagnostic and therapeutic tools where its prothrombotic property should be carefully investigated. - 178Singh, S. K.; Singh, M. K.; Kulkarni, P. P.; Sonkar, V. K.; Grácio, J. J. A.; Dash, D. Amine-Modified Graphene: Thrombo-Protective Safer Alternative to Graphene Oxide for Biomedical Applications. ACS Nano 2012, 6, 2731– 2740, DOI: 10.1021/nn300172t[ACS Full Text
 ], [CAS], Google Scholar178https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC38XjtVGhsrs%253D&md5=d9fd9e78af28fee43abd76d2e8ed8730Amine-Modified Graphene: Thrombo-Protective Safer Alternative to Graphene Oxide for Biomedical ApplicationsSingh, Sunil K.; Singh, Manoj K.; Kulkarni, Paresh P.; Sonkar, Vijay K.; Gracio, Jose J. A.; Dash, DebabrataACS Nano (2012), 6 (3), 2731-2740CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)Graphene and its derivs. have attracted significant research interest based on their application potential in different fields including biomedicine. However, recent reports have pointed to serious toxic effects of this nanomaterial on cells and organisms. Graphene oxide (GO) was found to be highly thrombogenic in mouse and evoked strong aggregatory response in human platelets. As platelets play a central role in hemostasis and thrombus formation, thrombotoxicity of GO potentially limits its biomedical applications. Surface chem. of nanomaterials is a crit. determinant of biocompatibility, and thus differentially functionalized nanomaterials exhibit varied cellular toxicity. Amine-modified carbon nanotubes have recently been shown to possess cytoprotective action, which was not exhibited by their relatively toxic carboxylated counterparts. The authors, therefore, evaluated the effect of amine modification of graphene on platelet reactivity. Remarkably, the results revealed for the first time that amine-modified graphene (G-NH2) had absolutely no stimulatory effect on human platelets nor did it induce pulmonary thromboembolism in mice following i.v. administration. Further, it did not evoke lysis of erythrocytes, another major cellular component in blood. These findings contrasted strikingly the observations with GO and reduced GO (RGO). In conclusion, G-NH2 is not endowed with thrombotoxic property unlike other commonly investigated graphene derivs. and is thus potentially safe for in vivo biomedical applications.
], [CAS], Google Scholar178https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC38XjtVGhsrs%253D&md5=d9fd9e78af28fee43abd76d2e8ed8730Amine-Modified Graphene: Thrombo-Protective Safer Alternative to Graphene Oxide for Biomedical ApplicationsSingh, Sunil K.; Singh, Manoj K.; Kulkarni, Paresh P.; Sonkar, Vijay K.; Gracio, Jose J. A.; Dash, DebabrataACS Nano (2012), 6 (3), 2731-2740CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)Graphene and its derivs. have attracted significant research interest based on their application potential in different fields including biomedicine. However, recent reports have pointed to serious toxic effects of this nanomaterial on cells and organisms. Graphene oxide (GO) was found to be highly thrombogenic in mouse and evoked strong aggregatory response in human platelets. As platelets play a central role in hemostasis and thrombus formation, thrombotoxicity of GO potentially limits its biomedical applications. Surface chem. of nanomaterials is a crit. determinant of biocompatibility, and thus differentially functionalized nanomaterials exhibit varied cellular toxicity. Amine-modified carbon nanotubes have recently been shown to possess cytoprotective action, which was not exhibited by their relatively toxic carboxylated counterparts. The authors, therefore, evaluated the effect of amine modification of graphene on platelet reactivity. Remarkably, the results revealed for the first time that amine-modified graphene (G-NH2) had absolutely no stimulatory effect on human platelets nor did it induce pulmonary thromboembolism in mice following i.v. administration. Further, it did not evoke lysis of erythrocytes, another major cellular component in blood. These findings contrasted strikingly the observations with GO and reduced GO (RGO). In conclusion, G-NH2 is not endowed with thrombotoxic property unlike other commonly investigated graphene derivs. and is thus potentially safe for in vivo biomedical applications. - 179Monasterio, B. G.; Alonso, B.; Sot, J.; García-Arribas, A. B.; Gil-Cartón, D.; Valle, M.; Zurutuza, A.; Goñi, F. M. Coating Graphene Oxide with Lipid Bilayers Greatly Decreases Its Hemolytic Properties. Langmuir 2017, 33, 8181– 8191, DOI: 10.1021/acs.langmuir.7b01552
- 180Cao, Y.; Li, J.; Liu, F.; Li, X.; Jiang, Q.; Cheng, S.; Gu, Y. Consideration of Interaction between Nanoparticles and Food Components for the Safety Assessment of Nanoparticles Following Oral Exposure: A Review. Environ. Toxicol. Pharmacol. 2016, 46, 206– 210, DOI: 10.1016/j.etap.2016.07.023[Crossref], [PubMed], [CAS], Google Scholar180https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC28Xht12ms7bM&md5=624420917170b7725dbde8a4d0c15ee1Consideration of interaction between nanoparticles and food components for the safety assessment of nanoparticles following oral exposure: A reviewCao, Yi; Li, Juan; Liu, Fang; Li, Xiyue; Jiang, Qin; Cheng, Shanshan; Gu, YuxiuEnvironmental Toxicology and Pharmacology (2016), 46 (), 206-210CODEN: ETOPFR; ISSN:1382-6689. (Elsevier B.V.)A review. Nanoparticles (NPs) are increasingly used in food, and the toxicity of NPs following oral exposure should be carefully assessed to ensure the safety. Indeed, a no. of studies have shown that oral exposure to NPs, esp. solid NPs, may induce toxicol. responses both in vivo and in vitro. However, most of the toxicol. studies only used NPs for oral exposure, and the potential interaction between NPs and food components in real life was ignored. In this review, we summarized the relevant studies and suggested that the interaction between NPs and food components may exist by that (1) NPs directly affect nutrients absorption through disruption of microvilli or alteration in expression of nutrient transporter genes; (2) food components directly affect NP absorption through physico-chem. modification; (3) the presence of food components affect oxidative stress induced by NPs. All of these interactions may eventually enhance or reduce the toxicol. responses induced by NPs following oral exposure. Studies only using NPs for oral exposure may therefore lead to misinterpretation and underestimation/overestimation of toxicity of NPs, and it is necessary to assess the synergistic effects of NPs in a complex system when considering the safety of NPs used in food.
- 181Pietroiusti, A.; Bergamaschi, E.; Campagna, M.; Campagnolo, L.; De Palma, G.; Iavicoli, S.; Leso, V.; Magrini, A.; Miragoli, M.; Pedata, P.; Palombi, L.; Iavicoli, I. The Unrecognized Occupational Relevance of the Interaction between Engineered Nanomaterials and the Gastro-Intestinal Tract: A Consensus Paper from a Multidisciplinary Working Group. Part. Fibre Toxicol. 2017, 14, 47, DOI: 10.1186/s12989-017-0226-0[Crossref], [PubMed], [CAS], Google Scholar181https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC1cXitVyrtb%252FI&md5=1c885a9cc0a0008b3a88acc7637d317aThe unrecognized occupational relevance of the interaction between engineered nanomaterials and the gastro-intestinal tract: a consensus paper from a multidisciplinary working groupPietroiusti, Antonio; Bergamaschi, Enrico; Campagna, Marcello; Campagnolo, Luisa; De Palma, Giuseppe; Iavicoli, Sergio; Leso, Veruscka; Magrini, Andrea; Miragoli, Michele; Pedata, Paola; Palombi, Leonardo; Iavicoli, IvoParticle and Fibre Toxicology (2017), 14 (), 47/1-47/23CODEN: PFTABQ; ISSN:1743-8977. (BioMed Central Ltd.)Background: There is a fundamental gap of knowledge on the health effects caused by the interaction of engineered nanomaterials (ENM) with the gastro-intestinal tract (GIT). This is partly due to the incomplete knowledge of the complex phys. and chem. transformations that ENM undergo in the GIT, and partly to the widespread belief that GIT health effects of ENM are much less relevant than pulmonary effects. However, recent exptl. findings, considering the role of new players in gut physiol. (e.g. the microbiota), shed light on several outcomes of the interaction ENM/GIT. Along with this new information, there is growing direct and indirect evidence that not only ingested ENM, but also inhaled ENM may impact on the GIT. This fact, which may have relevant implications in occupational setting, has never been taken into consideration. This review paper summarizes the opinions and findings of a multidisciplinary team of experts, focusing on two main aspects of the issue: 1) ENM interactions within the GIT and their possible consequences, and 2) relevance of gastro-intestinal effects of inhaled ENMs. Under point 1, we analyzed how luminal gut-constituents, including mucus, may influence the adherence of ENM to cell surfaces in a size-dependent manner, and how intestinal permeability may be affected by different physico-chem. characteristics of ENM. Cytotoxic, oxidative, genotoxic and inflammatory effects on different GIT cells, as well as effects on microbiota, are also discussed. Concerning point 2, recent studies highlight the relevance of gastro-intestinal handling of inhaled ENM, showing significant excretion with feces of inhaled ENM and supporting the hypothesis that GIT should be considered an important target of extrapulmonary effects of inhaled ENM. Conclusions: In spite of recent insights on the relevance of the GIT as a target for toxic effects of nanoparticles, there is still a major gap in knowledge regarding the impact of the direct vs. indirect oral exposure. This fact probably applies also to larger particles and dictates careful consideration in workers, who carry the highest risk of exposure to particulate matter.
- 182Abreu, M. T. Toll-like Receptor Signalling in the Intestinal Epithelium: How Bacterial Recognition Shapes Intestinal Function. Nat. Rev. Immunol. 2010, 10, 131– 144, DOI: 10.1038/nri2707[Crossref], [PubMed], [CAS], Google Scholar182https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3cXpslGnug%253D%253D&md5=c87fdf236f3b94f4cf14dc6d50cfe066Toll-like receptor signalling in the intestinal epithelium: how bacterial recognition shapes intestinal functionAbreu, Maria T.Nature Reviews Immunology (2010), 10 (2), 131-144CODEN: NRIABX; ISSN:1474-1733. (Nature Publishing Group)A review. A single layer of epithelial cells lines the small and large intestines and functions as a barrier between commensal bacteria and the rest of the body. Ligation of Toll-like receptors (TLRs) on intestinal epithelial cells by bacterial products promotes epithelial cell proliferation, secretion of IgA into the gut lumen and expression of antimicrobial peptides. As described in this Review, this establishes a microorganism-induced program of epithelial cell homeostasis and repair in the intestine. Dysregulation of this process can result in chronic inflammatory and over-exuberant repair responses, and it is assocd. with the development of colon cancer. Thus, dysregulated TLR signaling by intestinal epithelial cells may explain how colonic bacteria and inflammation promote colorectal cancer.
- 183Mabbott, N. A.; Donaldson, D. S.; Ohno, H.; Williams, I. R.; Mahajan, A. Microfold (M) Cells: Important Immunosurveillance Posts in the Intestinal Epithelium. Mucosal Immunol. 2013, 6, 666– 677, DOI: 10.1038/mi.2013.30[Crossref], [PubMed], [CAS], Google Scholar183https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3sXnvFyqt7k%253D&md5=4b5f5a5b8f4c10f8adcb585e94798ca0Microfold (M) cells: important immunosurveillance posts in the intestinal epitheliumMabbott, N. A.; Donaldson, D. S.; Ohno, H.; Williams, I. R.; Mahajan, A.Mucosal Immunology (2013), 6 (4), 666-677CODEN: MIUMAK; ISSN:1933-0219. (Nature Publishing Group)A review. The transcytosis of antigens across the gut epithelium by microfold cells (M cells) is important for the induction of efficient immune responses to some mucosal antigens in Peyer's patches. Recently, substantial progress has been made in our understanding of the factors that influence the development and function of M cells. This review highlights these important advances, with particular emphasis on: the host genes which control the functional maturation of M cells; how this knowledge has led to the rapid advance in our understanding of M-cell biol. in the steady state and during aging; mols. expressed on M cells which appear to be used as "immunosurveillance" receptors to sample pathogenic microorganisms in the gut; how certain pathogens appear to exploit M cells to infect the host; and finally how this knowledge has been used to specifically target antigens to M cells to attempt to improve the efficacy of mucosal vaccines.
- 184Ensign, L. M.; Cone, R.; Hanes, J. Oral Drug Delivery with Polymeric Nanoparticles: The Gastrointestinal Mucus Barriers. Adv. Drug Delivery Rev. 2012, 64, 557– 570, DOI: 10.1016/j.addr.2011.12.009[Crossref], [PubMed], [CAS], Google Scholar184https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC38Xls1emt7c%253D&md5=76ac5075bc0cdf79ad3d8cd6868371faOral drug delivery with polymeric nanoparticles: The gastrointestinal mucus barriersEnsign, Laura M.; Cone, Richard; Hanes, JustinAdvanced Drug Delivery Reviews (2012), 64 (6), 557-570CODEN: ADDREP; ISSN:0169-409X. (Elsevier B.V.)A review. Oral delivery is the most common method for drug administration. However, poor soly., stability, and bioavailability of many drugs make achieving therapeutic levels via the gastrointestinal (GI) tract challenging. Drug delivery must overcome numerous hurdles, including the acidic gastric environment and the continuous secretion of mucus that protects the GI tract. Nanoparticle drug carriers that can shield drugs from degrdn. and deliver them to intended sites within the GI tract may enable more efficient and sustained drug delivery. However, the rapid secretion and shedding of GI tract mucus can significantly limit the effectiveness of nanoparticle drug delivery systems. Many types of nanoparticles are efficiently trapped in and rapidly removed by mucus, making controlled release in the GI tract difficult. This review addresses the protective barrier properties of mucus secretions, how mucus affects the fate of orally administered nanoparticles, and recent developments in nanoparticles engineered to penetrate the mucus barrier.
- 185Sun, H.; Chow, E. C.; Liu, S.; Du, Y.; Pang, K. S. The Caco-2 Cell Monolayer: Usefulness and Limitations. Expert Opin. Drug Metab. Toxicol. 2008, 4, 395– 411, DOI: 10.1517/17425255.4.4.395[Crossref], [PubMed], [CAS], Google Scholar185https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BD1cXltVWmt7w%253D&md5=ec3241fe391b0cde5f63d261e91165e4The Caco-2 cell monolayer: usefulness and limitationsSun, Huadong; Chow, Edwin C. Y.; Liu, Shanjun; Du, Yimin; Pang, K. SandyExpert Opinion on Drug Metabolism & Toxicology (2008), 4 (4), 395-411CODEN: EODMAP; ISSN:1742-5255. (Informa Healthcare)A review. Background: The Caco-2 monolayer has been used extensively for the high-throughput screening of drug permeability and identification of substrates, inhibitors, and inducers of intestinal transporters, esp. P-glycoprotein (P-gp). Traditionally, the Caco-2 monolayer is viewed as a single barrier rather than a polarized cell monolayer consisting of metabolic enzymes that are sandwiched between two membrane barriers with distinctly different transporters. Objective: This review addressed the usefulness and limitations of the Caco-2 cell monolayer in drug discovery and mechanistic studies. Methods: This mini-review covered applications of the Caco-2 monolayer, clarified misconceptions, and critically addressed issues on data interpretation. Conclusion: The catenary model extends the usefulness of Caco-2 monolayer and provides proper mechanistic insight and data interpretation.
- 186Dorier, M.; Brun, E.; Veronesi, G.; Barreau, F.; Pernet-Gallay, K.; Desvergne, C.; Rabilloud, T.; Carapito, C.; Herlin-Boime, N.; Carrière, M. Impact of Anatase and Rutile Titanium Dioxide Nanoparticles on Uptake Carriers and Efflux Pumps in Caco-2 Gut Epithelial Cells. Nanoscale 2015, 7, 7352– 7360, DOI: 10.1039/C5NR00505A
- 187van der Zande, M.; Undas, A. K.; Kramer, E.; Monopoli, M. P.; Peters, R. J.; Garry, D.; Antunes Fernandes, E. C.; Hendriksen, P. J.; Marvin, H. J. P.; Peijnenburg, A. A.; Bouwmeester, H. Different Responses of Caco-2 and MCF-7 Cells to Silver Nanoparticles Are Based on Highly Similar Mechanisms of Action. Nanotoxicology 2016, 10, 1431– 1441, DOI: 10.1080/17435390.2016.1225132[Crossref], [PubMed], [CAS], Google Scholar187https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC28XhsV2hsbbF&md5=caec0c4c7dc29b19b6e730144c804a15Different responses of Caco-2 and MCF-7 cells to silver nanoparticles are based on highly similar mechanisms of actionvan der Zande, Meike; Undas, Anna K.; Kramer, Evelien; Monopoli, Marco P.; Peters, Ruud J.; Garry, David; Antunes Fernandes, Elsa C.; Hendriksen, Peter J.; Marvin, Hans J. P.; Peijnenburg, Ad A.; Bouwmeester, HansNanotoxicology (2016), 10 (10), 1431-1441CODEN: NANOGK; ISSN:1743-5404. (Taylor & Francis Ltd.)The mode of action of silver nanoparticles (AgNPs) is suggested to be exerted through both Ag+ and AgNP dependent mechanisms. Ingestion is one of the major NP exposure routes, and potential effects are often studied using Caco-2 cells, a well-established model for the gut epithelium. MCF-7 cells are epithelial breast cancer cells with extensive well-characterized toxicogenomics profiles. In the present study, we aimed to gain a deeper understanding of the cellular mol. responses in Caco-2 and MCF-7 cells after AgNP exposure in order to evaluate whether epithelial cells derived from different tissues demonstrated similar responses. These insights could possibly reduce the size of cell panels for NP hazard identification screening purposes. AgNPs of 20, 30, 60, and 110 nm, and AgNO3 were exposed for 6 h and 24 h. AgNPs were shown to be taken up and dissolve intracellularly. Compared with MCF-7 cells, Caco-2 cells showed a higher sensitivity to AgNPs, slower gene expression kinetics and absence of NP size-dependent responses. However, on a mol. level, no significant differences were obsd. between the two cell types. Transcriptomic anal. showed that Ag(NP) exposure caused (oxidative) stress responses, possibly leading to cell death in both cell lines. There was no indication for effects specifically induced by AgNPs. Responses to AgNPs appeared to be induced by silver ions released from the AgNPs. In conclusion, differences in mRNA responses to AgNPs between Caco-2 and MCF-7 cells were mainly related to timing and magnitude, but not to a different underlying mechanism.
- 188Vila, L.; García-Rodríguez, A.; Cortés, C.; Marcos, R.; Hernández, A. Assessing the Effects of Silver Nanoparticles on Monolayers of Differentiated Caco-2 Cells, as a Model of Intestinal Barrier. Food Chem. Toxicol. 2018, 116, 1– 10, DOI: 10.1016/j.fct.2018.04.008[Crossref], [PubMed], [CAS], Google Scholar188https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC1cXnt1Kgt7c%253D&md5=22549024c256d617e82247f340dccc9aAssessing the effects of silver nanoparticles on monolayers of differentiated Caco-2 cells, as a model of intestinal barrierVila, Laura; Garcia-Rodriguez, Alba; Cortes, Constanza; Marcos, Ricard; Hernandez, AlbaFood and Chemical Toxicology (2018), 116 (Part_B), 1-10CODEN: FCTOD7; ISSN:0278-6915. (Elsevier Ltd.)Since ingestion is one of the main routes of entry of nanoparticles (NPs) in our organism, simple and fast in vitro models of the intestinal barrier can be helpful to evaluate NPs risk. The human colon adenocarcinoma Caco-2 cell line has been extensively used due to its ability to differentiate, forming a well-structured cell monolayer. In this study, we have used these differentiated cells as a model of intestinal barrier to evaluate a wide set of effects caused by exposure to silver nanoparticles (AgNPs) with an av. size of 7.74nm. Different parameters such as toxicity, monolayer integrity and permeability (assessed by changes in cells' morphol. and gene expression pattern), internalization (uptake), translocation, and induction of DNA damage (DNA breaks and oxidative DNA damage) were evaluated. No significant effects were obsd. on the monolayer's integrity/permeability after exposure to silver nanoparticles, although cellular uptake was demonstrated by using confocal microscopy. Despite the obsd. uptake, no translocation of AgNPs to the basolateral chamber was demonstrated with any of the different exptl. approaches used. The genotoxic effects evaluated using the comet assay indicate that, although AgNPs were not able to induce direct DNA breaks, its exposure induced a significant increase in the oxidative DNA damage levels, at non-toxic concns.
- 189Susewind, J.; de Souza Carvalho-Wodarz, C.; Repnik, U.; Collnot, E.-M.; Schneider-Daum, N.; Griffiths, G. W.; Lehr, C.-M. A 3D Co-Culture of Three Human Cell Lines to Model the Inflamed Intestinal Mucosa for Safety Testing of Nanomaterials. Nanotoxicology 2016, 10, 53– 62, DOI: 10.3109/17435390.2015.1008065[Crossref], [PubMed], [CAS], Google Scholar189https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC28Xjs12mt70%253D&md5=4dcf052f62404442b1bb7bd965fbd9e3A 3D co-culture of three human cell lines to model the inflamed intestinal mucosa for safety testing of nanomaterialsSusewind, Julia; Carvalho-Wodarz, Cristiane de Souza; Repnik, Urska; Collnot, Eva-Maria; Schneider-Daum, Nicole; Griffiths, Gareth Wyn; Lehr, Claus-MichaelNanotoxicology (2016), 10 (1), 53-62CODEN: NANOGK; ISSN:1743-5404. (Taylor & Francis Ltd.)Oral exposure to nanomaterials is a current concern, asking for innovative biol. test systems to assess their safety, esp. also in conditions of inflammatory disorders. Aim of this study was to develop a 3D intestinal model, consisting of Caco-2 cells and two human immune cell lines, suitable to assess nanomaterial toxicity, in either healthy or diseased conditions. Human macrophages (THP-1) and human dendritic cells (MUTZ-3) were embedded in a collagen scaffold and seeded on the apical side of transwell inserts. Caco-2 cells were seeded on top of this layer, forming a 3D model of the intestinal mucosa. Toxicity of engineered nanoparticles (NM101 TiO2, NM300 Ag, Au) was evaluated in non-inflamed and inflamed co-cultures, and also compared to non-inflamed Caco-2 monocultures. Inflammation was elicited by IL-1β, and interactions with engineered NPs were addressed by different endpoints. The 3D co-culture showed well preserved ultrastructure and significant barrier properties. Ag NPs were found to be more toxic than TiO2 or Au NPs. But once inflamed with IL-1β, the co-cultures released higher amts. of IL-8 compared to Caco-2 monocultures. However, the cytotoxicity of Ag NPs was higher in Caco-2 monocultures than in 3D co-cultures. The naturally higher IL-8 prodn. in the co-cultures was enhanced even further by the Ag NPs. This study shows that it is possible to mimic inflamed conditions in a 3D co-culture model of the intestinal mucosa. The fact that it is based on three easily available human cell lines makes this model valuable to study the safety of nanomaterials in the context of inflammation.
- 190In, J. G.; Foulke-Abel, J.; Estes, M. K.; Zachos, N. C.; Kovbasnjuk, O.; Donowitz, M. Human Mini-Guts: New Insights into Intestinal Physiology and Host–pathogen Interactions. Nat. Rev. Gastroenterol. Hepatol. 2016, 13, 633– 642, DOI: 10.1038/nrgastro.2016.142[Crossref], [PubMed], [CAS], Google Scholar190https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC28XhsF2qsrfM&md5=c267c296105978fb71acb9ba7b7f31e9Human mini-guts: new insights into intestinal physiology and host-pathogen interactionsIn, Julie G.; Foulke-Abel, Jennifer; Estes, Mary K.; Zachos, Nicholas C.; Kovbasnjuk, Olga; Donowitz, MarkNature Reviews Gastroenterology & Hepatology (2016), 13 (11), 633-642CODEN: NRGHA9; ISSN:1759-5045. (Nature Publishing Group)The development of indefinitely propagating human 'mini-guts' has led to a rapid advance in gastrointestinal research related to transport physiol., developmental biol., pharmacol., and pathophysiol. These mini-guts, also called enteroids or colonoids, are derived from LGR5+ intestinal stem cells isolated from the small intestine or colon. Addn. of WNT3A and other growth factors promotes stemness and results in viable, physiol. functional human intestinal or colonic cultures that develop a crypt-villus axis and can be differentiated into all intestinal epithelial cell types. The success of research using human enteroids has highlighted the limitations of using animals or in vitro, cancer-derived cell lines to model transport physiol. and pathophysiol. For example, curative or preventive therapies for acute enteric infections have been limited, mostly due to the lack of a physiol. human intestinal model. However, the human enteroid model enables specific functional studies of secretion and absorption in each intestinal segment as well as observations of the earliest mol. events that occur during enteric infections. This Review describes studies characterizing these human mini-guts as a physiol. model to investigate intestinal transport and host-pathogen interactions.
- 191Kim, H. J.; Huh, D.; Hamilton, G.; Ingber, D. E. Human Gut-on-a-Chip Inhabited by Microbial Flora That Experiences Intestinal Peristalsis-like Motions and Flow. Lab Chip 2012, 12, 2165– 2174, DOI: 10.1039/c2lc40074j[Crossref], [PubMed], [CAS], Google Scholar191https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC38XnsFOntLk%253D&md5=e8af2c5cc2df26ff4e9e3ddc9aa43d37Human gut-on-a-chip inhabited by microbial flora that experiences intestinal peristalsis-like motions and flowKim, Hyun Jung; Huh, Dongeun; Hamilton, Geraldine; Ingber, Donald E.Lab on a Chip (2012), 12 (12), 2165-2174CODEN: LCAHAM; ISSN:1473-0189. (Royal Society of Chemistry)Development of an in vitro living cell-based model of the intestine that mimics the mech., structural, absorptive, transport and pathophysiol. properties of the human gut along with its crucial microbial symbionts could accelerate pharmaceutical development, and potentially replace animal testing. Here, we describe a biomimetic human gut-on-a-chip' microdevice composed of two microfluidic channels sepd. by a porous flexible membrane coated with extracellular matrix (ECM) and lined by human intestinal epithelial (Caco-2) cells that mimics the complex structure and physiol. of living intestine. The gut microenvironment is recreated by flowing fluid at a low rate (30 μL h-1) producing low shear stress (0.02 dyne cm-2) over the microchannels, and by exerting cyclic strain (10%; 0.15 Hz) that mimics physiol. peristaltic motions. Under these conditions, a columnar epithelium develops that polarizes rapidly, spontaneously grows into folds that recapitulate the structure of intestinal villi, and forms a high integrity barrier to small mols. that better mimics whole intestine than cells in cultured in static Transwell models. In addn., a normal intestinal microbe (Lactobacillus rhamnosus GG) can be successfully co-cultured for extended periods (>1 wk) on the luminal surface of the cultured epithelium without compromising epithelial cell viability, and this actually improves barrier function as previously obsd. in humans. Thus, this gut-on-a-chip recapitulates multiple dynamic phys. and functional features of human intestine that are crit. for its function within a controlled microfluidic environment that is amenable for transport, absorption, and toxicity studies, and hence it should have great value for drug testing as well as development of novel intestinal disease models.
- 192Nguyen, T. H. D.; Lin, M.; Mustapha, A. Toxicity of Graphene Oxide on Intestinal Bacteria and Caco-2 Cells. J. Food Prot. 2015, 78, 996– 1002, DOI: 10.4315/0362-028X.JFP-14-463[Crossref], [PubMed], [CAS], Google Scholar192https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2MXovVynsr8%253D&md5=316ac4a77198b04cba643fe432c4d629Toxicity of graphene oxide on intestinal bacteria and caco-2 cellsNguyen, Trang H. D.; Lin, Mengshi; Mustapha, AzlinJournal of Food Protection (2015), 78 (5), 996-1002CODEN: JFPRDR; ISSN:0362-028X. (International Association for Food Protection)In recent years, novel nanomaterials have received much attention due to their great potential for applications in agriculture, food safety, and food packaging. Among them, graphene and graphene oxide (GO) are emerging as promising nanomaterials that may have a profound impact on food packaging. However, there are some concerns from consumers and the scientific community about the potential toxicity and biocompatibility of nanomaterials. In this study, we investigated the antibacterial properties of GO against human intestinal bacteria. The cytotoxicity of GO was also studied in vitro using the Caco-2 cell line derived from a colon carcinoma. Electron microscopy was used to investigate the morphol. of GO and the interaction between GO flakes and Caco-2 cells. GO at different concns. (10 to 500 μg/mL) exhibited no toxicity against the selected bacteria and a mild cytotoxic action on Caco-2 cells after 24 h of exposure. The results show that weak adsorption of medium nutrients may contribute to GO's low toxicity. This study suggests that GO is biocompatible and has a potential to be used in agriculture and food science, indicating that more studies are needed to exploit its potential applications.
- 193Ruiz, O. N.; Fernando, K. A. S.; Wang, B.; Brown, N. A.; Luo, P. G.; McNamara, N. D.; Vangsness, M.; Sun, Y.-P.; Bunker, C. E. Graphene Oxide: A Nonspecific Enhancer of Cellular Growth. ACS Nano 2011, 5, 8100– 8107, DOI: 10.1021/nn202699t[ACS Full Text
 ], [CAS], Google Scholar193https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3MXht1ChtLjL&md5=3786cb6e4489747ae572db417fff6745Graphene Oxide: A Nonspecific Enhancer of Cellular GrowthRuiz, Oscar N.; Fernando, K. A. Shiral; Wang, Baojiang; Brown, Nicholas A.; Luo, Pengju George; McNamara, Nicholas D.; Vangsness, Marlin; Sun, Ya-Ping; Bunker, Christopher E.ACS Nano (2011), 5 (10), 8100-8107CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)There have been multiple conflicting reports about the biocompatibility and antimicrobial activity of graphene oxide. To address this, we conducted a study to characterize the antimicrobial properties of graphene oxide (GO) and its biocompatibility with mammalian cells. When GO was added to a bacterial culture at 25 μg/mL, the results showed that bacteria grew faster and to a higher optical d. than cultures without GO. SEM indicated that bacteria formed dense biofilms in the presence of GO. This was shown by a large mass of aggregated cells and extracellular polymeric material. Bacterial growth on filters coated with 25 and 75 μg of GO grew 2 and 3 times better than on filters without GO. Closer anal. showed that bacteria were able to attach and proliferate preferentially in areas contg. the highest GO levels. Graphene oxide films failed to produce growth inhibition zones around them, indicating a lack of antibacterial properties. Also, bacteria were able to grow on GO films to 9.5 × 109 cells from an initial inoculation of 1.0 × 106, indicating that it also lacks bacteriostatic activity. Thus, silver-coated GO films were able to produce clearing zones and cell death. Also, graphene oxide was shown to greatly enhance the attachment and proliferation of mammalian cells. This study conclusively demonstrates that graphene oxide does not have intrinsic antibacterial, bacteriostatic, and cytotoxic properties in both bacteria and mammalian cells. Furthermore, graphene oxide acts as a general enhancer of cellular growth by increasing cell attachment and proliferation.
], [CAS], Google Scholar193https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3MXht1ChtLjL&md5=3786cb6e4489747ae572db417fff6745Graphene Oxide: A Nonspecific Enhancer of Cellular GrowthRuiz, Oscar N.; Fernando, K. A. Shiral; Wang, Baojiang; Brown, Nicholas A.; Luo, Pengju George; McNamara, Nicholas D.; Vangsness, Marlin; Sun, Ya-Ping; Bunker, Christopher E.ACS Nano (2011), 5 (10), 8100-8107CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)There have been multiple conflicting reports about the biocompatibility and antimicrobial activity of graphene oxide. To address this, we conducted a study to characterize the antimicrobial properties of graphene oxide (GO) and its biocompatibility with mammalian cells. When GO was added to a bacterial culture at 25 μg/mL, the results showed that bacteria grew faster and to a higher optical d. than cultures without GO. SEM indicated that bacteria formed dense biofilms in the presence of GO. This was shown by a large mass of aggregated cells and extracellular polymeric material. Bacterial growth on filters coated with 25 and 75 μg of GO grew 2 and 3 times better than on filters without GO. Closer anal. showed that bacteria were able to attach and proliferate preferentially in areas contg. the highest GO levels. Graphene oxide films failed to produce growth inhibition zones around them, indicating a lack of antibacterial properties. Also, bacteria were able to grow on GO films to 9.5 × 109 cells from an initial inoculation of 1.0 × 106, indicating that it also lacks bacteriostatic activity. Thus, silver-coated GO films were able to produce clearing zones and cell death. Also, graphene oxide was shown to greatly enhance the attachment and proliferation of mammalian cells. This study conclusively demonstrates that graphene oxide does not have intrinsic antibacterial, bacteriostatic, and cytotoxic properties in both bacteria and mammalian cells. Furthermore, graphene oxide acts as a general enhancer of cellular growth by increasing cell attachment and proliferation. - 194Kucki, M.; Rupper, P.; Sarrieu, C.; Melucci, M.; Treossi, E.; Schwarz, A.; León, V.; Kraegeloh, A.; Flahaut, E.; Vázquez, E.; Palermo, V.; Wick, P. Interaction of Graphene-Related Materials with Human Intestinal Cells: An in Vitro Approach. Nanoscale 2016, 8, 8749– 8760, DOI: 10.1039/C6NR00319B
- 195Guarnieri, D.; Sánchez-Moreno, P.; Del Rio Castillo, A. E.; Bonaccorso, F.; Gatto, F.; Bardi, G.; Martín, C.; Vázquez, E.; Catelani, T.; Sabella, S.; Pompa, P. P. Biotransformation and Biological Interaction of Graphene and Graphene Oxide during Simulated Oral Ingestion. Small 2018, 14, 1800227, DOI: 10.1002/smll.201800227
- 196Nicholson, J. K.; Holmes, E.; Kinross, J.; Burcelin, R.; Gibson, G.; Jia, W.; Pettersson, S. Host-Gut Microbiota Metabolic Interactions. Science 2012, 336, 1262– 1267, DOI: 10.1126/science.1223813[Crossref], [PubMed], [CAS], Google Scholar196https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC38XnvFekt7c%253D&md5=a4383140dbfa427c36adb44d30add530Host-Gut Microbiota Metabolic InteractionsNicholson, Jeremy K.; Holmes, Elaine; Kinross, James; Burcelin, Remy; Gibson, Glenn; Jia, Wei; Pettersson, SvenScience (Washington, DC, United States) (2012), 336 (6086), 1262-1267CODEN: SCIEAS; ISSN:0036-8075. (American Association for the Advancement of Science)A review. The compn. and activity of the gut microbiota codevelop with the host from birth and is subject to a complex interplay that depends on the host genome, nutrition, and life-style. The gut microbiota is involved in the regulation of multiple host metabolic pathways, giving rise to interactive host-microbiota metabolic, signaling, and immune-inflammatory axes that physiol. connect the gut, liver, muscle, and brain. A deeper understanding of these axes is a prerequisite for optimizing therapeutic strategies to manipulate the gut microbiota to combat disease and improve health.
- 197Chen, H.; Zhao, R.; Wang, B.; Zheng, L.; Ouyang, H.; Wang, H.; Zhou, X.; Zhang, D.; Chai, Z.; Zhao, Y.; Feng, W. Acute Oral Administration of Single-Walled Carbon Nanotubes Increases Intestinal Permeability and Inflammatory Responses: Association with the Changes in Gut Microbiota in Mice. Adv. Healthcare Mater. 2018, 7, 1701313, DOI: 10.1002/adhm.201701313
- 198Kreyling, W. G.; Semmler-Behnke, M.; Takenaka, S.; Möller, W. Differences in the Biokinetics of Inhaled Nano- versus Micrometer-Sized Particles. Acc. Chem. Res. 2013, 46, 714– 722, DOI: 10.1021/ar300043r
- 199Hougaard, K. S.; Campagnolo, L.; Fadeel, B.; Gulumian, M.; Kagan, V. E.; Møller, P.; Jacobsen, N. R.; Savolainen, K. M. Developmental Toxicity of Engineered Nanomaterials. Reprod. Dev. Toxicol. 2017, 333– 357, DOI: 10.1016/B978-0-12-804239-7.00019-6
- 200Ema, M.; Kobayashi, N.; Naya, M.; Hanai, S.; Nakanishi, J. Reproductive and Developmental Toxicity Studies of Manufactured Nanomaterials. Reprod. Toxicol. 2010, 30, 343– 352, DOI: 10.1016/j.reprotox.2010.06.002[Crossref], [PubMed], [CAS], Google Scholar200https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3cXhtFGhtbvO&md5=b42c5a954d1de15dfbecb055928f7f9dReproductive and developmental toxicity studies of manufactured nanomaterialsEma, Makoto; Kobayashi, Norihiro; Naya, Masato; Hanai, Sosuke; Nakanishi, JunkoReproductive Toxicology (2010), 30 (3), 343-352CODEN: REPTED; ISSN:0890-6238. (Elsevier B.V.)A review. This paper reviews studies in vivo and in vitro on the reproductive and developmental toxicity of manufd. nanomaterials including metallic and metal oxide-based particles, fullerenes (C60), carbon black (CB), and luminescent particles. Studies in vivo showed increased allergic susceptibility in offspring of mouse dams intranasally insufflated with respirable-size titanium dioxide (TiO2), adverse effects on spermatogenesis and histopathol. changes in the testes and changes in gene expression in the brain of mouse offspring after maternal s.c. injection of TiO2 nanoparticles, transfer to rat fetuses of radiolabeled gold nanoparticles and C60 after maternal i.v. injection, death and morphol. abnormalities in mouse embryos after maternal i.p. injection of C60, and adverse effects on spermatogenesis in mouse offspring after maternal intratracheal instillation of CB nanoparticles. Studies in vitro revealed that TiO2 and CB nanoparticles affected the viability of mouse Leydig cells, that gold nanoparticles reduced the motility of human sperm, that silver, aluminum, and molybdenum trioxide were toxic to mouse spermatogonia stem cells, that silica nanoparticles and C60 inhibited the differentiation of mouse embryonic stem cells and midbrain cells, resp., and that cadmium selenium-core quantum dots inhibited pre- and postimplantation development of mouse embryos. Although this paper provides initial information on the potential reproductive and developmental toxicity of manufd. nanomaterials, further studies, esp. in vivo, using characterized nanoparticles, relevant routes of administration, and doses closely reflecting expected levels of exposure are needed.
- 201Liang, S.; Xu, S.; Zhang, D.; He, J.; Chu, M. Reproductive Toxicity of Nanoscale Graphene Oxide in Male Mice. Nanotoxicology 2015, 9, 92– 105, DOI: 10.3109/17435390.2014.893380
- 202Skovmand, A.; Jacobsen Lauvås, A.; Christensen, P.; Vogel, U.; Sørig Hougaard, K.; Goericke-Pesch, S. Pulmonary Exposure to Carbonaceous Nanomaterials and Sperm Quality. Part. Part. Fibre Toxicol. 2018, 15, 10, DOI: 10.1186/s12989-018-0242-8[Crossref], [PubMed], [CAS], Google Scholar202https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC1cXitFOku7bM&md5=231f96118742e1479a368f27a181fba4Pulmonary exposure to carbonaceous nanomaterials and sperm qualitySkovmand, Astrid; Lauvaes, Anna Jacobsen; Christensen, Preben; Vogel, Ulla; Hougaard, Karin Soerig; Goericke-Pesch, SandraParticle and Fibre Toxicology (2018), 15 (), 10/1-10/12CODEN: PFTABQ; ISSN:1743-8977. (BioMed Central Ltd.)Background: Semen quality parameters are potentially affected by nanomaterials in several ways: Inhaled nanosized particles are potent inducers of pulmonary inflammation, leading to the release of inflammatory mediators. Small amts. of particles may translocate from the lungs into the lung capillaries, enter the systemic circulation and ultimately reach the testes. Both the inflammatory response and the particles may induce oxidative stress which can directly affect spermatogenesis. Furthermore, spermatogenesis may be indirectly affected by changes in the hormonal milieu as systemic inflammation is a potential modulator of endocrine function. The aim of this study was to investigate the effects of pulmonary exposure to carbonaceous nanomaterials on sperm quality parameters in an exptl. mouse model. Methods: Effects on sperm quality after pulmonary inflammation induced by carbonaceous nanomaterials were investigated by intratracheally instilling sexually mature male NMRI mice with four different carbonaceous nanomaterials dispersed in nanopure water: graphene oxide (18 μg/mouse/i.t.), Flammruss 101, Printex 90 and SRM1650b (0.1 mg/mouse/i.t. each) weekly for seven consecutive weeks. Pulmonary inflammation was detd. by differential cell count in bronchoalveolar lavage fluid. Epididymal sperm concn. and motility were measured by computer-assisted sperm anal. Epididymal sperm viability and morphol. abnormalities were assessed manually using Hoechst 33,342/PI flourescent and Spermac staining, resp. Epididymal sperm were assessed with regard to sperm DNA integrity (damage). Daily sperm prodn. was measured in the testis, and testosterone levels were measured in blood plasma by ELISA. Results: Neutrophil nos. in the bronchoalveolar fluid showed sustained inflammatory response in the nanoparticleexposed groups one week after the last instillation. No significant changes in epididymal sperm parameters, daily sperm prodn. or plasma testosterone levels were found. Conclusion: Despite the sustained pulmonary inflammatory response, an eight week exposure to graphene oxide, Flammruss 101, Printex 90 and the diesel particle SRM1650b in the present study did not appear to affect semen parameters, daily sperm prodn. or testosterone concn. in male NMRI mice.
- 203Xu, S.; Zhang, Z.; Chu, M. Long-Term Toxicity of Reduced Graphene Oxide Nanosheets: Effects on Female Mouse Reproductive Ability and Offspring Development. Biomaterials 2015, 54, 188– 200, DOI: 10.1016/j.biomaterials.2015.03.015
- 204Chen, Y.; Hu, X.; Sun, J.; Zhou, Q. Specific Nanotoxicity of Graphene Oxide during Zebrafish Embryogenesis. Nanotoxicology 2016, 10, 42– 52, DOI: 10.3109/17435390.2015.1005032[Crossref], [PubMed], [CAS], Google Scholar204https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC28Xjs12mtrc%253D&md5=674566476ae7831ba8709a90c408c0b1Specific nanotoxicity of graphene oxide during zebrafish embryogenesisChen, Yuming; Hu, Xiangang; Sun, Jing; Zhou, QixingNanotoxicology (2016), 10 (1), 42-52CODEN: NANOGK; ISSN:1743-5404. (Taylor & Francis Ltd.)Graphene oxide (GO) has shown great potential for biol., medical, energy and electronic applications. As a consequence of these diverse applications, GO release into the ecosystem is inevitable; however, the corresponding risks are largely unknown, particularly with respect to the crit. period of embryogenesis. This study revealed that GO adhered to and enveloped the chorion of zebrafish embryos mainly via hydroxyl group interactions, blocked the pore canals of the chorionic membrane, and caused marked hypoxia and hatching delay. Furthermore, GO spontaneously penetrated the chorion, entered the embryo via endocytosis, damaged the mitochondria and primarily translocated to the eye, heart and yolk sac regions, which are involved in the circulatory system of zebrafish. In these organs, GO induced excessive generation of reactive oxygen species and increased oxidative stress, DNA damage and apoptosis. Graphene oxide also induced developmental malformation of the eye, cardiac/yolk sac edema, tail flexure and heart rate redn. In contrast to the common dose-effect relationships of nanoparticles, the adverse effects of GO on heart rate and tail/spinal cord flexure increased and then decreased as the GO concn. increased. These findings emphasize the specific adverse effects of GO on embryogenesis and highlight the potential ecol. and health risks of GO.
- 205Chwalibog, A.; Wierzbicki, M.; Sawosz, E.; Grodzik, M.; Hotowy, A.; Prasek, M.; Jaworski, S.; Sawosz, F. Carbon Nanoparticles Downregulate Expression of Basic Fibroblast Growth Factor in the Heart during Embryogenesis. Int. J. Nanomed. 2013, 8, 3427– 3435, DOI: 10.2147/IJN.S49745
- 206Muoth, C.; Aengenheister, L.; Kucki, M.; Wick, P.; Buerki-Thurnherr, T. Nanoparticle Transport across the Placental Barrier: Pushing the Field Forward!. Nanomedicine 2016, 11, 941– 957, DOI: 10.2217/nnm-2015-0012
- 207Huang, X.; Zhang, F.; Sun, X.; Choi, K.-Y.; Niu, G.; Zhang, G.; Guo, J.; Lee, S.; Chen, X. The Genotype-Dependent Influence of Functionalized Multiwalled Carbon Nanotubes on Fetal Development. Biomaterials 2014, 35, 856– 865, DOI: 10.1016/j.biomaterials.2013.10.027
- 208Qi, W.; Bi, J.; Zhang, X.; Wang, J.; Wang, J.; Liu, P.; Li, Z.; Wu, W. Damaging Effects of Multi-Walled Carbon Nanotubes on Pregnant Mice with Different Pregnancy Times. Sci. Rep. 2015, 4, 4352, DOI: 10.1038/srep04352
- 209Campagnolo, L.; Massimiani, M.; Palmieri, G.; Bernardini, R.; Sacchetti, C.; Bergamaschi, A.; Vecchione, L.; Magrini, A.; Bottini, M.; Pietroiusti, A. Biodistribution and Toxicity of Pegylated Single Wall Carbon Nanotubes in Pregnant Mice. Part. Part. Fibre Toxicol. 2013, 10, 21, DOI: 10.1186/1743-8977-10-21[Crossref], [PubMed], [CAS], Google Scholar209https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3sXhtVSrsrbL&md5=6b49b09365f66eea92407a2d424cad33Biodistribution and toxicity of pegylated single wall carbon nanotubes in pregnant miceCampagnolo, Luisa; Massimiani, Micol; Palmieri, Graziana; Bernardini, Roberta; Sacchetti, Cristiano; Bergamaschi, Antonio; Vecchione, Lucia; Magrini, Andrea; Bottini, Massimo; Pietroiusti, AntonioParticle and Fibre Toxicology (2013), 10 (), 21CODEN: PFTABQ; ISSN:1743-8977. (BioMed Central Ltd.)Background: Single wall carbon nanotubes (SWCNTs) are considered promising nanoparticles for industrial and biomedical applications; however their potential toxicity in several biol. systems, including the feto-placental unit, has been demonstrated. Functionalization of SWCNTs with polyethylene glycol chains (PEG-SWCNTs) dramatically reduces their toxicity, and for this reason PEG-SWCNTs are candidates for biomedical applications. However, no data are available on their safety for the developing embryo, in spite of the clin. and social relevance of this topic. The purpose of this study is therefore to investigate the safety of PEG-SWCNTs for their use as biomedical carriers in pregnancy. Methods: For toxicol. studies, amino-functionalized PEG-SWCNT were i.v. injected in CD1 pregnant mice at different doses (range 0.1-30 μg/mouse), in single or multiple administrations. For biodistribution studies, fluorescently labeled PEG-SWCNTs were obtained by acylation of terminal PEG amino groups with near IR emitting fluorochromes (PEG-SWCNT-750) and injected at the dosage of 10 μg/mouse, at either day 5.5 (when the placenta is still developing) or day 14.5 of gestation (when the maturation of the placenta is complete). Results: We found no adverse effects both on embryos and dams up to the dose of 10 μg/mouse. At the dose of 30 μg/mouse, occasional teratogenic effects, assocd. with placental damage, were detected both when administered as a single bolus (1 out of 10 dams; 1 malformed embryo) or as multiple doses (2 out of 10 dams; 5 malformed embryos). The difference in the prevalence of dams with malformed embryos between the 30 μg exposed group and controls approached the statistical significance (p = 0.06). Hepatic damage in dams was seen only in the multiple exposure group (4 out of 10; p = 0.04 when compared with the single exposure group or controls). PEG-SWCNT-750 reached the conceptus when administered early in pregnancy. At later stages, PEGSWCNT-750 were detected in the placenta and the yolk sac, but not in the embryo. Conclusions: PEG-SWCNTs may cause occasional teratogenic effects in mice beyond a threshold dose. Such effect might depend on their ability to reach the feto-placenta unit. Although not automatically transferable to humans, these data should be considered if exposing women during pregnancy.
- 210Philbrook, N. A.; Walker, V. K.; Afrooz, A. R. M. N.; Saleh, N. B.; Winn, L. M. Investigating the Effects of Functionalized Carbon Nanotubes on Reproduction and Development in Drosophila Melanogaster and CD-1 Mice. Reprod. Toxicol. 2011, 32, 442– 448, DOI: 10.1016/j.reprotox.2011.09.002[Crossref], [PubMed], [CAS], Google Scholar210https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3MXhsFegtrbO&md5=a4e88361f1f1226306a4a5ffb92f778cInvestigating the effects of functionalized carbon nanotubes on reproduction and development in Drosophila melanogaster and CD-1 micePhilbrook, Nicola A.; Walker, Virginia K.; Afrooz, A. R. M. Nabiul; Saleh, Navid B.; Winn, Louise M.Reproductive Toxicology (2011), 32 (4), 442-448CODEN: REPTED; ISSN:0890-6238. (Elsevier B.V.)Despite numerous applications for functionalized carbon nanotubes (fCNTs) in consumer products, such as electronics, and food packaging, as well as their development as drug delivery vehicles, the consequence of their uptake by living systems has been understudied. In particular, the impact of fCNTs on early development of different species is largely unknown. Here we investigated the effect of ingested hydroxyl-fCNTs on reprodn. and development in two model organisms: Drosophila and CD-1 mice. While fCNTs had no measurable impact on Drosophila, a single oral dose of fCNTs (10 mg/kg) administered to pregnant CD-1 dams during organogenesis significantly increased the no. of resorptions and resulted in fetal morphol. and skeletal abnormalities. The obsd. difference between the responses of these two models likely reflects their physiol. and/or differences in administration. This research underscores the need to examine the effects of fCNTs on reproductive health and development before the opportunities for maternal exposure by fCNTs increase further.
- 211Fu, C.; Liu, T.; Li, L.; Liu, H.; Liang, Q.; Meng, X. Effects of Graphene Oxide on the Development of Offspring Mice in Lactation Period. Biomaterials 2015, 40, 23– 31, DOI: 10.1016/j.biomaterials.2014.11.014[Crossref], [PubMed], [CAS], Google Scholar211https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2cXitVaktbjO&md5=4b0fb5267503a73aa1eea996c0221b3dEffects of graphene oxide on the development of offspring mice in lactation periodFu, Changhui; Liu, Tianlong; Li, Linlin; Liu, Huiyu; Liang, Qinghua; Meng, XianweiBiomaterials (2015), 40 (), 23-31CODEN: BIMADU; ISSN:0142-9612. (Elsevier Ltd.)The potential toxicity of graphene oxide (GO) has attracted much attention with numerous promising biomedical applications in recent years. However, information about GO on the development of filial animals is rare. In this work, we studied the potential developmental toxicity of GO when they entered the body of maternal mice and their offspring by oral exposure with two doses. The results showed that the increase of body wt., body length and tail length of the filial mice received GO at 0.5 mg mL-1 (about 0.8 mg each mouse) every day in the lactation period was significantly retarded comparing with the control group. The anatomy and histol. results revealed the delayed developments of offspring in high dosage group. We also evaluated the possible toxicol. mechanism caused by GO and found that the length of the intestinal villus of the filial mice received high concn. GO were decreased significantly compared with the control group. It can be concluded that GO showed many neg. effects on the development of mice in the lactation period. These findings can be significant for the development of graphene materials-based drug delivery system and other biomedical applications in the future.
- 212Kucki, M.; Aengenheister, L.; Diener, L.; Rippl, A. V.; Vranic, S.; Newman, L.; Vazquez, E.; Kostarelos, K.; Wick, P.; Buerki-Thurnherr, T. Impact of Graphene Oxide on Human Placental Trophoblast Viability, Functionality and Barrier Integrity. 2D Mater. 2018, 5, 035014, DOI: 10.1088/2053-1583/aab9e2
- 213Mendonça, M. C. P.; Soares, E. S.; de Jesus, M. B.; Ceragioli, H. J.; Ferreira, M. S.; Catharino, R. R.; da Cruz-Höfling, M. A. Reduced Graphene Oxide Induces Transient Blood–brain Barrier Opening: An in Vivo Study. J. Nanobiotechnol. 2015, 13, 78, DOI: 10.1186/s12951-015-0143-z[Crossref], [PubMed], [CAS], Google Scholar213https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC28XitVKisLnN&md5=1522e6c2bc44964d1ebef3909830a8c4Reduced graphene oxide induces transient blood-brain barrier opening: an in vivo studyMendonca, Monique Culturato Padilha; Soares, Edilene Siqueira; de Jesus, Marcelo Bispo; Ceragioli, Helder Jose; Ferreira, Monica Siqueira; Catharino, Rodrigo Ramos; da Cruz-Hoefling, Maria AliceJournal of Nanobiotechnology (2015), 13 (), 78/1-78/13CODEN: JNOAAO; ISSN:1477-3155. (BioMed Central Ltd.)Background: The blood-brain barrier (BBB) is a complex phys. and functional barrier protecting the central nervous system from phys. and chem. insults. Nevertheless, it also constitutes a barrier against therapeutics for treating neurol. disorders. In this context, nanomaterial-based therapy provides a potential alternative for overcoming this problem. Graphene family has attracted significant interest in nanomedicine because their unique physicochem. properties make them amenable to applications in drug/gene delivery and neural interface. Results: In this study, reduced graphene oxide (rGO) systemically-injected was found mainly located in the thalamus and hippocampus of rats. The entry of rGO involved a transitory decrease in the BBB paracellular tightness, as demonstrated at anatomical (Evans blue dye infusion), subcellular (transmission electron microscopy) and mol. (junctional protein expression) levels. Addnl., we examd. the usefulness of matrix-assisted laser desorption/ionization (MALDI) mass spectrometry imaging (MSI) as a new imaging method for detecting the temporal distribution of nanomaterials throughout the brain. Conclusions: rGO was able to be detected and monitored in the brain over time provided by a novel application for MALDI-MSI and could be a useful tool for treating a variety of brain disorders that are normally unresponsive to conventional treatment because of BBB impermeability.
- 214Pietroiusti, A.; Massimiani, M.; Fenoglio, I.; Colonna, M.; Valentini, F.; Palleschi, G.; Camaioni, A.; Magrini, A.; Siracusa, G.; Bergamaschi, A.; Sgambato, A.; Campagnolo, L. Low Doses of Pristine and Oxidized Single-Wall Carbon Nanotubes Affect Mammalian Embryonic Development. ACS Nano 2011, 5, 4624– 4633, DOI: 10.1021/nn200372g[ACS Full Text
 ], [CAS], Google Scholar214https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3MXmvFKqtbg%253D&md5=1f419d8ce7dc23fe075d9dc129a1ac81Low Doses of Pristine and Oxidized Single-Wall Carbon Nanotubes Affect Mammalian Embryonic DevelopmentPietroiusti, Antonio; Massimiani, Micol; Fenoglio, Ivana; Colonna, Massimiliano; Valentini, Federica; Palleschi, Giuseppe; Camaioni, Antonella; Magrini, Andrea; Siracusa, Gregorio; Bergamaschi, Antonio; Sgambato, Alessandro; Campagnolo, LuisaACS Nano (2011), 5 (6), 4624-4633CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)Several in vitro and in vivo studies suggest local and systemic effects following exposure to carbon nanotubes. No data are available, however, on their possible embryotoxicity in mammals. In this study, the authors tested the effect of pristine and oxidized single-wall carbon nanotubes (SWCNTs) on the development of the mouse embryo. To this end, SWCNTs (from 10 ng to 30 μg/mouse) were administered to female mice soon after implantation (postcoital day 5.5); 10 days later, animals were sacrificed, and uteri, placentas, and fetuses examd. A high percentage of early miscarriages and fetal malformations was obsd. in females exposed to oxidized SWCNTs, while lower percentages were found in animals exposed to the pristine material. The lowest ED was 100 ng/mouse. Extensive vascular lesions and increased prodn. of reactive oxygen species (ROS) were detected in placentas of malformed but not of normally developed fetuses. Increased ROS levels were likewise detected in malformed fetuses. No increased ROS prodn. or evident morphol. alterations were obsd. in maternal tissues. No fetal and placental abnormalities were ever obsd. in control animals. In parallel, SWCNT embryotoxicity was evaluated using the embryonic stem cell test (EST), a validated in vitro assay developed for predicting embryotoxicity of sol. chem. compds., but never applied in full to nanoparticles. The EST predicted the in vivo data, identifying oxidized SWCNTs as the more toxic compd.
], [CAS], Google Scholar214https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3MXmvFKqtbg%253D&md5=1f419d8ce7dc23fe075d9dc129a1ac81Low Doses of Pristine and Oxidized Single-Wall Carbon Nanotubes Affect Mammalian Embryonic DevelopmentPietroiusti, Antonio; Massimiani, Micol; Fenoglio, Ivana; Colonna, Massimiliano; Valentini, Federica; Palleschi, Giuseppe; Camaioni, Antonella; Magrini, Andrea; Siracusa, Gregorio; Bergamaschi, Antonio; Sgambato, Alessandro; Campagnolo, LuisaACS Nano (2011), 5 (6), 4624-4633CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)Several in vitro and in vivo studies suggest local and systemic effects following exposure to carbon nanotubes. No data are available, however, on their possible embryotoxicity in mammals. In this study, the authors tested the effect of pristine and oxidized single-wall carbon nanotubes (SWCNTs) on the development of the mouse embryo. To this end, SWCNTs (from 10 ng to 30 μg/mouse) were administered to female mice soon after implantation (postcoital day 5.5); 10 days later, animals were sacrificed, and uteri, placentas, and fetuses examd. A high percentage of early miscarriages and fetal malformations was obsd. in females exposed to oxidized SWCNTs, while lower percentages were found in animals exposed to the pristine material. The lowest ED was 100 ng/mouse. Extensive vascular lesions and increased prodn. of reactive oxygen species (ROS) were detected in placentas of malformed but not of normally developed fetuses. Increased ROS levels were likewise detected in malformed fetuses. No increased ROS prodn. or evident morphol. alterations were obsd. in maternal tissues. No fetal and placental abnormalities were ever obsd. in control animals. In parallel, SWCNT embryotoxicity was evaluated using the embryonic stem cell test (EST), a validated in vitro assay developed for predicting embryotoxicity of sol. chem. compds., but never applied in full to nanoparticles. The EST predicted the in vivo data, identifying oxidized SWCNTs as the more toxic compd. - 215Schmidt, A.; Morales-Prieto, D. M.; Pastuschek, J.; Fröhlich, K.; Markert, U. R. Only Humans Have Human Placentas: Molecular Differences between Mice and Humans. J. Reprod. Immunol. 2015, 108, 65– 71, DOI: 10.1016/j.jri.2015.03.001[Crossref], [PubMed], [CAS], Google Scholar215https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2MXksV2iu7o%253D&md5=3d6a128a9ffa0e85fae95020b42518a5Only humans have human placentas: molecular differences between mice and humansSchmidt, Andre; Morales-Prieto, Diana M.; Pastuschek, Jana; Froehlich, Karolin; Markert, Udo R.Journal of Reproductive Immunology (2015), 108 (), 65-71CODEN: JRIMDR; ISSN:0165-0378. (Elsevier Ireland Ltd.)The placenta is one of the organs with the highest evolutionary diversity among animal species. In consequence, an animal model that reflects human placentation exactly does not exist. However, the mouse is the most frequently used animal model for placenta and pregnancy research. It possesses a hemochorial placenta, which is similar, but also different from the human placenta. The question whether the similarities are sufficient for the achievement of useful results with regard to human pregnancy was debated recently at the 11th Congress of the European Society for Reproductive Immunol. (Budapest, Hungary). Here, we discuss the mol. features of the human placenta that are restricted to primates or even to humans. Many of the primate-specific genetic novelties, e.g., the large microRNA cluster on chromosome 19, have been detected during the last 10-15 years and could not be referred to in earlier discussions. Now, in the light of recent findings and a better understanding of interspecies differences, we conclude that the mouse model is often overvalued. Owing to the increasing no. of known human-specific factors in human placentation we consider that many aspects of human placentation can only be understood on the basis of expts. on human cells and tissues in combination with data collections from human subject studies.
- 216Scaini, D.; Ballerini, L. Nanomaterials at the Neural Interface. Curr. Opin. Neurobiol. 2018, 50, 50– 55, DOI: 10.1016/j.conb.2017.12.009[Crossref], [PubMed], [CAS], Google Scholar216https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2sXitVCmsbvF&md5=3a19385eebf419c45bd5130134ccd4d5Nanomaterials at the neural interfaceScaini, Denis; Ballerini, LauraCurrent Opinion in Neurobiology (2018), 50 (), 50-55CODEN: COPUEN; ISSN:0959-4388. (Elsevier Ltd.)Interfacing the nervous system with devices able to efficiently record or modulate the elec. activity of neuronal cells represents the underlying foundation of future theranostic applications in neurol. and of current openings in neuroscience research. These devices, usually sensing cell activity via microelectrodes, should be characterized by safe working conditions in the biol. milieu together with a well-controlled operation-life. The stable device/neuronal elec. coupling at the interface requires tight interactions between the electrode surface and the cell membrane. This neuro-electrode hybrid represents the hyphen between the soft nature of neural tissue, generating elec. signals via ion motions, and the rigid realm of microelectronics and medical devices, dealing with electrons in motion. Efficient integration of these entities is essential for monitoring, analyzing and controlling neuronal signaling but poses significant technol. challenges. Improving the cell/electrode interaction and thus the interface performance requires novel engineering of (nano)materials: tuning at the nanoscale electrode's properties may lead to engineer interfacing probes that better camouflaged with their biol. target. In this brief review, we highlight the most recent concepts in nanotechnologies and nanomaterials that might help reducing the mismatch between tissue and electrode, focusing on the device's mech. properties and its biol. integration with the tissue.
- 217Rauti, R.; Lozano, N.; León, V.; Scaini, D.; Musto, M.; Rago, I.; Ulloa Severino, F. P.; Fabbro, A.; Casalis, L.; Vázquez, E.; Kostarelos, K.; Prato, M.; Ballerini, L. Graphene Oxide Nanosheets Reshape Synaptic Function in Cultured Brain Networks. ACS Nano 2016, 10, 4459– 4471, DOI: 10.1021/acsnano.6b00130[ACS Full Text
 ], [CAS], Google Scholar217https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC28Xlt1Gjtrg%253D&md5=08a16f99ced41f8cdcb9a78856027191Graphene Oxide Nanosheets Reshape Synaptic Function in Cultured Brain NetworksRauti, Rossana; Lozano, Neus; Leon, Veronica; Scaini, Denis; Musto, Mattia; Rago, Ilaria; Ulloa Severino, Francesco P.; Fabbro, Alessandra; Casalis, Loredana; Vazquez, Ester; Kostarelos, Kostas; Prato, Maurizio; Ballerini, LauraACS Nano (2016), 10 (4), 4459-4471CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)Graphene offers promising advantages for biomedical applications. However, adoption of graphene technol. in biomedicine also poses important challenges in terms of understanding cell responses, cellular uptake, or the intracellular fate of sol. graphene derivs. In the biol. microenvironment, graphene nanosheets might interact with exposed cellular and subcellular structures, resulting in unexpected regulation of sophisticated biol. signaling. More broadly, biomedical devices based on the design of these 2D planar nanostructures for interventions in the central nervous system require an accurate understanding of their interactions with the neuronal milieu. Here, we describe the ability of graphene oxide nanosheets to down-regulate neuronal signaling without affecting cell viability.
], [CAS], Google Scholar217https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC28Xlt1Gjtrg%253D&md5=08a16f99ced41f8cdcb9a78856027191Graphene Oxide Nanosheets Reshape Synaptic Function in Cultured Brain NetworksRauti, Rossana; Lozano, Neus; Leon, Veronica; Scaini, Denis; Musto, Mattia; Rago, Ilaria; Ulloa Severino, Francesco P.; Fabbro, Alessandra; Casalis, Loredana; Vazquez, Ester; Kostarelos, Kostas; Prato, Maurizio; Ballerini, LauraACS Nano (2016), 10 (4), 4459-4471CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)Graphene offers promising advantages for biomedical applications. However, adoption of graphene technol. in biomedicine also poses important challenges in terms of understanding cell responses, cellular uptake, or the intracellular fate of sol. graphene derivs. In the biol. microenvironment, graphene nanosheets might interact with exposed cellular and subcellular structures, resulting in unexpected regulation of sophisticated biol. signaling. More broadly, biomedical devices based on the design of these 2D planar nanostructures for interventions in the central nervous system require an accurate understanding of their interactions with the neuronal milieu. Here, we describe the ability of graphene oxide nanosheets to down-regulate neuronal signaling without affecting cell viability. - 218Bramini, M.; Sacchetti, S.; Armirotti, A.; Rocchi, A.; Vázquez, E.; León Castellanos, V.; Bandiera, T.; Cesca, F.; Benfenati, F. Graphene Oxide Nanosheets Disrupt Lipid Composition, Ca 2+ Homeostasis, and Synaptic Transmission in Primary Cortical Neurons. ACS Nano 2016, 10, 7154– 7171, DOI: 10.1021/acsnano.6b03438
- 219High, B.; Cole, A. A.; Chen, X.; Reese, T. S. Electron Microscopic Tomography Reveals Discrete Transcleft Elements at Excitatory and Inhibitory Synapses. Front. Synaptic Neurosci. 2015, 7, 9, DOI: 10.3389/fnsyn.2015.00009[Crossref], [PubMed], [CAS], Google Scholar219https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A280%3ADC%252BC2MbnsV2lsw%253D%253D&md5=41b2a1ff44d8a7c62f28cda84068ae20Electron microscopic tomography reveals discrete transcleft elements at excitatory and inhibitory synapsesHigh Brigit; Chen Xiaobing; Reese Thomas S; Cole Andy AFrontiers in synaptic neuroscience (2015), 7 (), 9 ISSN:1663-3563.Electron microscopy has revealed an abundance of material in the clefts of synapses in the mammalian brain, and the biochemical and functional characteristics of proteins occupying synaptic clefts are well documented. However, the detailed spatial organization of the proteins in the synaptic clefts remains unclear. Electron microscope tomography provides a way to delineate and map the proteins spanning the synaptic cleft because freeze substitution preserves molecular details with sufficient contrast to visualize individual cleft proteins. Segmentation and rendering of electron dense material connected across the cleft reveals discrete structural elements that are readily classified into five types at excitatory synapses and four types at inhibitory synapses. Some transcleft elements resemble shapes and sizes of known proteins and could represent single dimers traversing the cleft. Some of the types of cleft elements at inhibitory synapses roughly matched the structure and proportional frequency of cleft elements at excitatory synapses, but the patterns of deployments in the cleft are quite different. Transcleft elements at excitatory synapses were often evenly dispersed in clefts of uniform (18 nm) width but some types show preference for the center or edges of the cleft. Transcleft elements at inhibitory synapses typically were confined to a peripheral region of the cleft where it narrowed to only 6 nm wide. Transcleft elements in both excitatory and inhibitory synapses typically avoid places where synaptic vesicles attach to the presynaptic membrane. These results illustrate that elements spanning synaptic clefts at excitatory and inhibitory synapses consist of distinct structures arranged by type in a specific but different manner at excitatory and inhibitory synapses.
- 220Falchi, A. M.; Sogos, V.; Saba, F.; Piras, M.; Congiu, T.; Piludu, M. Astrocytes Shed Large Membrane Vesicles That Contain Mitochondria, Lipid Droplets and ATP. Histochem. Cell Biol. 2013, 139, 221– 231, DOI: 10.1007/s00418-012-1045-x[Crossref], [PubMed], [CAS], Google Scholar220https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3sXhvV2nuro%253D&md5=5cfc41682abb1e7410ae68f9f63cb035Astrocytes shed large membrane vesicles that contain mitochondria, lipid droplets and ATPFalchi, Angela Maria; Sogos, Valeria; Saba, Francesca; Piras, Monica; Congiu, Terenzio; Piludu, MarcoHistochemistry and Cell Biology (2013), 139 (2), 221-231CODEN: HCBIFP; ISSN:0948-6143. (Springer)Various cells types, including stem and progenitor cells, can exchange complex information via plasma membrane-derived vesicles, which can carry signals both in their limiting membrane and lumen. Astrocytes, traditionally regarded as mere supportive cells, play previously unrecognized functions in neuronal modulation and are capable of releasing signalling mols. of different functional significance. In the present study, we provide direct evidence that human fetal astrocytes in culture, expressing the same feature as immature and reactive astrocytes, release membrane vesicles larger than the microvesicles described up to now. We found that these large vesicles, ranging from 1-5 to 8 μm in diam. and expressing on their surface β1-integrin proteins, contain mitochondria and lipid droplets together with ATP. We documented vesicle content with fluorescent-specific dyes and with the immunocytochem. technique we confirmed that mitochondria and lipid droplets were co-localized in the same vesicle. SEM and transmission electron microscopy confirmed that astrocytes shed from surface membrane vesicles of the same size as the ones detected by fluorescence microscopy. Our results report for the first time that cultured astrocytes, activated by repetitive stimulation of ATP released from neighboring cells, shed from their surface large membrane vesicles contg. mitochondria and lipid droplets.
- 221Antonyak, M. A.; Cerione, R. A. Microvesicles as Mediators of Intercellular Communication in Cancer. Methods Mol. Biol. 2014, 1165, 147– 173, DOI: 10.1007/978-1-4939-0856-1_11[Crossref], [PubMed], [CAS], Google Scholar221https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A280%3ADC%252BC2cjjvFertQ%253D%253D&md5=526160258bdbe772ef24a18f51b6b9e0Microvesicles as mediators of intercellular communication in cancerAntonyak Marc A; Cerione Richard AMethods in molecular biology (Clifton, N.J.) (2014), 1165 (), 147-73 ISSN:.The discovery that cancer cells generate large membrane-enclosed packets of epigenetic information, known as microvesicles (MVs), that can be transferred to other cells and influence their behavior (Antonyak et al., Small GTPases 3:219-224, 2012; Cocucci et al., Trends Cell Biol 19:43-51, 2009; Rak, Semin Thromb Hemost 36:888-906, 2010; Skog et al., Nat Cell Biol 10:1470-1476, 2008) has added a unique perspective to the classical paracrine signaling paradigm. This is largely because, in addition to growth factors and cytokines, MVs contain a variety of components that are not usually thought to be released into the extracellular environment by viable cells including plasma membrane-associated proteins, cytosolic- and nuclear-localized proteins, as well as nucleic acids, particularly RNA transcripts and micro-RNAs (Skog et al., Nat Cell Biol 10:1470-1476, 2008; Al-Nedawi et al., Nat Cell Biol 10:619-624, 2008; Antonyak et al., Proc Natl Acad Sci U S A 108:4852-4857, 2011; Balaj et al., Nat Commun 2:180, 2011; Choi et al., J Proteome Res 6:4646-4655, 2007; Del Conde et al., Blood 106:1604-1611, 2005; Gallo et al., PLoS One 7:e30679, 2012; Graner et al., FASEB J 23:1541-1557, 2009; Grange et al., Cancer Res 71:5346-5356, 2011; Hosseini-Beheshti et al., Mol Cell Proteomics 11:863-885, 2012; Martins et al., Curr Opin Oncol 25:66-75, 2013; Noerholm et al., BMC Cancer 12:22, 2012; Zhuang et al., EMBO J 31:3513-3523, 2012). When transferred between cancer cells, MVs have been shown to stimulate signaling events that promote cell growth and survival (Al-Nedawi et al., Nat Cell Biol 10:619-624, 2008). Cancer cell-derived MVs can also be taken up by normal cell types that surround the tumor, an outcome that helps shape the tumor microenvironment, trigger tumor vascularization, and even confer upon normal recipient cells the transformed characteristics of a cancer cell (Antonyak et al., Proc Natl Acad Sci U S A 108:4852-4857, 2011; Martins et al., Curr Opin Oncol 25:66-75, 2013; Al-Nedawi et al., Proc Natl Acad Sci U S A 106:3794-3799, 2009; Ge et al., Cancer Microenviron 5:323-332, 2012). Thus, the production of MVs by cancer cells plays crucial roles in driving the expansion of the primary tumor. However, it is now becoming increasingly clear that MVs are also stable in the circulation of cancer patients, where they can mediate long-range effects and contribute to the formation of the pre-metastatic niche, an essential step in metastasis (Skog et al., Nat Cell Biol 10:1470-1476, 2008; Noerholm et al., BMC Cancer 12:22, 2012; Peinado et al., Nat Med 18:883-891, 2012; Piccin et al., Blood Rev 21:157-171, 2007; van der Vos et al., Cell Mol Neurobiol 31:949-959, 2011). These findings, when taken together with the fact that MVs are being aggressively pursued as diagnostic markers, as well as being considered as potential targets for intervention against cancer (Antonyak et al., Small GTPases 3:219-224, 2012; Hosseini-Beheshti et al., Mol Cell Proteomics 11:863-885, 2012; Martins et al., Curr Opin Oncol 25:66-75, 2013; Ge et al., Cancer Microenviron 5:323-332, 2012; Peinado et al., Nat Med 18:883-891, 2012; Piccin et al., Blood Rev 21:157-171, 2007; Al-Nedawi et al., Cell Cycle 8:2014-2018, 2009; Cocucci and Meldolesi, Curr Biol 21:R940-R941, 2011; D'Souza-Schorey and Clancy, Genes Dev 26:1287-1299, 2012; Shao et al., Nat Med 18:1835-1840, 2012), point to critically important roles for MVs in human cancer progression that can potentially be exploited to develop new targeted approaches for treating this disease.
- 222Gottipati, M. K.; Bekyarova, E.; Brenner, M.; Haddon, R. C.; Parpura, V. Changes in the Morphology and Proliferation of Astrocytes Induced by Two Modalities of Chemically Functionalized Single-Walled Carbon Nanotubes Are Differentially Mediated by Glial Fibrillary Acidic Protein. Nano Lett. 2014, 14, 3720– 3727, DOI: 10.1021/nl4048114
- 223Shams, H.; Holt, B. D.; Mahboobi, S. H.; Jahed, Z.; Islam, M. F.; Dahl, K. N.; Mofrad, M. R. K. Actin Reorganization through Dynamic Interactions with Single-Wall Carbon Nanotubes. ACS Nano 2014, 8, 188– 197, DOI: 10.1021/nn402865e[ACS Full Text
 ], [CAS], Google Scholar223https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3sXhvFKntLzL&md5=06441e0aa094cafbaaa3b5a6387c468aActin Reorganization through Dynamic Interactions with Single-Wall Carbon NanotubesShams, Hengameh; Holt, Brian D.; Mahboobi, Seyed Hanif; Jahed, Zeinab; Islam, Mohammad F.; Dahl, Kris Noel; Mofrad, Mohammad R. K.ACS Nano (2014), 8 (1), 188-197CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)Single-wall carbon nanotubes (SWCNTs) have been widely used for biol. applications in recent years, and thus, it is crit. to understand how these inert nanomaterials influence cell behavior. Recently, it has been obsd. that cellular phenotypes such as proliferation, force generation and growth change upon SWCNT treatment, and SWCNTs directly affect the organization and redistribution of the actin cytoskeleton. However, the interactions between SWCNTs and actin at the mol. level or how this interaction changes actin structure remain largely unknown. Here, we investigated direct interaction of actin with SWCNT using all-atom mol. dynamics (MD) simulations and near-IR (NIR) spectroscopy of actin-dispersed SWCNTs. Actin can stably bind to the SWCNT surfaces via hydrophobic interactions but still allows nanotubes to slide and rotate on the actin surface. Our results establish several nanoscale conformational changes for the actin-SWCNT complexes, and we suggest these changes likely induce reorganization of actin filaments obsd. at larger scales.
], [CAS], Google Scholar223https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3sXhvFKntLzL&md5=06441e0aa094cafbaaa3b5a6387c468aActin Reorganization through Dynamic Interactions with Single-Wall Carbon NanotubesShams, Hengameh; Holt, Brian D.; Mahboobi, Seyed Hanif; Jahed, Zeinab; Islam, Mohammad F.; Dahl, Kris Noel; Mofrad, Mohammad R. K.ACS Nano (2014), 8 (1), 188-197CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)Single-wall carbon nanotubes (SWCNTs) have been widely used for biol. applications in recent years, and thus, it is crit. to understand how these inert nanomaterials influence cell behavior. Recently, it has been obsd. that cellular phenotypes such as proliferation, force generation and growth change upon SWCNT treatment, and SWCNTs directly affect the organization and redistribution of the actin cytoskeleton. However, the interactions between SWCNTs and actin at the mol. level or how this interaction changes actin structure remain largely unknown. Here, we investigated direct interaction of actin with SWCNT using all-atom mol. dynamics (MD) simulations and near-IR (NIR) spectroscopy of actin-dispersed SWCNTs. Actin can stably bind to the SWCNT surfaces via hydrophobic interactions but still allows nanotubes to slide and rotate on the actin surface. Our results establish several nanoscale conformational changes for the actin-SWCNT complexes, and we suggest these changes likely induce reorganization of actin filaments obsd. at larger scales. - 224Tian, X.; Yang, Z.; Duan, G.; Wu, A.; Gu, Z.; Zhang, L.; Chen, C.; Chai, Z.; Ge, C.; Zhou, R. Graphene Oxide Nanosheets Retard Cellular Migration via Disruption of Actin Cytoskeleton. Small 2017, 13, 1602133, DOI: 10.1002/smll.201602133
- 225Tu, Q.; Pang, L.; Chen, Y.; Zhang, Y.; Zhang, R.; Lu, B.; Wang, J. Effects of Surface Charges of Graphene Oxide on Neuronal Outgrowth and Branching. Analyst 2014, 139, 105– 115, DOI: 10.1039/C3AN01796F[Crossref], [PubMed], [CAS], Google Scholar225https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3sXhvVGhtbrF&md5=125f02728d3e3c26be7d83599bdc5583Effects of surface charges of graphene oxide on neuronal outgrowth and branchingTu, Qin; Pang, Long; Chen, Yun; Zhang, Yanrong; Zhang, Rui; Lu, Bingzhang; Wang, JinyiAnalyst (Cambridge, United Kingdom) (2014), 139 (1), 105-115CODEN: ANALAO; ISSN:0003-2654. (Royal Society of Chemistry)Graphene oxides with different surface charges were fabricated from carboxylated graphene oxide by chem. modification with amino- (-NH2), poly-m-aminobenzene sulfonic acid- (-NH2/-SO3H), or methoxyl- (-OCH3) terminated functional groups. The chem. functionalized graphene oxides and the carboxylated graphene oxide were characterized by IR spectroscopy, XPS, UV-Vis spectrometry, ζ potential measurements, field emission SEM, and contact angle analyses. Subsequently, the resulting graphene oxides were used as substrates for culturing primary rat hippocampal neurons to investigate neurite outgrowth and branching. The morphol. features of neurons that directly reflect their potential capability in synaptic transmission were characterized. The results demonstrate that the chem. properties of graphene oxide can be systematically modified by attaching different functional groups that confer known characteristics to the substrate. By manipulating the charge carried by the functionalized graphene oxides, the outgrowth and branching of neuronal processes can be controlled. Compared with neutral, zwitterionic, or neg. charged graphene oxides, pos. charged graphene oxide was found to be more beneficial for neurite outgrowth and branching. The ability to chem. modify graphene oxide to control neurite outgrowth could be implemented clin., esp. in cases wherein long-term presence of outgrowth modulation is necessary.
- 226Fabbro, A.; Scaini, D.; León, V.; Vázquez, E.; Cellot, G.; Privitera, G.; Lombardi, L.; Torrisi, F.; Tomarchio, F.; Bonaccorso, F.; Bosi, S.; Ferrari, A. C.; Ballerini, L.; Prato, M. Graphene-Based Interfaces Do Not Alter Target Nerve Cells. ACS Nano 2016, 10, 615– 623, DOI: 10.1021/acsnano.5b05647[ACS Full Text
 ], [CAS], Google Scholar226https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2MXitVygsbbL&md5=874aa49131b4623dbc19db6732f80942Graphene-Based Interfaces Do Not Alter Target Nerve CellsFabbro, Alessandra; Scaini, Denis; Leon, Veronica; Vazquez, Ester; Cellot, Giada; Privitera, Giulia; Lombardi, Lucia; Torrisi, Felice; Tomarchio, Flavia; Bonaccorso, Francesco; Bosi, Susanna; Ferrari, Andrea C.; Ballerini, Laura; Prato, MaurizioACS Nano (2016), 10 (1), 615-623CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)Neural-interfaces rely on the ability of electrodes to transduce stimuli into elec. patterns delivered to the brain. In addn. to sensitivity to the stimuli, stability in the operating conditions and efficient charge transfer to neurons, the electrodes should not alter the physiol. properties of the target tissue. Graphene is emerging as a promising material for neuro-interfacing applications, given its outstanding physico-chem. properties. Here, we use graphene-based substrates (GBSs) to interface neuronal growth. We test our GBSs on brain cell cultures by measuring functional and synaptic integrity of the emerging neuronal networks. We show that GBSs are permissive interfaces, even when uncoated by cell adhesion layers, retaining unaltered neuronal signaling properties, thus being suitable for carbon-based neural prosthetic devices.
], [CAS], Google Scholar226https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2MXitVygsbbL&md5=874aa49131b4623dbc19db6732f80942Graphene-Based Interfaces Do Not Alter Target Nerve CellsFabbro, Alessandra; Scaini, Denis; Leon, Veronica; Vazquez, Ester; Cellot, Giada; Privitera, Giulia; Lombardi, Lucia; Torrisi, Felice; Tomarchio, Flavia; Bonaccorso, Francesco; Bosi, Susanna; Ferrari, Andrea C.; Ballerini, Laura; Prato, MaurizioACS Nano (2016), 10 (1), 615-623CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)Neural-interfaces rely on the ability of electrodes to transduce stimuli into elec. patterns delivered to the brain. In addn. to sensitivity to the stimuli, stability in the operating conditions and efficient charge transfer to neurons, the electrodes should not alter the physiol. properties of the target tissue. Graphene is emerging as a promising material for neuro-interfacing applications, given its outstanding physico-chem. properties. Here, we use graphene-based substrates (GBSs) to interface neuronal growth. We test our GBSs on brain cell cultures by measuring functional and synaptic integrity of the emerging neuronal networks. We show that GBSs are permissive interfaces, even when uncoated by cell adhesion layers, retaining unaltered neuronal signaling properties, thus being suitable for carbon-based neural prosthetic devices. - 227Kitko, K. E.; Hong, T.; Lazarenko, R. M.; Ying, D.; Xu, Y.-Q.; Zhang, Q. Membrane Cholesterol Mediates the Cellular Effects of Monolayer Graphene Substrates. Nat. Commun. 2018, 9, 796, DOI: 10.1038/s41467-018-03185-0[Crossref], [PubMed], [CAS], Google Scholar227https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A280%3ADC%252BC1MrkvVOitg%253D%253D&md5=14687e7ebb114583fcc83d4d9a9ce80bMembrane cholesterol mediates the cellular effects of monolayer graphene substratesKitko Kristina E; Lazarenko Roman M; Zhang Qi; Kitko Kristina E; Xu Ya-Qiong; Zhang Qi; Hong Tu; Ying Da; Xu Ya-Qiong; Xu Ya-QiongNature communications (2018), 9 (1), 796 ISSN:.Graphene possesses extraordinary properties that promise great potential in biomedicine. However, fully leveraging these properties requires close contact with the cell surface, raising the concern of unexpected biological consequences. Computational models have demonstrated that graphene preferentially interacts with cholesterol, a multifunctional lipid unique to eukaryotic membranes. Here we demonstrate an interaction between graphene and cholesterol. We find that graphene increases cell membrane cholesterol and potentiates neurotransmission, which is mediated by increases in the number, release probability, and recycling rate of synaptic vesicles. In fibroblasts grown on graphene, we also find an increase in cholesterol, which promotes the activation of P2Y receptors, a family of receptor regulated by cholesterol. In both cases, direct manipulation of cholesterol levels elucidates that a graphene-induced cholesterol increase underlies the observed potentiation of each cell signaling pathway. These findings identify cholesterol as a mediator of graphene's cellular effects, providing insight into the biological impact of graphene.
- 228Pampaloni, N. P.; Lottner, M.; Giugliano, M.; Matruglio, A.; D’Amico, F.; Prato, M.; Garrido, J. A.; Ballerini, L.; Scaini, D. Single-Layer Graphene Modulates Neuronal Communication and Augments Membrane Ion Currents. Nat. Nanotechnol. 2018, 13, 755– 764, DOI: 10.1038/s41565-018-0163-6[Crossref], [PubMed], [CAS], Google Scholar228https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC1cXhtFeisb3L&md5=bdcc538e4ad665bc3e11625580b109c6Single-layer graphene modulates neuronal communication and augments membrane ion currentsPampaloni, Niccolo Paolo; Lottner, Martin; Giugliano, Michele; Matruglio, Alessia; D'Amico, Francesco; Prato, Maurizio; Garrido, Jose Antonio; Ballerini, Laura; Scaini, DenisNature Nanotechnology (2018), 13 (8), 755-764CODEN: NNAABX; ISSN:1748-3387. (Nature Research)The use of graphene-based materials to engineer sophisticated biosensing interfaces that can adapt to the central nervous system requires a detailed understanding of how such materials behave in a biol. context. Graphene's peculiar properties can cause various cellular changes, but the underlying mechanisms remain unclear. Here, we show that single-layer graphene increases neuronal firing by altering membrane-assocd. functions in cultured cells. Graphene tunes the distribution of extracellular ions at the interface with neurons, a key regulator of neuronal excitability. The resulting biophys. changes in the membrane include stronger potassium ion currents, with a shift in the fraction of neuronal firing phenotypes from adapting to tonically firing. By using exptl. and theor. approaches, we hypothesize that the graphene-ion interactions that are maximized when single-layer graphene is deposited on elec. insulating substrates are crucial to these effects.
- 229Li, N.; Zhang, X.; Song, Q.; Su, R.; Zhang, Q.; Kong, T.; Liu, L.; Jin, G.; Tang, M.; Cheng, G. The Promotion of Neurite Sprouting and Outgrowth of Mouse Hippocampal Cells in Culture by Graphene Substrates. Biomaterials 2011, 32, 9374– 9382, DOI: 10.1016/j.biomaterials.2011.08.065[Crossref], [PubMed], [CAS], Google Scholar229https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3MXht1Oqu77K&md5=7f898b8db97b9a382fa33ff48457da6dThe promotion of neurite sprouting and outgrowth of mouse hippocampal cells in culture by graphene substratesLi, Ning; Zhang, Xuemin; Song, Qin; Su, Ruigong; Zhang, Qi; Kong, Tao; Liu, Liwei; Jin, Gang; Tang, Mingliang; Cheng, GuoshengBiomaterials (2011), 32 (35), 9374-9382CODEN: BIMADU; ISSN:0142-9612. (Elsevier Ltd.)Graphene has been demonstrated in many biomedical applications and its potentials for neural interfacing. Emerging concerns on graphene, as a biomedical material, are its biocompatibility and how biol. targeted tissue/cells respond to it. Relatively few studies attempted to address the interactions of graphene or its derivs. with the tissues/cells, while very few reports on neural system. In this study, we tried to explore how neurites, one of the key structures for neural functions, are affected by graphene during the development until maturation in a mouse hippocampal culture model. The results reveal that graphene substrates exhibited excellent biocompatibility, as cell viability and morphol. were not affected. Meanwhile, neurite nos. and av. neurite length on graphene were significantly enhanced during 2-7 days after cell seeding compared with tissue culture polystyrene (TCPS) substrates. Esp. on Day 2 of the neural development period, graphene substrates efficiently promoted neurite sprouting and outgrowth to the maximal extent. Addnl., expression of growth-assoc. protein-43 (GAP-43) was examd. in both graphene and TCPS groups. Western blot anal. showed that GAP-43 expression was greatly enhanced in graphene group compared to TCPS group, which might result in the boost of neurite sprouting and outgrowth. This study suggests the potential of graphene as a material for neural interfacing and provides insight into the future biomedical applications of graphene.
- 230Tang, M.; Song, Q.; Li, N.; Jiang, Z.; Huang, R.; Cheng, G. Enhancement of Electrical Signaling in Neural Networks on Graphene Films. Biomaterials 2013, 34, 6402– 6411, DOI: 10.1016/j.biomaterials.2013.05.024[Crossref], [PubMed], [CAS], Google Scholar230https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3sXovVWitLc%253D&md5=716b52bb7c704ee6363edf161cde492aEnhancement of electrical signaling in neural networks on graphene filmsTang, Mingliang; Song, Qin; Li, Ning; Jiang, Ziyun; Huang, Rong; Cheng, GuoshengBiomaterials (2013), 34 (27), 6402-6411CODEN: BIMADU; ISSN:0142-9612. (Elsevier Ltd.)One of the key challenges for neural tissue engineering is to exploit supporting materials with robust functionalities not only to govern cell-specific behaviors, but also to form functional neural network. The unique elec. and mech. properties of graphene imply it as a promising candidate for neural interfaces, but little is known about the details of neural network formation on graphene as a scaffold material for tissue engineering. Therapeutic regenerative strategies aim to guide and enhance the intrinsic capacity of the neurons to reorganize by promoting plasticity mechanisms in a controllable manner. Here, we investigated the impact of graphene on the formation and performance in the assembly of neural networks in neural stem cell (NSC) culture. Using calcium imaging and electrophysiol. recordings, we demonstrate the capabilities of graphene to support the growth of functional neural circuits, and improve neural performance and elec. signaling in the network. These results offer a better understanding of interactions between graphene and NSCs, also they clearly present the great potentials of graphene as neural interface in tissue engineering.
- 231Djilas, M.; Olès, C.; Lorach, H.; Bendali, A.; Dégardin, J.; Dubus, E.; Lissorgues-Bazin, G.; Rousseau, L.; Benosman, R.; Ieng, S.-H.; Joucla, S.; Yvert, B.; Bergonzo, P.; Sahel, J.; Picaud, S. Three-Dimensional Electrode Arrays for Retinal Prostheses: Modeling, Geometry Optimization and Experimental Validation. J. Neural Eng. 2011, 8, 046020, DOI: 10.1088/1741-2560/8/4/046020[Crossref], [PubMed], [CAS], Google Scholar231https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A280%3ADC%252BC3MnpslCksA%253D%253D&md5=c3f302dd615b6c74c21f5b9cd1e23d59Three-dimensional electrode arrays for retinal prostheses: modeling, geometry optimization and experimental validationDjilas M; Oles C; Lorach H; Bendali A; Degardin J; Dubus E; Lissorgues-Bazin G; Rousseau L; Benosman R; Ieng S-H; Joucla S; Yvert B; Bergonzo P; Sahel J; Picaud SJournal of neural engineering (2011), 8 (4), 046020 ISSN:.Three-dimensional electrode geometries were proposed to increase the spatial resolution in retinal prostheses aiming at restoring vision in blind patients. We report here the results from a study in which finite-element modeling was used to design and optimize three-dimensional electrode geometries. Proposed implants exhibit an array of well-like shapes containing stimulating electrodes at their bottom, while the common return grid electrode surrounds each well on the implant top surface. Extending stimulating electrodes and/or the grid return electrode on the walls of the cavities was also considered. The goal of the optimization was to find model parameters that maximize the focalization of electrical stimulation, and therefore the spatial resolution of the electrode array. The results showed that electrode geometries with a well depth of 30 μm yield a tenfold increase in selectivity compared to the planar structures of similar electrode dimensions. Electrode array prototypes were microfabricated and implanted in dystrophic rats to determine if the tissue would behave as hypothesized in the model. Histological examination showed that retinal bipolar cells integrate the electrode well, creating isolated cell clusters. The modeling analysis showed that the stimulation current is confounded within the electrode well, leading to selective electrical stimulation of the individual bipolar cell clusters and thereby to electrode arrays with higher spatial resolution.
- 232Heim, M.; Rousseau, L.; Reculusa, S.; Urbanova, V.; Mazzocco, C.; Joucla, S.; Bouffier, L.; Vytras, K.; Bartlett, P.; Kuhn, A.; Yvert, B. Combined Macro-/Mesoporous Microelectrode Arrays for Low-Noise Extracellular Recording of Neural Networks. J. Neurophysiol. 2012, 108, 1793– 1803, DOI: 10.1152/jn.00711.2011[Crossref], [PubMed], [CAS], Google Scholar232https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A280%3ADC%252BC38jlvFSnug%253D%253D&md5=651d4fbd43fef7301aaf8b650d11399bCombined macro-/mesoporous microelectrode arrays for low-noise extracellular recording of neural networksHeim Matthias; Rousseau Lionel; Reculusa Stephane; Urbanova Veronika; Mazzocco Claire; Joucla Sebastien; Bouffier Laurent; Vytras Karel; Bartlett Philip; Kuhn Alexander; Yvert BlaiseJournal of neurophysiology (2012), 108 (6), 1793-803 ISSN:.Microelectrode arrays (MEAs) are appealing tools to probe large neural ensembles and build neural prostheses. Microelectronics microfabrication technologies now allow building high-density MEAs containing several hundreds of microelectrodes. However, several major problems become limiting factors when the size of the microelectrodes decreases. In particular, regarding recording of neural activity, the intrinsic noise level of a microelectrode dramatically increases when the size becomes small (typically below 20-μm diameter). Here, we propose to overcome this limitation using a template-based, single-scale meso- or two-scale macro-/mesoporous modification of the microelectrodes, combining the advantages of an overall small geometric surface and an active surface increased by several orders of magnitude. For this purpose, standard platinum MEAs were covered with a highly porous platinum overlayer obtained by lyotropic liquid crystal templating possibly in combination with a microsphere templating approach. These porous coatings were mechanically more robust than Pt-black coating and avoid potential toxicity issues. They had a highly increased active surface, resulting in a noise level ∼3 times smaller than that of conventional flat electrodes. This approach can thus be used to build highly dense arrays of small-size microelectrodes for sensitive neural signal detection.
- 233Gaffaney, J. D.; Dunning, F. M.; Wang, Z.; Hui, E.; Chapman, E. R. Synaptotagmin C2B Domain Regulates Ca 2+ -Triggered Fusion in Vitro. J. Biol. Chem. 2008, 283, 31763– 31775, DOI: 10.1074/jbc.M803355200
- 234Weerth, S. H.; Holtzclaw, L. A.; Russell, J. T. Signaling Proteins in Raft-like Microdomains Are Essential for Ca2+ Wave Propagation in Glial Cells. Cell Calcium 2007, 41, 155– 167, DOI: 10.1016/j.ceca.2006.06.006
- 235Chiacchiaretta, M.; Bramini, M.; Rocchi, A.; Armirotti, A.; Giordano, E.; Vázquez, E.; Bandiera, T.; Ferroni, S.; Cesca, F.; Benfenati, F. Graphene Oxide Upregulates the Homeostatic Functions of Primary Astrocytes and Modulates Astrocyte-to-Neuron Communication. Nano Lett. 2018, 18, 5827– 5838, DOI: 10.1021/acs.nanolett.8b02487[ACS Full Text
 ], [CAS], Google Scholar235https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC1cXhsVKju7nI&md5=256111935163f311c3f4e2bdf9566f80Graphene Oxide Upregulates the Homeostatic Functions of Primary Astrocytes and Modulates Astrocyte-to-Neuron CommunicationChiacchiaretta, Martina; Bramini, Mattia; Rocchi, Anna; Armirotti, Andrea; Giordano, Emanuele; Vazquez, Ester; Bandiera, Tiziano; Ferroni, Stefano; Cesca, Fabrizia; Benfenati, FabioNano Letters (2018), 18 (9), 5827-5838CODEN: NALEFD; ISSN:1530-6984. (American Chemical Society)Graphene-based materials are the focus of intense research efforts to devise novel theranostic strategies for targeting the central nervous system. In this work, we have investigated the consequences of long-term exposure of primary rat astrocytes to pristine graphene (GR) and graphene oxide (GO) flakes. We demonstrate that GR/GO interfere with a variety of intracellular processes as a result of their internalization through the endo-lysosomal pathway. Graphene-exposed astrocytes acquire a more differentiated morphol. phenotype assocd. with extensive cytoskeletal rearrangements. Profound functional alterations are induced by GO internalization, including the upregulation of inward-rectifying K+ channels and of Na+-dependent glutamate uptake, which are linked to the astrocyte capacity to control the extracellular homeostasis. Interestingly, GO-pretreated astrocytes promote the functional maturation of co-cultured primary neurons by inducing an increase in intrinsic excitability and in the d. of GABAergic synapses. The results indicate that graphene nanomaterials profoundly affect astrocyte physiol. in vitro, with consequences for neuronal network activity. This work supports the view that GO-based materials could be of great interest to address pathologies of the central nervous system assocd. to astrocyte dysfunctions.
], [CAS], Google Scholar235https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC1cXhsVKju7nI&md5=256111935163f311c3f4e2bdf9566f80Graphene Oxide Upregulates the Homeostatic Functions of Primary Astrocytes and Modulates Astrocyte-to-Neuron CommunicationChiacchiaretta, Martina; Bramini, Mattia; Rocchi, Anna; Armirotti, Andrea; Giordano, Emanuele; Vazquez, Ester; Bandiera, Tiziano; Ferroni, Stefano; Cesca, Fabrizia; Benfenati, FabioNano Letters (2018), 18 (9), 5827-5838CODEN: NALEFD; ISSN:1530-6984. (American Chemical Society)Graphene-based materials are the focus of intense research efforts to devise novel theranostic strategies for targeting the central nervous system. In this work, we have investigated the consequences of long-term exposure of primary rat astrocytes to pristine graphene (GR) and graphene oxide (GO) flakes. We demonstrate that GR/GO interfere with a variety of intracellular processes as a result of their internalization through the endo-lysosomal pathway. Graphene-exposed astrocytes acquire a more differentiated morphol. phenotype assocd. with extensive cytoskeletal rearrangements. Profound functional alterations are induced by GO internalization, including the upregulation of inward-rectifying K+ channels and of Na+-dependent glutamate uptake, which are linked to the astrocyte capacity to control the extracellular homeostasis. Interestingly, GO-pretreated astrocytes promote the functional maturation of co-cultured primary neurons by inducing an increase in intrinsic excitability and in the d. of GABAergic synapses. The results indicate that graphene nanomaterials profoundly affect astrocyte physiol. in vitro, with consequences for neuronal network activity. This work supports the view that GO-based materials could be of great interest to address pathologies of the central nervous system assocd. to astrocyte dysfunctions. - 236Cole, M.; Lindeque, P.; Halsband, C.; Galloway, T. S. Microplastics as Contaminants in the Marine Environment: A Review. Mar. Pollut. Bull. 2011, 62, 2588– 2597, DOI: 10.1016/j.marpolbul.2011.09.025[Crossref], [PubMed], [CAS], Google Scholar236https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3MXhsV2gsrfM&md5=ce50c3eecf36919311e3b05e13467174Microplastics as contaminants in the marine environment: A reviewCole, Matthew; Lindeque, Pennie; Halsband, Claudia; Galloway, Tamara S.Marine Pollution Bulletin (2011), 62 (12), 2588-2597CODEN: MPNBAZ; ISSN:0025-326X. (Elsevier Ltd.)A review. Since the mass prodn. of plastics began in the 1940s, microplastic contamination of the marine environment was a growing problem. Here, a review of the literature was conducted with the following objectives: (1) to summarize the properties, nomenclature and sources of microplastics; (2) to discuss the routes by which microplastics enter the marine environment; (3) to evaluate the methods by which microplastics are detected in the marine environment; (4) to assess spatial and temporal trends of microplastic abundance; and (5) to discuss the environmental impact of microplastics. Microplastics are both abundant and widespread within the marine environment, found in their highest concns. along coastlines and within mid-ocean gyres. Ingestion of microplastics was demonstrated in a range of marine organisms, a process which may facilitate the transfer of chem. additives or hydrophobic waterborne pollutants to biota. The authors conclude by highlighting key future research areas for scientists and policymakers.
- 237Montagner, A.; Bosi, S.; Tenori, E.; Bidussi, M.; Alshatwi, A. A.; Tretiach, M.; Prato, M.; Syrgiannis, Z. Ecotoxicological Effects of Graphene-Based Materials. 2D Mater. 2017, 4, 012001, DOI: 10.1088/2053-1583/4/1/012001
- 238Liu, S.; Zeng, T. H.; Hofmann, M.; Burcombe, E.; Wei, J.; Jiang, R.; Kong, J.; Chen, Y. Antibacterial Activity of Graphite, Graphite Oxide, Graphene Oxide, and Reduced Graphene Oxide: Membrane and Oxidative Stress. ACS Nano 2011, 5, 6971– 6980, DOI: 10.1021/nn202451x[ACS Full Text
 ], [CAS], Google Scholar238https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3MXhtVyls73L&md5=2b9a3ae97cc102efe556269af91473ebAntibacterial activity of graphite, graphite oxide, graphene oxide, and reduced graphene oxide: Membrane and oxidative stressLiu, Shao-Bin; Zeng, Ting-Ying Helen; Hofmann, Mario; Burcombe, Ehdi; Wei, Jun; Jiang, Rong-Rong; Kong, Jing; Chen, YuanACS Nano (2011), 5 (9), 6971-6980CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)Health and environmental impacts of graphene-based materials need to be thoroughly evaluated before their potential applications. Graphene has strong cytotoxicity toward bacteria. To better understand its antimicrobial mechanism, we compared the antibacterial activity of four types of graphene-based materials (graphite (Gt), graphite oxide (GtO), graphene oxide (GO), and reduced graphene oxide (rGO)) toward a bacterial model: Escherichia coli. Under similar concn. and incubation conditions, GO dispersion shows the highest antibacterial activity, sequentially followed by rGO, Gt, and GtO. Scanning electron microscope (SEM) and dynamic light scattering analyses show that GO aggregates have the smallest av. size among the four types of materials. SEM images display that the direct contacts with graphene nanosheets disrupt cell membrane. No superoxide anion (O2·-) induced reactive oxygen species (ROS) prodn. is detected. However, the four types of materials can oxidize glutathione, which serves as redox state mediator in bacteria. Conductive rGO and Gt have higher oxidn. capacities than insulating GO and GtO. Results suggest that antimicrobial actions are contributed by both membrane and oxidn. stress. We propose that a three-step antimicrobial mechanism, previously used for carbon nanotubes, is applicable to graphene-based materials. It includes initial cell deposition on graphene-based materials, membrane stress caused by direct contact with sharp nanosheets, and the ensuing superoxide anion-independent oxidn. The authors envision that physicochem. properties of graphene-based materials, such as d. of functional groups, size, and cond., can be precisely tailored to either reducing their health and environmental risks or increasing their application potentials.
], [CAS], Google Scholar238https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3MXhtVyls73L&md5=2b9a3ae97cc102efe556269af91473ebAntibacterial activity of graphite, graphite oxide, graphene oxide, and reduced graphene oxide: Membrane and oxidative stressLiu, Shao-Bin; Zeng, Ting-Ying Helen; Hofmann, Mario; Burcombe, Ehdi; Wei, Jun; Jiang, Rong-Rong; Kong, Jing; Chen, YuanACS Nano (2011), 5 (9), 6971-6980CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)Health and environmental impacts of graphene-based materials need to be thoroughly evaluated before their potential applications. Graphene has strong cytotoxicity toward bacteria. To better understand its antimicrobial mechanism, we compared the antibacterial activity of four types of graphene-based materials (graphite (Gt), graphite oxide (GtO), graphene oxide (GO), and reduced graphene oxide (rGO)) toward a bacterial model: Escherichia coli. Under similar concn. and incubation conditions, GO dispersion shows the highest antibacterial activity, sequentially followed by rGO, Gt, and GtO. Scanning electron microscope (SEM) and dynamic light scattering analyses show that GO aggregates have the smallest av. size among the four types of materials. SEM images display that the direct contacts with graphene nanosheets disrupt cell membrane. No superoxide anion (O2·-) induced reactive oxygen species (ROS) prodn. is detected. However, the four types of materials can oxidize glutathione, which serves as redox state mediator in bacteria. Conductive rGO and Gt have higher oxidn. capacities than insulating GO and GtO. Results suggest that antimicrobial actions are contributed by both membrane and oxidn. stress. We propose that a three-step antimicrobial mechanism, previously used for carbon nanotubes, is applicable to graphene-based materials. It includes initial cell deposition on graphene-based materials, membrane stress caused by direct contact with sharp nanosheets, and the ensuing superoxide anion-independent oxidn. The authors envision that physicochem. properties of graphene-based materials, such as d. of functional groups, size, and cond., can be precisely tailored to either reducing their health and environmental risks or increasing their application potentials. - 239Maleki Dizaj, S.; Mennati, A.; Jafari, S.; Khezri, K.; Adibkia, K. Antimicrobial Activity of Carbon-Based Nanoparticles. Adv. Pharm. Bull. 2015, 5, 19– 23, DOI: 10.5681/apb.2015.003[Crossref], [PubMed], [CAS], Google Scholar239https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A280%3ADC%252BC2MnmtVGksg%253D%253D&md5=624a6585ed6794a537dbd9c42fbba8dcAntimicrobial activity of carbon-based nanoparticlesMaleki Dizaj Solmaz; Jafari Samira; Mennati Afsaneh; Khezri Khadejeh; Adibkia KhosroAdvanced pharmaceutical bulletin (2015), 5 (1), 19-23 ISSN:2228-5881.Due to the vast and inappropriate use of the antibiotics, microorganisms have begun to develop resistance to the commonly used antimicrobial agents. So therefore, development of the new and effective antimicrobial agents seems to be necessary. According to some recent reports, carbon-based nanomaterials such as fullerenes, carbon nanotubes (CNTs) (especially single-walled carbon nanotubes (SWCNTs)) and graphene oxide (GO) nanoparticles show potent antimicrobial properties. In present review, we have briefly summarized the antimicrobial activity of carbon-based nanoparticles together with their mechanism of action. Reviewed literature show that the size of carbon nanoparticles plays an important role in the inactivation of the microorganisms. As major mechanism, direct contact of microorganisms with carbon nanostructures seriously affects their cellular membrane integrity, metabolic processes and morphology. The antimicrobial activity of carbon-based nanostructures may interestingly be investigated in the near future owing to their high surface/volume ratio, large inner volume and other unique chemical and physical properties. In addition, application of functionalized carbon nanomaterials as carriers for the ordinary antibiotics possibly will decrease the associated resistance, enhance their bioavailability and provide their targeted delivery.
- 240Akhavan, O.; Ghaderi, E. Toxicity of Graphene and Graphene Oxide Nanowalls Against Bacteria. ACS Nano 2010, 4, 5731– 5736, DOI: 10.1021/nn101390x[ACS Full Text
 ], [CAS], Google Scholar240https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3cXht1Kht77K&md5=6b3b3fc77f35bddc2137e17da2d887cdToxicity of graphene and graphene oxide nanowalls against bacteriaAkhavan, Omid; Ghaderi, ElhamACS Nano (2010), 4 (10), 5731-5736CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)Bacterial toxicity of graphene nanosheets in the form of graphene nanowalls deposited on stainless steel substrates was investigated for both Gram-pos. and Gram-neg. models of bacteria. The graphene oxide nanowalls were obtained by electrophoretic deposition of Mg2+-graphene oxide nanosheets synthesized by a chem. exfoliation method. On the basis of measuring the efflux of cytoplasmic materials of the bacteria, it was found that the cell membrane damage of the bacteria caused by direct contact of the bacteria with the extremely sharp edges of the nanowalls was the effective mechanism in the bacterial inactivation. In this regard, the Gram-neg. Escherichia coli with an outer membrane were more resistant to the cell membrane damage caused by the nanowalls than the Gram-pos. Staphylococcus aureus lacking the outer membrane. Moreover, the graphene oxide nanowalls reduced by hydrazine were more toxic to the bacteria than the unreduced graphene oxide nanowalls. The better antibacterial activity of the reduced nanowalls was assigned to the better charge transfer between the bacteria and the more sharpened edges of the reduced nanowalls, during the contact interaction.
], [CAS], Google Scholar240https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3cXht1Kht77K&md5=6b3b3fc77f35bddc2137e17da2d887cdToxicity of graphene and graphene oxide nanowalls against bacteriaAkhavan, Omid; Ghaderi, ElhamACS Nano (2010), 4 (10), 5731-5736CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)Bacterial toxicity of graphene nanosheets in the form of graphene nanowalls deposited on stainless steel substrates was investigated for both Gram-pos. and Gram-neg. models of bacteria. The graphene oxide nanowalls were obtained by electrophoretic deposition of Mg2+-graphene oxide nanosheets synthesized by a chem. exfoliation method. On the basis of measuring the efflux of cytoplasmic materials of the bacteria, it was found that the cell membrane damage of the bacteria caused by direct contact of the bacteria with the extremely sharp edges of the nanowalls was the effective mechanism in the bacterial inactivation. In this regard, the Gram-neg. Escherichia coli with an outer membrane were more resistant to the cell membrane damage caused by the nanowalls than the Gram-pos. Staphylococcus aureus lacking the outer membrane. Moreover, the graphene oxide nanowalls reduced by hydrazine were more toxic to the bacteria than the unreduced graphene oxide nanowalls. The better antibacterial activity of the reduced nanowalls was assigned to the better charge transfer between the bacteria and the more sharpened edges of the reduced nanowalls, during the contact interaction. - 241Efremova, L. V.; Vasilchenko, A. S.; Rakov, E. G.; Deryabin, D. G. Toxicity of Graphene Shells, Graphene Oxide, and Graphene Oxide Paper Evaluated with Escherichia Coli Biotests. BioMed Res. Int. 2015, 2015, 869361, DOI: 10.1155/2015/869361[Crossref], [PubMed], [CAS], Google Scholar241https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A280%3ADC%252BC28%252FnvFSlsg%253D%253D&md5=50213ed46350b8293abf51732d691413Toxicity of Graphene Shells, Graphene Oxide, and Graphene Oxide Paper Evaluated with Escherichia coli BiotestsEfremova Ludmila V; Deryabin Dmitry G; Vasilchenko Alexey S; Rakov Eduard GBioMed research international (2015), 2015 (), 869361 ISSN:.The plate-like graphene shells (GS) produced by an original methane pyrolysis method and their derivatives graphene oxide (GO) and graphene oxide paper (GO-P) were evaluated with luminescent Escherichia coli biotests and additional bacterial-based assays which together revealed the graphene-family nanomaterials' toxicity and bioactivity mechanisms. Bioluminescence inhibition assay, fluorescent two-component staining to evaluate cell membrane permeability, and atomic force microscopy data showed GO expressed bioactivity in aqueous suspension, whereas GS suspensions and the GO-P surface were assessed as nontoxic materials. The mechanism of toxicity of GO was shown not to be associated with oxidative stress in the targeted soxS::lux and katG::lux reporter cells; also, GO did not lead to significant mechanical disruption of treated bacteria with the release of intracellular DNA contents into the environment. The well-coordinated time- and dose-dependent surface charge neutralization and transport and energetic disorders in the Escherichia coli cells suggest direct membrane interaction, internalization, and perturbation (i.e., "membrane stress") as a clue to graphene oxide's mechanism of toxicity.
- 242Gurunathan, S.; Woong Han, J.; Abdal Daye, A.; Eppakayala, V.; Kim, J. Oxidative Stress-Mediated Antibacterial Activity of Graphene Oxide and Reduced Graphene Oxide in Pseudomonas Aeruginosa. Int. J. Nanomed. 2012, 7, 5901, DOI: 10.2147/IJN.S37397[Crossref], [PubMed], [CAS], Google Scholar242https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC38XhvV2jsL3I&md5=7d0716fb44db8085b1ac2fa83d0cff8fOxidative stress-mediated antibacterial activity of graphene oxide and reduced graphene oxide in Pseudomonas aeruginosaGurunathan, Sangiliyandi; Han, Jae Woong; Abdal Dayem, Ahmed; Eppakayala, Vasuki; Kim, Jin-HoiInternational Journal of Nanomedicine (2012), 7 (), 5901-5914CODEN: IJNNHQ; ISSN:1178-2013. (Dove Medical Press Ltd.)Graphene holds great promise for potential use in next-generation electronic and photonic devices due to its unique high carrier mobility, good optical transparency, large surface area and biocompatibility. The aim of this study was to study the antibacterial effects of graphene oxide (GO) and reduced graphene oxide (rGO) in Pseudomonas aeruginosa. The authors used a novel reducing agent, beta-mercaptoethanol (BME), for synthesis of graphene to avoid the use of toxic materials. To uncover the impacts of GO and rGO on human health, the antibacterial activity of two types of graphene-based material toward a bacterial model P. aeruginosa was studied and compared. The synthesized GO and rGO were characterized by UV-visible absorption spectroscopy, particle-size analyzer, x-ray diffraction, SEM and Raman spectroscopy. Further, to explain the antimicrobial activity of graphene oxide and reduced graphene oxide, the authors employed various assays, such as cell growth, cell viability, reactive oxygen species generation and DNA fragmentation. UV-visible spectra of the samples confirmed the transition of GO into graphene. Dynamic light-scattering analyses showed the av. size among the two types of graphene materials. X-ray diffraction data validated the structure of graphene sheets and high-resoln. SEM was employed to study the morphologies of prepd. graphene. Raman spectroscopy data indicated the removal of oxygen-contg. functional groups from the surface of GO and the formation of graphene. The exposure of cells to GO and rGO induced the prodn. of superoxide radical anion and loss of cell viability. Results suggest that the antibacterial activities are contributed to by loss of cell viability, induced oxidative stress and DNA fragmentation. Thus, the antibacterial activities of GO and rGO against P. aeruginosa were compared. The loss of P. aeruginosa viability increased in a dose- and time-dependent manner. Exposure to GO and rGO induced significant prodn. of superoxide radical anion compared to control. GO and rGO showed dose-dependent antibacterial activity against P. aeruginosa cells through the generation of reactive oxygen species, leading to cell death, which was further confirmed through resulting nuclear fragmentation. The data presented here are novel in that GO and rGO are effective bactericidal agents against P. aeruginosa, which would be used as a future antibacterial agent.
- 243Guo, Z.; Xie, C.; Zhang, P.; Zhang, J.; Wang, G.; He, X.; Ma, Y.; Zhao, B.; Zhang, Z. Toxicity and Transformation of Graphene Oxide and Reduced Graphene Oxide in Bacteria Biofilm. Sci. Total Environ. 2017, 580, 1300– 1308, DOI: 10.1016/j.scitotenv.2016.12.093[Crossref], [PubMed], [CAS], Google Scholar243https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC28XitFehsrbM&md5=b44d5023f1950d0403a463e6b7efdee1Toxicity and transformation of graphene oxide and reduced graphene oxide in bacteria biofilmGuo, Zhiling; Xie, Changjian; Zhang, Peng; Zhang, Junzhe; Wang, Guohua; He, Xiao; Ma, Yuhui; Zhao, Bin; Zhang, ZhiyongScience of the Total Environment (2017), 580 (), 1300-1308CODEN: STENDL; ISSN:0048-9697. (Elsevier B.V.)Impact of graphene based material (GNMs) on bacteria biofilm has not been well understood yet. In this study, the authors compared the impact of graphene oxide (GO) and reduced graphene oxide (rGO) on biofilm formation and development in Luria-Bertani (LB) medium using Escherichia coli and Staphylococcus aureus as models. GO significantly enhanced the cell growth, biofilm formation, and biofilm development even up to a concn. of 500 mg/L. In contrast, rGO (≥50 mg/L) strongly inhibited cell growth and biofilm formation. However, the inhibitory effects of rGO (50 mg/L and 100 mg/L) were attenuated in the mature phase (>24 h) and eliminated at 48 h. GO at 250 mg/L decreased the reactive oxygen species (ROS) levels in biofilm and extracellular region at mature phase. ROS levels were significantly increased by rGO at early phase, while they returned to the same levels as control at mature phase. These results suggest that oxidative stress contributed to the inhibitory effect of rGO on bacterial biofilm. The authors further found that supplement of extracellular polymeric substances (EPS) in the growth medium attenuated the inhibitory effect of rGO on the growth of developed biofilm. XPS results showed that rGO were oxidized to GO which can enhance the bacterial growth. The authors deduced that the elimination of the toxicity of rGO at mature phase was contributed by EPS protection and the oxidn. of rGO. This study provides new insights into the interaction of GNMs with bacteria biofilm.
- 244Combarros, R. G.; Collado, S.; Díaz, M. Toxicity of Graphene Oxide on Growth and Metabolism of Pseudomonas Putida. J. Hazard. Mater. 2016, 310, 246– 252, DOI: 10.1016/j.jhazmat.2016.02.038[Crossref], [PubMed], [CAS], Google Scholar244https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC28XjtlCnsrs%253D&md5=0e9a8534216eeb4f31ccc36840ba5e4bToxicity of graphene oxide on growth and metabolism of Pseudomonas putidaCombarros, R. G.; Collado, S.; Diaz, M.Journal of Hazardous Materials (2016), 310 (), 246-252CODEN: JHMAD9; ISSN:0304-3894. (Elsevier B.V.)The increasing consumption of graphene derivs. leads to greater presence of these materials in wastewater treatment plants and ecol. systems. The toxicity effect of graphene oxide (GO) on the microbial functions involved in the biol. wastewater treatment process is studied, using Pseudomonas putida and salicylic acid (SA) as bacterial and pollutant models. A multiparametric flow cytometry (FC) method has been developed to measure the metabolic activity and viability of P. putida in contact with GO. A continuous redn. in the percentages of viable cells and a slight increase, lower than 5%, in the percentages of damaged and dead cells, suggest that P. putida in contact with GO loses the membrane integrity but preserves metabolic activity. The growth of P. putida was strongly inhibited by GO, since 0.05 mg mL-1 of GO reduced the max. growth by a third, and the inhibition was considerably greater for GO concns. higher than 0.1 mg mL-1. The specific SA removal rate decreased with GO concn. up to 0.1 mg mL-1 indicating that while GO always reduces the growth of P. putida, for concns. higher than 0.1 mg mL-1, it also reduces its activity. Similar behavior is obsd. using simulated urban and industrial wastewaters, the obsd. effects being more acute in the industrial wastewaters.
- 245Tu, Y.; Lv, M.; Xiu, P.; Huynh, T.; Zhang, M.; Castelli, M.; Liu, Z.; Huang, Q.; Fan, C.; Fang, H.; Zhou, R. Destructive Extraction of Phospholipids from Escherichia Coli Membranes by Graphene Nanosheets. Nat. Nanotechnol. 2013, 8, 594– 601, DOI: 10.1038/nnano.2013.125[Crossref], [PubMed], [CAS], Google Scholar245https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3sXhtVKhtL7O&md5=7f60957a5cc3b8008520ab5aeb9858adDestructive extraction of phospholipids from Escherichia coli membranes by graphene nanosheetsTu, Yusong; Lv, Min; Xiu, Peng; Huynh, Tien; Zhang, Meng; Castelli, Matteo; Liu, Zengrong; Huang, Qing; Fan, Chunhai; Fang, Haiping; Zhou, RuhongNature Nanotechnology (2013), 8 (8), 594-601CODEN: NNAABX; ISSN:1748-3387. (Nature Publishing Group)Understanding how nanomaterials interact with cell membranes is related to how they cause cytotoxicity and is therefore crit. for designing safer biomedical applications. Recently, graphene (a two-dimensional nanomaterial) was shown to have antibacterial activity on Escherichia coli, but its underlying mol. mechanisms remain unknown. Here we show exptl. and theor. that pristine graphene and graphene oxide nanosheets can induce the degrdn. of the inner and outer cell membranes of Escherichia coli, and reduce their viability. TEM shows three rough stages, and mol. dynamics simulations reveal the at. details of the process. Graphene nanosheets can penetrate into and ext. large amts. of phospholipids from the cell membranes because of the strong dispersion interactions between graphene and lipid mols. This destructive extn. offers a novel mechanism for the mol. basis of graphene's cytotoxicity and antibacterial activity.
- 246Li, R.; Mansukhani, N. D.; Guiney, L. M.; Ji, Z.; Zhao, Y.; Chang, C. H.; French, C. T.; Miller, J. F.; Hersam, M. C.; Nel, A. E.; Xia, T. Identification and Optimization of Carbon Radicals on Hydrated Graphene Oxide for Ubiquitous Antibacterial Coatings. ACS Nano 2016, 10, 10966– 10980, DOI: 10.1021/acsnano.6b05692[ACS Full Text
 ], [CAS], Google Scholar246https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC28XhvFens7fN&md5=1bdf8bf923e831e15dd16c705281b26bIdentification and Optimization of Carbon Radicals on Hydrated Graphene Oxide for Ubiquitous Antibacterial CoatingsLi, Ruibin; Mansukhani, Nikhita D.; Guiney, Linda M.; Ji, Zhaoxia; Zhao, Yichao; Chang, Chong Hyun; French, Christopher T.; Miller, Jeff F.; Hersam, Mark C.; Nel, Andre E.; Xia, TianACS Nano (2016), 10 (12), 10966-10980CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)While the antibacterial properties of graphene oxide (GO) have been demonstrated across a spectrum of bacteria, the crit. role of functional groups is unclear. To address this important issue, we utilized redn. and hydration methods to establish a GO library with different oxidn., hydroxyl, and carbon radical (•C) levels that can be used to study the impact on antibacterial activity. Using antibiotic-resistant bacteria as a test platform, we found that the •C d. is most proximately assocd. with bacterial killing. Accordingly, hydrated GO (hGO), with the highest •C d., had the strongest antibacterial effects through membrane binding and induction of lipid peroxidn. To explore its potential applications, we demonstrated that coating of catheter and glass surfaces with hGO is capable of killing drug-resistant bacteria. In summary, •C is the principle surface moiety that can be utilized for clin. applications of GO-based antibacterial coatings.
], [CAS], Google Scholar246https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC28XhvFens7fN&md5=1bdf8bf923e831e15dd16c705281b26bIdentification and Optimization of Carbon Radicals on Hydrated Graphene Oxide for Ubiquitous Antibacterial CoatingsLi, Ruibin; Mansukhani, Nikhita D.; Guiney, Linda M.; Ji, Zhaoxia; Zhao, Yichao; Chang, Chong Hyun; French, Christopher T.; Miller, Jeff F.; Hersam, Mark C.; Nel, Andre E.; Xia, TianACS Nano (2016), 10 (12), 10966-10980CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)While the antibacterial properties of graphene oxide (GO) have been demonstrated across a spectrum of bacteria, the crit. role of functional groups is unclear. To address this important issue, we utilized redn. and hydration methods to establish a GO library with different oxidn., hydroxyl, and carbon radical (•C) levels that can be used to study the impact on antibacterial activity. Using antibiotic-resistant bacteria as a test platform, we found that the •C d. is most proximately assocd. with bacterial killing. Accordingly, hydrated GO (hGO), with the highest •C d., had the strongest antibacterial effects through membrane binding and induction of lipid peroxidn. To explore its potential applications, we demonstrated that coating of catheter and glass surfaces with hGO is capable of killing drug-resistant bacteria. In summary, •C is the principle surface moiety that can be utilized for clin. applications of GO-based antibacterial coatings. - 247Lu, X.; Feng, X.; Werber, J. R.; Chu, C.; Zucker, I.; Kim, J.-H.; Osuji, C. O.; Elimelech, M. Enhanced Antibacterial Activity through the Controlled Alignment of Graphene Oxide Nanosheets. Proc. Natl. Acad. Sci. U. S. A. 2017, 114, E9793– E9801, DOI: 10.1073/pnas.1710996114[Crossref], [PubMed], [CAS], Google Scholar247https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2sXhslagtbvJ&md5=31b1dc68115ba48371cb8836d9f54b97Enhanced antibacterial activity through the controlled alignment of graphene oxide nanosheetsLu, Xinglin; Feng, Xunda; Werber, Jay R.; Chu, Chiheng; Zucker, Ines; Kim, Jae-Hong; Osuji, Chinedum O.; Elimelech, MenachemProceedings of the National Academy of Sciences of the United States of America (2017), 114 (46), E9793-E9801CODEN: PNASA6; ISSN:0027-8424. (National Academy of Sciences)The cytotoxicity of 2D graphene-based nanomaterials (GBNs) is highly important for engineered applications and environmental health. However, the isotropic orientation of GBNs, most notably graphene oxide (GO), in previous exptl. studies obscured the interpretation of cytotoxic contributions of nanosheet edges. Here, we investigate the orientation-dependent interaction of GBNs with bacteria using GO composite films. To produce the films, GO nanosheets are aligned in a magnetic field, immobilized by crosslinking of the surrounding matrix, and exposed on the surface through oxidative etching. Characterization by small-angle X-ray scattering and at. force microscopy confirms that GO nanosheets align progressively well with increasing magnetic field strength and that the alignment is effectively preserved by crosslinking. When contacted with the model bacterium Escherichia coli, GO nanosheets with vertical orientation exhibit enhanced antibacterial activity compared with random and horizontal orientations. Further characterization is performed to explain the enhanced antibacterial activity of the film with vertically aligned GO. Using phospholipid vesicles as a model system, we observe that GO nanosheets induce phys. disruption of the lipid bilayer. Addnl., we find substantial GO-induced oxidn. of glutathione, a model intracellular antioxidant, paired with limited generation of reactive oxygen species, suggesting that oxidn. occurs through a direct electron-transfer mechanism. These phys. and chem. mechanisms both require nanosheet penetration of the cell membrane, suggesting that the enhanced antibacterial activity of the film with vertically aligned GO stems from an increased d. of edges with a preferential orientation for membrane disruption. The importance of nanosheet penetration for cytotoxicity has direct implications for the design of engineering surfaces using GBNs.
- 248Pandit, S.; Cao, Z.; Mokkapati, V. R. S. S.; Celauro, E.; Yurgens, A.; Lovmar, M.; Westerlund, F.; Sun, J.; Mijakovic, I. Vertically Aligned Graphene Coating Is Bactericidal and Prevents the Formation of Bacterial Biofilms. Adv. Mater. Interfaces 2018, 5, 1701331, DOI: 10.1002/admi.201701331
- 249Navarro, E.; Baun, A.; Behra, R.; Hartmann, N. B.; Filser, J.; Miao, A.-J.; Quigg, A.; Santschi, P. H.; Sigg, L. Environmental Behavior and Ecotoxicity of Engineered Nanoparticles to Algae, Plants, and Fungi. Ecotoxicology 2008, 17, 372– 386, DOI: 10.1007/s10646-008-0214-0[Crossref], [PubMed], [CAS], Google Scholar249https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BD1cXmsVKrsLc%253D&md5=d3512118ea8fc0a5ff4646610757f075Environmental behavior and ecotoxicity of engineered nanoparticles to algae, plants, and fungiNavarro, Enrique; Baun, Anders; Behra, Renata; Hartmann, Nanna B.; Filser, Juliane; Miao, Ai-Jun; Quigg, Antonietta; Santschi, Peter H.; Sigg, LauraEcotoxicology (2008), 17 (5), 372-386CODEN: ECOTEL; ISSN:0963-9292. (Springer)A review. Developments in nanotechnol. are leading to a rapid proliferation of new materials that are likely to become a source of engineered nanoparticles (ENPs) to the environment, where their possible ecotoxicol. impacts remain unknown. The surface properties of ENPs are of essential importance for their aggregation behavior, and thus for their mobility in aquatic and terrestrial systems and for their interactions with algae, plants and, fungi. Interactions of ENPs with natural org. matter have to be considered as well, as those will alter the ENPs aggregation behavior in surface waters or in soils. Cells of plants, algae, and fungi possess cell walls that constitute a primary site for interaction and a barrier for the entrance of ENPs. Mechanisms allowing ENPs to pass through cell walls and membranes are as yet poorly understood. Inside cells, ENPs might directly provoke alterations of membranes and other cell structures and mols., as well as protective mechanisms. Indirect effects of ENPs depend on their chem. and phys. properties and may include phys. restraints (clogging effects), solubilization of toxic ENP compds., or prodn. of reactive oxygen species. Many questions regarding the bioavailability of ENPs, their uptake by algae, plants, and fungi and the toxicity mechanisms remain to be elucidated.
- 250Tang, Y.; Tian, J.; Li, S.; Xue, C.; Xue, Z.; Yin, D.; Yu, S. Combined Effects of Graphene Oxide and Cd on the Photosynthetic Capacity and Survival of Microcystis Aeruginosa. Sci. Total Environ. 2015, 532, 154– 161, DOI: 10.1016/j.scitotenv.2015.05.081
- 251Saiz-Jimenez, C. The Conservation of Subterranean Cultural Heritage; CRC Press: Leiden, The Netherlands, 2014.
- 252Cheng, C.; Li, S.; Thomas, A.; Kotov, N. A.; Haag, R. Functional Graphene Nanomaterials Based Architectures: Biointeractions, Fabrications, and Emerging Biological Applications. Chem. Rev. 2017, 117, 1826– 1914, DOI: 10.1021/acs.chemrev.6b00520[ACS Full Text
 ], [CAS], Google Scholar252https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2sXmvVajtg%253D%253D&md5=ffbdb41eedafcc8b66762eec9a89e7e2Functional Graphene Nanomaterials Based Architectures: Biointeractions, Fabrications, and Emerging Biological ApplicationsCheng, Chong; Li, Shuang; Thomas, Arne; Kotov, Nicholas A.; Haag, RainerChemical Reviews (Washington, DC, United States) (2017), 117 (3), 1826-1914CODEN: CHREAY; ISSN:0009-2665. (American Chemical Society)A review. Functional graphene nanomaterials (FGNs) are fast emerging materials with extremely unique phys. and chem. properties and physiol. ability to interfere and /or interact with bioorganisms; as a result, FGNs present manifold possibilities for diverse biol. applications. Beyond their use in drug/gene delivery, phototherapy and bioimaging, recent studies have revealed that FGNs can significantly promote interfacial biointeractions, in particular, with proteins, mammalian cells/stem cells, and microbials. FGNs can adsorb and conc. nutrition factors including proteins from physiol. media. This accelerates the formation of extracellular matrix, which eventually promotes cell colonization by providing a more beneficial microenvironment for cell adhesion and growth. Furthermore, FGNs can also interact with cocultured cells by phys. or chem. stimulation, which significantly mediate their cellular signaling and biol. performance. In this review, the authors elucidate FGNs-bioorganism interactions and summarize recent advancements on designing FGN-based two-dimensional and three-dimensional architectures as multifunctional biol. platforms. The authors have also discussed the representative biol. applications regarding these FGN-based bioactive architectures. Furthermore, the future perspectives and emerging challenges will also be highlighted. Due to the lack of comprehensive reviews in this emerging field, this review may catch great interest and inspire many new opportunities across a broad range of disciplines.
], [CAS], Google Scholar252https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2sXmvVajtg%253D%253D&md5=ffbdb41eedafcc8b66762eec9a89e7e2Functional Graphene Nanomaterials Based Architectures: Biointeractions, Fabrications, and Emerging Biological ApplicationsCheng, Chong; Li, Shuang; Thomas, Arne; Kotov, Nicholas A.; Haag, RainerChemical Reviews (Washington, DC, United States) (2017), 117 (3), 1826-1914CODEN: CHREAY; ISSN:0009-2665. (American Chemical Society)A review. Functional graphene nanomaterials (FGNs) are fast emerging materials with extremely unique phys. and chem. properties and physiol. ability to interfere and /or interact with bioorganisms; as a result, FGNs present manifold possibilities for diverse biol. applications. Beyond their use in drug/gene delivery, phototherapy and bioimaging, recent studies have revealed that FGNs can significantly promote interfacial biointeractions, in particular, with proteins, mammalian cells/stem cells, and microbials. FGNs can adsorb and conc. nutrition factors including proteins from physiol. media. This accelerates the formation of extracellular matrix, which eventually promotes cell colonization by providing a more beneficial microenvironment for cell adhesion and growth. Furthermore, FGNs can also interact with cocultured cells by phys. or chem. stimulation, which significantly mediate their cellular signaling and biol. performance. In this review, the authors elucidate FGNs-bioorganism interactions and summarize recent advancements on designing FGN-based two-dimensional and three-dimensional architectures as multifunctional biol. platforms. The authors have also discussed the representative biol. applications regarding these FGN-based bioactive architectures. Furthermore, the future perspectives and emerging challenges will also be highlighted. Due to the lack of comprehensive reviews in this emerging field, this review may catch great interest and inspire many new opportunities across a broad range of disciplines. - 253Du, S.; Zhang, P.; Zhang, R.; Lu, Q.; Liu, L.; Bao, X.; Liu, H. Reduced Graphene Oxide Induces Cytotoxicity and Inhibits Photosynthetic Performance of the Green Alga Scenedesmus Obliquus. Chemosphere 2016, 164, 499– 507, DOI: 10.1016/j.chemosphere.2016.08.138[Crossref], [PubMed], [CAS], Google Scholar253https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC28XhsV2rtr3K&md5=030f7e164f42bf60911481f5653f9cedReduced graphene oxide induces cytotoxicity and inhibits photosynthetic performance of the green alga Scenedesmus obliquusDu, Shaoting; Zhang, Peng; Zhang, Ranran; Lu, Qi; Liu, Lin; Bao, Xiaowei; Liu, HuijunChemosphere (2016), 164 (), 499-507CODEN: CMSHAF; ISSN:0045-6535. (Elsevier Ltd.)Increased use of graphene materials might ultimately lead to their release into the environment. However, only a few studies have investigated the impact of graphene-based materials on green plants. In this study, the impact of reduced graphene oxide (RGO) on the microalgae Scenedesmus obliquus was evaluated to det. its phytotoxicity. Treatment with RGO suppressed the growth of the microalgae. The 72-h IC50 values of RGO evaluated using the logistic and Gompertz models were 148 and 151 mg L-1, resp. RGO significantly inhibited Chl a and Chl a/b levels in the algal cells. Chlorophyll a fluorescence anal. showed that RGO significantly down-regulated photosystem II activity. The mechanism of how RGO inhibited algal growth and photosynthetic performance was detd. by analyzing the alterations in ultrastructural morphol. RGO adhered to the algal cell surface as a semitranslucent coating. Cell wall damage and membrane integrity loss occurred in the treated cells. Moreover, nuclear chromatin clumping and starch grain no. increase were noted. These changes might be attributed to the increase in malondialdehyde and reactive oxygen species levels, which might have exceeded the scavenging ability of antioxidant enzymes (including peroxidase and superoxide dismutase). RGO impaired the extra- and intra-cellular morphol. and increased oxidative stress and thus inhibited algal growth and photosynthesis.
- 254Zhao, J.; Cao, X.; Wang, Z.; Dai, Y.; Xing, B. Mechanistic Understanding toward the Toxicity of Graphene-Family Materials to Freshwater Algae. Water Res. 2017, 111, 18– 27, DOI: 10.1016/j.watres.2016.12.037[Crossref], [PubMed], [CAS], Google Scholar254https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2sXhslGq&md5=3988f947ca81406be169c5d62977fcf1Mechanistic understanding toward the toxicity of graphene-family materials to freshwater algaeZhao, Jian; Cao, Xuesong; Wang, Zhenyu; Dai, Yanhui; Xing, BaoshanWater Research (2017), 111 (), 18-27CODEN: WATRAG; ISSN:0043-1354. (Elsevier Ltd.)We systematically investigated the toxicity mechanism of three graphene-family materials (GFMs), graphene oxide (GO), reduced graphene oxide (rGO) and multi-layer graphene (MG), to algae (Chlorella pyrenoidosa). GFMs exhibited much higher toxicity than other carbon materials (carbon nanotube and graphite), with the 96 h median effective concn. (EC50) values of 37.3 (GO), 34.0 (rGO), and 62.2 (MG) mg/L. Shading effect contributed approx. 16.4% of growth inhibition by GO due to its higher dispersibility and transformation while the other GFMs did not show any shading effect. Hydrophobic rGO and MG more readily heteroagglomerated with algae than GO, thus likely leading to more direct contacts with algae. Flow cytometry results showed significant decrease of membrane integrity after GFM exposure, and rGO caused the highest membrane damage, which was confirmed by the increased DNA and K+ efflux. The obsd. membrane damage was caused by a combination of oxidative stress and phys. penetration/extn. Moreover, all the three GFMs could adsorb macronutrients (N, P, Mg, and Ca) from the algal medium, thus leading to nutrient depletion-induced indirect toxicity. GO showed the highest nutrient depletion (53% of total toxicity) due to its abundant functional groups. The information provided in this work will be useful for understanding toxicity mechanism and environmental risk of different GFMs in aquatic environments.
- 255Hu, X.; Ouyang, S.; Mu, L.; An, J.; Zhou, Q. Effects of Graphene Oxide and Oxidized Carbon Nanotubes on the Cellular Division, Microstructure, Uptake, Oxidative Stress, and Metabolic Profiles. Environ. Sci. Technol. 2015, 49, 10825– 10833, DOI: 10.1021/acs.est.5b02102[ACS Full Text
 ], [CAS], Google Scholar255https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2MXhtlOntLbL&md5=771df09763ebca939ca26450d6817f48Effects of Graphene Oxide and Oxidized Carbon Nanotubes on the Cellular Division, Microstructure, Uptake, Oxidative Stress, and Metabolic ProfilesHu, Xiangang; Ouyang, Shaohu; Mu, Li; An, Jing; Zhou, QixingEnvironmental Science & Technology (2015), 49 (18), 10825-10833CODEN: ESTHAG; ISSN:0013-936X. (American Chemical Society)Nanomaterial oxides are common formations of nanomaterials in the natural environment. Herein, the nanotoxicol. of typical graphene oxide (GO) and carboxyl single-walled carbon nanotubes (C-SWCNT) was compared. The results showed that cell division of Chlorella vulgaris was promoted at 24 h and then inhibited at 96 h after nanomaterial exposure. At 96 h, GO and C-SWCNT inhibited the rates of cell division by 0.08-15% and 0.8-28.3%, resp. Both GO and C-SWCNT covered the cell surface, but the uptake percentage of C-SWCNT was 2-fold higher than that of GO. C-SWCNT induced stronger plasmolysis and mitochondrial membrane potential loss and decreased the cell viability to a greater extent than GO. Moreover, C-SWCNT-exposed cells exhibited more starch grains and lysosome formation and higher reactive oxygen species (ROS) levels than GO-exposed cells. Metabolomics anal. revealed significant differences in the metabolic profiles among the control, C-SWCNT and GO groups. The metabs. of alkanes, lysine, octadecadienoic acid and valine was assocd. with ROS and could be considered as new biomarkers of ROS. The nanotoxicol. mechanisms involved the inhibition of fatty acid, amino acid and small mol. acid metabs. These findings provide new insights into the effects of GO and C-SWCNT on cellular responses.
], [CAS], Google Scholar255https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2MXhtlOntLbL&md5=771df09763ebca939ca26450d6817f48Effects of Graphene Oxide and Oxidized Carbon Nanotubes on the Cellular Division, Microstructure, Uptake, Oxidative Stress, and Metabolic ProfilesHu, Xiangang; Ouyang, Shaohu; Mu, Li; An, Jing; Zhou, QixingEnvironmental Science & Technology (2015), 49 (18), 10825-10833CODEN: ESTHAG; ISSN:0013-936X. (American Chemical Society)Nanomaterial oxides are common formations of nanomaterials in the natural environment. Herein, the nanotoxicol. of typical graphene oxide (GO) and carboxyl single-walled carbon nanotubes (C-SWCNT) was compared. The results showed that cell division of Chlorella vulgaris was promoted at 24 h and then inhibited at 96 h after nanomaterial exposure. At 96 h, GO and C-SWCNT inhibited the rates of cell division by 0.08-15% and 0.8-28.3%, resp. Both GO and C-SWCNT covered the cell surface, but the uptake percentage of C-SWCNT was 2-fold higher than that of GO. C-SWCNT induced stronger plasmolysis and mitochondrial membrane potential loss and decreased the cell viability to a greater extent than GO. Moreover, C-SWCNT-exposed cells exhibited more starch grains and lysosome formation and higher reactive oxygen species (ROS) levels than GO-exposed cells. Metabolomics anal. revealed significant differences in the metabolic profiles among the control, C-SWCNT and GO groups. The metabs. of alkanes, lysine, octadecadienoic acid and valine was assocd. with ROS and could be considered as new biomarkers of ROS. The nanotoxicol. mechanisms involved the inhibition of fatty acid, amino acid and small mol. acid metabs. These findings provide new insights into the effects of GO and C-SWCNT on cellular responses. - 256Nogueira, P. F. M.; Nakabayashi, D.; Zucolotto, V. The Effects of Graphene Oxide on Green Algae Raphidocelis Subcapitata. Aquat. Toxicol. 2015, 166, 29– 35, DOI: 10.1016/j.aquatox.2015.07.001[Crossref], [PubMed], [CAS], Google Scholar256https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2MXhtF2rtrzE&md5=2fd1bb57adaabe853a3f7e0071dc4405The effects of graphene oxide on green algae Raphidocelis subcapitataNogueira, P. F. M.; Nakabayashi, D.; Zucolotto, V.Aquatic Toxicology (2015), 166 (), 29-35CODEN: AQTODG; ISSN:0166-445X. (Elsevier B.V.)Graphene represents a new class of nanomaterials that has attracted great interest due to its unique elec., thermal, and mech. properties. Once disposed in the environment, graphene can interact with biol. systems and is expected to exhibit toxicol. effects. The ecotoxicity of graphene and its derivs., viz.: graphene oxide (GO) depends on their physicochem. properties, including purity, diam., length, surface charge, functionalization and aggregation state. In this study we evaluated the effects of graphene oxide (GO) on green algae Raphidocelis subcapitata. The algae were exposed to different concns. of GO pre-equilibrated for 24 h with oligotrophic freshwater medium (20 mL ) during incubation in a growth chamber under controlled conditions: 120 μEm-2 s-1 illumination; 12:12 h light dark cycle and const. temp. of 22 ± 2 °C. Algal growth was monitored daily for 96 h by direct cell counting. Reactive oxygen species level (ROS), membrane damage (cell viability) and autofluorescence (chl-a fluorescence) were evaluated using fluorescent staining and further analyzed by flow cytometry. The toxic effects from GO, as obsd. in algal d. and autofluorescence, started at concns. from 20 and 10 μg mL-1, resp. Such toxicity is probably the result of ROS generation and membrane damage (cell viability). The shading effect caused by GO agglomeration in culture medium may also contribute to reduce algal d. The results reported here provide knowledge regarding the GO toxicity on green algae, contributing to a better understanding of its environmental behavior and impacts.
- 257Pereira, M. M.; Mouton, L.; Yéprémian, C.; Couté, A.; Lo, J.; Marconcini, J. M.; Ladeira, L. O.; Raposo, N. R.; Brandão, H. M.; Brayner, R. Ecotoxicological Effects of Carbon Nanotubes and Cellulose Nanofibers in Chlorella Vulgaris. J. Nanobiotechnol. 2014, 12, 15, DOI: 10.1186/1477-3155-12-15[Crossref], [PubMed], [CAS], Google Scholar257https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2MXivVahs7c%253D&md5=0391218499eb7b573f841e2b7667f5f9Ecotoxicological effects of carbon nanotubes and cellulose nanofibers in Chlorella vulgarisPereira, Michele M.; Mouton, Ludovic; Yepremian, Claude; Coute, Alain; Lo, Joanne; Marconcini, Jose M.; Ladeira, Luiz O.; Raposo, Nadia R. B.; Brandao, Humberto M.; Brayner, RobertaJournal of Nanobiotechnology (2014), 12 (), 15/1-15/13, 13 pp.CODEN: JNOAAO; ISSN:1477-3155. (BioMed Central Ltd.)Background: MWCNT and CNF are interesting NPs that possess great potential for applications in various fields such as water treatment, reinforcement materials and medical devices. However, the rapid dissemination of NPs can impact the environment and in the human health. Thus, the aim of this study was to evaluate the MWCNT and cotton CNF toxicol. effects on freshwater green microalgae Chlorella vulgaris. Results: Exposure to MWCNT and cotton CNF led to redns. on algal growth and cell viability. NP exposure induced reactive oxygen species (ROS) prodn. and a decreased of intracellular ATP levels. Addn. of NPs further induced ultrastructural cell damage. MWCNTs penetrate the cell membrane and individual MWCNTs are seen in the cytoplasm while no evidence of cotton CNFs was found inside the cells. Cellular uptake of MWCNT was obsd. in algae cells cultured in BB medium, but cells cultured in Seine river water did not internalize MWCNTs. Conclusions: Under the conditions tested, such results confirmed that exposure to MWCNTs and to cotton CNFs affects cell viability and algal growth.
- 258Dubinsky, Z.; Schofield, O. From the Light to the Darkness: Thriving at the Light Extremes in the Oceans. Hydrobiologia 2010, 639, 153– 171, DOI: 10.1007/s10750-009-0026-0
- 259Garacci, M.; Barret, M.; Mouchet, F.; Sarrieu, C.; Lonchambon, P.; Flahaut, E.; Gauthier, L.; Silvestre, J.; Pinelli, E. Few Layer Graphene Sticking by Biofilm of Freshwater Diatom Nitzschia Palea as a Mitigation to Its Ecotoxicity. Carbon 2017, 113, 139– 150, DOI: 10.1016/j.carbon.2016.11.033[Crossref], [CAS], Google Scholar259https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC28XhvFGjsLzO&md5=b9f4153fc1e708d2dc2a0d1f6d89ef38Few Layer Graphene sticking by biofilm of freshwater diatom Nitzschia palea as a mitigation to its ecotoxicityGaracci, M.; Barret, M.; Mouchet, F.; Sarrieu, C.; Lonchambon, P.; Flahaut, E.; Gauthier, L.; Silvestre, J.; Pinelli, E.Carbon (2017), 113 (), 139-150CODEN: CRBNAH; ISSN:0008-6223. (Elsevier Ltd.)Carbon-based nanoparticles such as graphene have many applications leading to their industrial prodn. Few-Layer Graphene (FLG) is thus likely to be found in the environment, and esp. in rivers. In this study, the effect of FLG on the photosynthetic benthic diatom Nitzschia palea was assessed making distinction between the impact of a direct contact with FLG and a shading effect of FLG on diatoms. Growth inhibition of diatoms exposed to FLG at 50 mg L-1 was obsd. at 48 h of exposure assocd. with an increase in diatoms mortality. At 144 h, the growth rate was recovered. However, in shading condition, at 48 h of FLG exposure, a persistent growth inhibition was obsd. at 50 mg L-1. Microscopic observations and a monitoring of FLG concn. in the medium allowed to conclude that exo-polymeric substances (EPS), naturally secreted by N. palea, strongly interact with FLG, sticking nanoparticles at the bottom of wells. Our results highlight the potential mechanisms of clarification of the water column by diatoms biofilms, by sticking FLG even at high concn. Overall, these results suggest that one potential toxicity process of graphene could be a combination of direct and shading effect leading to a strong interaction between biofilm and nanoparticles.
- 260Lüttge, U.; Büdel, B. Resurrection Kinetics of Photosynthesis in Desiccation-Tolerant Terrestrial Green Algae (Chlorophyta) on Tree Bark. Plant Biol. 2010, 12, 437– 444, DOI: 10.1111/j.1438-8677.2009.00249.x[Crossref], [PubMed], [CAS], Google Scholar260https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3cXlslWqur4%253D&md5=b7d32b4fed607fa9237d67f6a5345c0bResurrection kinetics of photosynthesis in desiccation-tolerant terrestrial green algae (Chlorophyta) on tree barkLuettge, U.; Buedel, B.Plant Biology (Hoboken, NJ, United States) (2010), 12 (3), 437-444CODEN: PBIOFN; ISSN:1435-8603. (Wiley-Blackwell)The rough bark of orchard trees (Malus) around Darmstadt is predominantly covered in red to purple-brown layers (biofilms) of epiphytic terrestrial alga of Trentepohlia umbrina. The smooth bark of forest trees (Fagus sylvatica L. and Acer sp.) in the same area is covered by bright green biofilms composed of the green algae Desmococcus, Apatococcus and Trebouxia, with a few cells of Coccomyxa and "Chlorella" trebouxioides between them. These algae are desiccation tolerant. After samples of bark with the biofilms were kept in dry air in darkness for various periods of time, potential quantum yield of PSII, Fv/Fm, recovered during rehydration upon rewetting. The kinetics and degree of recovery depended on the length of time that the algae were kept in dry air in the desiccated state. Recovery was better for green biofilm samples, i.e. quite good even after 80 days of desiccation (Fv/Fm = ca. 50% of initial value), than the red samples, where recovery was only adequate up to ca. 30-40 days of desiccation (Fv/Fm = ca. 20-55% of initial value). It is concluded that the different bark types constitute different ecophysiol. niches that can be occupied by the algae and that can be distinguished by their capacity to recover from desiccation after different times in the dry state.
- 261Holzinger, A.; Karsten, U. Desiccation Stress and Tolerance in Green Algae: Consequences for Ultrastructure, Physiological and Molecular Mechanisms. Front. Plant Sci. 2013, 4, 327, DOI: 10.3389/fpls.2013.00327[Crossref], [PubMed], [CAS], Google Scholar261https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A280%3ADC%252BC3sbjtlCksA%253D%253D&md5=9da7309cdb7b416da9081de08714a033Desiccation stress and tolerance in green algae: consequences for ultrastructure, physiological and molecular mechanismsHolzinger Andreas; Karsten UlfFrontiers in plant science (2013), 4 (), 327 ISSN:1664-462X.Although most green algae typically occur in aquatic ecosystems, many species also live partly or permanently under aeroterrestrial conditions, where the cells are exposed to the atmosphere and hence regularly experience dehydration. The ability of algal cells to survive in an air-dried state is termed desiccation tolerance. The mechanisms involved in desiccation tolerance of green algae are still poorly understood, and hence the aim of this review is to summarize recent findings on the effects of desiccation and osmotic water loss. Starting from structural changes, physiological, and biochemical consequences of desiccation will be addressed in different green-algal lineages. The available data clearly indicate a range of strategies, which are rather different in streptophycean and non-streptophycean green algae. While members of the Trebouxiophyceae exhibit effective water loss-prevention mechanisms based on the biosynthesis and accumulation of particular organic osmolytes such as polyols, these compounds are so far not reported in representatives of the Streptophyta. In members of the Streptophyta such as Klebsormidium, the most striking observation is the appearance of cross-walls in desiccated samples, which are strongly undulating, suggesting a high degree of mechanical flexibility. This aids in maintaining structural integrity in the dried state and allows the cell to maintain turgor pressure for a prolonged period of time during the dehydration process. Physiological strategies in aeroterrestrial green algae generally include a rapid reduction of photosynthesis during desiccation, but also a rather quick recovery after rewetting, whereas aquatic species are sensitive to drying. The underlying mechanisms such as the affected molecular components of the photosynthetic machinery are poorly understood in green algae. Therefore, modern approaches based on transcriptomics, proteomics, and/or metabolomics are urgently needed to better understand the molecular mechanisms involved in desiccation-stress physiology of these organisms. The very limited existing information is described in the present review.
- 262Montagner, A.; Bosi, S.; Tenori, E.; Bidussi, M.; Alshatwi, A. A.; Tretiach, M.; Prato, M.; Syrgiannis, Z. Ecotoxicological Effects of Graphene-Based Materials. 2D Mater. 2017, 4, 012001, DOI: 10.1088/2053-1583/4/1/012001
- 263Wang, Y.; Chang, C. H.; Ji, Z.; Bouchard, D. C.; Nisbet, R. M.; Schimel, J. P.; Gardea-Torresdey, J. L.; Holden, P. A. Agglomeration Determines Effects of Carbonaceous Nanomaterials on Soybean Nodulation, Dinitrogen Fixation Potential, and Growth in Soil. ACS Nano 2017, 11, 5753– 5765, DOI: 10.1021/acsnano.7b01337[ACS Full Text
 ], [CAS], Google Scholar263https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2sXos1agtb8%253D&md5=6b2e1df4924948a58dd7b0f130883e2eAgglomeration Determines Effects of Carbonaceous Nanomaterials on Soybean Nodulation, Dinitrogen Fixation Potential, and Growth in SoilWang, Ying; Chang, Chong Hyun; Ji, Zhaoxia; Bouchard, Dermont C.; Nisbet, Roger M.; Schimel, Joshua P.; Gardea-Torresdey, Jorge L.; Holden, Patricia A.ACS Nano (2017), 11 (6), 5753-5765CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)The potential effects of carbonaceous nanomaterials (CNMs) on agricultural plants are of concern. However, little research has been performed using plants cultivated to maturity in soils contaminated with various CNMs at different concns. Here, we grew soybean for 39 days to seed prodn. in soil amended with 0.1, 100, or 1000 mg kg-1 of either multi-walled carbon nanotubes (MWCNTs), graphene nanoplatelets (GNPs), or carbon black (CB), and studied plant growth, nodulation, and dinitrogen (N2) fixation potential. Plants in all CNM treatments flowered earlier (producing 60 to 372% more flowers when reprodn. started) than the unamended controls. The low MWCNT-treated plants were shorter (by 15%) with slower leaf cover expansion (by 26%) and less final leaf area (by 24%) than the controls. Nodulation and N2 fixation potential appeared neg. impacted by CNMs, with stronger effects at lower CNM concns. All CNM treatments reduced the whole-plant N2 fixation potential, with the highest redns. (by over 91%) in the low and medium CB, and the low MWCNT, treatments. CB and GNPs appeared to accumulate inside nodules as obsd. by transmission electron microscopy. CNM dispersal in aq. soil exts. was studied to explain the inverse dose-response relationships, showing that CNMs at higher concns. were more agglomerated (over 90% CNMs settled as agglomerates >3 μm after 12 h) and therefore proportionally less bioavailable. Overall, our findings suggest that lower concns. of CNMs in soils could be more impactful to leguminous N2 fixation, owing to greater CNM dispersal and therefore increased bioavailability at lower concns.
], [CAS], Google Scholar263https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2sXos1agtb8%253D&md5=6b2e1df4924948a58dd7b0f130883e2eAgglomeration Determines Effects of Carbonaceous Nanomaterials on Soybean Nodulation, Dinitrogen Fixation Potential, and Growth in SoilWang, Ying; Chang, Chong Hyun; Ji, Zhaoxia; Bouchard, Dermont C.; Nisbet, Roger M.; Schimel, Joshua P.; Gardea-Torresdey, Jorge L.; Holden, Patricia A.ACS Nano (2017), 11 (6), 5753-5765CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)The potential effects of carbonaceous nanomaterials (CNMs) on agricultural plants are of concern. However, little research has been performed using plants cultivated to maturity in soils contaminated with various CNMs at different concns. Here, we grew soybean for 39 days to seed prodn. in soil amended with 0.1, 100, or 1000 mg kg-1 of either multi-walled carbon nanotubes (MWCNTs), graphene nanoplatelets (GNPs), or carbon black (CB), and studied plant growth, nodulation, and dinitrogen (N2) fixation potential. Plants in all CNM treatments flowered earlier (producing 60 to 372% more flowers when reprodn. started) than the unamended controls. The low MWCNT-treated plants were shorter (by 15%) with slower leaf cover expansion (by 26%) and less final leaf area (by 24%) than the controls. Nodulation and N2 fixation potential appeared neg. impacted by CNMs, with stronger effects at lower CNM concns. All CNM treatments reduced the whole-plant N2 fixation potential, with the highest redns. (by over 91%) in the low and medium CB, and the low MWCNT, treatments. CB and GNPs appeared to accumulate inside nodules as obsd. by transmission electron microscopy. CNM dispersal in aq. soil exts. was studied to explain the inverse dose-response relationships, showing that CNMs at higher concns. were more agglomerated (over 90% CNMs settled as agglomerates >3 μm after 12 h) and therefore proportionally less bioavailable. Overall, our findings suggest that lower concns. of CNMs in soils could be more impactful to leguminous N2 fixation, owing to greater CNM dispersal and therefore increased bioavailability at lower concns. - 264Begum, P.; Fugetsu, B. Induction of Cell Death by Graphene in Arabidopsis Thaliana (Columbia Ecotype) T87 Cell Suspensions. J. Hazard. Mater. 2013, 260, 1032– 1041, DOI: 10.1016/j.jhazmat.2013.06.063[Crossref], [PubMed], [CAS], Google Scholar264https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3sXht1ylu7zM&md5=96bdb824dedc9dacd0d8165f9e22d972Induction of cell death by graphene in Arabidopsis thaliana (Columbia ecotype) T87 cell suspensionsBegum, Parvin; Fugetsu, BunshiJournal of Hazardous Materials (2013), 260 (), 1032-1041CODEN: JHMAD9; ISSN:0304-3894. (Elsevier B.V.)The toxicity of graphene on suspensions of Arabidopsis thaliana (Columbia ecotype) T87 cells was investigated by examg. the morphol., mitochondrial dysfunction, reactive oxygen species generation (ROS), and translocation of graphene as the toxicol. endpoints. The cells were grown in Jouanneau and Peaud-Lenoel (JPL) media and exposed to graphene at concns. 0-80 mg/L. Morphol. changes were obsd. by scanning electron microscope and the adverse effects such as fragmented nuclei, membrane damage, mitochondrial dysfunction was obsd. with fluorescence microscopy by staining with Hoechst 33342/propidium iodide and succinate dehydrogenase (mitochondrial bioenergetic enzyme). Anal. of intracellular ROS by 2',7'-dichlorofluorescein diacetate demonstrated that graphene induced a 3.3-fold increase in ROS, suggesting that ROS are key mediators in the cell death signaling pathway. Transmission electron microscopy verified the translocation of graphene into cells and an endocytosis-like structure was obsd. which suggested graphene entering into the cells by endocytosis. In conclusion, our results show that graphene induced cell death in T87 cells through mitochondrial damage mediated by ROS.
- 265Wang, Q.; Zhao, S.; Zhao, Y.; Rui, Q.; Wang, D. Toxicity and Translocation of Graphene Oxide in Arabidopsis Plants under Stress Conditions. RSC Adv. 2014, 4, 60891– 60901, DOI: 10.1039/C4RA10621K[Crossref], [CAS], Google Scholar265https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2cXhsl2nsr7M&md5=96adef44a2318dbca0fc060c81524e28Toxicity and translocation of graphene oxide in Arabidopsis plants under stress conditionsWang, Qianqian; Zhao, Shengqing; Zhao, Yunli; Rui, Qi; Wang, DayongRSC Advances (2014), 4 (105), 60891-60901CODEN: RSCACL; ISSN:2046-2069. (Royal Society of Chemistry)In the present study, we investigated the toxicity and translocation of graphene oxide (GO) in the μg L-1 range in Arabidopsis plants under both normal and stress conditions. Exposure to GO for 4 wk did not cause adverse effects on the development of Arabidopsis seedlings. In contrast, the combined exposure to GO and PEG 6000 (20%) or NaCl (200 mM) resulted in a more severe loss of morphol., decrease in fresh wt. or root length, and increase in root-to-shoot ratio in Arabidopsis seedlings compared with exposure to stress alone. The combined exposure to GO and PEG 6000 (20%) or NaCl (200 mM) resulted in a greater increase in hydrogen peroxide content or membrane ion leakage, decrease in superoxide dismutase activity or catalase activity, and induction of reactive oxygen species prodn. in Arabidopsis seedlings compared with exposure to stress alone. The combined exposure to GO and PEG 6000 (20%) or NaCl (200 mM) induced more severe alterations in expression patterns of genes required for development, abiotic stress, and membrane ion leakage in Arabidopsis seedlings. Moreover, under stress conditions, more GO was distributed in Arabidopsis seedlings and GO was translocated from roots to leaves. We hypothesize that, under stress conditions, GO may induce oxidative stress and membrane ion leakage, which may in turn induce GO translocation from the roots to the leaves. Our results will be useful for understanding toxicity and translocation of GO under different environmental conditions.
- 266Zhao, S.; Wang, Q.; Zhao, Y.; Rui, Q.; Wang, D. Toxicity and Translocation of Graphene Oxide in Arabidopsis Thaliana. Environ. Toxicol. Pharmacol. 2015, 39, 145– 156, DOI: 10.1016/j.etap.2014.11.014[Crossref], [PubMed], [CAS], Google Scholar266https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2cXitVyksrnF&md5=c1d5256dd7da1f77f70d3aeab2e98839Toxicity and translocation of graphene oxide in Arabidopsis thalianaZhao, Shengqing; Wang, Qianqian; Zhao, Yunli; Rui, Qi; Wang, DayongEnvironmental Toxicology and Pharmacology (2015), 39 (1), 145-156CODEN: ETOPFR; ISSN:1382-6689. (Elsevier B.V.)The authors investigated the possible safety property and translocation of graphene oxide (GO) in the range of μg/L in Arabidopsis. GO exposure did not obviously influence germination, seed development, shoot and root development of seedlings, and flowering time. Meanwhile, GO exposure could not induce severe H2O2 prodn., increase in malondialdehyde content, formation of oxidative stress, and altered activities of antioxidant enzymes. Moreover, GO exposure did not change expression patterns of examd. genes required for germination, photomorphogenesis, root development, and transition from vegetative to reproductive development. In the seedling, the authors did not observe severe GO accumulation in mesophyll and parenchyma cells of leaf or stem, and in sieve element in leaf, stem, or root. In contrast, the authors obsd. the severe GO accumulation in root hair and root parenchyma cells. The authors' results provide the physiol. basis for safety property of GO at the examd. concns. in Arabidopsis plants. Furthermore, the authors' data imply that although GO was absorbed by Arabidopsis plants through root hairs, plants might still have strong ability to be against GO translocation into stem or leaves. In addn., the authors found that cotyledon might serve as an important site for GO distribution during the early development.
- 267Chen, L.; Wang, C.; Li, H.; Qu, X.; Yang, S.-T.; Chang, X.-L. Bioaccumulation and Toxicity of 13 C-Skeleton Labeled Graphene Oxide in Wheat. Environ. Sci. Technol. 2017, 51, 10146– 10153, DOI: 10.1021/acs.est.7b00822
- 268Liu, S.; Wei, H.; Li, Z.; Li, S.; Yan, H.; He, Y.; Tian, Z. Effects of Graphene on Germination and Seedling Morphology in Rice. J. Nanosci. Nanotechnol. 2015, 15, 2695– 2701, DOI: 10.1166/jnn.2015.9254[Crossref], [PubMed], [CAS], Google Scholar268https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2MXls1Cltbk%253D&md5=eee12e9c95715ae90e03f3984ca48f70Effects of graphene on germination and seedling morphology in riceLiu, Shangjie; Wei, Hongmin; Li, Zhiyang; Li, Shun; Yan, Han; He, Yong; Tian, ZhihongJournal of Nanoscience and Nanotechnology (2015), 15 (4), 2695-2701CODEN: JNNOAR; ISSN:1533-4880. (American Scientific Publishers)The effects of graphene on the germination and growth of rice seeds were studied. Seeds were treated with graphene solns. at different concns. Obvious delaying effects on the germination rate were obsd. with the increasing of graphene concn. The growth of radicle and plumule was inhibited. And also, the morphol. (root length, stem length, adventitious no., root fresh wt., fresh wt. of over ground part and root cap ratio) of rice seedlings was certainly affected. After been treated by different concns. of graphene for 16 d, promoting effects on adventitious root no., root fresh wt. and fresh wt. of over ground part were obsd. at concn. of 5 mg/L. Significant inhibitions on the stem length and fresh wt. of over ground part were obsd. at concn. of 50 mg/L. In addn., all the indexes were inhibited at concns. of 100 mg/L and 200 mg/L. It indicates that graphene certainly inhibit the morphogenesis of rice seedlings. But the mechanism by which graphene of 5 mg/L improves part of growth indexes still needs further study.
- 269Anjum, N. A.; Singh, N.; Singh, M. K.; Sayeed, I.; Duarte, A. C.; Pereira, E.; Ahmad, I. Single-Bilayer Graphene Oxide Sheet Impacts and Underlying Potential Mechanism Assessment in Germinating Faba Bean (Vicia Faba L.). Sci. Total Environ. 2014, 472, 834– 841, DOI: 10.1016/j.scitotenv.2013.11.018[Crossref], [PubMed], [CAS], Google Scholar269https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2cXht1KjtLw%253D&md5=d315abb33f325eb98ecf55689035da87Single-bilayer graphene oxide sheet impacts and underlying potential mechanism assessment in germinating faba bean (Vicia faba L.)Anjum, Naser A.; Singh, Neetu; Singh, Manoj K.; Sayeed, Iqbal; Duarte, Armando C.; Pereira, Eduarda; Ahmad, IqbalScience of the Total Environment (2014), 472 (), 834-841CODEN: STENDL; ISSN:0048-9697. (Elsevier B.V.)This study investigates the impact of different single-bilayer graphene oxide sheet (hereafter 'graphene oxide', GO; size: 0.5-5 μm) concns. (0, 100, 200, 400, 800 and 1600 mg L- 1) and underlying potential mechanisms in germinating faba bean (Vicia faba L.) seedlings. The study revealed both pos. and neg. concn.-dependent GO-effects on V. faba. Significant neg. impacts of GO concns. (ordered by magnitude of effect: 1600 >200>100 mg GO L- 1) were indicated by decreases in growth parameters and the activity of H2O2-decompg. enzymes (ascorbate peroxidase, APX; catalase, CAT), and by increases in the levels of electrolyte leakage (EL), H2O2, and lipid and protein oxidn. The pos. impacts of 400 and 800 mg GO L- 1 included significant improvements in V. faba health status indicated by decreased levels of EL, H2O2, and lipid and protein oxidn., and by enhanced H2O2-decompg. APX and CAT activity, and increased proline and seed-relative water content. V. faba seedlings-polypeptide patterns strongly substantiated these GO-concn. effects. Overall, the pos. effects of these two GO concns. (800 >400 mg L- 1) on V. faba seedlings indicate their safe nature and allow to suggest further studies.
- 270Chichiriccò, G.; Poma, A. Penetration and Toxicity of Nanomaterials in Higher Plants. Nanomaterials 2015, 5, 851– 873, DOI: 10.3390/nano5020851[Crossref], [PubMed], [CAS], Google Scholar270https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2MXpvFCrurk%253D&md5=40f9442a645358e732a2f8f36bc2a786Penetration and toxicity of nanomaterials in higher plantsChichiricco, Giuseppe; Poma, AnnaNanomaterials (2015), 5 (2), 851-873CODEN: NANOKO; ISSN:2079-4991. (MDPI AG)Nanomaterials (NMs) comprise either inorg. particles consisting of metals, oxides, and salts that exist in nature and may be also produced in the lab., or org. particles originating only from the lab., having at least one dimension between 1 and 100 nm in size. According to shape, size, surface area, and charge, NMs have different mech., chem., elec., and optical properties that make them suitable for technol. and biomedical applications and thus they are being increasingly produced and modified. Despite their beneficial potential, their use may be hazardous to health owing to the capacity to enter the animal and plant body and interact with cells. Studies on NMs involve technologists, biologists, physicists, chemists, and ecologists, so there are numerous reports that are significantly raising the level of knowledge, esp. in the field of nanotechnol.; however, many aspects concerning nanobiol. remain undiscovered, including the interactions with plant biomols. In this review we examine current knowledge on the ways in which NMs penetrate plant organs and interact with cells, with the aim of shedding light on the reactivity of NMs and toxicity to plants. These points are discussed critically to adjust the balance with regard to the risk to the health of the plants as well as providing some suggestions for new studies on this topic.
- 271Begum, P.; Ikhtiari, R.; Fugetsu, B. Graphene Phytotoxicity in the Seedling Stage of Cabbage, Tomato, Red Spinach, and Lettuce. Carbon 2011, 49, 3907– 3919, DOI: 10.1016/j.carbon.2011.05.029[Crossref], [CAS], Google Scholar271https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3MXotlChur8%253D&md5=01e1aba97e9af8d853793ce41263da0cGraphene phytotoxicity in the seedling stage of cabbage, tomato, red spinach, and lettuceBegum, Parvin; Ikhtiari, Refi; Fugetsu, BunshiCarbon (2011), 49 (12), 3907-3919CODEN: CRBNAH; ISSN:0008-6223. (Elsevier Ltd.)The effects of graphene on root and shoot growth, biomass, shape, cell death, and reactive oxygen species (ROS) of cabbage, tomato, red spinach, and lettuce, were investigated using a concn. range from 500 to 2000 mg/L. The results of the combined morphol. and physiol. analyses indicate that after 20 days of exposure under our exptl. conditions, graphene significantly inhibited plant growth and biomass compared to a control. The no. and size of leaves of the graphene-treated plants were reduced in a dose-dependent manner. Significant effects also were detected showing a concn.-dependent increase in ROS and cell death as well as visible symptoms of necrotic lesions, indicating graphene-induced adverse effects on cabbage, tomato, and red spinach mediated by oxidative stress necrosis. Little or no significant toxic effect was obsd. with lettuce seedlings under the same conditions. The potential effect of graphene largely depends on dose, exposure time, and plant species and deserves further attention.
- 272Candotto Carniel, F.; Gorelli, D.; Flahaut, E.; Fortuna, L.; Del Casino, C.; Cai, G.; Nepi, M.; Prato, M.; Tretiach, M. Graphene Oxide Impairs the Pollen Performance of Nicotiana Tabacum and Corylus Avellana Suggesting Potential Negative Effects on the Sexual Reproduction of Seed Plants. Environ. Sci.: Nano 2018, 5, 1608– 1617, DOI: 10.1039/C8EN00052B[Crossref], [CAS], Google Scholar272https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC1cXhtVGntrjM&md5=258ee7be9036602f9b8194a14d492907Graphene oxide impairs the pollen performance of Nicotiana tabacum and Corylus avellana suggesting potential negative effects on the sexual reproduction of seed plantsCandotto Carniel, Fabio; Gorelli, Davide; Flahaut, Emmanuel; Fortuna, Lorenzo; Del Casino, Cecilia; Cai, Giampiero; Nepi, Massimo; Prato, Maurizio; Tretiach, MauroEnvironmental Science: Nano (2018), 5 (7), 1608-1617CODEN: ESNNA4; ISSN:2051-8161. (Royal Society of Chemistry)The prodn. of graphene based materials (GBMs) is steadily increasing but the effects of the possible release of GBMs in the environment are far from being understood. Graphene oxide (GO) is among the most active GBMs and it causes widely varying effects on the vegetative body of seed plants. However, nothing is known yet about its potential effects on the reproductive process. This study addresses the effects of GO on pollen germination and pollen tube elongation in the model species Nicotiana tabacum and in the non-model species Corylus avellana. In vitro germination expts. were conducted without or with GO (control and treated samples, resp.) at concns. of 25, 50 and 100 μg mL-1. Pollen germination and tube elongation were affected at GO concns. ≥50 μg mL-1, decreasing by 20% and 19% in N. tabacum and by 68% and 58% in C. avellana, resp. GO did not affect the viability of N. tabacum pollen, but doubled the frequency of bent tubes. Microscopy observations of pollen tubes exposed to a cell-permeant, dual-excitation ratiometric pH indicator revealed that GO affected the intracellular pH homeostasis. Further germination expts. on C. avellana conducted by inverting the pH conditions of the control and treated (100 μg GO mL-1) samples demonstrated that the main factor influencing the pollen performance is the acidic properties of GO. This might affect the reproductive process of numerous seed plants thus being relevant from an environmental point of view.
- 273Zhang, W.; Wang, C.; Li, Z.; Lu, Z.; Li, Y.; Yin, J.-J.; Zhou, Y.-T.; Gao, X.; Fang, Y.; Nie, G.; Zhao, Y. Unraveling Stress-Induced Toxicity Properties of Graphene Oxide and the Underlying Mechanism. Adv. Mater. 2012, 24, 5391– 5397, DOI: 10.1002/adma.201202678[Crossref], [PubMed], [CAS], Google Scholar273https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC38Xht1GltbbL&md5=cbb583e05af4c21f2ba877a83fa72285Unraveling Stress-induced Toxicity Properties of Graphene Oxide and the Underlying MechanismZhang, Wendi; Wang, Chi; Li, Zhongjun; Lu, Zhenzhen; Li, Yiye; Yin, Jun-Jie; Zhou, Yu-Ting; Gao, Xingfa; Fang, Ying; Nie, Guangjun; Zhao, YuliangAdvanced Materials (Weinheim, Germany) (2012), 24 (39), 5391-5397CODEN: ADVMEW; ISSN:0935-9648. (Wiley-VCH Verlag GmbH & Co. KGaA)Here, the authors used a simple animal model, Caenorhabditis elegans (C. elegans) to investigate in vivo the toxic profile of graphene oxide (GO) and functionalized GO modified with PEGylated poly-L-lysine (PLL-PEG) (GO/PP) under both normal and stress conditions. With this simple model, the potential in vivo toxicity of nanosheets under stress was studied using juglone or heat for stress. The authors found in the cyt C/H2O2 system, the addn. of GO/PP significantly enhanced the yield of DMPOX and slightly advanced the appearance of DMPOX. Addnl. studies showed DMPOX was formed exclusively in the presence of both cytochrome c (cyto c) and H2O2. DMPO was not oxidized to DMPOX by either GO/PP alone or GO/PP with H2O2, meaning that the cyt c intermediate caused the accumulation of DMPOX and that GO/PP assisted the electron transfer in this pathway. The role of the cyt c/H2O2 system might constitute one of the important pathways for the toxicity mechanism of nanosheets under these or other pathophysiol. conditions.
- 274Jung, S.-K.; Qu, X.; Aleman-Meza, B.; Wang, T.; Riepe, C.; Liu, Z.; Li, Q.; Zhong, W. Multi-Endpoint, High-Throughput Study of Nanomaterial Toxicity in Caenorhabditis Elegans. Environ. Sci. Technol. 2015, 49, 2477– 2485, DOI: 10.1021/es5056462[ACS Full Text
 ], [CAS], Google Scholar274https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2MXhsVCgsbk%253D&md5=388936461e00d7f81dce0e453df8f172Multi-endpoint, High-Throughput Study of Nanomaterial Toxicity in Caenorhabditis elegansJung, Sang-Kyu; Qu, Xiaolei; Aleman-Meza, Boanerges; Wang, Tianxiao; Riepe, Celeste; Liu, Zheng; Li, Qilin; Zhong, WeiweiEnvironmental Science & Technology (2015), 49 (4), 2477-2485CODEN: ESTHAG; ISSN:0013-936X. (American Chemical Society)The booming nanotechnol. industry has raised public concerns about the environmental health and safety impact of engineered nanomaterials (ENMs). High-throughput assays are needed to obtain toxicity data for the rapidly increasing no. of ENMs. Here the authors present a suite of high-throughput methods to study nanotoxicity in intact animals using Caenorhabditis elegans as a model. At the population level, the authors' system measures food consumption of thousands of animals to evaluate population fitness. At the organism level, the authors' automated system analyzes hundreds of individual animals for body length, locomotion speed, and lifespan. To demonstrate the utility of the authors' system, the authors applied this technol. to test the toxicity of 20 nanomaterials at four concns. Only fullerene nanoparticles (nC60), fullerol, TiO2, and CeO2 showed little or no toxicity. Various degrees of toxicity were detected from different forms of carbon nanotubes, graphene, carbon black, Ag, and fumed SiO2 nanoparticles. Aminofullerene and UV-irradiated nC60 also showed small but significant toxicity. The authors further investigated the effects of nanomaterial size, shape, surface chem., and exposure conditions on toxicity. The authors' data are publicly available at the open-access nanotoxicity database ww.QuantWorm.org/nano.
], [CAS], Google Scholar274https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2MXhsVCgsbk%253D&md5=388936461e00d7f81dce0e453df8f172Multi-endpoint, High-Throughput Study of Nanomaterial Toxicity in Caenorhabditis elegansJung, Sang-Kyu; Qu, Xiaolei; Aleman-Meza, Boanerges; Wang, Tianxiao; Riepe, Celeste; Liu, Zheng; Li, Qilin; Zhong, WeiweiEnvironmental Science & Technology (2015), 49 (4), 2477-2485CODEN: ESTHAG; ISSN:0013-936X. (American Chemical Society)The booming nanotechnol. industry has raised public concerns about the environmental health and safety impact of engineered nanomaterials (ENMs). High-throughput assays are needed to obtain toxicity data for the rapidly increasing no. of ENMs. Here the authors present a suite of high-throughput methods to study nanotoxicity in intact animals using Caenorhabditis elegans as a model. At the population level, the authors' system measures food consumption of thousands of animals to evaluate population fitness. At the organism level, the authors' automated system analyzes hundreds of individual animals for body length, locomotion speed, and lifespan. To demonstrate the utility of the authors' system, the authors applied this technol. to test the toxicity of 20 nanomaterials at four concns. Only fullerene nanoparticles (nC60), fullerol, TiO2, and CeO2 showed little or no toxicity. Various degrees of toxicity were detected from different forms of carbon nanotubes, graphene, carbon black, Ag, and fumed SiO2 nanoparticles. Aminofullerene and UV-irradiated nC60 also showed small but significant toxicity. The authors further investigated the effects of nanomaterial size, shape, surface chem., and exposure conditions on toxicity. The authors' data are publicly available at the open-access nanotoxicity database ww.QuantWorm.org/nano. - 275Zhao, Y.; Wu, Q.; Wang, D. An Epigenetic Signal Encoded Protection Mechanism Is Activated by Graphene Oxide to Inhibit Its Induced Reproductive Toxicity in Caenorhabditis Elegans. Biomaterials 2016, 79, 15– 24, DOI: 10.1016/j.biomaterials.2015.11.052
- 276Yang, R.; Ren, M.; Rui, Q.; Wang, D. A Mir-231-Regulated Protection Mechanism against the Toxicity of Graphene Oxide in Nematode Caenorhabditis Elegans. Sci. Rep. 2016, 6, 32214, DOI: 10.1038/srep32214[Crossref], [PubMed], [CAS], Google Scholar276https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC28XhsVWmsLvL&md5=46fa7e74be417569088d1b8b34c0e0bfA mir-231-Regulated Protection Mechanism against the Toxicity of Graphene Oxide in Nematode Caenorhabditis elegansYang, Ruilong; Ren, Mingxia; Rui, Qi; Wang, DayongScientific Reports (2016), 6 (), 32214CODEN: SRCEC3; ISSN:2045-2322. (Nature Publishing Group)Recently, several dysregulated microRNAs (miRNAs) have been identified in organisms exposed to graphene oxide (GO). However, their biol. functions and mechanisms of the action are still largely unknown. Here, we investigated the mol. mechanism of mir-231 in the regulation of GO toxicity using in vivo assay system of Caenorhabditis elegans. We found that GO exposure inhibited the expression of mir-231::GFP in multiple tissues, in particular in the intestine. mir-231 acted in intestine to regulate the GO toxicity, and overexpression of mir-231 in intestine caused a susceptible property of nematodes to GO toxicity. smk-1 encoding a homolog to mammalian SMEK functioned as a targeted gene for mir-231, and was also involved in the intestinal regulation of GO toxicity. Mutation of smk-1 gene induced a susceptible property to GO toxicity, whereas the intestinal overexpression of smk-1 resulted in a resistant property to GO toxicity. Moreover, mutation of smk-1 gene suppressed the resistant property of mir-231 mutant to GO toxicity. In nematodes, SMK-1 further acted upstream of the transcriptional factor DAF-16/FOXO in insulin signaling pathway to regulate GO toxicity. Therefore, mir-231 may encode a GO-responsive protection mechanism against the GO toxicity by suppressing the function of the SMK-1 - DAF-16 signaling cascade in nematodes.
- 277Ren, M.; Zhao, L.; Lv, X.; Wang, D. Antimicrobial Proteins in the Response to Graphene Oxide in Caenorhabditis Elegans. Nanotoxicology 2017, 11, 578– 590, DOI: 10.1080/17435390.2017.1329954[Crossref], [PubMed], [CAS], Google Scholar277https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2sXosVahsL8%253D&md5=21918060a5d7c0c64ed030619cc5707dAntimicrobial proteins in the response to graphene oxide in Caenorhabditis elegansRen, Mingxia; Zhao, Li; Lv, Xiao; Wang, DayongNanotoxicology (2017), 11 (4), 578-590CODEN: NANOGK; ISSN:1743-5404. (Taylor & Francis Ltd.)Upon exposure to environmental engineered nanomaterials (ENMs), animals will activate certain response signals to protect themselves from the toxic effects. However, the underlying mol. mechanisms for this response are still largely unclear. Using in vivo assay system of Caenorhabditis elegans, we here found that antimicrobial proteins of LYS-1, LYS-8, SPP-1, DOD-6, and F55G11.4 were activated by graphene oxide (GO) exposure. These antimicrobial proteins functioned as mol. targets of transcriptional factor DAF-16 in insulin signaling pathway, and acted in intestine to regulate the response to GO. Among these antimicrobial proteins, DOD-6, F55G11.4, and SPP-1 participated in the formation of signaling cascade of DAF-16-DOD-6-SOD-3-F55G11.4/SPP-1 in response to GO exposure by activating the antioxidn. system. Different from this, LYS-1 and LYS-8, two lysozymes, mediated TUB-2 signaling and DAF-8-DAF-5 signaling cascade, resp., to regulate the response to GO exposure. During the regulation of response to GO exposure, LYS-1 and LYS-8 acted synergistically, which could be largely explained by the obsd. synergistic interaction between TUB-2 and DAF-8. Therefore, our results demonstrate the crucial protection role of antimicrobial proteins for animals in response to environmental ENMs' exposure. The elucidated different signaling cascades mediated by antimicrobial proteins provide important mol. targets for future toxicity assessment and chem. modification of GO.
- 278Zanni, E.; De Bellis, G.; Bracciale, M. P.; Broggi, A.; Santarelli, M. L.; Sarto, M. S.; Palleschi, C.; Uccelletti, D. Graphite Nanoplatelets and Caenorhabditis Elegans : Insights from an in Vivo Model. Nano Lett. 2012, 12, 2740– 2744, DOI: 10.1021/nl204388p[ACS Full Text
 ], [CAS], Google Scholar278https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC38XntlOhu7s%253D&md5=a139e0455282de8b09f0789f1a488cbdGraphite Nanoplatelets and Caenorhabditis elegans: Insights from an in Vivo ModelZanni, Elena; De Bellis, Giovanni; Bracciale, Maria P.; Broggi, Alessandra; Santarelli, Maria L.; Sarto, Maria S.; Palleschi, Claudio; Uccelletti, DanielaNano Letters (2012), 12 (6), 2740-2744CODEN: NALEFD; ISSN:1530-6984. (American Chemical Society)We evaluated the toxicity of graphite nanoplatelets (GNPs) in the model organism Caenorhabditis elegans. The GNPs resulted nontoxic by measuring longevity as well as reproductive capability end points. An imaging technique based on Fourier transform IR spectroscopy (FT-IR) mapping was also developed to analyze the GNPs spatial distribution inside the nematodes. Conflicting reports on the in vitro antimicrobial properties of graphene-based nanomaterials prompted us to challenge the host-pathogen system C. elegans-Pseudomonas aeruginosa to assess these findings through an in vivo model.
], [CAS], Google Scholar278https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC38XntlOhu7s%253D&md5=a139e0455282de8b09f0789f1a488cbdGraphite Nanoplatelets and Caenorhabditis elegans: Insights from an in Vivo ModelZanni, Elena; De Bellis, Giovanni; Bracciale, Maria P.; Broggi, Alessandra; Santarelli, Maria L.; Sarto, Maria S.; Palleschi, Claudio; Uccelletti, DanielaNano Letters (2012), 12 (6), 2740-2744CODEN: NALEFD; ISSN:1530-6984. (American Chemical Society)We evaluated the toxicity of graphite nanoplatelets (GNPs) in the model organism Caenorhabditis elegans. The GNPs resulted nontoxic by measuring longevity as well as reproductive capability end points. An imaging technique based on Fourier transform IR spectroscopy (FT-IR) mapping was also developed to analyze the GNPs spatial distribution inside the nematodes. Conflicting reports on the in vitro antimicrobial properties of graphene-based nanomaterials prompted us to challenge the host-pathogen system C. elegans-Pseudomonas aeruginosa to assess these findings through an in vivo model. - 279Dziewięcka, M.; Karpeta-Kaczmarek, J.; Augustyniak, M.; Majchrzycki, Ł.; Augustyniak-Jabłokow, M. A. Evaluation of in Vivo Graphene Oxide Toxicity for Acheta Domesticus in Relation to Nanomaterial Purity and Time Passed from the Exposure. J. Hazard. Mater. 2016, 305, 30– 40, DOI: 10.1016/j.jhazmat.2015.11.021[Crossref], [PubMed], [CAS], Google Scholar279https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2MXhvFWktLrJ&md5=adda3ee3eaa8dc433bb4d19be14368bdEvaluation of in vivo graphene oxide toxicity for Acheta domesticus in relation to nanomaterial purity and time passed from the exposureDziewiecka, Marta; Karpeta-Kaczmarek, Julia; Augustyniak, Maria; Majchrzycki, Lukasz; Augustyniak-Jablokow, Maria A.Journal of Hazardous Materials (2016), 305 (), 30-40CODEN: JHMAD9; ISSN:0304-3894. (Elsevier B.V.)Graphene and its oxidized form-graphene oxide (GO) have become exceptionally popular in industry and medicine due to their unique properties. However, there are suspicions that GO can cause adverse effects. Therefore, comprehensive knowledge on its potential toxicity is essential. This research assesses the in vivo toxicity of pure and Mn-contg. GO, which were injected into the hemolymph of Acheta domesticus. The activity of catalase (CAT) and glutathione peroxidases (GSTPx) as well as heat shock protein (HSP 70) and total antioxidant capacity (TAC) levels were measured at consecutive time points 1, 24, 48 and 72 h after injection. Neither pure GO nor GO contg. Mn were neutral to the organism. The results proved the intensification of oxidative stress after GO injection, which was confirmed by increased enzyme activity. The organism seems to cope with this stress, esp. in the 1st 24 h after injection. In the following days, increasing HSP 70 levels were obsd., which might suggest the synthesis of new proteins and the removal of old and damaged ones. With that in mind, the potential toxicity of the studied material, which could lead to serious and permanent damage to the organism, should still be taken into consideration.
- 280Pretti, C.; Oliva, M.; Pietro, R. Di; Monni, G.; Cevasco, G.; Chiellini, F.; Pomelli, C.; Chiappe, C. Ecotoxicity of Pristine Graphene to Marine Organisms. Ecotoxicol. Environ. Saf. 2014, 101, 138– 145, DOI: 10.1016/j.ecoenv.2013.11.008[Crossref], [PubMed], [CAS], Google Scholar280https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2cXitV2isLw%253D&md5=00902f967ebd259aa4cdf4419cd7a5a6Ecotoxicity of pristine graphene to marine organismsPretti, Carlo; Oliva, Matteo; Di Pietro, Roberta; Monni, Gianfranca; Cevasco, Giorgio; Chiellini, Federica; Pomelli, Christian; Chiappe, CinziaEcotoxicology and Environmental Safety (2014), 101 (), 138-145CODEN: EESADV; ISSN:0147-6513. (Elsevier B.V.)The ecotoxicity of pristine graphene nanoparticles (GNC1, PGMF) in model marine organisms was investigated. PGMF resulted more toxic than GNC1 to the bioluminescent bacterium Vibrio fischeri and the unicellular alga Dunaliella tertiolecta on the basis of EC50 values (end-points: inhibition of bioluminescence and growth, resp.). No acute toxicity was demonstrated with respect to the crustacean Artemia salina although light microscope images showed the presence of PGMF and GNC1 aggregates into the gut; a 48-h exposure expt. revealed an altered pattern of oxidative stress biomarkers, resulting in a significant increase of catalase activities in both PGMF and GNC1 1 mg/L treated A. salina and a significant increase of glutathione peroxidase activities in PGMF (0.1 and 1 mg/L) treated A. salina. Increased levels of lipid peroxidn. of membranes was also obsd. in PGMF 1 mg/L exposed A. salina.
- 281Guo, X.; Dong, S.; Petersen, E. J.; Gao, S.; Huang, Q.; Mao, L. Biological Uptake and Depuration of Radio-Labeled Graphene by Daphnia Magna. Environ. Sci. Technol. 2013, 47, 12524– 12531, DOI: 10.1021/es403230u[ACS Full Text
 ], [CAS], Google Scholar281https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3sXhsFOks7zF&md5=fd543c0638766968697113101f744dd8Biological uptake and depuration of radio-labeled graphene by daphnia magnaGuo, Xiangke; Dong, Shipeng; Petersen, Elijah J.; Gao, Shixiang; Huang, Qingguo; Mao, LiangEnvironmental Science & Technology (2013), 47 (21), 12524-12531CODEN: ESTHAG; ISSN:0013-936X. (American Chemical Society)Graphene layers are potential candidates in a large no. of applications. However, little is known about their ecotoxicol. risks largely as a result of a lack of quantification techniques in complex environmental matrixes. In this study, graphene was synthesized by means of graphitization and exfoliation of sandwich-like FePO4/dodecylamine hybrid nanosheets, and 14C was incorporated in the synthesis. 14C-labeled graphene was spiked to artificial freshwater and the uptake and depuration of graphene by Daphnia magna were assessed. After exposure for 24 h to a 250 μg/L soln. of graphene, the graphene concn. in the organism was nearly 1% of the organism dry mass. These organisms excreted the graphene to clean artificial freshwater and achieved roughly const. body burdens after 24 h depuration periods regardless of the initial graphene exposure concn. Addn. of algae and humic acid to water during the depuration period resulted in release of a significant fraction (>90%) of the accumulated graphene, but some still remained in the organism. Accumulated graphene in adult Daphnia was likely transferred to the neonates. The uptake and elimination results provided here support the environmental risk assessment of graphene and the graphene quantification method is a powerful tool for addnl. studies.
], [CAS], Google Scholar281https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3sXhsFOks7zF&md5=fd543c0638766968697113101f744dd8Biological uptake and depuration of radio-labeled graphene by daphnia magnaGuo, Xiangke; Dong, Shipeng; Petersen, Elijah J.; Gao, Shixiang; Huang, Qingguo; Mao, LiangEnvironmental Science & Technology (2013), 47 (21), 12524-12531CODEN: ESTHAG; ISSN:0013-936X. (American Chemical Society)Graphene layers are potential candidates in a large no. of applications. However, little is known about their ecotoxicol. risks largely as a result of a lack of quantification techniques in complex environmental matrixes. In this study, graphene was synthesized by means of graphitization and exfoliation of sandwich-like FePO4/dodecylamine hybrid nanosheets, and 14C was incorporated in the synthesis. 14C-labeled graphene was spiked to artificial freshwater and the uptake and depuration of graphene by Daphnia magna were assessed. After exposure for 24 h to a 250 μg/L soln. of graphene, the graphene concn. in the organism was nearly 1% of the organism dry mass. These organisms excreted the graphene to clean artificial freshwater and achieved roughly const. body burdens after 24 h depuration periods regardless of the initial graphene exposure concn. Addn. of algae and humic acid to water during the depuration period resulted in release of a significant fraction (>90%) of the accumulated graphene, but some still remained in the organism. Accumulated graphene in adult Daphnia was likely transferred to the neonates. The uptake and elimination results provided here support the environmental risk assessment of graphene and the graphene quantification method is a powerful tool for addnl. studies. - 282Souza, J. P.; Venturini, F. P.; Santos, F.; Zucolotto, V. Chronic Toxicity in Ceriodaphnia Dubia Induced by Graphene Oxide. Chemosphere 2018, 190, 218– 224, DOI: 10.1016/j.chemosphere.2017.10.018[Crossref], [PubMed], [CAS], Google Scholar282https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2sXhs1aktLnE&md5=a26fe6addedb2abf71c2f6ed4b9eee80Chronic toxicity in Ceriodaphnia dubia induced by graphene oxideSouza, Jaqueline P.; Venturini, Francine P.; Santos, Fabricio; Zucolotto, ValtencirChemosphere (2018), 190 (), 218-224CODEN: CMSHAF; ISSN:0045-6535. (Elsevier Ltd.)The unique physico-chem. properties of nanomaterials have allowed their application in different areas including electronics, energy storage, nanomedicine, environmental remediation and biotechnol. Graphene and its derivs., in particular, have been com. available, with prediction for increasing their prodn. in the next years, in a way that their release into aquatic environments is very likely to occur, and the impacts of such situation on organisms are still not completely understood. In this context, we evaluated graphene oxide (GO) effects on the freshwater cladoceran Ceriodaphnia dubia through acute and chronic toxicity, feeding rates, and reactive oxygen species (ROS) generation. The mean effective concn. (EC50) estd. during acute exposure was 1.25 mg L-1 of GO. The chronic exposure resulted in significant decrease in the no. of neonates. The feeding rates were also decreased by GO exposure. Sub-lethal concns. of GO caused an increase in ROS generation in the organisms. Our results indicated that GO cause acute and chronic effects to C. dubia. In the presence of GO there was a shift in the available energy for self-maintenance rather than feeding or reprodn. activities. This study provides useful information on GO concns. that might impair the aquatic biota, and supports regulatory efforts concerning the environmental safety of this product.
- 283De Marchi, L.; Neto, V.; Pretti, C.; Figueira, E.; Brambilla, L.; Rodriguez-Douton, M. J.; Rossella, F.; Tommasini, M.; Furtado, C.; Soares, A. M. V. M.; Freitas, R. Physiological and Biochemical Impacts of Graphene Oxide in Polychaetes: The Case of Diopatra Neapolitana. Comp. Biochem. Physiol., Part C: Toxicol. Pharmacol. 2017, 193, 50– 60, DOI: 10.1016/j.cbpc.2017.01.005[Crossref], [PubMed], [CAS], Google Scholar283https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2sXhvF2is74%253D&md5=77df10be735c1b176d7fcc5442cd8cecPhysiological and biochemical impacts of graphene oxide in polychaetes: The case of Diopatra neapolitanaDe Marchi, Lucia; Neto, Victor; Pretti, Carlo; Figueira, Etelvina; Brambilla, Luigi; Rodriguez-Douton, Maria Jesus; Rossella, Francesco; Tommasini, Matteo; Furtado, Clascidia; Soares, Amadeu M. V. M.; Freitas, RosaComparative Biochemistry and Physiology, Part C: Toxicology & Pharmacology (2017), 193 (), 50-60CODEN: CBPPFK; ISSN:1532-0456. (Elsevier)Graphene oxide (GO) is an important carbon nanomaterial (NM) that has been used, but limited literature is available regarding the impacts induced in aquatic organisms by this pollutant and, in particular in invertebrate species. The polychaete Diopatra neapolitana has frequently been used to evaluate the effects of environmental disturbances in estuarine systems due to its ecol. and socio-economic importance but to our knowledge no information is available on D. neapolitana physiol. and biochem. alterations due to GO exposure. Thus, the present study aimed to assess the toxic effects of different concns. of GO (0.01; 0.10 and 1.00 mg/L) in D. neapolitana physiol. (regenerative capacity) and biochem. (energy reserves, metabolic activity and oxidative stress related biomarkers) performance, after 28 days of exposure. The results obtained revealed that the exposure to GO induced neg. effects on the regenerative capacity of D. neapolitana, with organisms exposed to higher concns. regenerating less segments and taking longer periods to completely regenerate. GO also seemed to alter energy-related responses, esp. glycogen content, with higher values in polychaetes exposed to GO which may result from a decreased metab. (measured by electron transport system activity), when exposed to GO. Furthermore, under GO contamination D. neapolitana presented cellular damage, despite higher activities of antioxidant and biotransformation enzymes in individuals exposed to GO.
- 284Zhang, P.; Selck, H.; Tangaa, S. R.; Pang, C.; Zhao, B. Bioaccumulation and Effects of Sediment-Associated Gold- and Graphene Oxide Nanoparticles on Tubifex Tubifex. J. Environ. Sci. 2017, 51, 138– 145, DOI: 10.1016/j.jes.2016.08.015
- 285Hu, C.; Wang, Q.; Zhao, H.; Wang, L.; Guo, S.; Li, X. Ecotoxicological Effects of Graphene Oxide on the Protozoan Euglena Gracilis. Chemosphere 2015, 128, 184– 190, DOI: 10.1016/j.chemosphere.2015.01.040[Crossref], [PubMed], [CAS], Google Scholar285https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2MXisFCju7c%253D&md5=7dfec61a766c7d9668eaab3ec67e74b9Ecotoxicological effects of graphene oxide on the protozoan Euglena gracilisHu, Changwei; Wang, Qing; Zhao, Haitao; Wang, Lizhi; Guo, Shaofen; Li, XiulingChemosphere (2015), 128 (), 184-190CODEN: CMSHAF; ISSN:0045-6535. (Elsevier Ltd.)Potential environmental risks posed by nanomaterials increase with their extensive prodn. and application. As a newly emerging carbon material, graphene oxide (GO) exhibits excellent electrochem. properties and has promising applications in many areas. However, the ecotoxicity of GO to organisms, esp. aquatic organisms, remains poorly understood. Accordingly, this study examd. the toxicity of GO with protozoa Euglena gracilis as test organism. Growth inhibition test was initially performed to investigate acute toxic effects. Protozoa were subsequently exposed to GO ranging from 0.5 mg L-1 to 5 mg L-1 for 10 d. The growth, photosynthetic pigment content, activities of antioxidant enzymes, ultrastructure of the protozoa, as well as the shading effect of GO, were analyzed to det. the mechanism of the toxicity effect. Results showed that the 96 h EC50 value of GO in E. gracilis was 3.76 ± 0.74 mg L-1. GO at a concn. of 2.5 mg L-1 exerted significant (P < 0.01) adverse effects on the organism. These effects were evidenced by the inhibition of growth and the enhancement of malondialdehyde content and antioxidant enzyme activities. Shading effect and oxidative stress may be responsible for GO toxicity.
- 286Mesarič, T.; Sepčič, K.; Piazza, V.; Gambardella, C.; Garaventa, F.; Drobne, D.; Faimali, M. Effects of Nano Carbon Black and Single-Layer Graphene Oxide on Settlement, Survival and Swimming Behaviour of Amphibalanus Amphitrite Larvae. Chem. Ecol. 2013, 29, 643– 652, DOI: 10.1080/02757540.2013.817563[Crossref], [CAS], Google Scholar286https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3sXhtFelt7jM&md5=a90d9fb7da3c7ec15c32a0ee0bfba1d3Effects of nano carbon black and single-layer graphene oxide on settlement, survival and swimming behaviour of Amphibalanus amphitrite larvaeMesaric, Tina; Sepcic, Kristina; Piazza, Veronica; Gambardella, Chiara; Garaventa, Francesca; Drobne, Damjana; Faimali, MarcoChemistry and Ecology (2013), 29 (7), 643-652CODEN: CHECDY; ISSN:0275-7540. (Taylor & Francis Ltd.)The effects of two carbon-based nanomaterials, nano-sized carbon black (nCB), and single-layer graphene oxide (GO) on settlement of Amphibalanus amphitrite (Cirripedia, Crustacea) cypris larvae (cyprids) were assessed after 24, 48, and 72 h of exposure. Addnl., the effects of these nanomaterials on the mortality and swimming behavior of the nauplius larvae (nauplii) of the same organism were detd. after 24 and 48 h. The data indicate that nCB is more effective as a potential antisettlement agent than single-layer GO; moreover, nCB did not show any adverse effects on the larvae. The swimming behavior of II stage nauplii of A. amphitrite exposed to a suspension of nCB was inhibited only at very high nCB concns. (≥0.5 mg/mL). Single-layer GO, on the contrary, showed lower antisettlement effects and was more active in altering the survival and inhibiting the swimming behavior of the nauplii. An indication of the toxic or non-toxic mechanisms of the antisettlement properties of both of these nanomaterials is provided by the reversibility of the antisettlement activity. In conclusion, we propose nCB as an innovative antifouling nanomaterial that shows low toxicity towards the model organism (crustaceans) used in this study.
- 287Grillo, R.; Rosa, A. H.; Fraceto, L. F. Engineered Nanoparticles and Organic Matter: A Review of the State-of-the-Art. Chemosphere 2015, 119, 608– 619, DOI: 10.1016/j.chemosphere.2014.07.049[Crossref], [PubMed], [CAS], Google Scholar287https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2cXhtlKmur7N&md5=00d72651e7e12319408856a3b1313420Engineered nanoparticles and organic matter: A review of the state-of-the-artGrillo, Renato; Rosa, Andre H.; Fraceto, Leonardo F.Chemosphere (2015), 119 (), 608-619CODEN: CMSHAF; ISSN:0045-6535. (Elsevier Ltd.)A review. Growth in the development and prodn. of engineered nanoparticles (ENPs) in recent years has increased the potential for interactions of these nanomaterials with aquatic and terrestrial environments. Carefully designed studies are therefore required in order to understand the fate, transport, stability, and toxicity of nanoparticles. Natural org. matter (NOM), such as the humic substances found in water, sediment, and soil, is one of the substances capable of interacting with ENPs. This review presents the findings of studies of the interaction of ENPs and NOM, and the possible effects on nanoparticle stability and the toxicity of these materials in the environment. In addn., ENPs and NOM are utilized for many different purposes, including the removal of metals and org. compds. from effluents, and the development of new electronic sensors and other devices for the detection of active substances. Discussion is therefore provided of some of the ways in which NOM can be used in the prodn. of nanoparticles. Although there has been an increase in the no. of studies in this area, further progress is needed to improve understanding of the dynamic interactions between ENPs and NOM.
- 288Castro, V. L.; Clemente, Z.; Jonsson, C.; Silva, M.; Vallim, J. H.; de Medeiros, A. M. Z.; Martinez, D. S. T. Nanoecotoxicity Assessment of Graphene Oxide and Its Relationship with Humic Acid. Environ. Toxicol. Chem. 2018, 37, 1998– 2012, DOI: 10.1002/etc.4145
- 289Maes, H. M.; Stibany, F.; Giefers, S.; Daniels, B.; Deutschmann, B.; Baumgartner, W.; Schäffer, A. Accumulation and Distribution of Multiwalled Carbon Nanotubes in Zebrafish (Danio Rerio). Environ. Sci. Technol. 2014, 48, 12256– 12264, DOI: 10.1021/es503006v
- 290Liu, X. T.; Mu, X. Y.; Wu, X. L.; Meng, L. X.; Guan, W. B.; Ma, Y. Q.; Sun, H.; Wang, C. J.; Li, X. F. Toxicity of Multi-Walled Carbon Nanotubes, Graphene Oxide, and Reduced Graphene Oxide to Zebrafish Embryos. Biomed. Environ. Sci. 2014, 27, 676– 683, DOI: 10.3967/bes2014.103
- 291Chen, L.; Hu, P.; Zhang, L.; Huang, S.; Luo, L.; Huang, C. Toxicity of Graphene Oxide and Multi-Walled Carbon Nanotubes against Human Cells and Zebrafish. Sci. China: Chem. 2012, 55, 2209– 2216, DOI: 10.1007/s11426-012-4620-z[Crossref], [CAS], Google Scholar291https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC38XhsVCgtLrN&md5=bb9b76afef0af3c4dd70b26906ba88e3Toxicity of graphene oxide and multi-walled carbon nanotubes against human cells and zebrafishChen, Li Qiang; Hu, Ping Ping; Zhang, Li; Huang, Si Zhou; Luo, Ling Fei; Huang, Cheng ZhiScience China: Chemistry (2012), 55 (10), 2209-2216CODEN: SCCCCS; ISSN:1869-1870. (Science China Press)Graphene possesses unique phys. and chem. properties, which have inspired a wide range of potential biomedical applications. However, little is known about the adverse effects of graphene on the human body and ecol. environment. The purpose of our work is to make assessment on the toxicity of graphene oxide (GO) against human cell line (human bone marrow neuroblastoma cell line and human epithelial carcinoma cell line) and zebrafish (Danio rerio) by comparing the toxic effects of GO with its sister, multi-walled carbon nanotubes (MWNTs). The results show that GO has a moderate toxicity to organisms since it can induce minor (about 20%) cell growth inhibition and slight hatching delay of zebrafish embryos at a dosage of 50 mg/L, but did not result in significant increase of apoptosis in embryo, while MWNTs exhibit acute toxicity leading to a strong inhibition of cell proliferation and serious morphol. defects in developing embryos even at relatively low concn. of 25 mg/L. The distinctive toxicity of GO and MWNTs should be ascribed to the different models of interaction between nanomaterials and organisms, which arises from the different geometric structures of nanomaterials. Collectively, our work suggests that GO does actual toxicity to organisms posing potential environmental risks and the result is also shedding light on the geometrical structure-dependent toxicity of graphitic nanomaterials.
- 292Souza, J. P.; Baretta, J. F.; Santos, F.; Paino, I. M. M.; Zucolotto, V. Toxicological Effects of Graphene Oxide on Adult Zebrafish (Danio Rerio). Aquat. Toxicol. 2017, 186, 11– 18, DOI: 10.1016/j.aquatox.2017.02.017[Crossref], [PubMed], [CAS], Google Scholar292https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2sXjsVKhsLc%253D&md5=8e5234e2751cf6425cb2c274018e16baToxicological effects of graphene oxide on adult zebrafish (Danio rerio)Souza, Jaqueline P.; Baretta, Jessica F.; Santos, Fabricio; Paino, Ieda M. M.; Zucolotto, ValtencirAquatic Toxicology (2017), 186 (), 11-18CODEN: AQTODG; ISSN:0166-445X. (Elsevier B.V.)Graphene exhibits unique phys. and chem. properties that facilitate its application in many fields, including electronics and biomedical areas. However, the use of graphene and its derivs. could result in accumulation in aquatic environments, and the risks posed by these compds. for organisms are not completely understood. In this study, we investigated the effects of graphene oxide (GO) on adult zebrafish (Danio rerio). Exptl. fish were exposed to 2, 10 or 20 mg L-1 GO, and the cytotoxicity, genotoxicity and oxidative stress were assessed. The morphol. of the gills and liver tissues was also analyzed. Graphene oxide exposure led to an increase in the no. of gill cells that were in early apoptotic and necrotic stages, but genotoxicity was not obsd. in blood cells. We also obsd. the generation of Reactive Oxygen Species (ROS) in gill cells. Structural anal. revealed injuries to gill tissues, including a dilated marginal channel, lamellar fusion, clubbed tips, swollen mucocytes, epithelial lifting, aneurysms, and necrosis. Liver tissues also presented lesions such as peripherally located nuclei. Furthermore, hepatocytes exhibited a non-uniform shape, picnotic nuclei, vacuole formation, cell rupture, and necrosis. Our results showed that sub-LDs of graphene oxide could be harmful to fish species and thus represent risks for the aquatic food chain.
- 293Zhang, X.; Zhou, Q.; Zou, W.; Hu, X. Molecular Mechanisms of Developmental Toxicity Induced by Graphene Oxide at Predicted Environmental Concentrations. Environ. Sci. Technol. 2017, 51, 7861– 7871, DOI: 10.1021/acs.est.7b01922[ACS Full Text
 ], [CAS], Google Scholar293https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2sXpvFOms74%253D&md5=ee7aeaccf2c5d85622b8daa87d7649eeMolecular Mechanisms of Developmental Toxicity Induced by Graphene Oxide at Predicted Environmental ConcentrationsZhang, Xingli; Zhou, Qixing; Zou, Wei; Hu, XiangangEnvironmental Science & Technology (2017), 51 (14), 7861-7871CODEN: ESTHAG; ISSN:0013-936X. (American Chemical Society)Developmental toxicity is a crit. issue in nanotoxicity. However, very little is known about the effects of graphene oxide (GO, a widely used carbon material) at predicted environmental concns. on biol. development or the specific mol. mechanisms. The present study established that the development of zebrafish embryos exposed to trace concns. (1-100 μg/L) of GO was impaired because of DNA modification, protein carbonylation and excessive generation of reactive oxygen species (ROS), esp. the superoxide radical. Noticeably, there was a non-monotonic response of zebrafish developmental toxicity to GO at μg/L to mg/L levels. Transcriptomics anal. revealed that disturbing collagen- and matrix metalloproteinase (MMP)-related genes affected the skeletal and cardiac development of zebrafish. Moreover, metabolomics anal. showed that the inhibition of amino acid metab. and the ratios of unsatd. fatty acids (UFAs) to satd. fatty acids (SFAs) contributed to the above developmental toxicity. The present work verifies the developmental toxicity of GO at trace concns. and illustrates for the first time the specific mol. mechanisms thereof. Because of the potential developmental toxicity of GO at trace concns., government administrators and nanomaterial producers should consider its potential risks prior to the widespread environmental exposure to GO.
], [CAS], Google Scholar293https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2sXpvFOms74%253D&md5=ee7aeaccf2c5d85622b8daa87d7649eeMolecular Mechanisms of Developmental Toxicity Induced by Graphene Oxide at Predicted Environmental ConcentrationsZhang, Xingli; Zhou, Qixing; Zou, Wei; Hu, XiangangEnvironmental Science & Technology (2017), 51 (14), 7861-7871CODEN: ESTHAG; ISSN:0013-936X. (American Chemical Society)Developmental toxicity is a crit. issue in nanotoxicity. However, very little is known about the effects of graphene oxide (GO, a widely used carbon material) at predicted environmental concns. on biol. development or the specific mol. mechanisms. The present study established that the development of zebrafish embryos exposed to trace concns. (1-100 μg/L) of GO was impaired because of DNA modification, protein carbonylation and excessive generation of reactive oxygen species (ROS), esp. the superoxide radical. Noticeably, there was a non-monotonic response of zebrafish developmental toxicity to GO at μg/L to mg/L levels. Transcriptomics anal. revealed that disturbing collagen- and matrix metalloproteinase (MMP)-related genes affected the skeletal and cardiac development of zebrafish. Moreover, metabolomics anal. showed that the inhibition of amino acid metab. and the ratios of unsatd. fatty acids (UFAs) to satd. fatty acids (SFAs) contributed to the above developmental toxicity. The present work verifies the developmental toxicity of GO at trace concns. and illustrates for the first time the specific mol. mechanisms thereof. Because of the potential developmental toxicity of GO at trace concns., government administrators and nanomaterial producers should consider its potential risks prior to the widespread environmental exposure to GO. - 294Mouchet, F.; Landois, P.; Flahaut, E.; Pinelli, E.; Gauthier, L. Assessment of the Potential in Vivo Ecotoxicity of Double-Walled Carbon Nanotubes (DWNTs) in Water, Using the Amphibian Ambystoma Mexicanum. Nanotoxicology 2007, 1, 149– 156, DOI: 10.1080/17435390701556080
- 295Mouchet, F.; Landois, P.; Sarremejean, E.; Bernard, G.; Puech, P.; Pinelli, E.; Flahaut, E.; Gauthier, L. Characterisation and in Vivo Ecotoxicity Evaluation of Double-Wall Carbon Nanotubes in Larvae of the Amphibian Xenopus Laevis. Aquat. Toxicol. 2008, 87, 127– 137, DOI: 10.1016/j.aquatox.2008.01.011[Crossref], [PubMed], [CAS], Google Scholar295https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BD1cXktlejs7g%253D&md5=6a875275b5226bc710e965de7b30b67bCharacterisation and in vivo ecotoxicity evaluation of double-wall carbon nanotubes in larvae of the amphibian Xenopus laevisMouchet, Florence; Landois, Perine; Sarremejean, Elodie; Bernard, Guillaume; Puech, Pascal; Pinelli, Eric; Flahaut, Emmanuel; Gauthier, LauryAquatic Toxicology (2008), 87 (2), 127-137CODEN: AQTODG; ISSN:0166-445X. (Elsevier B.V.)Because of their outstanding properties, carbon nanotubes (CNTs) are being assessed for inclusion in many manufd. products. Due to their massive prodn. and growing no. of potential applications, the impact of CNTs on the environment must be taken into consideration. The present investigation evaluates the ecotoxicol. potential of double-walled carbon nanotubes (DWNTs) in the amphibian larvae Xenopus laevis at a large range of concns. in water (from 10 to 500 mg L-1). Acute toxicity and genotoxicity were analyzed after 12 days of static exposure in lab. conditions. Acute toxicity was evaluated according to the mortality and the growth of larvae. The genotoxic effects were analyzed by scoring the micronucleated erythrocytes of the circulating blood of larvae according to the International Std. micronucleus assay. Moreover, histol. prepns. of larval intestine were prepd. after 12 days of exposure for observation using optical and transmission electron microscopy (TEM). Finally, the intestine of an exposed larva was prepd. on a slide for analyze by Raman imaging. The results showed no genotoxicity in erythrocytes of larvae exposed to DWNTs in water, but acute toxicity at every concn. of DWNTs studied which was related to phys. blockage of the gills and/or digestive tract. Indeed, black masses suggesting the presence of CNTs were obsd. inside the intestine using optical microscopy and TEM, and confirmed by Raman spectroscopy anal. Assessing the risks of CNTs requires better understanding, esp. including mechanistic and environmental investigations.
- 296Mouchet, F.; Landois, P.; Puech, P.; Pinelli, E.; Flahaut, E.; Gauthier, L. Carbon Nanotube Ecotoxicity in Amphibians: Assessment of Multiwalled Carbon Nanotubes and Comparison with Double-Walled Carbon Nanotubes. Nanomedicine 2010, 5, 963– 974, DOI: 10.2217/nnm.10.60
- 297Muzi, L.; Mouchet, F.; Cadarsi, S.; Janowska, I.; Russier, J.; Ménard-Moyon, C.; Risuleo, G.; Soula, B.; Galibert, A.-M.; Flahaut, E.; Pinelli, E.; Gauthier, L.; Bianco, A. Examining the Impact of Multi-Layer Graphene Using Cellular and Amphibian Models. 2D Mater. 2016, 3, 025009, DOI: 10.1088/2053-1583/3/2/025009[Crossref], [CAS], Google Scholar297https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC28XitVCmt73I&md5=84a2ec4bf3863208d1a18db8489492c6Examining the impact of multi-layer graphene using cellular and amphibian modelsMuzi, Laura; Mouchet, Florence; Cadarsi, Stephanie; Janowska, Izabela; Russier, Julie; Menard-Moyon, Cecilia; Risuleo, Gianfranco; Soula, Brigitte; Galibert, Anne-Marie; Flahaut, Emmanuel; Pinelli, Eric; Gauthier, Laury; Bianco, Alberto2D Materials (2016), 3 (2), 025009/1-025009/10CODEN: DMATB7; ISSN:2053-1583. (IOP Publishing Ltd.)In the last few years, graphene has been defined as the revolutionary material showing an incredible expansion in industrial applications. Different graphene forms have been applied in several contexts, spreading from energy technologies and electronics to food and agriculture technologies. Graphene showed promises also in the biomedical field. Hopeful results have been already obtained in diagnostic, drug delivery, tissue regeneration and photothermal cancer ablation. In view of the enormous development of graphene-based technologies, a careful assessment of its impact on health and environment is demanded. It is evident how investigating the graphene toxicity is of fundamental importance in the context of medical purposes. On the other hand, the nanomaterial present in the environment, likely to be generated all along the industrial life-cycle, may have harmful effects on living organisms. In the present work, an important contribution on the impact of multi-layer graphene (MLG) on health and environment is given by using a multifaceted approach. For the first purpose, the effect of the material on two mammalian cell models was assessed. Key cytotoxicity parameters were considered such as cell viability and inflammatory response induction. This was combined with an evaluation of MLG toxicity towards Xenopus laevis, used as both in vivo and environmental model organism.
- 298Mottier, A.; Mouchet, F.; Laplanche, C.; Cadarsi, S.; Lagier, L.; Arnault, J.-C.; Girard, H. A.; León, V.; Vázquez, E.; Sarrieu, C.; Pinelli, E.; Gauthier, L.; Flahaut, E. Surface Area of Carbon Nanoparticles: A Dose Metric for a More Realistic Ecotoxicological Assessment. Nano Lett. 2016, 16, 3514– 3518, DOI: 10.1021/acs.nanolett.6b00348[ACS Full Text
 ], [CAS], Google Scholar298https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC28XmvVKltb0%253D&md5=ec22485edc1de1c9851bc99b00dc2317Surface Area of Carbon Nanoparticles: A Dose Metric for a More Realistic Ecotoxicological AssessmentMottier, Antoine; Mouchet, Florence; Laplanche, Christophe; Cadarsi, Stephanie; Lagier, Laura; Arnault, Jean-Charles; Girard, Hugues A.; Leon, Veronica; Vazquez, Ester; Sarrieu, Cyril; Pinelli, Eric; Gauthier, Laury; Flahaut, EmmanuelNano Letters (2016), 16 (6), 3514-3518CODEN: NALEFD; ISSN:1530-6984. (American Chemical Society)Engineered nanoparticles such as graphenes, nanodiamonds, and carbon nanotubes correspond to different allotropes of carbon and are among the best candidates for applications in fast-growing nanotechnol. It is thus likely that they may get into the environment at each step of their life cycle: prodn., use, and disposal. The aquatic compartment concs. pollutants and is expected to be esp. impacted. The toxicity of a compd. is conventionally evaluated using mass concn. as a quant. measure of exposure. However, several studies have highlighted that such a metric is not the best descriptor at the nanoscale. Here we compare the inhibition of Xenopus laevis larvae growth after in vivo exposure to different carbon nanoparticles for 12 days using different dose metrics and clearly show that surface area is the most relevant descriptor of toxicity for different types of carbon allotropes.
], [CAS], Google Scholar298https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC28XmvVKltb0%253D&md5=ec22485edc1de1c9851bc99b00dc2317Surface Area of Carbon Nanoparticles: A Dose Metric for a More Realistic Ecotoxicological AssessmentMottier, Antoine; Mouchet, Florence; Laplanche, Christophe; Cadarsi, Stephanie; Lagier, Laura; Arnault, Jean-Charles; Girard, Hugues A.; Leon, Veronica; Vazquez, Ester; Sarrieu, Cyril; Pinelli, Eric; Gauthier, Laury; Flahaut, EmmanuelNano Letters (2016), 16 (6), 3514-3518CODEN: NALEFD; ISSN:1530-6984. (American Chemical Society)Engineered nanoparticles such as graphenes, nanodiamonds, and carbon nanotubes correspond to different allotropes of carbon and are among the best candidates for applications in fast-growing nanotechnol. It is thus likely that they may get into the environment at each step of their life cycle: prodn., use, and disposal. The aquatic compartment concs. pollutants and is expected to be esp. impacted. The toxicity of a compd. is conventionally evaluated using mass concn. as a quant. measure of exposure. However, several studies have highlighted that such a metric is not the best descriptor at the nanoscale. Here we compare the inhibition of Xenopus laevis larvae growth after in vivo exposure to different carbon nanoparticles for 12 days using different dose metrics and clearly show that surface area is the most relevant descriptor of toxicity for different types of carbon allotropes. - 299Lagier, L.; Mouchet, F.; Laplanche, C.; Mottier, A.; Cadarsi, S.; Evariste, L.; Sarrieu, C.; Lonchambon, P.; Pinelli, E.; Flahaut, E.; Gauthier, L. Surface Area of Carbon-Based Nanoparticles Prevails on Dispersion for Growth Inhibition in Amphibians. Carbon 2017, 119, 72– 81, DOI: 10.1016/j.carbon.2017.04.016[Crossref], [CAS], Google Scholar299https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2sXmsVeitrw%253D&md5=6f28e4115ab70ef90740b500692c636cSurface area of carbon-based nanoparticles prevails on dispersion for growth inhibition in amphibiansLagier, L.; Mouchet, F.; Laplanche, C.; Mottier, A.; Cadarsi, S.; Evariste, L.; Sarrieu, C.; Lonchambon, P.; Pinelli, E.; Flahaut, E.; Gauthier, L.Carbon (2017), 119 (), 72-81CODEN: CRBNAH; ISSN:0008-6223. (Elsevier Ltd.)The attractive properties of carbon-based nanoparticles such as graphene and its derivs. or carbon nanotubes lead to their use in many application fields, whether they are raw or functionalized, such as oxidized. These particles may finally contaminate the aquatic compartment, which is a major receptacle of pollutants. The study of their impact on aquatic organisms is thus essential. At the nano scale, recent studies have highlighted that sp. surface area should be used as the most relevant descriptor of toxicity instead of the conventional mass concn. By using a dose-response model, this work compares the chronic toxicity obsd. on Xenopus laevis larvae after 12-day in vivo exposure to raw, oxidized carbon allotropes, or in the presence of chem. dispersant. The authors show that chem. dispersion does not influence the obsd. chronic toxicity, whether it is through surface chem. (oxidn. state) or through the addn. of a dispersant. The biol. hypothesis leading to growth inhibition are discussed. Finally, these results confirm that surface area is the more suited metric unit describing growth inhibition.
- 300Auffan, M.; Tella, M.; Santaella, C.; Brousset, L.; Paillès, C.; Barakat, M.; Espinasse, B.; Artells, E.; Issartel, J.; Masion, A.; Rose, J.; Wiesner, M. R.; Achouak, W.; Thiéry, A.; Bottero, J.-Y. An Adaptable Mesocosm Platform for Performing Integrated Assessments of Nanomaterial Risk in Complex Environmental Systems. Sci. Rep. 2015, 4, 5608, DOI: 10.1038/srep05608
- 301Bour, A.; Mouchet, F.; Silvestre, J.; Gauthier, L.; Pinelli, E. Environmentally Relevant Approaches to Assess Nanoparticles Ecotoxicity: A Review. J. Hazard. Mater. 2015, 283, 764– 777, DOI: 10.1016/j.jhazmat.2014.10.021[Crossref], [PubMed], [CAS], Google Scholar301https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2cXhvVCms7zI&md5=91eeae0d69c9d990bce0e54ce9a74232Environmentally relevant approaches to assess nanoparticles ecotoxicity: A reviewBour, Agathe; Mouchet, Florence; Silvestre, Jerome; Gauthier, Laury; Pinelli, EricJournal of Hazardous Materials (2015), 283 (), 764-777CODEN: JHMAD9; ISSN:0304-3894. (Elsevier B.V.)A review concerning engineered nanoparticle (NP) environmental fate and ecotoxicity using environmentally relevant exposure methods is given. These exposure methods differ from standardized protocols and can be classified into 3 groups: exptl. trophic chains which study trophic routes; multi-species exposures under lab. conditions which allow for complex, controlled exposure; and outdoor exposures more similar to environmentally realistic conditions. The majority of micro- or mesocosm studies focused on NP partitioning and bioaccumulation. One other major study parameter, NP ecotoxicity, has been assessed in single species, single species via the trophic route, and at the community level. The induction of biochem. defense systems, immuno-modulation, growth and reprodn. effects, behavioral alterations, and mortality have been used as indicators of major toxicity, depending on the studied species. The major effects of NP on microbial and algal communities include modifications of community compn. and diversity, decreased biomass, and community activity changes. Topics discussed include: organismal NP uptake and accumulation; exposure methods for integrated NP ecotoxicity (lab. trophic route, indoor multi-species, outdoor); studied end-points and main results (NP partitioning and biogeochem. analyses, NP toxicity); discussion (integrated studies approaching environmental conditions are emerging, serious gaps remain); and summary.
- 302Mottier, A.; Mouchet, F.; Pinelli, É.; Gauthier, L.; Flahaut, E. Environmental Impact of Engineered Carbon Nanoparticles: From Releases to Effects on the Aquatic Biota. Curr. Opin. Biotechnol. 2017, 46, 1– 6, DOI: 10.1016/j.copbio.2016.11.024[Crossref], [PubMed], [CAS], Google Scholar302https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2sXhs1Oluw%253D%253D&md5=5ba691077aeef4c73d145f895ff37472Environmental impact of engineered carbon nanoparticles: from releases to effects on the aquatic biotaMottier, Antoine; Mouchet, Florence; Pinelli, Eric; Gauthier, Laury; Flahaut, EmmanuelCurrent Opinion in Biotechnology (2017), 46 (), 1-6CODEN: CUOBE3; ISSN:0958-1669. (Elsevier B.V.)Nano-ecotoxicol. is an emerging science which aims to assess the environmental effect of nanotechnologies. The development of this particular aspect of ecotoxicol. was made necessary in order to evaluate the potential impact of recently produced and used materials: nanoparticles (NPs). Among all the types of NPs, carbon nanoparticles (CNPs) esp. draw attention giving the increasing no. of applications and integration into consumer products. However the potential impacts of CNPs in the environment remain poorly known. This review aims to point out the crit. issues and aspects that will govern the toxicity of CNPs in the environment.
- 303Bour, A.; Mouchet, F.; Verneuil, L.; Evariste, L.; Silvestre, J.; Pinelli, E.; Gauthier, L. Toxicity of CeO2 Nanoparticles at Different Trophic Levels – Effects on Diatoms, Chironomids and Amphibians. Chemosphere 2015, 120, 230– 236, DOI: 10.1016/j.chemosphere.2014.07.012
- 304Bour, A.; Mouchet, F.; Cadarsi, S.; Silvestre, J.; Verneuil, L.; Baqué, D.; Chauvet, E.; Bonzom, J.-M.; Pagnout, C.; Clivot, H.; Fourquaux, I.; Tella, M.; Auffan, M.; Gauthier, L.; Pinelli, E. Toxicity of CeO 2 Nanoparticles on a Freshwater Experimental Trophic Chain: A Study in Environmentally Relevant Conditions through the Use of Mesocosms. Nanotoxicology 2016, 10, 245– 255, DOI: 10.3109/17435390.2015.1053422
- 305Hu, X.; Kang, J.; Lu, K.; Zhou, R.; Mu, L.; Zhou, Q. Graphene Oxide Amplifies the Phytotoxicity of Arsenic in Wheat. Sci. Rep. 2015, 4, 6122, DOI: 10.1038/srep06122
- 306Wang, D.; Wang, G.; Zhang, G.; Xu, X.; Yang, F. Using Graphene Oxide to Enhance the Activity of Anammox Bacteria for Nitrogen Removal. Bioresour. Technol. 2013, 131, 527– 530, DOI: 10.1016/j.biortech.2013.01.099[Crossref], [PubMed], [CAS], Google Scholar306https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3sXisVKjtr8%253D&md5=f8140bbab4f8b68d642d4d1364dbd6e9Using graphene oxide to enhance the activity of anammox bacteria for nitrogen removalWang, Dong; Wang, Guowen; Zhang, Guoquan; Xu, Xiaochen; Yang, FenglinBioresource Technology (2013), 131 (), 527-530CODEN: BIRTEB; ISSN:0960-8524. (Elsevier Ltd.)Graphene oxide (GO) was applied to enhance the activity of anaerobic ammonium oxidn. (anammox) bacteria for N removal. A GO dose-dependent effect on anammox bacteria was obsd. through batch tests. The results showed that the activity increased as the GO dose was varied within 0.05-0.1 g/L. A max. 10.26% increase of anaerobic ammonium oxidizing activity was achieved at 0.1 g/L GO. Anal. of extracellular polymeric substances (EPS) indicated that the highest carbohydrate, protein, and total EPS contents (42.5, 125.7, and 168.2 mg/g volatile suspended solids, resp.) were obtained with 0.1 g/L GO. Appropriate GO dose stimulated EPS prodn. to promote the activity of anammox bacteria. Transmission electron microscopy showed the large surface area of GO benefited cell attachment. These findings proved that the application of GO was an effective approach to enhancing the activity of anammox bacteria.
- 307Du, J.; Hu, X.; Zhou, Q. Graphene Oxide Regulates the Bacterial Community and Exhibits Property Changes in Soil. RSC Adv. 2015, 5, 27009– 27017, DOI: 10.1039/C5RA01045D[Crossref], [CAS], Google Scholar307https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2MXktFels7w%253D&md5=1bb0d4aee78428e9df21dcf50a354467Graphene oxide regulates the bacterial community and exhibits property changes in soilDu, Junjie; Hu, Xiangang; Zhou, QixingRSC Advances (2015), 5 (34), 27009-27017CODEN: RSCACL; ISSN:2046-2069. (Royal Society of Chemistry)The extensive use of pristine graphene oxide (PGO) increases its environmental release. The interactions of PGO with soils, one of the ultimate repositories for discharged nanomaterial, remain unclear. In the present study, a pyrosequencing anal. based on the bacterial 16S rRNA gene showed that the bacterial community in a PGO-soil sample (PGOS) became richer and more diverse compared with a control soil sample (CS). PGO altered the structure of soil bacterial communities, with some nitrogen-fixing and dissimilatory iron reducing bacteria being selectively enriched, esp. at the genus level. SGO (soil-modified graphene oxide) exhibited a greater thickness, a higher C/O ratio, a rougher texture, a lower transparency and a smaller size than PGO. Nitrogen-contg. groups and the elements including Mg, Al, Si, K, Ca and Fe were detected in SGO. The changes in surface groups were consistent with the formation of org. mols. coating the SGO. SGO, which exhibited fewer neg. charges, was more unstable than PGO. In addn., SGO presented higher chem. activity than PGO; for example, SGO exhibited more unpaired electrons and disordered structures. This work highlights the crit. interactions of PGO and soil which deserve comprehensive consideration in assessing the risks of nanomaterials.
- 308Xiong, T.; Yuan, X.; Wang, H.; Leng, L.; Li, H.; Wu, Z.; Jiang, L.; Xu, R.; Zeng, G. Implication of Graphene Oxide in Cd-Contaminated Soil: A Case Study of Bacterial Communities. J. Environ. Manage. 2018, 205, 99– 106, DOI: 10.1016/j.jenvman.2017.09.067
- 309Ghosal, D.; Ghosh, S.; Dutta, T. K.; Ahn, Y. Current State of Knowledge in Microbial Degradation of Polycyclic Aromatic Hydrocarbons (PAHs): A Review. Front. Microbiol. 2016, 7, 1369, DOI: 10.3389/fmicb.2016.01369[Crossref], [PubMed], [CAS], Google Scholar309https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A280%3ADC%252BC2svhtVyhtQ%253D%253D&md5=ad7c00b8bc46197167f2142b54ea4efeCurrent State of Knowledge in Microbial Degradation of Polycyclic Aromatic Hydrocarbons (PAHs): A ReviewGhosal Debajyoti; Ghosh Shreya; Dutta Tapan K; Ahn YounghoFrontiers in microbiology (2016), 7 (), 1369 ISSN:1664-302X.Polycyclic aromatic hydrocarbons (PAHs) include a group of organic priority pollutants of critical environmental and public health concern due to their toxic, genotoxic, mutagenic and/or carcinogenic properties and their ubiquitous occurrence as well as recalcitrance. The increased awareness of their various adverse effects on ecosystem and human health has led to a dramatic increase in research aimed toward removing PAHs from the environment. PAHs may undergo adsorption, volatilization, photolysis, and chemical oxidation, although transformation by microorganisms is the major neutralization process of PAH-contaminated sites in an ecologically accepted manner. Microbial degradation of PAHs depends on various environmental conditions, such as nutrients, number and kind of the microorganisms, nature as well as chemical property of the PAH being degraded. A wide variety of bacterial, fungal and algal species have the potential to degrade/transform PAHs, among which bacteria and fungi mediated degradation has been studied most extensively. In last few decades microbial community analysis, biochemical pathway for PAHs degradation, gene organization, enzyme system, genetic regulation for PAH degradation have been explored in great detail. Although, xenobiotic-degrading microorganisms have incredible potential to restore contaminated environments inexpensively yet effectively, but new advancements are required to make such microbes effective and more powerful in removing those compounds, which were once thought to be recalcitrant. Recent analytical chemistry and genetic engineering tools might help to improve the efficiency of degradation of PAHs by microorganisms, and minimize uncertainties of successful bioremediation. However, appropriate implementation of the potential of naturally occurring microorganisms for field bioremediation could be considerably enhanced by optimizing certain factors such as bioavailability, adsorption and mass transfer of PAHs. The main purpose of this review is to provide an overview of current knowledge of bacteria, halophilic archaea, fungi and algae mediated degradation/transformation of PAHs. In addition, factors affecting PAHs degradation in the environment, recent advancement in genetic, genomic, proteomic and metabolomic techniques are also highlighted with an aim to facilitate the development of a new insight into the bioremediation of PAH in the environment.
- 310Xu, Y.; Zhou, N.-Y. Microbial Remediation of Aromatics-Contaminated Soil. Front. Environ. Sci. Eng. 2017, 11, 1, DOI: 10.1007/s11783-017-0894-x[Crossref], [CAS], Google Scholar310https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2sXhs1KhtLfI&md5=447097f1def89835f7fcfe07adc385b8Copper recovery from waste printed circuit boards concentrated metal scraps by electrolysisLiu, Xiaonan; Tan, Qiuxia; Li, Yungui; Xu, Zhonghui; Chen, MengjunFrontiers of Environmental Science & Engineering (2017), 11 (5), 1-5CODEN: FESECJ; ISSN:2095-221X. (Higher Education Press)Copper recovery is the core of waste printed circuit boards (WPCBs) treatment. In this study, we proposed a feasible and efficient way to recover copper from WPCBs concd. metal scraps by direct electrolysis and factors that affect copper recovery rate and purity, mainly CuSO4·5H2O concn., NaCl concn., H2SO4 concn. and c.d., were discussed in detail. The results indicated that copper recovery rate increased first with the increase of CuSO4·5H2O, NaCl, H2SO4 and c.d. and then decreased with further increasing these conditions. NaCl, H2SO4 and c.d. also showed a similar impact on copper purity, which also increased first and then decreased. Copper purity increased with the increase of CuSO4·5H2O. When the concn. of CuSO4·5H2O, NaCl and H2SO4 was resp. 90, 40 and 118 g/L and c.d. was 80 mA/cm2, copper recovery rate and purity was up to 97.32% and 99.86%, resp. Thus, electrolysis proposes a feasible and prospective approach for waste printed circuit boards recycle, even for e-waste, though more researches are needed for industrial application.
- 311Tortella, G. R.; Diez, M. C.; Durán, N. Fungal Diversity and Use in Decomposition of Environmental Pollutants. Crit. Rev. Microbiol. 2005, 31, 197– 212, DOI: 10.1080/10408410500304066[Crossref], [PubMed], [CAS], Google Scholar311https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BD2MXht1Kntb7J&md5=83b6ea122e3e2449a15d1b779f5d5fddFungal diversity and use in decomposition of environmental pollutantsTortella, Gonzalo R.; Diez, Maria Cristina; Duran, NelsonCritical Reviews in Microbiology (2005), 31 (4), 197-212CODEN: CRVMAC; ISSN:1040-841X. (Taylor & Francis, Inc.)A review. This article presents a crit. review of the actual state of fungal activities on environmental pollutants, fungal diversity, the use of fungi in the degrdn. of chem. pollutants, enzyme degrading systems and perspectives on the use of fungi in bioremediation and unexplored research. The ability of fungi to transform or metabolize chem. pollutants has received much attention due to environmental persistence and chem. toxicity. The fungal degrdn. of xenobiotics is looked upon as an effective method of removing these pollutants from the environment by a process which is currently known as bioremediation. This review summarizes information from fundamental works that have revealed that a wide variety of fungi are capable of degrading an equally wide range of toxic chem. The capacity of non-ligninolytic and ligninolytic fungi in the bioremediation of polycyclic arom. hydrocarbon (PAHs), benzene-toluene-ethylbenzene-xylene (BTEX), chlorophenols, polychlorinated biphenyl, munitions waste and pesticides have been discussed. Besides this, several extracellular enzymes are involved in the metab. of xenobiotic compds. as well as other factors related to these processes.
- 312Schreiner, K. M.; Filley, T. R.; Blanchette, R. A.; Bowen, B. B.; Bolskar, R. D.; Hockaday, W. C.; Masiello, C. A.; Raebiger, J. W. White-Rot Basidiomycete-Mediated Decomposition of C 60 Fullerol. Environ. Sci. Technol. 2009, 43, 3162– 3168, DOI: 10.1021/es801873q
- 313Xie, J.; Ming, Z.; Li, H.; Yang, H.; Yu, B.; Wu, R.; Liu, X.; Bai, Y.; Yang, S.-T. Toxicity of Graphene Oxide to White Rot Fungus Phanerochaete Chrysosporium. Chemosphere 2016, 151, 324– 331, DOI: 10.1016/j.chemosphere.2016.02.097[Crossref], [PubMed], [CAS], Google Scholar313https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC28XjvVGnt7c%253D&md5=3322ce069120d8689a34c69ab012399aToxicity of graphene oxide to white rot fungus Phanerochaete chrysosporiumXie, Jingru; Ming, Zhu; Li, Hongliang; Yang, Hua; Yu, Baowei; Wu, Ruihan; Liu, Xiaoyang; Bai, Yitong; Yang, Sheng-TaoChemosphere (2016), 151 (), 324-331CODEN: CMSHAF; ISSN:0045-6535. (Elsevier Ltd.)With the wide prodn. and applications of graphene and its derivs., their toxicity to the environment has received much attention nowadays. In this study, we investigated the toxicity of graphene oxide (GO) to white rot fungus (Phanerochaete chrysosporium). GO was prepd. by modified Hummers method and well characterized before use. P. chrysosporium was exposed to GO at the concns. of 0-4 mg/mL for 7 d. The fresh and dry wts., pH values of culture media, structures, ultrastructures, IR spectra and activities of the decompn. of pollutants were measured to reveal the hazards of GO to P. chrysosporium. Our results indicated that low concns. of GO stimulated the growth of P. chrysosporium. The exposure to GO induced more acidic pH values of the culture media after 7 d. GO induced the disruption of the fiber structure of P. chrysosporium, while at 4 mg/mL some very long and thick fibers were formed. Such changes were reflected in the SEM investigations, where the disruption of fibers was obsd. In the ultrastructural investigations, the shape of P. chrysosporium cells changed and more vesicles were found upon the exposure to GO. The IR spectroscopy analyses suggested that the chem. compns. of mycelia were not changed qual. Beyond the toxicity, GO did not alter the activities of P. chrysosporium at low concns., but led to the complete loss of activity at high concns. The implication to the ecol. safety of graphene is discussed.
- 314Yang, H.; Feng, S.; Ma, Q.; Ming, Z.; Bai, Y.; Chen, L.; Yang, S.-T. Influence of Reduced Graphene Oxide on the Growth, Structure and Decomposition Activity of White-Rot Fungus Phanerochaete Chrysosporium. RSC Adv. 2018, 8, 5026– 5033, DOI: 10.1039/C7RA12364G[Crossref], [CAS], Google Scholar314https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC1cXhsl2rsrY%253D&md5=e109dec9ca5dc69a4735ca5df7b59470Influence of reduced graphene oxide on the growth, structure and decomposition activity of white-rot fungus Phanerochaete chrysosporiumYang, Hua; Feng, Shicheng; Ma, Qiang; Ming, Zhu; Bai, Yitong; Chen, Lingyun; Yang, Sheng-TaoRSC Advances (2018), 8 (9), 5026-5033CODEN: RSCACL; ISSN:2046-2069. (Royal Society of Chemistry)Graphene materials have attracted great interest nowadays due to their large-scale prodn. and wide applications. It is urgent to evaluate the ecol. and environmental risk of graphene materials for the healthy development of the graphene industry. Herein, we evaluated the influence of reduced graphene oxide (RGO) on the growth, structure and decompn. activity of white-rot fungus, whose decompn. function is vital for carbon cycle. RGO slightly stimulated the fresh wt. and dry wt. gains of Phanerochaete chrysosporium. A larger no. of fibrous structures were obsd. at low RGO concns. in P. chrysosporium, which was consistent with the elongation of cells obsd. under a transmission electron microscope. RGO did not affect the chem. compn. of P. chrysosporium. Moreover, the laccase prodn. of P. chrysosporium was not influenced by RGO. The degrdn. activities of P. chrysosporium for dye and wood appeared to be promoted slightly, but the differences were insignificant compared to the control. Therefore, RGO had low toxicity to white-rot fungus and was relatively safe for the carbon cycle.
- 315Ankley, G. T.; Bennett, R. S.; Erickson, R. J.; Hoff, D. J.; Hornung, M. W.; Johnson, R. D.; Mount, D. R.; Nichols, J. W.; Russom, C. L.; Schmieder, P. K.; Serrrano, J. A.; Tietge, J. E.; Villeneuve, D. L. Adverse Outcome Pathways: A Conceptual Framework to Support Ecotoxicology Research and Risk Assessment. Environ. Toxicol. Chem. 2010, 29, 730– 741, DOI: 10.1002/etc.34[Crossref], [PubMed], [CAS], Google Scholar315https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC3cXjt12ju7Y%253D&md5=3b2dfc0652b76d1bed60b8885091dbc2Adverse outcome pathways: a conceptual framework to support ecotoxicology research and risk assessmentAnkley, Gerald T.; Bennett, Richard S.; Erickson, Russell J.; Hoff, Dale J.; Hornung, Michael W.; Johnson, Rodney D.; Mount, David R.; Nichols, John W.; Russom, Christine L.; Schmieder, Patricia K.; Serrrano, Jose A.; Tietge, Joseph E.; Villeneuve, Daniel L.Environmental Toxicology and Chemistry (2010), 29 (3), 730-741CODEN: ETOCDK; ISSN:0730-7268. (John Wiley & Sons Ltd.)A review. Ecol. risk assessors face increasing demands to assess more chems., with greater speed and accuracy, and to do so using fewer resources and exptl. animals. New approaches in biol. and computational sciences may be able to generate mechanistic information that could help in meeting these challenges. However, to use mechanistic data to support chem. assessments, there is a need for effective translation of this information into endpoints meaningful to ecol. risk - effects on survival, development, and reprodn. in individual organisms and, by extension, impacts on populations. Here we discuss a framework designed for this purpose, the adverse outcome pathway (AOP). An AOP is a conceptual construct that portrays existing knowledge concerning the linkage between a direct mol. initiating event and an adverse outcome at a biol. level of organization relevant to risk assessment. The practical utility of AOPs for ecol. risk assessment of chems. is illustrated using five case examples. The examples demonstrate how the AOP concept can focus toxicity testing in terms of species and endpoint selection, enhance across-chem. extrapolation, and support prediction of mixt. effects. The examples also show how AOPs facilitate use of mol. or biochem. endpoints (sometimes referred to as biomarkers) for forecasting chem. impacts on individuals and populations. In the concluding sections of the paper, we discuss how AOPs can help to guide research that supports chem. risk assessments and advocate for the incorporation of this approach into a broader systems biol. framework.
- 316Leist, M.; Ghallab, A.; Graepel, R.; Marchan, R.; Hassan, R.; Bennekou, S. H.; Limonciel, A.; Vinken, M.; Schildknecht, S.; Waldmann, T.; Danen, E.; van Ravenzwaay, B.; Kamp, H.; Gardner, I.; Godoy, P.; Bois, F. Y.; Braeuning, A.; Reif, R.; Oesch, F.; Drasdo, D. Adverse Outcome Pathways: Opportunities, Limitations and Open Questions. Arch. Toxicol. 2017, 91, 3477– 3505, DOI: 10.1007/s00204-017-2045-3[Crossref], [PubMed], [CAS], Google Scholar316https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2sXhs12ltrrJ&md5=202b42123eb30e9685bc6cd6d1c6b88cAdverse outcome pathways: opportunities, limitations and open questionsLeist, Marcel; Ghallab, Ahmed; Graepel, Rabea; Marchan, Rosemarie; Hassan, Reham; Bennekou, Susanne Hougaard; Limonciel, Alice; Vinken, Mathieu; Schildknecht, Stefan; Waldmann, Tanja; Danen, Erik; van Ravenzwaay, Ben; Kamp, Hennicke; Gardner, Iain; Godoy, Patricio; Bois, Frederic Y.; Braeuning, Albert; Reif, Raymond; Oesch, Franz; Drasdo, Dirk; Hoehme, Stefan; Schwarz, Michael; Hartung, Thomas; Braunbeck, Thomas; Beltman, Joost; Vrieling, Harry; Sanz, Ferran; Forsby, Anna; Gadaleta, Domenico; Fisher, Ciaran; Kelm, Jens; Fluri, David; Ecker, Gerhard; Zdrazil, Barbara; Terron, Andrea; Jennings, Paul; van der Burg, Bart; Dooley, Steven; Meijer, Annemarie H.; Willighagen, Egon; Martens, Marvin; Evelo, Chris; Mombelli, Enrico; Taboureau, Olivier; Mantovani, Alberto; Hardy, Barry; Koch, Bjorn; Escher, Sylvia; van Thriel, Christoph; Cadenas, Cristina; Kroese, D.; van de Water, Bob; Hengstler, Jan G.Archives of Toxicology (2017), 91 (11), 3477-3505CODEN: ARTODN; ISSN:0340-5761. (Springer)Adverse outcome pathways (AOPs) are a recent toxicol. construct that connects, in a formalized, transparent and quality-controlled way, mechanistic information to apical endpoints for regulatory purposes. AOP links a mol. initiating event (MIE) to the adverse outcome (AO) via key events (KE), in a way specified by key event relationships (KER). Although this approach to formalize mechanistic toxicol. information only started in 2010, over 200 AOPs have already been established. At this stage, new requirements arise, such as the need for harmonization and re-assessment, for continuous updating, as well as for alerting about pitfalls, misuses and limits of applicability. In this review, the history of the AOP concept and its most prominent strengths are discussed, including the advantages of a formalized approach, the systematic collection of wt. of evidence, the linkage of mechanisms to apical end points, the examn. of the plausibility of epidemiol. data, the identification of crit. knowledge gaps and the design of mechanistic test methods. To prep. the ground for a broadened and appropriate use of AOPs, some widespread misconceptions are explained. Moreover, potential weaknesses and shortcomings of the current AOP rule set are addressed (1) to facilitate the discussion on its further evolution and (2) to better define appropriate vs. less suitable application areas. Exemplary toxicol. studies are presented to discuss the linearity assumptions of AOP, the management of event modifiers and compensatory mechanisms, and whether a sepn. of toxicodynamics from toxicokinetics including metab. is possible in the framework of pathway plasticity. Suggestions on how to compromise between different needs of AOP stakeholders have been added. A clear definition of open questions and limitations is provided to encourage further progress in the field.
- 317Groso, A.; Petri-Fink, A.; Magrez, A.; Riediker, M.; Meyer, T. Management of Nanomaterials Safety in Research Environment. Part. Part. Fibre Toxicol. 2010, 7, 40, DOI: 10.1186/1743-8977-7-40[Crossref], [PubMed], [CAS], Google Scholar317https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A280%3ADC%252BC3M7gt1SktA%253D%253D&md5=e68c48393049da69b8c1c831975d0116Management of nanomaterials safety in research environmentGroso Amela; Petri-Fink Alke; Magrez Arnaud; Riediker Michael; Meyer ThierryParticle and fibre toxicology (2010), 7 (), 40 ISSN:.Despite numerous discussions, workshops, reviews and reports about responsible development of nanotechnology, information describing health and environmental risk of engineered nanoparticles or nanomaterials is severely lacking and thus insufficient for completing rigorous risk assessment on their use. However, since preliminary scientific evaluations indicate that there are reasonable suspicions that activities involving nanomaterials might have damaging effects on human health; the precautionary principle must be applied. Public and private institutions as well as industries have the duty to adopt preventive and protective measures proportionate to the risk intensity and the desired level of protection. In this work, we present a practical, 'user-friendly' procedure for a university-wide safety and health management of nanomaterials, developed as a multi-stakeholder effort (government, accident insurance, researchers and experts for occupational safety and health). The process starts using a schematic decision tree that allows classifying the nano laboratory into three hazard classes similar to a control banding approach (from Nano 3--highest hazard to Nano1--lowest hazard). Classifying laboratories into risk classes would require considering actual or potential exposure to the nanomaterial as well as statistical data on health effects of exposure. Due to the fact that these data (as well as exposure limits for each individual material) are not available, risk classes could not be determined. For each hazard level we then provide a list of required risk mitigation measures (technical, organizational and personal). The target 'users' of this safety and health methodology are researchers and safety officers. They can rapidly access the precautionary hazard class of their activities and the corresponding adequate safety and health measures. We succeed in convincing scientist dealing with nano-activities that adequate safety measures and management are promoting innovation and discoveries by ensuring them a safe environment even in the case of very novel products. The proposed measures are not considered as constraints but as a support to their research. This methodology is being implemented at the Ecole Polytechnique de Lausanne in over 100 research labs dealing with nanomaterials. It is our opinion that it would be useful to other research and academia institutions as well.
- 318Imhof, C.; Clark, K.; Meyer, T.; Schmid, K.; Riediker, M. Research and Development—where People Are Exposed to Nanomaterials. J. Occup. Health 2015, 57, 179– 188, DOI: 10.1539/joh.14-0189-FS[Crossref], [PubMed], [CAS], Google Scholar318https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2MXnvValurg%253D&md5=a4a1de89973b63391241eb2265cc2d7dResearch and development-where people are exposed to nanomaterialsImhof, Chantal; Clark, Katherine; Meyer, Thierry; Schmid, Kaspar; Riediker, MichaelJournal of Occupational Health (2015), 57 (2), 179-188CODEN: JOCHFV; ISSN:1341-9145. (Japan Society for Occupational Health)Objectives: Many nanomaterials (materials with structures smaller than 100 nm) have chem., phys. and bioactive characteristics of interest for novel applications. Considerable research efforts have been launched in this field. This study aimed to study exposure scenarios commonly encountered in research settings. Methods: We studied one of the leading Swiss universities and first identified all research units dealing with nanomaterials. After a preliminary evaluation of quantities and process types used, a detailed anal. was conducted in units where more than a few micrograms were used per wk. Results: In the investigated labs., background levels were usually low and in the range of a few thousand particles per cubic centimeter. Powder applications resulted in concns. of 10,000 to 100,000 particles/cm3 when measured inside fume hoods, but there were no or mostly minimal increases in the breathing zone of researchers. Mostly low exposures were obsd. for activities involving liq. applications. However, centrifugation and lyophilization of nanoparticle-contg. solns. resulted in high particle no. levels (up to 300,000 particles/cm3) in work spaces where researchers did not always wear respiratory protection. No significant increases were found for processes involving nanoparticles bound to surfaces, nor were they found in labs. that were visualizing properties and structure of small amts. of nanomaterials. Conclusions: Research activities in modern labs. equipped with control techniques were assocd. with minimal releases of nanomaterials into the working space. However, the focus should not only be on processes involving nanopowders but should also be on processes involving nanoparticle-contg. liqs., esp. if the work involves phys. agitation, aerosolization or drying of the liqs.
- 319Spinazzè, A.; Cattaneo, A.; Campagnolo, D.; Bollati, V.; Bertazzi, P. A.; Cavallo, D. M. Engineered Nanomaterials Exposure in the Production of Graphene. Aerosol Sci. Technol. 2016, 50, 812– 821, DOI: 10.1080/02786826.2016.1195906[Crossref], [CAS], Google Scholar319https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC28XhtVCmt7fN&md5=ae8df74c9e4e496ffd7379e984537f28Engineered nanomaterials exposure in the production of grapheneSpinazze, Andrea; Cattaneo, Andrea; Campagnolo, Davide; Bollati, Valentina; Bertazzi, Pier Alberto; Cavallo, Domenico M.Aerosol Science and Technology (2016), 50 (8), 812-821CODEN: ASTYDQ; ISSN:0278-6826. (Taylor & Francis, Inc.)The objective of this study was to obtain the multi-metric occupational exposure assessment to graphene family nanomaterials (GFNs) particles of workers engaged in the large-scale prodn. of graphene. The study design consisted of the combination of (i) direct-reading instruments, used to evaluate the total particle no. concns. relative to the background concn. (time series with spatial approach) and the mean size-dependent characteristics of particles (mean diam. and surface-area concn.) and (ii) filter-based air sampling for the detn. of size-resolved particle mass concns. The data obtained from direct reading measurement were then used to est. the 8-h time weighted av. (8-h TWA) exposure to GFNs particles for workers involved in different working tasks. Workers were generally exposed to 8-h TWA GFNs particle levels lower than the proposed ref. value (40,000 particle/cm3). Furthermore, despite high short-term exposure conditions were present during specific operations of the prodn. process, the possibility of significant exposure peaks is not likely to be expected. The estd. 8-h TWA concn. showed differences between the unexposed (<100 particle/cm3; <0.05 μg/m3) and exposed subjects (mean concn. ranging from 909 to 6438 particle/cm3 and from 0.38 to 3.86 μg/m3). The research outcomes can be of particular interest because the exposure of workers in real working conditions was assessed with a multi-metric approach; in this regard, the study suggests that workers who are directly involved in some specific working task (material sampling for quality control) have higher potential for occupational exposure than operators who are in charge of routine prodn. work. 2016 American Assocn. for Aerosol Research.
- 320Lee, J. H.; Han, J. H.; Kim, J. H.; Kim, B.; Bello, D.; Kim, J. K.; Lee, G. H.; Sohn, E. K.; Lee, K.; Ahn, K.; Faustman, E. M.; Yu, I. J. Exposure Monitoring of Graphene Nanoplatelets Manufacturing Workplaces. Inhalation Toxicol. 2016, 28, 281– 291, DOI: 10.3109/08958378.2016.1163442[Crossref], [PubMed], [CAS], Google Scholar320https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC28Xlslamtbc%253D&md5=e14eed454c2c824c98698d6b334c31f7Exposure monitoring of graphene nanoplatelets manufacturing workplacesLee, Ji Hyun; Han, Jong Hun; Kim, Jae Hyun; Kim, Boowook; Bello, Dhimiter; Kim, Jin Kwon; Lee, Gun Ho; Sohn, Eun Kyung; Lee, Kyungmin; Ahn, Kangho; Faustman, Elaine M.; Yu, Il JeInhalation Toxicology (2016), 28 (6), 281-291CODEN: INHTE5; ISSN:0895-8378. (Taylor & Francis Ltd.)Graphenes have emerged as a highly promising, two-dimensional engineered nanomaterial that can possibly substitute carbon nanotubes. They are being explored in numerous R&D and industrial applications in labs. across the globe, leading to possible human and environmental exposures to them. Yet, there are no published data on graphene exposures in occupational settings and no readily available methods for their detection and quantitation exist. This study investigates for the first time the potential exposure of workers and research personnel to graphenes in two research facilities and evaluates the status of the control measures. One facility manufs. graphene using graphite exfoliation and chem. vapor deposition (CVD), while the other facility grows graphene on a copper plate using CVD, which is then transferred to a polyethylene terephthalate (PET) sheet. Graphene exposures and process emissions were investigated for three tasks - CVD growth, exfoliation, and transfer - using a multi-metric approach, which utilizes several direct reading instruments, integrated sampling, and chem. and morphol. anal. Real-time instruments included a dust monitor, condensation particle counter (CPC), nanoparticle surface area monitor, scanning mobility particle sizer, and an aethalometer. Morphol., graphenes and other nanostructures released from the work process were investigated using a transmission electron microscope (TEM). Graphenes were quantified in airborne respirable samples as elemental carbon via thermo-optical anal. The mass concns. of total suspended particulate at Workplaces A and B were very low, and elemental carbon concns. were mostly below the detection limit, indicating very low exposure to graphene or any other particles. The real-time monitoring, esp. the aethalometer, showed a good response to the released black carbon, providing a signature of the graphene released during the opening of the CVD reactor at Workplace A. The TEM observation of the samples obtained from Workplaces A and B showed graphene-like structures and aggregated/agglomerated carbon structures. Taken together, the current findings on common scenarios (exfoliation, CVD growth, and transfer), while not inclusive of all graphene manufg. processes, indicate very minimal graphene or particle exposure at facilities manufg. graphenes with good manufg. practices.
- 321Lo, L.-M.; Hammond, D.; Bartholomew, I.; Almaguer, D.; Heitbrink, W.; Topmiller, J. Engineering Controls for Nano-Scale Graphene Platelets During Manufacturing and Handling Processes. Department of Health and Human Services Centers for Disease Control and Prevention National Institute for Occupational Safety and Health, 2011.Google ScholarThere is no corresponding record for this reference.
- 322Heitbrink, W. A.; Lo, L.-M.; Dunn, K. H. Exposure Controls for Nanomaterials at Three Manufacturing Sites. J. Occup. Environ. Hyg. 2015, 12, 16– 28, DOI: 10.1080/15459624.2014.930559
- 323Rebitzer, G.; Ekvall, T.; Frischknecht, R.; Hunkeler, D.; Norris, G.; Rydberg, T.; Schmidt, W.-P.; Suh, S.; Weidema, B. P.; Pennington, D. W. Life Cycle Assessment: Part 1: Framework, Goal and Scope Definition, Inventory Analysis, and Applications. Environ. Int. 2004, 30, 701– 720, DOI: 10.1016/j.envint.2003.11.005[Crossref], [PubMed], [CAS], Google Scholar323https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BD2cXisFCgsbs%253D&md5=8135a490f5b1d9ae822a0dd868e61f2aLife cycle assessment. Part 1: Framework, goal and scope definition, inventory analysis, and applicationsRebitzer, G.; Ekvall, T.; Frischknecht, R.; Hunkeler, D.; Norris, G.; Rydberg, T.; Schmidt, W.-P.; Suh, S.; Weidema, B. P.; Pennington, D. W.Environment International (2004), 30 (5), 701-720CODEN: ENVIDV; ISSN:0160-4120. (Elsevier)A review. Sustainable development requires methods and tools to measure and compare the environmental impacts of human activities for the provision of goods and services (both of which are summarized under the term products). Environmental impacts include those from emissions into the environment and through the consumption of resources, as well as other interventions (e.g., land use) assocd. with providing products that occur when extg. resources, producing materials, manufg. the products, during consumption/use, and at the products' end-of-life (collection/sorting, reuse, recycling, waste disposal). These emissions and consumptions contribute to a wide range of impacts, such as climate change, stratospheric ozone depletion, tropospheric ozone (smog) creation, eutrophication, acidification, toxicol. stress on human health and ecosystems, the depletion of resources, water use, land use, and noise-among others. A clear need, therefore, exists to be proactive and to provide complimentary insights, apart from current regulatory practices, to help reduce such impacts. Practitioners and researchers from many domains come together in life cycle assessment (LCA) to calc. indicators of the aforementioned potential environmental impacts that are linked to products-supporting the identification of opportunities for pollution prevention and redns. in resource consumption while taking the entire product life cycle into consideration. This paper, part 1 in two, introduces the LCA framework and procedure, outlines how to define and model a product's life cycle, and provides an overview of available methods and tools for tabulating and compiling assocd. emissions and resource consumption data in a life cycle inventory (LCI). It also discusses the application of LCA in industry and policy making. The 2nd paper, by Pennington et al. (Environ. Int. 2003, in press), highlights the key features, summarizes available approaches, and outlines the key challenges of assessing the aforementioned inventory data in terms of contributions to environmental impacts (life cycle impact assessment, LCIA).
- 324Arvidsson, R.; Kushnir, D.; Molander, S.; Sandén, B. A. Energy and Resource Use Assessment of Graphene as a Substitute for Indium Tin Oxide in Transparent Electrodes. J. Cleaner Prod. 2016, 132, 289– 297, DOI: 10.1016/j.jclepro.2015.04.076[Crossref], [CAS], Google Scholar324https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2MXnsl2qt78%253D&md5=b799948ebda626fa0ef959b7eb067375Energy and resource use assessment of graphene as a substitute for indium tin oxide in transparent electrodesArvidsson, Rickard; Kushnir, Duncan; Molander, Sverker; Sanden, Bjoern A.Journal of Cleaner Production (2016), 132 (), 289-297CODEN: JCROE8; ISSN:0959-6526. (Elsevier Ltd.)One of the most promising applications of graphene is as material in transparent electrodes in applications such as liq. crystal displays (LCDs) and solar cells. In this study, we assess life cycle resource requirements of producing an electrode area of graphene by chem. vapor deposition (CVD) and compare to the prodn. of indium tin oxide (ITO). The resources considered are energy and scarce metals. The results show that graphene layers can have lower life cycle energy use than ITO layers, with 3-10 times redn. for our best case scenario. Regarding use of scarce metals, the use of indium in ITO prodn. is more problematic than the use of copper in graphene prodn., although the latter may constitute a resource constraint in the very long run. The substitution of ITO by graphene thus seems favorable from a resource point of view. Higher order effects may outweigh or enhance the energy use benefit. For example, cheaper, graphene-based electrodes may spur increased prodn. of LCDs, leading to increased abs. energy use, or spur the development of new energy technologies, such as solar cells and fuel cells. The latter could potentially lead to larger abs. redns. in resource use if these new technologies will replace fossil-based energy systems.
- 325Arvidsson, R.; Molander, S. Prospective Life Cycle Assessment of Epitaxial Graphene Production at Different Manufacturing Scales and Maturity. J. Ind. Ecol. 2017, 21, 1153– 1164, DOI: 10.1111/jiec.12526[Crossref], [CAS], Google Scholar325https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2sXhs12mtb3N&md5=a8dd6c6985efcb9150263998160c5fc8Prospective Life Cycle Assessment of Epitaxial Graphene Production at Different Manufacturing Scales and MaturityArvidsson, Rickard; Molander, SverkerJournal of Industrial Ecology (2017), 21 (5), 1153-1164CODEN: JINEFZ; ISSN:1088-1980. (Wiley-Blackwell)Epitaxial growth is a potential prodn. process for the new material graphene, where it is grown on silicon carbide (SiC) wafers at high temps. We provide first ests. of the life cycle cumulative energy demand, climate change, terrestrial acidification, and eco-toxicity of this prodn. For this purpose, we applied prospective life cycle assessment (LCA) for three prodn. scenarios (lab, pilot, and an industrial scenario), which reflect different prodn. scales and technol. maturity. The functional unit was one square centimeter of graphene. Results show that the three scenarios have similar impacts, which goes against previous studies that have suggested a decrease with larger prodn. scale and technol. maturity. The reason for this result is the dominance of electricity use in the SiC wafer prodn. for all impacts (>99% in the worst case, >76% in the best case). Only when assuming thinner SiC wafers in the industrial scenario is there a redn. in impacts by around a factor of 10. A surface-area-based comparison to the life cycle energy use of graphene produced by chem. vapor deposition showed that epitaxial graphene was considerably more energy intensive-approx. a factor of 1,000. We recommend producers of epitaxial graphene to investigate the feasibility of thinner SiC wafers and use electricity based on wind, solar, or hydropower. The main methodol. recommendation from the study is to achieve a temporal robustness of LCA studies of emerging technologies, which includes the consideration of different background systems and differences in prodn. scale and technol. maturity.
- 326Pizza, A.; Metz, R.; Hassanzadeh, M.; Bantignies, J.-L. Life Cycle Assessment of Nanocomposites Made of Thermally Conductive Graphite Nanoplatelets. Int. J. Life Cycle Assess. 2014, 19, 1226– 1237, DOI: 10.1007/s11367-014-0733-2[Crossref], [CAS], Google Scholar326https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2cXosVegtr8%253D&md5=e1e6a5b9ca461fafca0cf3995785f249Life cycle assessment of nanocomposites made of thermally conductive graphite nanoplateletsPizza, Alfredo; Metz, Renaud; Hassanzadeh, Mehrdad; Bantignies, Jean-LouisInternational Journal of Life Cycle Assessment (2014), 19 (6), 1226-1237CODEN: IJLCFF; ISSN:0948-3349. (Springer)Purpose: Polymers typically have intrinsic thermal cond. much lower than other materials. Enhancement of this property may be obtained by the addn. of conductive fillers. Nanofillers are preferred to traditional ones, due to their low percolation threshold resulting from their high aspect ratio. Beyond these considerations, it is imperative that the development of such new fillers takes place in a safe and sustainable manner. A conventional life cycle assessment (LCA) has been conducted on epoxy-based composites, filled with graphite nanoplatelets (GnP). In particular, this study focuses on energy requirements for the prodn. of such composites, in order to stress environmental hot spots and primary energy of GnP prodn. process (nano-wastes and nanoparticles emissions are not included). Methods: A cradle-to-grave approach has been employed for this assessment, in an attributional modeling perspective. The data for the LCA have been gathered from both lab. data and bibliog. refs. A tech. LCA software package, SimaPro (SimaPro 7.3), which contains Ecoinvent (2010) life cycle inventory (LCI) database, has been used for the life cycle impact assessment (LCIA), studying 13 mid-point indicators. Sensitivity and uncertainty analyses have also been performed. Results and discussion: One kilogram of GnP filler requires 1,879 MJ of primary energy while the prepn. of 1 kg of epoxy composite loaded with 0.058 kg of GnP 303 MJ. Besides energy consumption in the filler prepn., it is shown that the thermoset matrix material has also a non-negligible impact on the life cycle despite the use of GnP: the primary energy required to make epoxy resin is 187 MJ, i.e., 62 % of the total energy to make 1 kg of composite. Conclusions: Raw material extn. and filler and resin prepn. phase exhibit the highest environmental impact while the composite prodn. is negligible. Thermosetting resin remains the highest primary energy demand when used as matrix for GnP fillers. The result of the sensitivity anal. carried out on the electricity mix used during the GnP and the composite prodn. processes does not affect the conclusions.
- 327Arvidsson, R.; Kushnir, D.; Sandén, B. A.; Molander, S. Prospective Life Cycle Assessment of Graphene Production by Ultrasonication and Chemical Reduction. Environ. Sci. Technol. 2014, 48, 4529– 4536, DOI: 10.1021/es405338k[ACS Full Text
 ], [CAS], Google Scholar327https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2cXksFWitL0%253D&md5=6c8e87870f2c77c1f9e1fd2e89f2eb34Prospective Life Cycle Assessment of Graphene Production by Ultrasonication and Chemical ReductionArvidsson, Rickard; Kushnir, Duncan; Sanden, Bjoern A.; Molander, SverkerEnvironmental Science & Technology (2014), 48 (8), 4529-4536CODEN: ESTHAG; ISSN:0013-936X. (American Chemical Society)One promising future bulk application of graphene is as composite additive. Therefore, we compare two prodn. routes for in-soln. graphene using a cradle-to-gate lifecycle assessment focusing on potential differences in energy use, blue water footprint, human toxicity, and ecotoxicity. The data used for the assessment is based on information in scientific papers and patents. Considering the prospective nature of this study, environmental impacts from background systems such as energy prodn. were not included. The prodn. routes are either based on ultrasonication or chem. redn. The results show that the ultrasonication route has lower energy and water use, but higher human and ecotoxicity impacts, compared to the chem. redn. route. However, a sensitivity anal. showed that solvent recovery in the ultrasonication process gives lower impacts for all included impact categories. The sensitivity anal. also showed that solvent recovery is important to lower the blue water footprint of the chem. redn. route as well. The results demonstrate the possibility to conduct a life cycle assessment study based mainly on information from patents and scientific articles, enabling prospective life cycle assessment studies of products at early stages of technol. development.
], [CAS], Google Scholar327https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2cXksFWitL0%253D&md5=6c8e87870f2c77c1f9e1fd2e89f2eb34Prospective Life Cycle Assessment of Graphene Production by Ultrasonication and Chemical ReductionArvidsson, Rickard; Kushnir, Duncan; Sanden, Bjoern A.; Molander, SverkerEnvironmental Science & Technology (2014), 48 (8), 4529-4536CODEN: ESTHAG; ISSN:0013-936X. (American Chemical Society)One promising future bulk application of graphene is as composite additive. Therefore, we compare two prodn. routes for in-soln. graphene using a cradle-to-gate lifecycle assessment focusing on potential differences in energy use, blue water footprint, human toxicity, and ecotoxicity. The data used for the assessment is based on information in scientific papers and patents. Considering the prospective nature of this study, environmental impacts from background systems such as energy prodn. were not included. The prodn. routes are either based on ultrasonication or chem. redn. The results show that the ultrasonication route has lower energy and water use, but higher human and ecotoxicity impacts, compared to the chem. redn. route. However, a sensitivity anal. showed that solvent recovery in the ultrasonication process gives lower impacts for all included impact categories. The sensitivity anal. also showed that solvent recovery is important to lower the blue water footprint of the chem. redn. route as well. The results demonstrate the possibility to conduct a life cycle assessment study based mainly on information from patents and scientific articles, enabling prospective life cycle assessment studies of products at early stages of technol. development. - 328Rosenbaum, R. K.; Bachmann, T. M.; Gold, L. S.; Huijbregts, M. A. J.; Jolliet, O.; Juraske, R.; Koehler, A.; Larsen, H. F.; MacLeod, M.; Margni, M.; McKone, T. E.; Payet, J.; Schuhmacher, M.; van de Meent, D.; Hauschild, M. Z. USEtox—the UNEP-SETAC Toxicity Model: Recommended Characterisation Factors for Human Toxicity and Freshwater Ecotoxicity in Life Cycle Impact Assessment. Int. J. Life Cycle Assess. 2008, 13, 532– 546, DOI: 10.1007/s11367-008-0038-4[Crossref], [CAS], Google Scholar328https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BD1MXmslKl&md5=492b486f95c0b3257f363649f4341cf8USEtox- the UNEP-SETAC toxicity model: recommended characterisation factors for human toxicity and freshwater ecotoxicity in life cycle impact assessmentRosenbaum, Ralph K.; Bachmann, Till M.; Gold, Lois Swirsky; Huijbregts, Mark A. J.; Jolliet, Olivier; Juraske, Ronnie; Koehler, Annette; Larsen, Henrik F.; MacLeod, Matthew; Margni, Manuele; McKone, Thomas E.; Payet, Jerome; Schuhmacher, Marta; van de Meent, Dik; Hauschild, Michael Z.International Journal of Life Cycle Assessment (2008), 13 (7), 532-546CODEN: IJLCFF; ISSN:0948-3349. (Springer)In 2005, a comprehensive comparison of life cycle impact assessment toxicity characterization models was initiated by the United Nations Environment Program (UNEP)-Society for Environmental Toxicol. and Chem. (SETAC) Life Cycle Initiative, directly involving the model developers of CalTOX, IMPACT 2002, USES-LCA, BETR, EDIP, WATSON, and EcoSense. In this paper, we describe this model comparison process and its results-in particular the scientific consensus model developed by the model developers. The main objectives of this effort were (1) to identify specific sources of differences between the models' results and structure, (2) to detect the indispensable model components and (3) to build a scientific consensus model from them, representing recommended practice. A chem. test set of 45 orgs. covering a wide range of property combinations was selected for this purpose. All models used this set. In three workshops, the model comparison participants identified key fate, exposure and effect issues via comparison of the final characterization factors and selected intermediate outputs for fate, human exposure and toxic effects for the test set applied to all models. Through this process, we were able to reduce intermodel variation from an initial range of up to 13 orders of magnitude down to no more than two orders of magnitude for any substance. This led to the development of USEtox, a scientific consensus model that contains only the most influential model elements. These were, for example, process formulations accounting for intermittent rain, defining a closed or open system environment or nesting an urban box in a continental box. The precision of the new characterization factors (CFs) is within a factor of 100-1000 for human health and 10-100 for freshwater ecotoxicity of all other models compared to 12 orders of magnitude variation between the CFs of each model, resp. The achieved redn. of inter-model variability by up to 11 orders of magnitude is a significant improvement. USEtox provides a parsimonious and transparent tool for human health and ecosystem CF ests. Based on a referenced database, it has now been used to calc. CFs for several thousand substances and forms the basis of the recommendations from UNEP-SETAC's Life Cycle Initiative regarding characterization of toxic impacts in life cycle assessment. We provide both recommended and interim (not recommended and to be used with caution) characterization factors for human health and freshwater ecotoxicity impacts. After a process of consensus building among stakeholders on a broad scale as well as several improvements regarding a wider and easier applicability of the model, USEtox will become available to practitioners for the calcn. of further CFs.
- 329Salieri, B.; Righi, S.; Pasteris, A.; Olsen, S. I. Freshwater Ecotoxicity Characterisation Factor for Metal Oxide Nanoparticles: A Case Study on Titanium Dioxide Nanoparticle. Sci. Total Environ. 2015, 505, 494– 502, DOI: 10.1016/j.scitotenv.2014.09.107[Crossref], [PubMed], [CAS], Google Scholar329https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2cXhslersbjI&md5=351c11d05c81182f59ed1419ef65c6f9Freshwater ecotoxicity characterisation factor for metal oxide nanoparticles: A case study on titanium dioxide nanoparticleSalieri, Beatrice; Righi, Serena; Pasteris, Andrea; Olsen, Stig IrvingScience of the Total Environment (2015), 505 (), 494-502CODEN: STENDL; ISSN:0048-9697. (Elsevier B.V.)The Life Cycle Assessment (LCA) methodol. is widely applied in several industrial sectors to evaluate the environmental performance of processes, products and services. Recently, several reports and studies have emphasized the importance of LCA in the field of engineered nanomaterials. However, to date only a few LCA studies on nanotechnol. have been carried out, and fewer still have assessed aspects relating to ecotoxicity. This is mainly due to the lack of knowledge in relation on human and environmental exposure and effect of engineered nanoparticles (ENPs). This bottleneck is continued when performing Life Cycle Impact Assessment, where characterization models and consequently characterization factors (CFs) for ENPs are missing. This paper aims to provide the freshwater ecotoxicity CF for titanium dioxide nanoparticles (nano-TiO2). The USEtox model has been selected as a characterization model. An adjusted multimedia fate model has been developed which accounts for nano-specific fate process descriptors (i.e., sedimentation, aggregation with suspended particle matter, etc.) to est. the fate of nano-TiO2 in freshwater. A literature survey of toxicity tests performed on freshwater organism representative of multiple trophic levels was conducted, including algae, crustaceans and fish to collect relevant EC50 values. Then, the toxic effect of nano-TiO2 was computed on the basis of the HC50 value. Thus, following the principle of USEtox model and accounting for nano-specific descriptors a CF for the toxic impact of freshwater ecotoxicity of 0.28 PAF day M3 kg- 1 is proposed.
- 330Ettrup, K.; Kounina, A.; Hansen, S. F.; Meesters, J. A. J.; Vea, E. B.; Laurent, A. Development of Comparative Toxicity Potentials of TiO 2 Nanoparticles for Use in Life Cycle Assessment. Environ. Sci. Technol. 2017, 51, 4027– 4037, DOI: 10.1021/acs.est.6b05049
- 331Meesters, J. A. J.; Koelmans, A. A.; Quik, J. T. K.; Hendriks, A. J.; van de Meent, D. Multimedia Modeling of Engineered Nanoparticles with SimpleBox4nano: Model Definition and Evaluation. Environ. Sci. Technol. 2014, 48, 5726– 5736, DOI: 10.1021/es500548h[ACS Full Text
 ], [CAS], Google Scholar331https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2cXmvVWjt7o%253D&md5=b67c608a11c9e4fe9ed94cd8e434e55cMultimedia Modeling of Engineered Nanoparticles with SimpleBox4Nano: Model Definition and EvaluationMeesters, Johannes A. J.; Koelmans, Albert A.; Quik, Joris T. K.; Hendriks, A. Jan; van de Meent, DikEnvironmental Science & Technology (2014), 48 (10), 5726-5736CODEN: ESTHAG; ISSN:0013-936X. (American Chemical Society)Screening level models for environmental assessment of engineered nanoparticles (ENP) are not generally available. This work assessed the validity of SimpleBox4Nano (SB4N), the first model of this type, and evaluated it by comparing it with a known material flow model. SB4N expressed ENP transport and concns. in and across air, rain, surface water, soil, and sediment, accounting for nano-specific processes e.g., aggregation, attachment, and dissoln. The model solves simultaneous mass balance equations (MBE) using simple matrix algebra. MBE link all concns. and transfer processes using first-order rate consts. for all processes known to be relevant for ENP. First-order rate consts. were obtained from the literature. The SB4N output is ENP mass concns. as free dispersive species, hetero-aggregates with natural colloids, and larger natural particles in each compartment in time and at steady state. Known scenario studies for Switzerland were used to demonstrate the impact of transport processes included in SB4N on predicted environmental concns. It is argued that SB4N-predicted environmental concns. are useful as background concns. for environmental risk assessment.
], [CAS], Google Scholar331https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2cXmvVWjt7o%253D&md5=b67c608a11c9e4fe9ed94cd8e434e55cMultimedia Modeling of Engineered Nanoparticles with SimpleBox4Nano: Model Definition and EvaluationMeesters, Johannes A. J.; Koelmans, Albert A.; Quik, Joris T. K.; Hendriks, A. Jan; van de Meent, DikEnvironmental Science & Technology (2014), 48 (10), 5726-5736CODEN: ESTHAG; ISSN:0013-936X. (American Chemical Society)Screening level models for environmental assessment of engineered nanoparticles (ENP) are not generally available. This work assessed the validity of SimpleBox4Nano (SB4N), the first model of this type, and evaluated it by comparing it with a known material flow model. SB4N expressed ENP transport and concns. in and across air, rain, surface water, soil, and sediment, accounting for nano-specific processes e.g., aggregation, attachment, and dissoln. The model solves simultaneous mass balance equations (MBE) using simple matrix algebra. MBE link all concns. and transfer processes using first-order rate consts. for all processes known to be relevant for ENP. First-order rate consts. were obtained from the literature. The SB4N output is ENP mass concns. as free dispersive species, hetero-aggregates with natural colloids, and larger natural particles in each compartment in time and at steady state. Known scenario studies for Switzerland were used to demonstrate the impact of transport processes included in SB4N on predicted environmental concns. It is argued that SB4N-predicted environmental concns. are useful as background concns. for environmental risk assessment. - 332Salieri, B.; Turner, D. A.; Nowack, B.; Hischier, R. Life Cycle Assessment of Manufactured Nanomaterials: Where Are We?. NanoImpact 2018, 10, 108– 120, DOI: 10.1016/j.impact.2017.12.003
- 333Kostarelos, K. Translating Graphene and 2D Materials into Medicine. Nat. Rev. Mater. 2016, 1, 16084, DOI: 10.1038/natrevmats.2016.84[Crossref], [CAS], Google Scholar333https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2sXhtVertLc%253D&md5=fe673d8c628cc99ebd20d177b6247fcbTranslating graphene and 2D materials into medicineKostarelos, KostasNature Reviews Materials (2016), 1 (11), 16084CODEN: NRMADL; ISSN:2058-8437. (Nature Publishing Group)Adoption of graphene and other 2D crystals in biomedicine is challenging - some guidelines to facilitate this process and avoid inflated expectations should be considered.
- 334Valsami-Jones, E.; Lynch, I. How Safe Are Nanomaterials?. Science 2015, 350, 388– 389, DOI: 10.1126/science.aad0768[Crossref], [PubMed], [CAS], Google Scholar334https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2MXhslOmt7rJ&md5=b5cad7b2aa65882579d64d704d3d860fHow safe are nanomaterials?Valsami-Jones, Eugenia; Lynch, IseultScience (Washington, DC, United States) (2015), 350 (6259), 388-389CODEN: SCIEAS; ISSN:0036-8075. (American Association for the Advancement of Science)There is no expanded citation for this reference.
- 335Yang, K.; Li, Y.; Tan, X.; Peng, R.; Liu, Z. Behavior and Toxicity of Graphene and Its Functionalized Derivatives in Biological Systems. Small 2013, 9, 1492– 1503, DOI: 10.1002/smll.201201417[Crossref], [PubMed], [CAS], Google Scholar335https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC38XhtlKisb3L&md5=2e4c82579a1a53870b3911feb232d074Behavior and toxicity of graphene and its functionalized derivatives in biological systemsYang, Kai; Li, Yingjie; Tan, Xiaofang; Peng, Rui; Liu, ZhuangSmall (2013), 9 (9-10), 1492-1503CODEN: SMALBC; ISSN:1613-6810. (Wiley-VCH Verlag GmbH & Co. KGaA)A review. Graphene, as a class of 2D carbon nanomaterial, has attracted tremendous interest in different areas in recent years including biomedicine. The toxicity and behavior of graphene in biol. systems are thus important fundamental issues that require significant attention. In this article, the toxicity of graphene is reviewed by describing the behavior of graphene and its derivs. in microorganisms, cells, and animals. Despite certain inconsistencies in several detailed exptl. results and hypotheses of toxicity mechanisms, results from numerous reports all agree that the physicochem. properties such as surface functional groups, charges, coatings, sizes, and structural defects of graphene may affect its in vitro/in vivo behavior as well as its toxicity in biol. systems. It is hoped that this review article will provide an overview understanding of the impacts, behavior, and toxicol. of graphene and its derivs. in various biol. systems.
- 336Seabra, A. B.; Paula, A. J.; de Lima, R.; Alves, O. L.; Durán, N. Nanotoxicity of Graphene and Graphene Oxide. Chem. Res. Toxicol. 2014, 27, 159– 168, DOI: 10.1021/tx400385x[ACS Full Text
 ], [CAS], Google Scholar336https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2cXitFKjsA%253D%253D&md5=2cd380d9e3b577a6208e7fc694abd2c6Nanotoxicity of Graphene and Graphene OxideSeabra, Amedea B.; Paula, Amauri J.; de Lima, Renata; Alves, Oswaldo L.; Duran, NelsonChemical Research in Toxicology (2014), 27 (2), 159-168CODEN: CRTOEC; ISSN:0893-228X. (American Chemical Society)A review. Graphene and its derivs. are promising candidates for important biomedical applications because of their versatility. The prospective use of graphene-based materials in a biol. context requires a detailed comprehension of the toxicity of these materials. Moreover, due to the expanding applications of nanotechnol., human and environmental exposures to graphene-based nanomaterials are likely to increase in the future. Because of the potential risk factors assocd. with the manuf. and use of graphene-related materials, the no. of nanotoxicol. studies of these compds. has been increasing rapidly in the past decade. These studies have researched the effects of the nanostructural/biol. interactions on different organizational levels of the living system, from biomols. to animals. This review discusses recent results based on in vitro and in vivo cytotoxicity and genotoxicity studies of graphene-related materials and critically examines the methodologies employed to evaluate their toxicities. The environmental impact from the manipulation and application of graphene materials is also reported and discussed. Finally, this review presents mechanistic aspects of graphene toxicity in biol. systems. More detailed studies aiming to investigate the toxicity of graphene-based materials and to properly assoc. the biol. phenomenon with their chem., structural, and morphol. variations that result from several synthetic and processing possibilities are needed. Knowledge about graphene-based materials could ensure the safe application of this versatile material. Consequently, the focus of this review is to provide a source of inspiration for new nanotoxicol. approaches for graphene-based materials.
], [CAS], Google Scholar336https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2cXitFKjsA%253D%253D&md5=2cd380d9e3b577a6208e7fc694abd2c6Nanotoxicity of Graphene and Graphene OxideSeabra, Amedea B.; Paula, Amauri J.; de Lima, Renata; Alves, Oswaldo L.; Duran, NelsonChemical Research in Toxicology (2014), 27 (2), 159-168CODEN: CRTOEC; ISSN:0893-228X. (American Chemical Society)A review. Graphene and its derivs. are promising candidates for important biomedical applications because of their versatility. The prospective use of graphene-based materials in a biol. context requires a detailed comprehension of the toxicity of these materials. Moreover, due to the expanding applications of nanotechnol., human and environmental exposures to graphene-based nanomaterials are likely to increase in the future. Because of the potential risk factors assocd. with the manuf. and use of graphene-related materials, the no. of nanotoxicol. studies of these compds. has been increasing rapidly in the past decade. These studies have researched the effects of the nanostructural/biol. interactions on different organizational levels of the living system, from biomols. to animals. This review discusses recent results based on in vitro and in vivo cytotoxicity and genotoxicity studies of graphene-related materials and critically examines the methodologies employed to evaluate their toxicities. The environmental impact from the manipulation and application of graphene materials is also reported and discussed. Finally, this review presents mechanistic aspects of graphene toxicity in biol. systems. More detailed studies aiming to investigate the toxicity of graphene-based materials and to properly assoc. the biol. phenomenon with their chem., structural, and morphol. variations that result from several synthetic and processing possibilities are needed. Knowledge about graphene-based materials could ensure the safe application of this versatile material. Consequently, the focus of this review is to provide a source of inspiration for new nanotoxicol. approaches for graphene-based materials. - 337Costa, P. M.; Fadeel, B. Emerging Systems Biology Approaches in Nanotoxicology: Towards a Mechanism-Based Understanding of Nanomaterial Hazard and Risk. Toxicol. Appl. Pharmacol. 2016, 299, 101– 111, DOI: 10.1016/j.taap.2015.12.014[Crossref], [PubMed], [CAS], Google Scholar337https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC28Xhtlemsg%253D%253D&md5=276c63c57002fab03d0a710756898c4bEmerging systems biology approaches in nanotoxicology: Towards a mechanism-based understanding of nanomaterial hazard and riskCosta, Pedro M.; Fadeel, BengtToxicology and Applied Pharmacology (2016), 299 (), 101-111CODEN: TXAPA9; ISSN:0041-008X. (Elsevier Inc.)Engineered nanomaterials are being developed for a variety of technol. applications. However, the increasing use of nanomaterials in society has led to concerns about their potential adverse effects on human health and the environment. During the first decade of nanotoxicol. research, the realization has emerged that effective risk assessment of the multitudes of new nanomaterials would benefit from a comprehensive understanding of their toxicol. mechanisms, which is difficult to achieve with traditional, low-throughput, single end-point oriented approaches. Therefore, systems biol. approaches are being progressively applied within the nano(eco)toxicol. sciences. This novel paradigm implies that the study of biol. systems should be integrative resulting in quant. and predictive models of nanomaterial behavior in a biol. system. To this end, global 'omics' approaches with which to assess changes in genes, proteins, metabolites, etc. are deployed allowing for computational modeling of the biol. effects of nanomaterials. Here, we highlight omics and systems biol. studies in nanotoxicol., aiming towards the implementation of a systems nanotoxicol. and mechanism-based risk assessment of nanomaterials.
- 338Nel, A.; Xia, T.; Meng, H.; Wang, X.; Lin, S.; Ji, Z.; Zhang, H. Nanomaterial Toxicity Testing in the 21st Century: Use of a Predictive Toxicological Approach and High-Throughput Screening. Acc. Chem. Res. 2013, 46, 607– 621, DOI: 10.1021/ar300022h[ACS Full Text
 ], [CAS], Google Scholar338https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC38Xot1Olt78%253D&md5=d456ce272e7dcb58fc59450fb4fb991eNanomaterial Toxicity Testing in the 21st Century: Use of a Predictive Toxicological Approach and High-Throughput ScreeningNel, Andre; Xia, Tian; Meng, Huan; Wang, Xiang; Lin, Sijie; Ji, Zhaoxia; Zhang, HaiyuanAccounts of Chemical Research (2013), 46 (3), 607-621CODEN: ACHRE4; ISSN:0001-4842. (American Chemical Society)A review. The prodn. of engineered nanomaterials (ENMs) is a scientific breakthrough in material design and the development of new consumer products. While the successful implementation of nanotechnol. is important for the growth of the global economy, the authors also need to consider the possible environmental health and safety (EHS) impact as a result of the novel physicochem. properties that could generate hazardous biol. outcomes. To assess ENM hazard, reliable and reproducible screening approaches are needed to test the basic materials as well as nanoenabled products. A platform is required to investigate the potentially endless no. of biophysicochem. interactions at the nano/bio interface, in response to which the authors have developed a predictive toxicol. approach. The authors define a predictive toxicol. approach as the use of mechanisms-based high-throughput screening in vitro to make predictions about the physicochem. properties of ENMs that may lead to the generation of pathol. or disease outcomes in vivo. The in vivo results are used to validate and improve the in vitro high-throughput screening (HTS) and to establish structure-activity relationships (SARs) that allow hazard ranking and modeling by an appropriate combination of in vitro and in vivo testing. This notion is in agreement with the landmark 2007 report from the US National Academy of Sciences, "Toxicity Testing in the 21st Century: A Vision and a Strategy" (http://www.nap.edu/catalog.php?record_id=11970), which advocates increased efficiency of toxicity testing by transitioning from qual., descriptive animal testing to quant., mechanistic, and pathway-based toxicity testing in human cells or cell lines using high-throughput approaches. Accordingly, the authors have implemented HTS approaches to screen compositional and combinatorial ENM libraries to develop hazard ranking and structure-activity relationships that can be used for predicting in vivo injury outcomes. This predictive approach allows the bulk of the screening anal. and high-vol. data generation to be carried out in vitro, following which limited, but crit., validation studies are carried out in animals or whole organisms. Risk redn. in the exposed human or environmental populations can then focus on limiting or avoiding exposures that trigger these toxicol. responses as well as implementing safer design of potentially hazardous ENMs. In this Account, the authors review the tools required for establishing predictive toxicol. paradigms to assess inhalation and environmental toxicol. scenarios through the use of compositional and combinatorial ENM libraries, mechanism-based HTS assays, hazard ranking, and development of nano-SARs. The authors will discuss the major injury paradigms that have emerged based on specific ENM properties, as well as describing the safer design of ZnO nanoparticles based on characterization of dissoln. chem. as a major predictor of toxicity.
], [CAS], Google Scholar338https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC38Xot1Olt78%253D&md5=d456ce272e7dcb58fc59450fb4fb991eNanomaterial Toxicity Testing in the 21st Century: Use of a Predictive Toxicological Approach and High-Throughput ScreeningNel, Andre; Xia, Tian; Meng, Huan; Wang, Xiang; Lin, Sijie; Ji, Zhaoxia; Zhang, HaiyuanAccounts of Chemical Research (2013), 46 (3), 607-621CODEN: ACHRE4; ISSN:0001-4842. (American Chemical Society)A review. The prodn. of engineered nanomaterials (ENMs) is a scientific breakthrough in material design and the development of new consumer products. While the successful implementation of nanotechnol. is important for the growth of the global economy, the authors also need to consider the possible environmental health and safety (EHS) impact as a result of the novel physicochem. properties that could generate hazardous biol. outcomes. To assess ENM hazard, reliable and reproducible screening approaches are needed to test the basic materials as well as nanoenabled products. A platform is required to investigate the potentially endless no. of biophysicochem. interactions at the nano/bio interface, in response to which the authors have developed a predictive toxicol. approach. The authors define a predictive toxicol. approach as the use of mechanisms-based high-throughput screening in vitro to make predictions about the physicochem. properties of ENMs that may lead to the generation of pathol. or disease outcomes in vivo. The in vivo results are used to validate and improve the in vitro high-throughput screening (HTS) and to establish structure-activity relationships (SARs) that allow hazard ranking and modeling by an appropriate combination of in vitro and in vivo testing. This notion is in agreement with the landmark 2007 report from the US National Academy of Sciences, "Toxicity Testing in the 21st Century: A Vision and a Strategy" (http://www.nap.edu/catalog.php?record_id=11970), which advocates increased efficiency of toxicity testing by transitioning from qual., descriptive animal testing to quant., mechanistic, and pathway-based toxicity testing in human cells or cell lines using high-throughput approaches. Accordingly, the authors have implemented HTS approaches to screen compositional and combinatorial ENM libraries to develop hazard ranking and structure-activity relationships that can be used for predicting in vivo injury outcomes. This predictive approach allows the bulk of the screening anal. and high-vol. data generation to be carried out in vitro, following which limited, but crit., validation studies are carried out in animals or whole organisms. Risk redn. in the exposed human or environmental populations can then focus on limiting or avoiding exposures that trigger these toxicol. responses as well as implementing safer design of potentially hazardous ENMs. In this Account, the authors review the tools required for establishing predictive toxicol. paradigms to assess inhalation and environmental toxicol. scenarios through the use of compositional and combinatorial ENM libraries, mechanism-based HTS assays, hazard ranking, and development of nano-SARs. The authors will discuss the major injury paradigms that have emerged based on specific ENM properties, as well as describing the safer design of ZnO nanoparticles based on characterization of dissoln. chem. as a major predictor of toxicity. - 339Fadeel, B.; Farcal, L.; Hardy, B.; Vázquez-Campos, S.; Hristozov, D.; Marcomini, A.; Lynch, I.; Valsami-Jones, E.; Alenius, H.; Savolainen, K. Advanced Tools for the Safety Assessment of Nanomaterials. Nat. Nanotechnol. 2018, 13, 537– 543, DOI: 10.1038/s41565-018-0185-0[Crossref], [PubMed], [CAS], Google Scholar339https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC1cXhtlSjsrnP&md5=54220c1454805f6138590193f1b9e7b5Advanced tools for the safety assessment of nanomaterialsFadeel, Bengt; Farcal, Lucian; Hardy, Barry; Vazquez-Campos, Socorro; Hristozov, Danail; Marcomini, Antonio; Lynch, Iseult; Valsami-Jones, Eugenia; Alenius, Harri; Savolainen, KaiNature Nanotechnology (2018), 13 (7), 537-543CODEN: NNAABX; ISSN:1748-3387. (Nature Research)Engineered nanomaterials (ENMs) have tremendous potential to produce beneficial technol. impact in numerous sectors in society. Safety assessment is, of course, of paramount importance. However, the myriad variations of ENM properties makes the identification of specific features driving toxicity challenging. At the same time, reducing animal tests by introducing alternative and/or predictive in vitro and in silico methods has become a priority. It is important to embrace these new advances in the safety assessment of ENMs. Indeed, remarkable progress has been made in recent years with respect to mechanism-based hazard assessment of ENMs, including systems biol. approaches as well as high-throughput screening platforms, and new tools are also emerging in risk assessment and risk management for humans and the environment across the whole life-cycle of nano-enabled products. Here, we highlight some of the key advances in the hazard and risk assessment of ENMs.
- 340Brockmeier, E. K.; Hodges, G.; Hutchinson, T. H.; Butler, E.; Hecker, M.; Tollefsen, K. E.; Garcia-Reyero, N.; Kille, P.; Becker, D.; Chipman, K.; Colbourne, J.; Collette, T. W.; Cossins, A.; Cronin, M.; Graystock, P.; Gutsell, S.; Knapen, D.; Katsiadaki, I.; Lange, A.; Marshall, S. The Role of Omics in the Application of Adverse Outcome Pathways for Chemical Risk Assessment. Toxicol. Sci. 2017, 158, 252– 262, DOI: 10.1093/toxsci/kfx097[Crossref], [PubMed], [CAS], Google Scholar340https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC1cXjt1WrtLc%253D&md5=9a21c5896929bf796db4ff9dbb04fd98The role of omics in the application of adverse outcome pathways for chemical risk assessmentBrockmeier, Erica K.; Hodges, Geoff; Hutchinson, Thomas H.; Butler, Emma; Hecker, Markus; Tollefsen, Knut Erik; Garcia-Reyero, Natalia; Kille, Peter; Becker, Dorthe; Chipman, Kevin; Colbourne, John; Collette, Timothy W.; Cossins, Andrew; Cronin, Mark; Graystock, Peter; Gutsell, Steve; Knapen, Dries; Katsiadaki, Ioanna; Lange, Anke; Marshall, Stuart; Owen, Stewart F.; Perkins, Edward J.; Plaistow, Stewart; Schroeder, Anthony; Taylor, Daisy; Viant, Mark; Ankley, Gerald; Falciani, FrancescoToxicological Sciences (2017), 158 (2), 252-262CODEN: TOSCF2; ISSN:1096-0929. (Oxford University Press)A review. In conjunction with the second International Environmental Omics Symposium (iEOS) conference, held at the University of Liverpool (United Kingdom) in Sept. 2014, a workshop was held to bring together experts in toxicol. and regulatory science from academia, government and industry. The purpose of the workshop was to review the specific roles that high-content omics datasets (eg, transcriptomics, metabolomics, lipidomics, and proteomics) can hold within the adverse outcome pathway (AOP) framework for supporting ecol. and human health risk assessments. In light of the growing no. of examples of the application of omics data in the context of ecol. risk assessment, we considered how omics datasets might continue to support the AOP framework. In particular, the role of omics in identifying potential AOP mol. initiating events and providing supportive evidence of key events at different levels of biol. organization and across taxonomic groups was discussed. Areas with potential for short and medium-term breakthroughs were also discussed, such as providing mechanistic evidence to support chem. read-across, providing wt. of evidence information for mode of action assignment, understanding biol. networks, and developing robust extrapolations of species-sensitivity. Key challenges that need to be addressed were considered, including the need for a cohesive approach towards exptl. design, the lack of a mutually agreed framework to quant. link genes and pathways to key events, and the need for better interpretation of chem. induced changes at the mol. level. This article was developed to provide an overview of ecol. risk assessment process and a perspective on how high content mol.-level datasets can support the future of assessment procedures through the AOP framework.
- 341Wittwehr, C.; Aladjov, H.; Ankley, G.; Byrne, H. J.; de Knecht, J.; Heinzle, E.; Klambauer, G.; Landesmann, B.; Luijten, M.; MacKay, C.; Maxwell, G.; Meek, M. E.; Paini, A.; Perkins, E.; Sobanski, T.; Villeneuve, D.; Waters, K. M.; Whelan, M. How Adverse Outcome Pathways Can Aid the Development and Use of Computational Prediction Models for Regulatory Toxicology. Toxicol. Sci. 2017, 155, 326– 336, DOI: 10.1093/toxsci/kfw207[Crossref], [PubMed], [CAS], Google Scholar341https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC1cXhsFajsL0%253D&md5=2ee63942f5aa24b407e87aae8e917259How adverse outcome pathways can aid the development and use of computational prediction models for regulatory toxicologyWittwehr, Clemens; Aladjov, Hristo; Ankley, Gerald; Byrne, Hugh J.; de Knecht, Joop; Heinzle, Elmar; Klambauer, Gunter; Landesmann, Brigitte; Luijten, Mirjam; MacKay, Cameron; Maxwell, Gavin; Meek, M. E. Bette; Paini, Alicia; Perkins, Edward; Sobanski, Tomasz; Villeneuve, Dan; Waters, Katrina M.; Whelan, MauriceToxicological Sciences (2017), 155 (2), 326-336CODEN: TOSCF2; ISSN:1096-0929. (Oxford University Press)A review. Efforts are underway to transform regulatory toxicol. and chem. safety assessment from a largely empirical science based on direct observation of apical toxicity outcomes in whole organism toxicity tests to a predictive one in which outcomes and risk are inferred from accumulated mechanistic understanding. The adverse outcome pathway (AOP) framework provides a systematic approach for organizing knowledge that may support such inference. Likewise, computational models of biol. systems at various scales provide another means and platform to integrate current biol. understanding to facilitate inference and extrapolation. We argue that the systematic organization of knowledge into AOP frameworks can inform and help direct the design and development of computational prediction models that can further enhance the utility of mechanistic and in silico data for chem. safety assessment. This concept was explored as part of a workshop on AOP-Informed Predictive Modeling Approaches for Regulatory Toxicol. held Sept. 24-25, 2015. Examples of AOP-informed model development and its application to the assessment of chems. for skin sensitization and multiple modes of endocrine disruption are provided. The role of problem formulation, not only as a crit. phase of risk assessment, but also as guide for both AOP and complementary model development is described. Finally, a proposal for actively engaging the modeling community in AOP-informed computational model development is made. The contents serve as a vision for how AOPs can be leveraged to facilitate development of computational prediction models needed to support the next generation of chem. safety assessment.
- 342Worth, A.; Aschberger, K.; Bofill, D. A.; Bessems, J.; Gerloff, K.; Graepel, R.; Joossens, E.; Lamon, L.; Palosaari, T.; Richarz, A. Evaluation of the Availability and Applicability of Computational Approaches in the Safety Assessment of Nanomaterials Final Report of the Nanocomput Project. JRC Sci. Technol. Report. 2017, DOI: 10.2760/248139
- 343Burello, E. Review of (Q)SAR Models for Regulatory Assessment of Nanomaterials Risks. NanoImpact 2017, 8, 48– 58, DOI: 10.1016/j.impact.2017.07.002
- 344Grosse, Y.; Loomis, D.; Guyton, K. Z.; Lauby-Secretan, B.; El Ghissassi, F.; Bouvard, V.; Benbrahim-Tallaa, L.; Guha, N.; Scoccianti, C.; Mattock, H.; Straif, K. Carcinogenicity of Fluoro-Edenite, Silicon Carbide Fibres and Whiskers, and Carbon Nanotubes. Lancet Oncol. 2014, 15, 1427– 1428, DOI: 10.1016/S1470-2045(14)71109-X[Crossref], [PubMed], [CAS], Google Scholar344https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC2cXhvVGks7jP&md5=e21e58269ad7cb899273cf43d860ae69Carcinogenicity of fluoro-edenite, silicon carbide fibres and whiskers, and carbon nanotubesGrosse, Yann; Loomis, Dana; Guyton, Kathryn Z.; Lauby-Secretan, Beatrice; El Ghissassi, Fatiha; Bouvard, Veronique; Benbrahim-Tallaa, Lamia; Guha, Neela; Scoccianti, Chiara; Mattock, Heidi; Straif, KurtLancet Oncology (2014), 15 (13), 1427-1428CODEN: LOANBN; ISSN:1470-2045. (Elsevier Ltd.)A review. This article focuses about the carcinogenicity of fluoro-edenite, silicon carbide fibers and whiskers, and carbon nanotubes including single-walled (SWCNTs) and multi-walled(MWCNTs) types. It also discusses about MWCNTs, SWCNTs induced genetic lesions like DNA strand breaks, oxidized DNA bases, mutations, micronucleus formation, and chromosomal aberrations in rodents and in cultured human lung or mesothelial cells. The authors concluded that fibrous silicon carbide is possibly carcinogenic to humans (Group 2B) based on limited evidence in humans that it causes lung cancer, and SWCNTs and MWCNTs excluding MWCNT-7 were categorized as not classifiable as to their carcinogenicity to humans (Group 3).
- 345Kurapati, R.; Mukherjee, S. P.; Martín, C.; Bepete, G.; Vázquez, E.; Pénicaud, A.; Fadeel, B.; Bianco, A. Degradation of Single-Layer and Few-Layer Graphene by Neutrophil Myeloperoxidase. Angew. Chem., Int. Ed. 2018, 57, 11722– 11727, DOI: 10.1002/anie.201806906[Crossref], [CAS], Google Scholar345https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC1cXhsVWhurvF&md5=e271ca63513cd7a71ffe382716bf2a53Degradation of single-layer and few-layer graphene by neutrophil myeloperoxidaseKurapati, Rajendra; Mukherjee, Sourav P.; Martin, Cristina; Bepete, George; Vazquez, Ester; Penicaud, Alain; Fadeel, Bengt; Bianco, AlbertoAngewandte Chemie, International Edition (2018), 57 (36), 11722-11727CODEN: ACIEF5; ISSN:1433-7851. (Wiley-VCH Verlag GmbH & Co. KGaA)Biodegradability of graphene is one of the fundamental parameters detg. the fate of this material in vivo. Two types of aq. dispersible graphene, corresponding to single-layer (SLG) and few-layer graphene (FLG), devoid of either chem. functionalization or stabilizing surfactants, were subjected to biodegrdn. by human myeloperoxidase (hMPO) mediated catalysis. Graphene biodegrdn. was also studied in the presence of activated, degranulating human neutrophils. The degrdn. of both FLG and SLG sheets was confirmed by Raman spectroscopy and electron microscopy analyses, leading to the conclusion that highly dispersed pristine graphene is not biopersistent.
- 346Kurapati, R.; Kostarelos, K.; Prato, M.; Bianco, A. Biomedical Uses for 2D Materials Beyond Graphene: Current Advances and Challenges Ahead. Adv. Mater. 2016, 28, 6052– 6074, DOI: 10.1002/adma.201506306[Crossref], [PubMed], [CAS], Google Scholar346https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC28Xms1KrtLY%253D&md5=00d6a23a34be14c124c3e2ad6095a815Biomedical Uses for 2D Materials Beyond Graphene: Current Advances and Challenges AheadKurapati, Rajendra; Kostarelos, Kostas; Prato, Maurizio; Bianco, AlbertoAdvanced Materials (Weinheim, Germany) (2016), 28 (29), 6052-6074CODEN: ADVMEW; ISSN:0935-9648. (Wiley-VCH Verlag GmbH & Co. KGaA)Currently, a broad interdisciplinary research effort is pursued on biomedical applications of 2D materials (2DMs) beyond graphene, due to their unique physicochem. and electronic properties. The discovery of new 2DMs is driven by the diverse chem. compns. and tuneable characteristics offered. Researchers are increasingly attracted to exploit those as drug delivery systems, highly efficient photothermal modalities, multimodal therapeutics with non-invasive diagnostic capabilities, biosensing, and tissue engineering. A crucial limitation of some of the 2DMs is their moderate colloidal stability in aq. media. In addn., the lack of suitable functionalization strategies should encourage the exploration of novel chem. methodologies with that purpose. Moreover, the clin. translation of these emerging materials will require undertaking of fundamental research on biocompatibility, toxicol. and biopersistence in the living body as well as in the environment. Here, a thorough account of the biomedical applications using 2DMs explored today is given.
- 347Guiney, L. M.; Wang, X.; Xia, T.; Nel, A. E.; Hersam, M. C. Assessing and Mitigating the Hazard Potential of Two-Dimensional Materials. ACS Nano 2018, 12, 6360– 6377, DOI: 10.1021/acsnano.8b02491[ACS Full Text
 ], [CAS], Google Scholar347https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC1cXhtFSrtLnN&md5=b7846c56dbaf5d3315e2c113ea66efabAssessing and Mitigating the Hazard Potential of Two-Dimensional MaterialsGuiney, Linda M.; Wang, Xiang; Xia, Tian; Nel, Andre E.; Hersam, Mark C.ACS Nano (2018), 12 (7), 6360-6377CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)The family of two-dimensional (2D) materials is comprised of a continually expanding palette of unique compns. and properties with potential applications in electronics, optoelectronics, energy capture and storage, catalysis, and nanomedicine. To accelerate the implementation of 2D materials in widely disseminated technologies, human health and environmental implications need to be addressed. While extensive research has focused on assessing the toxicity and environmental fate of graphene and related carbon nanomaterials, the potential hazards of other 2D materials have only recently begun to be explored. Herein, the toxicity and environmental fate of postcarbon 2D materials, such as transition metal dichalcogenides, hexagonal boron nitride, and black phosphorus, are reviewed as a function of their prepn. methods and surface functionalization. Specifically, we delineate how the hazard potential of 2D materials is directly related to structural parameters and physicochem. properties and how exptl. design is crit. to the accurate elucidation of the underlying toxicol. mechanisms. Finally, a multidisciplinary approach for streamlining the hazard assessment of emerging 2D materials is outlined, thereby providing a pathway for accelerating their safe use in a range of technol. relevant contexts.
], [CAS], Google Scholar347https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC1cXhtFSrtLnN&md5=b7846c56dbaf5d3315e2c113ea66efabAssessing and Mitigating the Hazard Potential of Two-Dimensional MaterialsGuiney, Linda M.; Wang, Xiang; Xia, Tian; Nel, Andre E.; Hersam, Mark C.ACS Nano (2018), 12 (7), 6360-6377CODEN: ANCAC3; ISSN:1936-0851. (American Chemical Society)The family of two-dimensional (2D) materials is comprised of a continually expanding palette of unique compns. and properties with potential applications in electronics, optoelectronics, energy capture and storage, catalysis, and nanomedicine. To accelerate the implementation of 2D materials in widely disseminated technologies, human health and environmental implications need to be addressed. While extensive research has focused on assessing the toxicity and environmental fate of graphene and related carbon nanomaterials, the potential hazards of other 2D materials have only recently begun to be explored. Herein, the toxicity and environmental fate of postcarbon 2D materials, such as transition metal dichalcogenides, hexagonal boron nitride, and black phosphorus, are reviewed as a function of their prepn. methods and surface functionalization. Specifically, we delineate how the hazard potential of 2D materials is directly related to structural parameters and physicochem. properties and how exptl. design is crit. to the accurate elucidation of the underlying toxicol. mechanisms. Finally, a multidisciplinary approach for streamlining the hazard assessment of emerging 2D materials is outlined, thereby providing a pathway for accelerating their safe use in a range of technol. relevant contexts. - 348Faria, M.; Björnmalm, M.; Thurecht, K. J.; Kent, S. J.; Parton, R. G.; Kavallaris, M.; Johnston, A. P. R.; Gooding, J. J.; Corrie, S. R.; Boyd, B. J.; Thordarson, P.; Whittaker, A. K.; Stevens, M. M.; Prestidge, C. A.; Porter, C. J. H.; Parak, W. J.; Davis, T. P.; Crampin, E. J.; Caruso, F. Minimum Information Reporting in Bio–nano Experimental Literature. Nat. Nanotechnol. 2018, 13, 777– 785, DOI: 10.1038/s41565-018-0246-4[Crossref], [PubMed], [CAS], Google Scholar348https://chemport.cas.org/services/resolver?origin=ACS&resolution=options&coi=1%3ACAS%3A528%3ADC%252BC1cXhs1KnsrvP&md5=8df276a875711e35adde271273eafb1eMinimum information reporting in bio-nano experimental literatureFaria, Matthew; Bjornmalm, Mattias; Thurecht, Kristofer J.; Kent, Stephen J.; Parton, Robert G.; Kavallaris, Maria; Johnston, Angus P. R.; Gooding, J. Justin; Corrie, Simon R.; Boyd, Ben J.; Thordarson, Pall; Whittaker, Andrew K.; Stevens, Molly M.; Prestidge, Clive A.; Porter, Christopher J. H.; Parak, Wolfgang J.; Davis, Thomas P.; Crampin, Edmund J.; Caruso, FrankNature Nanotechnology (2018), 13 (9), 777-785CODEN: NNAABX; ISSN:1748-3387. (Nature Research)Studying the interactions between nanoengineered materials and biol. systems plays a vital role in the development of biol. applications of nanotechnol. and the improvement of our fundamental understanding of the bio-nano interface. A significant barrier to progress in this multidisciplinary area is the variability of published literature with regards to characterizations performed and exptl. details reported. Here, we suggest a 'min. information std.' for exptl. literature investigating bio-nano interactions. This std. consists of specific components to be reported, divided into three categories: material characterization, biol. characterization and details of exptl. protocols. Our intention is for these proposed stds. to improve reproducibility, increase quant. comparisons of bio-nano materials, and facilitate meta analyses and in silico modeling.
Supporting Information
Supporting Information
ARTICLE SECTIONSThe Supporting Information is available free of charge on the ACS Publications website at DOI: 10.1021/acsnano.8b04758.
Five figures and five tables describing 3D plots to illustrate the range of GBMs that have been subjected to toxicological studies (PDF)
Terms & Conditions
Most electronic Supporting Information files are available without a subscription to ACS Web Editions. Such files may be downloaded by article for research use (if there is a public use license linked to the relevant article, that license may permit other uses). Permission may be obtained from ACS for other uses through requests via the RightsLink permission system: http://pubs.acs.org/page/copyright/permissions.html.