Abstrakt
Sztuczne nawożenie oceaniczne (AOF) ma na celu bezpieczne stymulowanie wzrostu fitoplanktonu w oceanie i zwiększenie sekwestracji węgla. Skuteczność sekwestracji węgla AOF wydaje się niższa niż naturalne procesy nawożenia oceanów, głównie ze względu na niską biodostępność dodanych składników odżywczych, a także niskie wskaźniki eksportu biomasy produkowanej przez AOF do głębokiego oceanu. Tutaj badamy potencjalne zastosowanie zmodyfikowanych nanocząstek (EPS) w celu przezwyciężenia tych problemów. Dane ze 123 badań pokazują, że niektóre EPS mogą zwiększać wzrost fitoplanktonu w stężeniach niższych niż te, które mogą być toksyczne w ekosystemach morskich. EPS mogą również wydłużyć okres kwitnienia, zwiększyć agregację fitoplanktonu i eksport dwutlenku węgla oraz zająć się wtórnymi czynnikami ograniczającymi w AOF. Ocena cyklu życia i analizy kosztów sugerują, że CO netto2 wychwytywanie jest możliwe dla żelaza, SiO2 i Al2O3 EPS o kosztach 2–5 razy wyższych niż koszty konwencjonalnych AOF, podczas gdy zwiększenie efektywności AOF dzięki EPS powinno znacznie zwiększyć CO netto2 Uchwyć i zmniejszyć te koszty. W związku z tym AOF oparty na EPS może być ważnym elementem strategii łagodzenia skutków globalnego ocieplenia.
Główny
Najnowsze międzynarodowe scenariusze naprawy klimatu opierają się na masowym usuwaniu dwutlenku węgla (CDR) z atmosfery, oprócz ostrego CO2 redukcja emisji, aby utrzymać globalne ocieplenie na poziomie poniżej 2 °C (ref. 1,2). Jedno z podejść CDR, sztuczne nawożenie oceanów (AOF), obejmuje celowe dodanie ograniczającego składnika odżywczego (zazwyczaj żelaza) w celu stymulowania wzrostu fitoplanktonu i CO2 absorpcja w oceanach (rys. 1a)2,3,4,5,6,7,8,9. Ułamek stymulowanej biomasy fitoplanktonu następnie tonie, eksportując węgiel do głębokiego oceanu i potencjalnie na dno oceanu, przez setki do tysięcy lat.
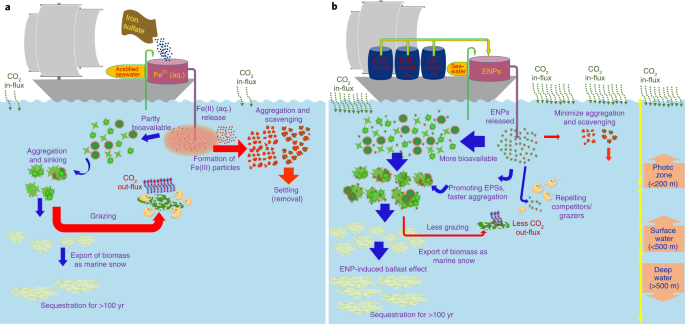
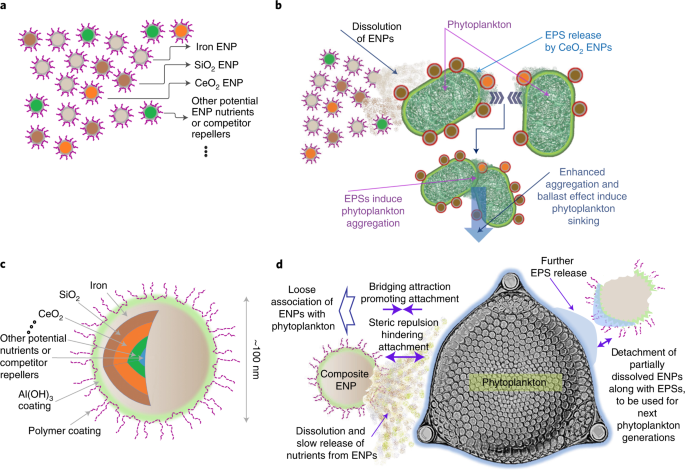
Schematy nawożenia oceanów oparte na konwencjonalnym podejściu wykorzystującym siarczan żelaza (a) i nowe podejście z EPS zaproponowane w niniejszym opracowaniu (b). Po rozpuszczeniu siarczanu żelaza w zakwaszonej wodzie morskiej na pokładzie statku, roztwór jest uwalniany do oceanu, gdzie rozpuszczalne żelazo (Fe(II) (aq.)) może być częściowo wykorzystane przez fitoplankton i spowodować zakwit, pobierając CO2 z atmosfery. Cząstki stałe pozostałe po zakwitach fitoplanktonu mogą następnie ulec agregacji, a następnie sedymentacji. Jeśli biomasa powstała w wyniku tego zakwitu dotrze do głębin morskich (na przykład >1000 m), może pochłaniać węgiel przez stulecia. Jednak cały ten proces może być utrudniony na etapie, gdy Fe(II) (aq.) jest uwalniany do wody morskiej przez tworzenie cząstek stałych żelaza (oksyhydr) tlenków, które mogą następnie agregować i osiadać poza strefą fotyczną zamiast być biodostępne dla fitoplanktonu. Proces ten może być również utrudniony przez niskie tempo produkcji i / lub niską szybkość osiadania biomasy w porównaniu z szybkością wypasu i remineralizacji. W b etap szybkiego usuwania dodanych składników odżywczych można zminimalizować poprzez zaprojektowanie powierzchni EPS, na przykład za pomocą powłoki polimerowej lub bimetalicznej. Może to spowodować, że dodane nanocząsteczkowe składniki odżywcze staną się bardziej biodostępne dla fitoplanktonu w dłuższym okresie i potencjalnie spowodują większy rozkwit niż w konwencjonalnym scenariuszu. EPS mogą również indukować uwalnianie EPS z komórek fitoplanktonu, co może zwiększać agregację i sedymentację fitoplanktonu, promować efekt balastu, a tym samym skutkować bardziej efektywnym eksportem ich biomasy do głębokiego oceanu.
Do tej pory przeprowadzono 13 eksperymentów terenowych wykorzystujących sztuczne dodawanie Fe2+ do oceanu ponad 25–300 km2 oprócz kilku badań terenowych monitorujących naturalne występowanie nawożenia oceanów żelazem4,6,10. Badania te wykazały, że chociaż znaczne zakwity fitoplanktonu mogą być stymulowane w większości sztucznych dodatków, ich skuteczność w CO2 Spadek jest znacznie mniejszy niż w przypadku naturalnie występującego nawożenia, na przykład poprzez osadzanie się pyłu ziemskiego w atmosferze6. Powolne tempo eksportu biomasy, zwłaszcza jeśli nie jest zwiększone w porównaniu ze wskaźnikami remineralizacji (tempo, w jakim węgiel organiczny jest przekształcany w CO2 przez bakterie), niweczą potencjalne korzyści z AOF. Remineralizacja może również prowadzić do zubożenia tlenu w wodach podpowierzchniowych oraz produkcji metanu i podtlenku azotu o wyższym współczynniku ocieplenia globalnego niż CO2 (sygn. 11). Niemniej jednak, wraz z coraz powszechniejszymi obawami opinii publicznej dotyczącymi skutków zmiany klimatu i potrzebą technologii emisji ujemnych, aby osiągnąć cele porozumienia paryskiego z 2015 r., ostatnio ponownie zainteresowano się AOF1,2,3,4,5.
Ze względu na stosunkowo dużą gęstość liczbową oraz bardzo dużą powierzchnię właściwą i dyfuzyjność, nanocząstki (1–100 nm) są prawdopodobnie biodostępne dla fitoplanktonu w oceanie12,13,14,15. Ważna rola naturalnie występujących nanocząstek została już ustalona w naturalnym nawożeniu oceanów12,13,14,16,17,18,19. Na przykład zaproponowano naturalne nanocząstki tlenku żelaza (tlenowodorotlenkowego) jako źródło biodostępnego żelaza w strumieniach z lodowców14,15, osady kontynentalne13, popioły wulkaniczne12 i emisje kominów hydrotermalnych19. Naturalne nanocząsteczki mogą również dostarczać innych składników odżywczych, takich jak fosfor16. Odkrycia te sugerują, że zastosowanie zmodyfikowanych nanocząstek (EPS) w AOF może prowadzić do pożądanej wydajności ze względu na ich nanocechy, które przypominają ich naturalne odpowiedniki. Ponadto możliwe jest zaprojektowanie EPS w celu złagodzenia wad obecnego podejścia AOF, a tym samym maksymalizacji ich skuteczności. Jeśli znaczna CO2 Wykorzystanie EPS może umożliwić zastosowanie tego podejścia jako technologii CDR w mniejszych skalach lub w określonych lokalizacjach, a tym samym rozwiać niektóre obawy dotyczące ryzyka geoinżynierii całego ekosystemu morskiego i dalszej "kradzieży składników odżywczych".
Zastosowania EPS w systemach środowiskowych na stosunkowo dużą skalę były szeroko badane w ciągu ostatnich dwóch dekad, takich jak nanoskalowe zawiesiny żelaza zerowartościowego (NZVI) stosowane do rekultywacji gleby / wód gruntowych20,21,22 oraz stosowanie różnych EPS w celu wzmocnienia zrównoważonego rolnictwa23 i akwakultura24,25. W remediacji gleby/wód gruntowych, pomimo początkowych wyzwań związanych z dostarczaniem EPS do stref źródeł zanieczyszczeń i obaw związanych z zagrożeniami EPS dla zasobów wody pitnej, technologia ta została już szeroko skomercjalizowana na całym świecie20.
Poniżej przedstawiamy możliwe możliwości EPS w zakresie przeciwdziałania niedogodnościom i zagrożeniom związanym z AOF. Ponadto szacujemy wpływ na środowisko i koszty ekonomiczne stosowania EPS dla AOF, przeprowadzając ocenę cyklu życia (LCA; Informacje uzupełniające, sekcja 1) oraz rachunek kosztów cyklu życia (LCC; Informacje uzupełniające, sekcja 2) oraz ocenić toksyczne i korzystne aspekty EPS dla ekosystemów morskich w oparciu o dane zebrane ze 123 badań wybranych spośród 265 recenzowanych badań.
Wyzwania związane z nawożeniem oceanów i rozwiązania nanotechnologiczne
Biodostępność i zwiększenie wzrostu fitoplanktonu
Nanocząstki metaliczne mogą być bardziej biodostępne dla fitoplanktonu niż formy rozpuszczalne ze względu na wyższe lokalne stężenia generowane wokół komórek fitoplanktonu26. Wynika to z powiązania EPS z powierzchniami komórek planktonowych, co może prowadzić do wyższego stężenia powierzchniowego EPS i produktów ich rozpuszczania, a tym samym do większego wychwytu biologicznego26. Żelazo dodane w postaci rozpuszczalnej w poprzednich eksperymentach AOF natychmiast utworzyło koloidalne tlenki żelaza (oksyhydr) i ostatecznie mikrometrowe cząstki lub agregaty, które prawdopodobnie zapadły się ze strefy fotycznej, zmniejszając biodostępność żelaza (ryc. 1a)4,14,17,18,27,28,29. EPS, ze względu na ich modyfikację powierzchni, rozwiążą ten problem (rys. 1b), wykorzystując polimery (na przykład karboksymetylocelulozę) lub metale (na przykład wodorotlenek glinu) do kontrolowania szybkości ich agregacji i rozpuszczania, zwłaszcza w krytycznym zakresie wielkości 10–100 nm, dostosowując w ten sposób ich funkcjonalność i trwałość w mediach środowiskowych20,21,30.
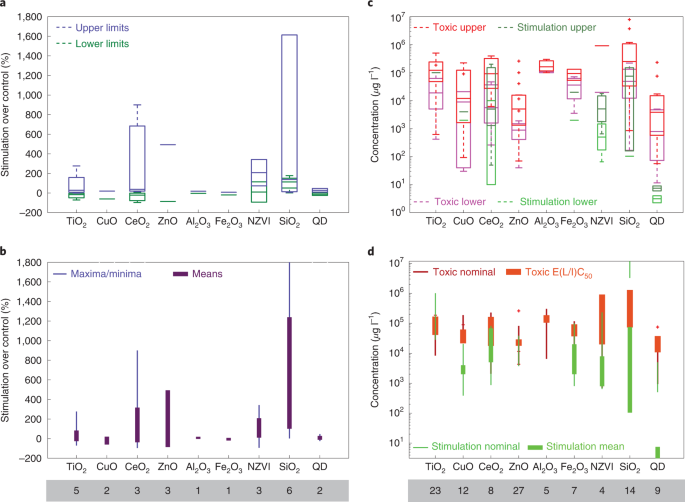
Liczne badania wykazały stymulujący wpływ ENP na wzrost glonów (ryc. 2a,b oraz tabela uzupełniająca 1). Znaczące zwiększenie populacji glonów można osiągnąć za pomocą NZVI, SiO2 i CeO2 ENP o średnim efekcie stymulacji (obfitość lub wzrost komórek) wzrosły o 35–756% w porównaniu z grupą kontrolną31,32,33,34. W szczególności rola NZVI w zwiększaniu wzrostu mikroalg morskich była porównywalna lub wyższa niż powszechnie stosowana EDTA-Fe przy stężeniach równomolowych 11,7 μM (ref. 31). Przypisano to podobnej lub wyższej biodostępności ENP, która może wiązać się z zewnątrzkomórkowymi substancjami polimerowymi (EPS) wokół komórki glonów, prowadząc do wychwytu ENP poprzez endocytozę31. Co ważne, tempo wzrostu glonów było podobne dla szerokiego zakresu stężeń NZVI (1,17–117 μM)31, ujawniając kolejną zaletę stosowania EPS: wzrost glonów jest mniej zależny od stężenia EPS w przeciwieństwie do znacznego wpływu stężenia w przypadku stosowania rozpuszczalnego żelaza35,36.
a, wykres ramkowy dolnej i górnej granicy stymulacji wzrostu w porównaniu z grupą kontrolną obserwowaną dla różnych EPS. QD, kropka kwantowa. b, Minimalne i maksymalne wartości tych samych danych (cienkie słupki) w porównaniu z wartościami średnimi (grube pręty). c, zakresy stężeń różnych EPS powodujących skutki toksyczne (toksyczność ostra lub przewlekła, w tym mediana skuteczna (EC50), śmiertelne (LC50) lub hamujące (IC50) w odniesieniu do różnych gatunków związanych z ekosystemami morskimi, takich jak fitoplankton, zooplankton, ryby i skorupiaki (purpurowe i czerwone) w porównaniu z zakresami stężeń powodującymi sprzyjanie wzrostowi glonów/fitoplanktonu (jasnozielone i ciemnozielone). d, Nominalne zakresy średnich stężeń badanych pod kątem toksyczności w różnych badaniach (cienkie pomarańczowe paski) oraz zakresy średnich stężeń toksycznych (EC50LC50 lub IC50, grube pomarańczowe paski) obserwowane dla różnych EPS w porównaniu z nominalnymi zakresami średnich stężeń badanych w badaniach stymulacji wzrostu glonów (cienkie zielone paski) ze średnimi zakresami stężeń skutkującymi stymulacją wzrostu (grube zielone paski). Liczby pod nazwą każdej EPS wskazują liczbę badań objętych zakresami danych. Dane stymulujące wzrost są związane z gatunkami glonów morskich (21% danych), gatunkami słodkowodnymi (33% danych) i gatunkami wspólnymi dla tych dwóch środowisk (46% danych). Szczegółowy zestaw danych i wykaz odniesień są dostępne w tabelach uzupełniających 1 i 6. Na każdym polu wykresów pola środkowy znak pokazuje medianę, a dolna i górna strona wskazują odpowiednio 25. i 75. percentyl. Znaczniki "+" wskazują poszczególne wartości odstające, a wąsy pokazują zakres danych nieodstających.
Jeśli chodzi o kwestię, czy stężenie dodanych EPS powinno być porównywalne ze stężeniami koloidów naturalnych, aby EPS były biodostępne, zauważamy, że ogólnie rzecz biorąc, to interakcje, a tym samym powinowactwo między gatunkami w roztworze (niezależnie od tego, czy są to gatunki jonowe, czy nanocząsteczkowe) i powierzchnie (w tym przypadku fitoplankton EPS) kontrolują biodostępność gatunków, a nie stężenia26,31. Nasz szacunek potencjalnego zakresu stężenia EPS dla AOF (jak opisano w informacjach uzupełniających, sekcja 5) wynosi ~1010–1014 cząstki na litr, które są podobne lub większe niż podane stężenia koloidów tła i nanocząstek w wodzie morskiej ~107–1012 cząstek na litr37,38. Ten zakres numerów ENP wynosi również ~800–1010 pomnożone potencjalne stężenie liczbowe produkowanego fitoplanktonu (4 × 102–4 × 108 cząstki na litr; Informacje uzupełniające, sekcja 5), sugerując, że dodane EPS nie są przyćmione przez koloidy otoczenia lub potencjalną liczbę fitoplanktonu powstałą podczas AOF.
Współograniczenie przez inne składniki odżywcze
Niepełny rozwój kwitnienia w kilku eksperymentach AOF częściowo przypisano wyczerpaniu drugorzędnych składników odżywczych, w szczególności współograniczaniu przez kwas krzemowy do wzrostu okrzemek4,6,39. Takiemu uszczupleniu wtórnych ograniczających składników pokarmowych można skutecznie rozwiązać w kontekście nanotechnologii poprzez zastosowanie mieszaniny EPS lub wszechstronnego nanokompozytu rdzeń-powłoka, jak pokazano na rys. 3. Wykazano już zwiększenie wzrostu komórek mikroalg w obecności krzemionkowych EPS (ryc. 2a,b). Nanocząstki kompozytowe zawierające wszystkie składniki odżywcze wymagane przez fitoplankton mogą być projektowane i wytwarzane w wydajnie zaprojektowanej architekturze w celu dostarczenia do fitoplanktonu (rys. 3c,d) w celu zminimalizowania całkowitej ilości masy składników odżywczych wymaganej dla systemu AOF na dużą skalę, zmniejszając w ten sposób niektóre z jego zagrożeń i skutków ubocznych. Takie wykorzystanie nanokompozytów dominuje obecnie w innych kontekstach nanotechnologii, takich jak remediacja środowiska, ulepszanie rolnictwa / akwakultury i biorafineria mikroalg21,24,25,40. Donoszono o współograniczaniu składników odżywczych fitoplanktonu przez mikroelementy metali śladowych, takie jak, kobalt, mangan i aluminium41,42, podczas gdy stymulacja wzrostu glonów w obecności ZnO i Al2O3 Zaobserwowano również EPS, co sugeruje, że EPS są obiecujące w rozwiązywaniu problemu współograniczania przez inne składniki odżywcze (ryc. 2a,b).
Dwa możliwe scenariusze, w których EPS mogą być stosowane w AOF, obejmują zastosowanie mieszaniny EPS z różnymi powłokami (a, b) oraz zastosowanie wszechstronnego nanokompozytu (c, d). Ogólnie rzecz biorąc, w odpowiedzi na EPS, komórki fitoplanktonu wytwarzają EPS, które mogą sprzyjać sterycznemu odpychaniu się do przyczepiania34, podczas gdy przyciąganie polimerów mostkujących i potencjalnie hydrofobowe przyciąganie63 mogą razem prowadzić do luźnego przylegania EPS do fitoplanktonu powierzchniowego EPS69. Ta ostatnia jest korzystna dla AOF, ponieważ może prowadzić do oderwania EPS od powierzchni komórki po częściowym wykorzystaniu, co może zapewnić dostępność dla następnych pokoleń fitoplanktonu. Oderwanie kompleksu ENP–EPS od komórek fitoplanktonu może również wynikać z dalszego wydalania EPS przez fitoplankton w obecności EPS47,64. W mieszanym scenariuszu EPS (a,b) nanocząstki, takie jak żelazne EPS, mogą dostarczać składniki odżywcze dla fitoplanktonu poprzez rozpuszczanie, jednocześnie promując wytwarzanie EPS, co może agregować komórki fitoplanktonu i zwiększać prędkość tonięcia. Niektóre EPS, takie jak SiO2, które mogą być zaprojektowane do interakcji z komórkami, mogą przyczepiać się do powierzchni komórki EPS i dodatkowo zwiększać ich szybkość tonięcia poprzez efekt balastu (b). W drugim scenariuszu (c,d) wielowarstwowe EPS rdzeń i powłoka są projektowane z grubościami różnych warstw zgodnie z ilością i czasem składników odżywczych wymaganych przez gatunki fitoplanktonu w momencie, gdy składnik pokarmowy staje się ograniczający (d). Wszystkie cząstki mogą być pokryte polimerami i/lub warstwami metalicznymi, takimi jak wodorotlenek glinu (Al(OH))3)30 w celu zminimalizowania przywiązania ENP–ENP poprzez tworzenie odpychania sterycznego lub ekranowanie przyciągających sił magnetycznych. Mogą one również kontrolować ich interakcje z komórkami, a także ich rozpuszczanie.
Ograniczenie światła
Ograniczenie światła zostało zaproponowane jako ważny czynnik zmniejszający skuteczność AOF4. W dziedzinie agrotechnologii stosowanie EPS, takich jak TiO2 i ZnO do liści wykazały zwiększoną absorpcję światła słonecznego i ogólnie zwiększoną wydajność fotosyntezy23. Korzystanie z CeO2 ENP, które są biokompatybilne z szeroką gamą mikroorganizmów, okazały się obiecujące w filtrowaniu szkodliwego światła ultrafioletowego i umożliwianiu absorpcji użytecznego światła widzialnego, chroniąc w ten sposób mikroalgi43,44. Chociaż może to nie dotyczyć bezpośrednio ograniczeń związanych z ogólnym spektrum światła w oceanach, takich jak Ocean Południowy, EPS, takie jak CeO2 Nanocząstki mogą nadal poprawiać efektywność wykorzystania światła przez fitoplankton. Ogólnie rzecz biorąc, ponieważ ENP mają mniejszy rozmiar niż długość fali światła widzialnego, mają one zwykle mniejszy efekt zacienienia niż większe cząstki odżywcze, takie jak tlenowodorotlenki Fe(III), które naturalnie powstają w konwencjonalnym AOF. Ponadto niewydolność światła utrudnia fotoredukcję koloidalnego Fe(III) do rozpuszczalnego Fe(II), a tym samym zmniejsza biodostępność żelaza do wychwytu fitoplanktonu29. To z kolei może przyspieszyć usuwanie żelaza w postaci cząstek stałych ze słupa wody. Z drugiej strony, potencjalnie dobrze rozproszone EPS są na ogół bezpośrednio biodostępne dla fitoplanktonu bez potrzeby dalszego rozpuszczania w warunkach ograniczających światło26,31,33.
Efektywność eksportu na głębiny morskie
Stosowanie EPS do AOF może również zwiększyć efektywność wywozu zgromadzonej biomasy fitoplanktonu. Pojedyncze komórki fitoplanktonu, zwłaszcza gatunki nieokrzemkowe i żywe komórki, mogą mieć gęstość niższą niż gęstość wody morskiej, zmniejszając ich potencjał tonięcia45. Szybkość tonięcia fitoplanktonu można zwiększyć, gdy materiały o większej gęstości są adsorbowane na komórkach lub włączane do agregatów w celu wywołania efektu balastu. Krzemionkowe ENP (w stężeniu 75 mg l−1) okazały się skuteczne w ułatwianiu sedymentacji i usuwania cyjanobakterii ze słupa wody46. Wychwyt krzemionki zwiększył gęstość cyjanobakterii i prędkość tonięcia poprzez tworzenie cyjanobakterii-SiO2 Kompleksy. Nawet 1% wzrost gęstości fitoplanktonu może podwoić prędkość tonięcia45. Oznacza to stosunek masy dodanej SiO2 ENP dla biomasy fitoplanktonu wytworzonej podczas kwitnienia może wynosić zaledwie 1:100, aby podwoić tempo eksportu biomasy poprzez efekt balastowy.
Innym ważnym czynnikiem wpływającym na eksport fitoplanktonu jest tendencja do ich agregacji. EPS fitoplanktonu morskiego ma kluczowe znaczenie dla tworzenia się śniegu morskiego, który jest uważany za kluczowy dla eksportu fitoplanktonu do głębin morskich47. Zastosowanie SiO2 i CeO2 Zaproponowano również EPS w celu ułatwienia usuwania wycieków ropy naftowej poprzez promowanie produkcji EPS przez fitoplankton morski, co prowadzi do zwiększonej agregacji i zatonięcia47. W związku z tym SiO2 EPS mogą nie tylko dotyczyć współograniczenia przez wiele składników pokarmowych, ale także mogą ułatwiać wywóz fitoplanktonu jako środka balastowego i promotora fitoplanktonu EPS. Bardziej efektywny eksport balastowej materii organicznej może zmniejszyć podpowierzchniową deoksygenację oraz produkcję metanu i podtlenku azotu spowodowaną remineralizacją słupa wody.
Długowieczność produkcji biomasy
Pasące się skorupiaki mogą skrócić żywotność kwitnienia fitoplanktonu i zmniejszyć wydajność AOF39,48,49. EPS mają możliwość ochrony rozwijającego się zakwitu poprzez odstraszanie pasących się i konkurentów, a może to być kontrolowane poprzez dostrajanie dawek różnych EPS rozważanych dla AOF. Eksperymenty mezokosmiczne wykazały, że EPS, takie jak CuNP i AuNP, po dodaniu w połączeniu ze składnikami odżywczymi (azotem i fosforem), mogą zwiększyć kontynuację kwitnienia o ponad 50 dni50, ze względu na niekorzystny wpływ EPS na konkurentów gatunków planktonowych. Ponadto ENP tlenku glinu wypaczyły selektywny wzór żywienia Daphnia w kierunku paszy dla glonów, która nie była narażona na ENP51.
Wielowarstwowe ENP rdzeniowo-skorupowe można zaprojektować z sekwencją warstw zgodnie z sekwencją ograniczeń mikroelementów i późniejszą presją wypasu podczas różnych etapów rozwoju i zatapiania fitoplanktonu (rys. 3c,d). Chroni to wewnętrzne warstwy wielowarstwowego ENP dla rdzenia-powłoki przed rozpuszczeniem, a tym samym rozcieńczeniem w wodzie morskiej, utrzymując produkcję biomasy w wodach powierzchniowych przez dłuższy czas przy niższej całkowitej masie dodanej substancji odżywczej. Wpływ rozcieńczenia na stężenie EPS jest mniejszy niż ich rozpuszczalnej postaci, ponieważ dyfuzyjność EPS w zakresie wielkości 10–100 nm (15,5 do 1,55 cm2 Yr−1 w temperaturze 25 °C) jest na ogół o jeden do dwóch rzędów wielkości mniejszy niż rozpuszczalny Fe2+ (222,8 cm2 Yr−1 w temperaturze 25 °C) w stanie spoczynku52.
Chociaż czynniki takie jak tonięcie biomasy, długowieczność kwitnienia fitoplanktonu i wielkość kruszywa mogą być równoważące i są obecnie przedmiotem trwających badań7,8,53, zdolności EPS do zwiększania wzrostu fitoplanktonu i promowania produkcji EPS (co zwiększa agregację komórek i eksport biomasy) są korzystne dla usuwania dwutlenku węgla. Konieczne są również dalsze badania w celu zrozumienia tych czynników towarzyszących w warunkach naturalnych i w obecności EPS.
Ogólnie rzecz biorąc, chociaż przyszłe badania mogą testować i opracowywać bardziej funkcjonalizowane hybrydowe EPS stworzone specjalnie dla systemów AOF oraz badać ich los i zagrożenia ekologiczne w oceanie, wśród obecnie stosowanych EPS są różni kandydaci, w tym NZVI, tlenek żelaza, SiO2, ZnO, CeO2Al2O3 i TiO2 nanocząstki, które mogą być istotne dla przyszłych zastosowań AOF (tabela 1).
LCA i LCC
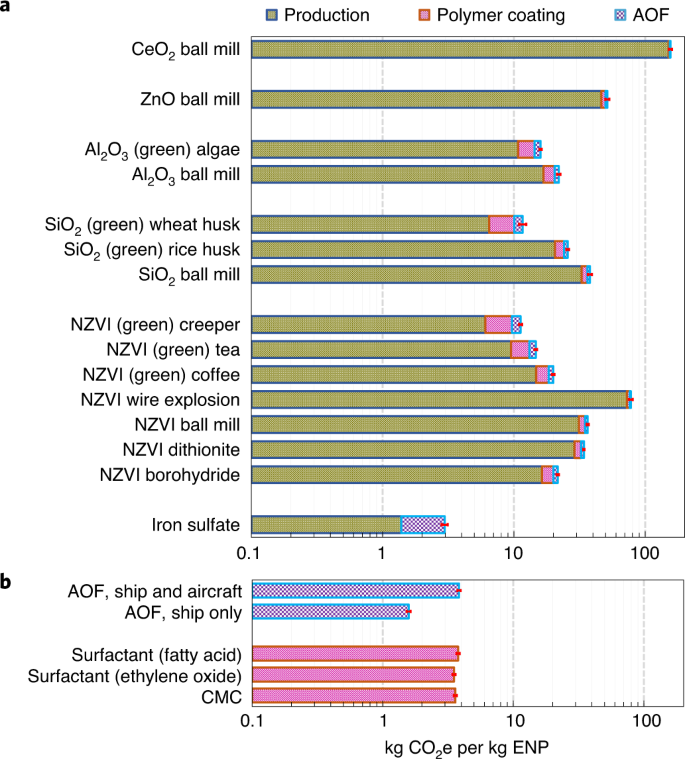
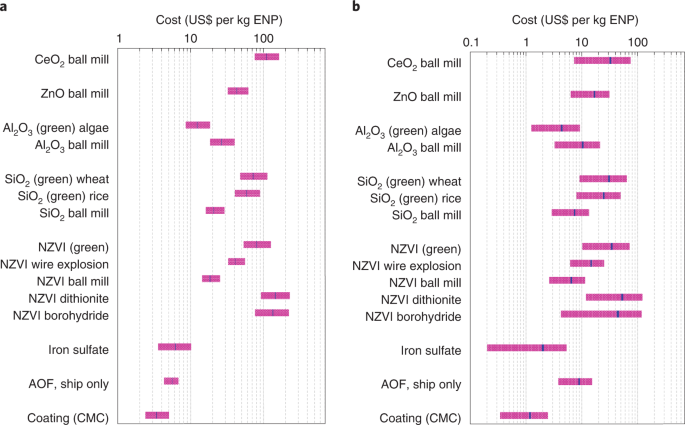
Trybunał przeprowadził analizę LCA i LCC dla kilku odpowiednich EPS (NZVI, SiO2Al2O3, ZnO i CeO2), ich powłoki polimerowe i działanie AOF (transport materiałów, dystrybucja w oceanie i monitorowanie późniejszych uderzeń). Rozważyliśmy szereg metod syntezy EPS, w tym chemiczne, mechaniczne i zielone (oparte na ekstraktach roślinnych54) (rys. 4 i 5, rys. uzupełniające. 1 oraz tabele uzupełniające 2–5). WSPÓŁ2-równoważny (CO2e) emisje na kg EPS dla wszystkich zaangażowanych procesów wynoszą średnio 38,3 kg (od 11,2 do 156 kg), czyli 13 razy (lub 4–53 razy) więcej niż w przypadku siarczanu żelaza tradycyjnie stosowanego w AOF (rys. 4a,b). Całkowity koszt tych procesów wynosi średnio 72 USD za kg EPS (21–153 USD; Figa. 5a). Liczby te będą mniejsze, jeśli weźmiemy pod uwagę tylko najlepsze metody syntezy dla NZVI, SiO2 i Al2O3 dla których możliwe jest kilka metod syntezy (na przykład metody zielone z 12,9 kg CO2emisja i koszt średnio 63,6 USD za kg ENP do wykorzystania w AOF). Średnio prowadzą one do 4-10 razy większego CO2 w porównaniu z konwencjonalnie stosowanym siarczanem żelaza. Odtąd omawiamy tylko te rodzaje EPS, ponieważ mogą to być również główne EPS dla AOF.
WSPÓŁ2Emisje określone na podstawie LCA dla produkcji NZVI, SiO2Al2O3, ZnO i CeO2 EPS za pomocą kilku metod syntezy (a), ich powłok polimerowych i ich zastosowania w AOF (b). Siarczan żelaza wcześniej stosowany w AOF został również uwzględniony w analizach w celu porównania. Procesy AOF obejmują transport z miejsca produkcji do regionu dystrybucji, dystrybucję przez ocean za pośrednictwem statku lub samolotu oraz monitorowanie wydajności AOF przy użyciu statków podobnych do tych używanych do dystrybucji. Słupki błędów to niepewności oparte na 99% przedziałach ufności szacunków uzyskanych z analizy Monte Carlo70. Metody syntezy ENP obejmują redukcję borowodorku sodu, redukcję ditionitu, syntezy zielone przy użyciu zielonej herbaty, kawy i ekstraktów z liści pnącza wirginijskiego (Parthenocissus tricuspidata), mielenie kulowe i wybuch drutu elektrycznego dla NZVI; zielone syntezy i mielenie kulowe dla SiO2; zielona synteza i mielenie kulowe dla Al2O3; oraz frezowanie kulowe dla ZnO i CeO2. CMC, karboksymetyloceluloza.
Koszty po lit. a) i przed lit. b), w tym koszty pracy, koszty kapitałowe i koszty środowiskowe produkcji NZVI, SiO2Al2O3, ZnO i CeO2 EPS różnymi metodami syntezy, z wykorzystaniem powłok polimerowych ENP i procesów operacyjnych AOF (dostawa i dystrybucja, wyłącznie przy użyciu statków). Analizę przeprowadzono również dla siarczanu żelaza dla porównania. Fioletowe słupki pokazują zakresy szacowanych kosztów, a niebieskie linie w pobliżu środka słupków wskazują uśrednione wyniki.
Chociaż szacowanie eksportu dwutlenku węgla jest trudne i niepewne, zwłaszcza w perspektywie długoterminowej53,55, w oparciu o poprzednie badania AOF na skalę terenową, każdy kilogram dodanego żelaza może prowadzić do ~ 80-800 kg CO2 usunięcie w trakcie zapłodnienia56 (wartości przeliczone ze stosunku molowego podanego w odniesieniu do stosunku masy), chociaż 50–67% tej wartości może być kompensowane przez CO2 uwalnianie z nadmiernego oddychania mikrobiologicznego, zmniejszając oszacowanie do 40–400 kg CO2 (sygn. 56,57). Dolna granica tego zakresu jest nadal ~3-krotnie wyższa niż ilość CO2e emisje na kg NZVI, SiO2 i Al2O3 EPS syntetyzuje się metodami ekologicznymi (12,9 kg), a jeszcze wyższą przy syntezie metodą mielenia kulowego (30,0 kg). W oparciu o ten zakres wydajności nasze analizy pokazują, że AOF z siarczanem żelaza kosztuje ~ 0,030-0,300 USD za kg CO2 usunięto, co mieści się w wcześniej zgłoszonych przedziałach 0,008–0,450 USD (refs. 9,58) i prowadzi do 2,97 kg CO2e emisje na kg wykorzystanego żelaza, jak określono tutaj. Chociaż stosowanie EPS (NZVI, SiO2 i Al2O3) może zwiększyć koszty o ~2–5 razy (0,16–1,6 USD w przypadku zielonych metod syntezy lub 0,07–0,65 USD w przypadku metody mielenia kulowego dla NZVI i SiO2) w porównaniu z siarczanem żelaza wykazaliśmy tutaj, że ENP mogą zwiększać wydajność AOF znacznie przewyższającą skuteczność siarczanu żelaza2. Ponadto nasza analiza LCC uwzględnia również koszty pracy, kapitału i środowiska, a także koszty monitorowania, które wcześniej rzadko były uwzględniane58. Nasze podejście jest stosunkowo konserwatywne, ponieważ koszty pracy, kapitału i środowiska są w większości uwzględnione w cenach materiałów i procesów uwzględnianych w inwentaryzacji cyklu życia, podczas gdy koszty te zostały określone oddzielnie (rys. 5a,b). Jeśli pominiemy te dodatkowe koszty z naszej analizy, zastosowanie wyżej wymienionych EPS zwiększa koszty w porównaniu z konwencjonalnym AOF tylko o około 1,4–2,2 razy (0,036–0,37 USD dla wszystkich zielonych metod syntezy lub 0,024–0,24 USD w przypadku metody mielenia kulowego dla NZVI i SiO2; Figa. 5b).
Inne potencjalne wpływy na środowisko wynikające z naszej analizy LCA podsumowano w tabeli uzupełniającej 4, pokazując, że w większości przypadków CeO2 synteza (z wykorzystaniem metody mielenia kulowego) wywiera największy wpływ na środowisko spośród różnych typów/metod syntezy EPS. Chociaż metody ekologiczne we wszystkich kategoriach oddziaływania, z wyjątkiem zajmowania gruntów miejskich, są najbardziej przyjaznymi dla środowiska metodami syntezy, w kilku kategoriach (zajmowanie gruntów rolnych, eutrofizacja mórz i zajmowanie gruntów miejskich) mogą one również powodować duże skutki (tabela uzupełniająca 4). Potencjalne koszty ekonomiczne wynikające z czterech ważnych kategorii oddziaływania na środowisko, tj. zmiany klimatu, eutrofizacji wód słodkich, zubożenia warstwy ozonowej i zakwaszenia lądowego, przedstawiono w tabeli uzupełniającej 3. Koszty te wahają się od nieznacznego do 21 USD (średnio 1,14 USD) za kg wykorzystanej EPS i są ogólnie najwyższe w przypadku zmiany klimatu (CO2emisje) wśród różnych kategorii, z wyjątkiem zielonej syntezy procesów NZVI i AOF (tylko statki), które wykazują największy wpływ na środowisko w kategorii zakwaszenia lądowego (odpowiednio 2,4 USD i 0,37 USD; Tabela uzupełniająca 3). Dalsze dyskusje na temat wykonalności wykorzystania EPS w EPS przedstawiono w informacjach uzupełniających, sekcja 3–5.
Toksyczność EPS w oceanach
Podczas gdy naturalne nanocząstki istnieją w większości ustawień oceanicznych14,18, potencjalne niekorzystne zagrożenia dla środowiska związane z dodawaniem EPS do oceanów wymagają rygorystycznej oceny. Porównaliśmy dane dotyczące toksyczności dla EPS z 98 badań (tabela uzupełniająca 6 i ryc. 2c,d). Zakresy stężeń EPS uznane za toksyczne dla bentosowych i planktonicznych gatunków morskich porównuje się ze stężeniami, które stymulują wzrost glonów. Dane te pokazują, że stężenia ENP indukujące stymulację wzrostu są w większości poniżej zakresów toksyczności, szczególnie dla NZVI i kropek kwantowych, z prawie brakiem pokrywania się w zwiększonym wzroście w porównaniu z zakresami toksycznymi, oraz dla SiO2Fe2O3 i CeO2 z niewielkimi zakładkami (rys. 2c,d). Zakres stężeń, który powoduje stymulację wzrostu uśredniony dla NZVI, tlenków żelaza, SiO2 i CeO2 wynosi 2,07–44,3 mg l−1 mając na uwadze, że zakres stężeń toksycznych uśredniony dla tych EPS wynosi 132–1 090 mg l−1. Jeśli górny próg zakresu stężenia stymulacji zostanie wybrany do zastosowania EPS, stężenie to – które jest już znacznie poniżej dolnej granicy toksyczności – znacznie spadnie w oceanie do czasu, gdy ENP dotrą do głębszych siedlisk z powodu rozcieńczenia i absorpcji przez zakwit fitoplanktonu i inne procesy. Może to częściowo złagodzić obawy dotyczące potencjalnych zagrożeń dla ekosystemów morskich związanych z EPS, chociaż należy również rozważyć potencjalne akumulacje wynikające z powtarzających się aof. Ponadto stężenie 75 mg l−1 SiO2 EPS, które mogą wywoływać efekt balastu46 znajduje się w pobliżu dolnej granicy SiO2 Zakres stężeń toksycznych ENP, 73–1 300 mg l−1, co sugeruje, że osiągnięcie pewnych poziomów efektu balastu przy użyciu ENP jest możliwe z toksykologicznego punktu widzenia.
Podczas gdy obecność EPS może indukować produkcję reaktywnych form tlenu (ROS), promujący wpływ kilku EPS na wzrost glonów (ryc. 2a,b) sugeruje, że rentowności sprzedaży nie wywołują toksyczności w podanych powyżej zakresach stężeń EPS. Jest to zgodne z niedawną zmianą paradygmatu z postrzegania ROS jako powodującego toksyczność na ich niezbędne dla biologicznych i fizykochemicznych funkcji organizmów i wpływające na obieg składników odżywczych w środowisku morskim59,60. Ponadto niektóre EPS, takie jak CeO2 może chronić przed ROS poprzez ich oczyszczanie32,33.
Losy i transport EPS w oceanach
Chociaż potencjalnie niskie stężenia EPS wymagane dla AOF sprzyjają minimalizacji agregacji EPS, nadal wymagane są modyfikacje powierzchni EPS w celu ograniczenia agregacji i osiadania, a tym samym wydłużenia czasu przebywania w wodach powierzchniowych14,20,52,61. Zazwyczaj osiąga się to za pomocą polimerów, które są niedrogie, wydajne, biokompatybilne i mogą być adsorbowane na powierzchniach EPS za pomocą prostych procesów fizykoorpcji i / lub przy użyciu metali, które mają również na celu poprawę wydajności EPS w strukturze rdzenia-powłoki20,21,30,52. Polimery generalnie zapewniają odpychanie steryczne na powierzchni ENP, podczas gdy metalowa powłoka może zmniejszyć stałą Hamakera lub wzmocnić odpychanie elektrostatyczne, aby pokonać siły, takie jak van der Waals i przyciąganie magnetyczne20,21,30,52. Ligandy o niskiej masie cząsteczkowej (na przykład eter diolowy), które są dobrze solwatowane w stężonej solance, wykazały znaczny efekt stabilizacji sterycznej w warunkach wody morskiej dla 10 nm SiO2 EPS61. Niektóre polimery (na przykład kopolimery sulfonowane), które nie wiążą się z kationami dwuwartościowymi, zapewniają steryczny efekt stabilizacji ENP tlenku żelaza przed flokulacją mostkową62. Takie polimery mogą również zmniejszać heteroagregację ENP z wszechobecnymi koloidami w wodzie morskiej, chociaż potrzebne są dalsze badania w celu zbadania tych efektów. Heteroagregacja między EPS a komórkami fitoplanktonu w wyniku mostkowania polimerów63 może być jedną z możliwych dróg usuwania EPS z powierzchni oceanu. Jednak ciągłe wydalanie rozpuszczalnej frakcji EPS z fitoplanktonu64, zwłaszcza ze względu na obecność EPS47, może powodować oderwanie ENP od ściany komórkowej (ryc. 3), a tym samym ograniczyć usuwanie EPS poprzez heteroagregację z fitoplanktonem. Tak złożone mechanizmy są obecnie słabo poznane i wymagają dalszych badań.
Ogólnie rzecz biorąc, obecne badania nad losem i transportem EPS sugerują, że jest mało prawdopodobne, aby nanocząstki pozostały długo w swojej pierwotnej postaci w środowisku wodnym, ponieważ różne mechanizmy agregacji, rozpuszczania i przekształcania powodują ich usunięcie ze słupa wody lub zmieniają ich właściwości w taki sposób, że stają się podobne do ich naturalnych koloidalnych odpowiedników wszechobecnych w środowisku17,18.
Wyzwania regulacyjne i akceptacja społeczna
Istnieją już obawy dotyczące potencjalnych negatywnych skutków AOF, takich jak zwiększenie produkcji metanu i podtlenku azotu, wpływ na ekosystem oceaniczny lub wpływ dalekiego pola na produktywność4,6,65. Chociaż działalność operacyjna AOF jest obecnie zakazana przez odpowiednie organy regulacyjne, na przykład konwencję londyńską/protokół londyński, droga do prowadzenia legalnych badań naukowych na małą skalę, które spełniają ramy oceny środowiskowej, jest nadal otwarta4,6,66,67. Rośnie akceptacja, że potrzebne są dalsze badania w celu oceny skutków ubocznych AOF, tak aby można było spełnić żądania decydentów i społeczeństwa dotyczące lepszego zrozumienia takich skutków4,6,65. Ponadto lądowe zastosowania EPS zyskały już uznanie w kilku przypadkach, takich jak odkażanie i oczyszczanie wody pitnej68, rekultywacja wód podziemnych20,21,22 oraz zrównoważone rolnictwo/akwakultura23,24,25. Niemniej jednak stosowanie EPS w AOF jest nową dziedziną, która wymaga również znacznego rozważenia potencjalnych skutków.
Wnioski i plan działania na rzecz przyszłych badań
Chociaż EPS są obiecujące w rozwiązywaniu wielu obecnych ograniczeń AOF, takich jak biodostępność, współograniczenie składników odżywczych i światła, trwałość kwitnienia fitoplanktonu i efektywność eksportu dwutlenku węgla, nasze obecne informacje i szacunki opierają się na różnych kontekstach, a nie na ukierunkowanych badaniach dotyczących stosowania EPS w realistycznych warunkach AOF. Niektóre potencjalne wyzwania, którym należy sprostać, obejmują obawy opinii publicznej i regulacyjne dotyczące potencjalnej toksyczności EPS dla ekosystemów morskich w realistycznych warunkach, nieznany długoterminowy wpływ dodatków do EPS na biogeochemię oceanów oraz tendencję EPS do agregacji w środowisku morskim. Żadne z tych wyzwań nie jest koniecznie nie do pokonania.
Aby zacząć rozwiązywać takie ograniczenia, konieczne są badania w następujących kluczowych obszarach:
-
Wybór optymalnych właściwości idealnej hybrydowej EPS lub mieszanki kilku indywidualnych EPS w celu zebrania ich połączonych korzyści dla najbardziej efektywnego AOF (rys. 3).
-
Projektowanie i wytwarzanie nowatorskich wieloskładnikowych/hybrydowych EPS w celu spełnienia wymagań AOF, w tym zapewnienie optymalnych czynników ograniczających wzrost fitoplanktonu, stabilność fizykochemiczną w wodzie morskiej, ograniczone interakcje z naturalnymi koloidami i selektywne interakcje z fitoplanktonem. Pomimo równoważących skutków niektórych z tych wymogów, nanotechnologia może stanowić wyjątkową okazję do ich rozwiązania.
-
Ocena wpływu ekologicznego stosowania EPS we wszystkich skalach, od prostych testów laboratoryjnych w skali laboratoryjnej po eksperymenty mezokosmiczne i terenowe.
-
Konieczny jest dalszy rozwój oceanicznych modeli biogeochemicznych w celu rozważenia bardziej solidnego opisu mechanizmów związanych z AOF, takich jak balastowanie i zakopywanie biomasy w osadach morskich53. Takie modele powinny również uwzględniać los i transport EPS w oceanie oraz umożliwiać optymalizację wyników EPS w AOF. Modele te mogą być następnie wykorzystywane do testowania różnych scenariuszy AOF w skali lokalnej i globalnej, badania długoterminowych i dalekosiężnych skutków oraz dostarczania narzędzi do podejmowania decyzji.
-
Zrozumienie mechanizmów zwiększania wzrostu fitoplanktonu przez EPS oraz losu EPS i wytworzonej biomasy w środowiskach morskich, które są istotne dla realistycznych warunków AOF.
Osiągnięcie znacznego CO2 usunięcie z atmosfery za pośrednictwem AOF z obsługą EPS, konieczne będzie długotrwałe wielokrotne dodawanie EPS. Oszacowanie wydatków i ryzyk związanych z takim wdrożeniem wymaga określenia efektywnych i bezpiecznych zakresów koncentracji w realnych warunkach. Powinno to obejmować rozważenie losu dodanych EPS i eksportowanej biomasy w głębokich wodach i osadach w celu zrozumienia długoterminowych skutków AOF.
Dalszy rozwój technologii może być kontynuowany poprzez projektowanie inteligentnych EPS, które mogą skutecznie celować w fitoplankton i zwiększać szybkość agregacji i tonięcia fitoplanktonu, jednocześnie potencjalnie odstraszając pastwiska w celu ochrony eksportu biomasy. Jeżeli część mieszaniny EPS lub hybrydowej EPS zapewnia taką korzystną aktywność, to z kolei zapobiegnie problemom środowiskowym, takim jak produkcja metanu i podtlenku azotu oraz zużycie tlenu, lub opóźni ich działanie.
Ogólnie rzecz biorąc, EPS, ze względu na dużą gęstość liczbową, powierzchnię właściwą, dyfuzję, biodostępność i potencjał do projektowania ich efektywnej ukierunkowalności i innych funkcji, mogą zapewnić wiele korzyści w zakresie zastosowania w AOF. Korzyści te stanowią odpowiedź na wyzwania związane ze stosowaniem konwencjonalnych podejść do AOF (wykorzystanie rozpuszczonych składników odżywczych), które obejmują zwiększenie biodostępności, współdostarczanie składników odżywczych, wydajność fotosyntezy, wydajność eksportu i długowieczność kwitnienia fitoplanktonu. Chociaż nasze analizy pokazują, że CO2Emisje i koszty wdrożenia AOF przy użyciu wybranych EPS (NZVI, SiO2 i Al2O3) są wyższe odpowiednio o 4–10 i 2–5 razy w porównaniu z zastosowaniem żelaza rozpuszczonego, wyniki te opierają się na najgorszym scenariuszu, w którym stosowanie EPS prowadzi do podobnego CO2 usunięcie osiągnięte przy zastosowaniu podejścia konwencjonalnego. Potencjał EPS w zakresie sprostania wyżej wymienionym wyzwaniom za pomocą konwencjonalnego AOF prawdopodobnie poprawi skuteczność AOF i może złagodzić obawy dotyczące jego wdrażania. Podsumowując, AOF oparty na EPS może być niezwykłym podejściem do usuwania dwutlenku węgla w walce ze zmianami klimatu.
Dostępność danych
Wszystkie wykorzystane dane, w tym toksyczność, wzmocnienie wzrostu, LCA i analiza LCC, przedstawiono w informacjach uzupełniających.
Odwołania
IPCC Climate Change 2022: Łagodzenie zmian klimatu. Wkład grupy roboczej III w szóste sprawozdanie oceniające IPCC (2022).
A Research Strategy for Ocean-based Carbon Dioxide Removal and Sequestration (Narodowe Akademie Nauk, Inżynierii i Medycyny, 2021).
Usuwanie gazów cieplarnianych (Royal Society, 2018); https://royalsociety.org/topics-policy/projects/greenhouse-gas-removal/
Williamson, P. i wsp. Nawożenie oceanów dla geoinżynierii: przegląd skuteczności, wpływu na środowisko i nowego zarządzania. Proces Saf. Environ. Prot. 90, 475–488 (2012).
Güssow, K., Proelss, A., Oschlies, A., Rehdanz, K. & Rickels, W. Oceaniczne nawożenie żelazem: dlaczego potrzebne są dalsze badania. Mar. Policy 34, 911–918 (2010).
Yoon, J.-E. Wsp. Recenzje i syntezy: oceaniczne eksperymenty z nawożeniem żelazem – przeszłość, teraźniejszość i przyszłość w przyszłym projekcie Korean Iron Fertilization Experiment in the Southern Ocean (KIFES). Biogeosciences 15, 5847–5889 (2018).
Smetacek, V. i wsp. Głęboki eksport węgla z zakwitu okrzemek nawożonych żelazem na Oceanie Południowym. Nature 487, 313–319 (2012).
Boyd, P. W. i wsp. Mezoskalowy zakwit fitoplanktonu w polarnym Oceanie Południowym stymulowany przez nawożenie żelazem. Nature 407, 695–702 (2000).
Boyd, P. W. Implikacje nawożenia oceanów żelazem na dużą skalę: wprowadzenie i synteza. Mar. Ecol. Prog. Ser. 364, 213–218 (2008).
Pollard, R. T. i in. Eksport węgla głębokowodnego Oceanu Południowego wzmocniony przez naturalne nawożenie żelazem. Nature 457, 577–580 (2009).
Xiao, K.-Q., Moore, O. W., Babakhani, P., Curti, L. & Peacock, C. L. Mineralogical control on methylotrophic methanogenesis and implications for cryptic methane cycling in marine surface sediment. Nat. Commun. 13, 1–9 (2022).
Langmann, B., Zakšek, K., Hort, M. & Duggen, S. Popiół wulkaniczny jako nawóz do oceanu powierzchniowego. Atmos. Chem. Phys. 10, 3891–3899 (2010).
Homoky, W. B. i wsp. Koloidy żelaza dominują w osadach do wnętrza oceanu. Proc. Natl Acad. Sci. USA 118, e2016078118 (2021).
Raiswell, R. & Canfield, D. E. Cykl biogeochemiczny żelaza w przeszłości i teraźniejszości. Geochemia. Perspektywa. 1, 1–2 (2012).
Raiswell, R. Iceberg-hostowany nanocząsteczkowy Fe w Oceanie Południowym: mineralogia, pochodzenie, kinetyka rozpuszczania i źródło biodostępnego Fe. Deep Sea Res. 2 Top. Stadnina. Oceanogr. 58, 1364–1375 (2011).
Saeed, H. i wsp. Regulacja biodostępności fosforu przez nanocząsteczki żelaza w monomiktycznym jeziorze. Sci. Rep. 8, 1–14 (2018).
Hochella, M. F. i wsp. Nanominerały, nanocząstki mineralne i systemy ziemskie. Science 319, 1631–1635 (2008).
Hochella, M. F. i wsp. Naturalne, przypadkowe i inżynieryjne nanomateriały oraz ich wpływ na system Ziemi. Science 363, eaau8299 (2019).
Fitzsimmons, J. N. i wsp. Trwałość żelaza w dystalnym pióropuszu hydrotermicznym wspieranym przez wymianę rozpuszczonych cząstek. Nat. Geosci. 10, 195–201 (2017).
Phenrat, T. & Lowry, G. V. Nanoskalowe zerowalentne cząstki żelaza do przywracania środowiska (Springer, 2019).
O'Carroll, D., Sleep, B., Krol, M., Boparai, H. & Kocur, C. Nanoskalowe zero wartościowych cząstek żelaza i bimetalicznych do remediacji zanieczyszczonych miejsc. Adv. Water Res. 51, 104–122 (2013).
Park, C. M., Wang, D. & Su, C. w Handbook of Nanomaterials for Industrial Applications (ed Hussain, C. M.) 849–882 (Elsevier, 2018).
Lowry, G. V., Avellan, A. & Gilbertson, L. M. Szanse i wyzwania dla nanotechnologii w rewolucji agrotechnologicznej. Nat. Nanotechnol. 14, 517 (2019).
Sabo-Attwood, T., Apul, O. G., Bisesi, J. H. Jr, Kane, A. S. & Saleh, N. B. Zastosowania w skali nano w akwakulturze: możliwości poprawy produkcji i kontroli chorób. J. Ryba. Dis. 44, 359–370 (2021).
Moges, F. D., Patel, P., Parashar, S. K. S. & Das, B. Mechanistyczne spostrzeżenia na temat różnorodnych strategii opartych na nanotechnologii na rzecz poprawy akwakultury: całościowy przegląd. Akwakultura 519, 734770 (2020).
Ponton, D. E. i wsp. Trójwarstwowe nanocząstki srebra do śledzenia rozpuszczania i asocjacji z zieloną algą. Nanotoxicology 13, 1149–1160 (2019).
Wells, M. L. & Mayer, L. M. Fttokonwersja koloidalnych tlenowodorotlenków żelaza w wodzie morskiej. Głębiny morskie Res. A 38, 1379–1395 (1991).
Bowie, A. R. i wsp. Los dodanego żelaza podczas eksperymentu nawożenia mezoskali na Oceanie Południowym. Deep Sea Res. 2 Top. Stadnina. Oceanogr. 48, 2703–2743 (2001).
Coale, K. H. i wsp. IronEx-I, eksperyment wzbogacania żelaza in situ: projekt eksperymentalny, wdrożenie i wyniki. Deep Sea Res. 2 Top. Stadnina. Oceanogr. 45, 919–945 (1998).
Hu, Y.-B. & Li, X.-Y. Wpływ cienkiej warstwy powłoki wodorotlenku glinu na stabilność zawiesiny i redukcyjną reaktywność nanoskalowego żelaza zerowartościowego. Appl. Catal. B 226, 554–564 (2018).
Kadar, E., Rooks, P., Lakey, C. & White, D. A. Wpływ zmodyfikowanych nanocząstek żelaza na wzrost i status metaboliczny kultur morskich mikroalg. Sci. Całkowite otoczenie. 439, 8–17 (2012).
Deng, X.-Y. Wsp. Biologiczne działanie TiO2 i CeO2 nanocząstki na wzrost, aktywność fotosyntetyczną i składniki komórkowe okrzemki morskiej Phaeodactylum tricornutum. Sci. Całkowite otoczenie. 575, 87–96 (2017).
Sendra, M., Yeste, P. M., Moreno-Garrido, I., Gatica, J. M. & Blasco, J. CeO2 NP, toksyczne lub ochronne dla fitoplanktonu? Ładunek nanocząstek i ściany komórkowej jako czynniki powodujące zmiany w złożoności komórek. Sci. Całkowite otoczenie. 590, 304–315 (2017).
Chen, F. i wsp. Reakcja glonów na zmodyfikowane nanocząstki: obecne zrozumienie, mechanizmy i implikacje. Environ. Sci.: Nano 6, 1026–1042 (2019).
Huang, X., Wei, L., Huang, Z. & Yan, J. Wpływ wysokich stężeń jonów żelazowych na całkowitą charakterystykę lipidów i lipidów Tetraselmis subcordiformis, Nannochloropsis oculata i Pavlova viridis. J. Appl. Phycol. 26, 105–114 (2014).
Rajabi Islami, H. & Assareh, R. Wpływ różnych stężeń żelaza na wzrost, akumulację lipidów i profil kwasów tłuszczowych do produkcji biodiesla z Tetradesmus obliquus. J. Appl. Phycol. 31, 3421–3432 (2019).
Graca, B., Zgrundo, A., Zakrzewska, D., Rzodkiewicz, M. & Karczewski, J. Pochodzenie i losy nanocząstek w wodzie morskiej – wyniki wstępne. Chemosfera 206, 359–368 (2018).
Wells, M. L. & Goldberg, E. D. Występowanie małych koloidów w wodzie morskiej. Nature 353, 342–344 (1991).
Boyd, P. W. i wsp. Upadek i los wywołanego żelazem subarktycznego zakwitu fitoplanktonu. Natura 428, 549 (2004).
Nguyen, M. K., Moon, J.-Y., Bui, V. K. H., Oh, Y.-K. & Lee, Y.-C. Najnowsze zaawansowane zastosowania nanomateriałów w biorafinerii mikroalg. Glony Res. 41, 101522 (2019).
Brand, L. E., Sunda, W. G. & Guillard, R. R. L. Ograniczenie wskaźników reprodukcji fitoplanktonu morskiego przez, mangan i żelazo. Limnol. Oceanogr. 28, 1182–1198 (1983).
Zhou, L., Tan, Y., Huang, L., Fortin, C. & Campbell, P. G. C. Wpływ glinu na fitoplankton morski: implikacje dla zrewidowanej hipotezy żelaza (hipoteza żelaza i aluminium). Biogeochemia 139, 123–137 (2018).
Xia, T. i wsp. Porównanie mechanizmu toksyczności nanocząstek tlenku i tlenku ceru w oparciu o właściwości rozpuszczania i stresu oksydacyjnego. ACS Nano 2, 2121–2134 (2008).
Sicard, C. i wsp. Dyrektor generalny2 nanocząstki do ochrony organizmów fotosyntetycznych unieruchomionych w żelach krzemionkowych. Chem. Mater. 23, 1374–1378 (2011).
Sommer, U., Charalampous, E., Genitsaris, S. & Moustaka-Gouni, M. Korzyści, koszty i taksonomiczny rozkład wielkości ciała fitoplanktonu morskiego. J. Plankton Res. 39, 494–508 (2017).
Xiong, W. i wsp. Zapobieganie zakwitom sinic za pomocą nanokrzemionki: strategia inspirowana biomineralizacją. Okolica. Sci. Technol. 51, 12717–12726 (2017).
Chiu, M.-H. Wsp. Wpływ zmodyfikowanych nanocząstek na uwalnianie substancji egzopolimerowych z fitoplanktonu morskiego. Nanoskala Res. Lett. 12, 620 (2017).
Martin, P. i wsp. Nawożenie żelazem zwiększyło produkcję zbiorowisk netto, ale nie strumień cząstek w dół podczas eksperymentu LOHAFEX z nawożenia żelazem na Oceanie Południowym. Glob. Biogeochemia. Cykle 27, 871–881 (2013).
Laglera, L. M. i wsp. Podział żelaza podczas LOHAFEX: wypas widłonogów jako główny czynnik recyklingu żelaza na Oceanie Południowym. Mar. Chem. 196, 148–161 (2017).
Simonin, M. i wsp. Zmodyfikowane nanocząstki oddziałują ze składnikami odżywczymi, aby zintensyfikować eutrofizację w eksperymencie ekosystemu mokradeł. Ecol. Appl. 28, 1435–1449 (2018).
Pakrashi, S., Dalai, S., Chandrasekaran, N. & Mukherjee, A. Troficzny potencjał przenoszenia nanocząstek tlenku glinu przy użyciu reprezentatywnego producenta pierwotnego (Chlorella ellipsoides) i pierwotnego konsumenta (Ceriodaphnia dubia). Aquat. Toxicol. 152, 74–81 (2014).
Baalousha, M. Wpływ właściwości fizykochemicznych nanomateriałów i mediów na kinetykę agregacji nanomateriałów. NanoImpact 6, 55–68 (2017).
Henson, S. A. i wsp. Niepewna reakcja eksportu biologicznego węgla oceanicznego w zmieniającym się świecie. Nat. Geosci. 15, 248–254 (2022).
Kozma, G., Rónavári, A., Kónya, Z. & Kukovecz, A. Przyjazne dla środowiska metody syntezy zerowartościowych nanocząstek żelaza. ACS Sustain. Chem. Eng. 4, 291–297 (2016).
Boyd, P. W., Claustre, H., Levy, M., Siegel, D. A. & Weber, T. Wielopłaszczyznowe pompy cząstek napędzają sekwestrację węgla w oceanie. Nature 568, 327–335 (2019).
de Baar, H. J. W., Gerringa, L. J. A., Laan, P. & Timmermans, K. R. Skuteczność usuwania węgla na dodane żelazo w nawożeniu żelaza oceanicznego. Mar. Ecol. Prog. Ser. 364, 269–282 (2008).
Aumont, O. & Bopp, L. Globalizacja wyników badań oceanicznych nawożenia żelazem in situ. Globalny biogeochemia. Cykle 20, 1–15 (2006).
Harrison, D. P. Metoda szacowania kosztów sekwestracji dwutlenku węgla poprzez dostarczanie żelaza do oceanu. Int. J. Glob. Ciepły. 5, 231–254 (2013).
Hansel, C. M. & Diaz, J. M. Produkcja zewnątrzkomórkowych reaktywnych form tlenu przez faunę i florę morską. Annu. Rev. Mar. Sci. 13, 177–200 (2021).
Rezayian, M., Niknam, V. & Ebrahimzadeh, H. Uszkodzenia oksydacyjne i system antyoksydacyjny w algach. Toxicol. Rep. 6, 1309–1313 (2019).
Worthen, A. J., Tran, V., Cornell, K. A., Truskett, T. M. & Johnston, K. P. Steryczna stabilizacja nanocząstek za pomocą szczepionych ligandów o niskiej masie cząsteczkowej w wysoko stężonych solankach, w tym jonach dwuwartościowych. Soft Matter 12, 2025–2039 (2016).
Bagaria, H. G. i wsp. Stabilizacja nanocząstek tlenku żelaza w solance wysokosodowej i wapniowej w wysokich temperaturach za pomocą adsorbowanych kopolimerów sulfonowanych. Langmuir 29, 3195–3206 (2013).
Wang, H., Adeleye, AS, Huang, Y., Li, F. & Keller, A. A. Heteroagregacja nanocząstek z biokoloidami i geokoloidami. Adv. Interfejs koloidalny Sci. 226, 24–36 (2015).
Cheng, Q. i wsp. Zwiększone wydalanie zewnątrzkomórkowych substancji polimerowych związanych z tolerancją nonylofenolu w Dictyosphaerium sp. J. Hazard. Mater. 395, 122644 (2020).
Oschlies, A., Koeve, W., Rickels, W. & Rehdanz, K. Skutki uboczne i aspekty księgowe hipotetycznego nawożenia żelazem na dużą skalę Oceanu Południowego. Biogeosciences (BG) 7, 4017–4035 (2010).
GESAMP. Przegląd wysokiego szczebla szerokiego zakresu proponowanych technik geoinżynierii morskiej, tom 98 (INTL. MAR. ORG., 2019).
Freestone, D. & Rayfuse, R. Oceaniczne nawożenie żelazem i prawo międzynarodowe. Mar. Ecol. Prog. Ser. 364, 227–233 (2008).
Alvarez, P. J. J., Chan, C. K., Elimelech, M., Halas, N. J. & Villagrán, D. Pojawiające się możliwości nanotechnologii w celu zwiększenia bezpieczeństwa wodnego. Nat. Nanotechnol. 13, 634–641 (2018).
Ma, S., Zhou, K., Yang, K. & Lin, D. Heteroaglomeracja nanocząstek tlenkowych z komórkami glonów: wpływ typu cząstek, siły jonowej i pH. Okolica. Sci. Technol. 49, 932–939 (2015).
Goedkoop, M., De Schryver, A., Oele, M., Durksz, S. & de Roest, D. Wprowadzenie do LCA z SimaPro 7 (PRé Consultants, 2008).
Potwierdzenia
P.B. i C.L.P. potwierdzają wsparcie Europejskiej Rady ds. Badań Naukowych (ERBN) w ramach programu badań naukowych i innowacji Unii Europejskiej "Horyzont 2020" (umowa o grant nr 725613 MinOrg). B.S.T. otrzymał wsparcie od Fundacji Ochrony Środowiska Grantham. Dziękujemy Christianowi Märzowi i Williamowi B. Homoky'emu za przejrzenie wczesnego szkicu artykułu oraz anonimowym recenzentom za konstruktywne komentarze, które ulepszyły manuskrypt.
Informacje o autorze
Autorzy i afiliacje
Składki
P.B. wpadł na ten pomysł. P.B. i T.P. zaplanowali badania i zebrali dane z literatury dotyczącej toksyczności i wzmocnienia wzrostu. P.B. i K.S. przeprowadzili LCA i LCC. P.B. napisał pierwszy szkic rękopisu. P.B., M.B. i M.F.H. przygotowali liczby. M.B., B.S.T. i M.F.H. dostarczyły krytycznych opinii. M.F.H. nadzorował badania. P.B., M.B., C.L.P., B.S.T. i M.F.H. napisali, zrecenzowali i zredagowali manuskrypt. Wszyscy autorzy czytali, dyskutowali i komentowali manuskrypt.
Autor korespondencyjny
Deklaracje etyczne
Sprzeczne interesy
Autorzy deklarują brak sprzecznych interesów.
Wzajemna weryfikacja
Informacje dotyczące wzajemnej oceny
Nature Nanotechnology dziękuje Philipowi Williamsonowi i innym, anonimowym recenzentom za ich wkład w recenzowanie tej pracy.
Dodatkowe informacje
Nota wydawcy Springer Nature pozostaje neutralny w odniesieniu do roszczeń jurysdykcyjnych w publikowanych mapach i afiliacjach instytucjonalnych.
Informacje uzupełniające
Informacje uzupełniające
Sekcje uzupełniające 1–5, Ryc. 1–3 i tabele 1–6.
Prawa i uprawnienia
Otwarty dostęp Ten artykuł jest dostępny na licencji Creative Commons Uznanie autorstwa 4.0 Międzynarodowej, która zezwala na wykorzystanie, udostępnianie, adaptację, dystrybucję i powielanie na dowolnym nośniku lub w dowolnym formacie, o ile podasz odpowiednie informacje o oryginalnym autorze (autorach) i źródle, podasz link do licencji Creative Commons i wskażesz, czy wprowadzono zmiany. Obrazy lub inne materiały osób trzecich w tym artykule są zawarte w licencji Creative Commons artykułu, chyba że zaznaczono inaczej w linii kredytowej do materiału. Jeśli materiał nie jest objęty licencją Creative Commons artykułu, a zamierzone użycie nie jest dozwolone przez przepisy ustawowe lub wykracza poza dozwolony użytek, musisz uzyskać pozwolenie bezpośrednio od właściciela praw autorskich. Aby wyświetlić kopię tej licencji, odwiedź stronę http://creativecommons.org/licenses/by/4.0/.
O tym artykule
Cytuj ten artykuł
Babakhani, P., Phenrat, T., Baalousha, M. i wsp. Potencjalne zastosowanie zmodyfikowanych nanocząstek w nawożeniu oceanów do usuwania dwutlenku węgla w atmosferze na dużą skalę. Nat. Nanotechnol. 17, 1342–1351 (2022). https://doi.org/10.1038/s41565-022-01226-w
Otrzymał:
Akceptowane:
Opublikowany:
Data wydania:
DOI: https://doi.org/10.1038/s41565-022-01226-w